Method Article
Масс-спектрометрический подходы к изучению структуры белка и взаимодействия в лиофилизированных порошков
* Эти авторы внесли равный вклад
В этой статье
Резюме
Here, we present detailed protocols for solid-state amide hydrogen/deuterium exchange mass spectrometry (ssHDX-MS) and solid-state photolytic labeling mass spectrometry (ssPL-MS) for proteins in solid powders. The methods provide high-resolution information on protein conformation and interactions in the amorphous solid-state, which may be useful in formulation design.
Аннотация
Амид водород / дейтерий обмен (ssHDX-MS) и боковой цепью фотолитический маркировка (SSPL-MS), а затем с помощью масс-спектрометрического анализа могут быть полезны для характеристики лиофилизированные составы белков терапии. Маркировка с последующим подходящего протеолитического расщепления позволяет структура белка и взаимодействия должен быть отображен с разрешением пептида уровня. Поскольку белка структурные элементы стабилизируются сети химических связей из главных цепей и боковых цепей аминокислот, определенной маркировки атомов в аминокислотных остатков дает представление о структуре и конформации белка. В отличие от обычных методов, используемых для изучения белков в лиофилизированных твердых веществ (например, ИК-Фурье), ssHDX-MS и SSPL-MS предоставления количественной и сайт-специфической информации. Степень дейтерия включения и кинетических параметров может быть связано с быстро и медленно обмена амидных бассейна (N быстро, медленно Н) и непосредственно отражает градРЗЭ складывания белка и структуры в лиофилизированных композиций. Стабильный фотолитический маркировка не пройти бэк-обмен, преимущество над ssHDX-МС. Здесь мы предоставляем подробные протоколы как для ssHDX-МС и SSPL-МС, с использованием миоглобина (Мб) в качестве модели белка в лиофилизированных препаратов, содержащих либо трегалозу или сорбит.
Введение
Белковые препараты быстро растущим сектором биофармацевтической промышленности и предлагают новые перспективные методы лечения ранее неразрешимых заболеваний, в том числе гормональных расстройств, рака и аутоиммунных заболеваний 1. В 2012 году мировой рынок биотерапевтических достиг $ 138 млрд, а как ожидается, достигнет $ 179 млрд к году 2018 2. Белки являются крупные и более хрупкими, чем обычные низкомолекулярные лекарственные и поэтому они более восприимчивы ко многим видам деградации 3. Для обеспечения надлежащего срока годности и стабильности, белковые препараты часто изготавливают в виде лиофилизированных (то есть, лиофилизированная) твердых порошков. Тем не менее, белок может все еще испытывают деградации в твердом состоянии, в частности, если его нативная структура не сохраняется в процессе лиофилизации 4,5. Заверив, что структура была сохранена возможна только при наличии аналитические методы, которые можно исследовать конформацию белка в твердом состоянии с sufficienРазрешение т.
ЯМР-спектроскопия 6 и рентгеновской кристаллографии 7 являются широко используемые методы высокого разрешения для оценки структуры белка в растворе и кристаллических твердых тел 8. Из-за природы наполнителей и методов обработки, используемых, лиофилизированные композиции, как правило, белковые аморфного, а не кристаллического 9. Отсутствие однородности и микроскопической того делает вышеуказанные методы непрактичными для белков в аморфных твердых телах. Инфракрасной Фурье-спектроскопии (FTIR) 10, спектроскопия комбинационного рассеяния 11 и ближней инфракрасной спектроскопии (NIR) 12 регулярно используется биофармацевтической промышленности для сравнения вторичной структуры белка в лиофилизированных порошков, которые нативного раствора состояния структуры. Тем не менее, эти методы низкое разрешение и может только предоставить информацию о глобальных изменениях в вторичной структуры. Твердотельный структурная характеристика с помощью фурьепоказал, либо слабый 13,14 или плохое 15 корреляцию с долгосрочной стабильности хранения. Эти ограничения подчеркивают необходимость для подходящих методов высокого разрешения для определения структуры белка возмущения в твердом состоянии.
Химическая маркировка в сочетании с протеолиза и массового спектрометрического анализа стала мощным подход к мониторингу структуру белка и молекулярных взаимодействий в водном растворе. В фармацевтической разработки, HDX-MS был использован для картирования эпитопов в антиген-антитело взаимодействий 16,17, на карту рецепторных взаимодействий с наркотиками 18, чтобы контролировать эффекты пост-трансляционных модификаций на конформацию белковых препаратов 19, и сравнить от партии к партии вариации в разработке биоподобий 20. Аналогичным образом, Фотоактивируемые лиганды были использованы для выявления лекарственных целей и для определения аффинности связывания и специфичности препарат-рецептор взаимодействий 21,22. Для электроннойXtend применение этих методов к лиофилизированных композиций, наша группа разработала твердотельный дейтерия обмена водорода масс-спектрометрии (ssHDX-MS) и твердотельных фотолитический маркировка масс-спектрометрии (SSPL-MS) для изучения конформации белков и наполнителя взаимодействия в лиофилизированных образцов с высоким разрешением.
В обоих ssHDX-МС и SSPL-MS, белок помечен при идеальных условиях реакции в лиофилизированных твердых веществ, и образцы затем восстановлен и анализировали с помощью масс-спектрометрии с использованием или без протеолитического расщепления. ssHDX-MS предоставляет информацию на главной экспозиции цепи на дейтерия пара, в то время как SSPL-MS обеспечивает информацию об окружающей среде боковых цепей (рис 1). Эти два метода, таким образом, может обеспечить дополнительную информацию о конформации белка в твердом состоянии. Здесь мы предоставляем общую протокол для изучения белков в лиофилизированных веществ с помощью ssHDX-МС и SSPL-МС (рис 2), используя Мбайт,модель белка. Мы покажем, способность этих двух методов выявить различия в составах с двумя различными наполнителями.
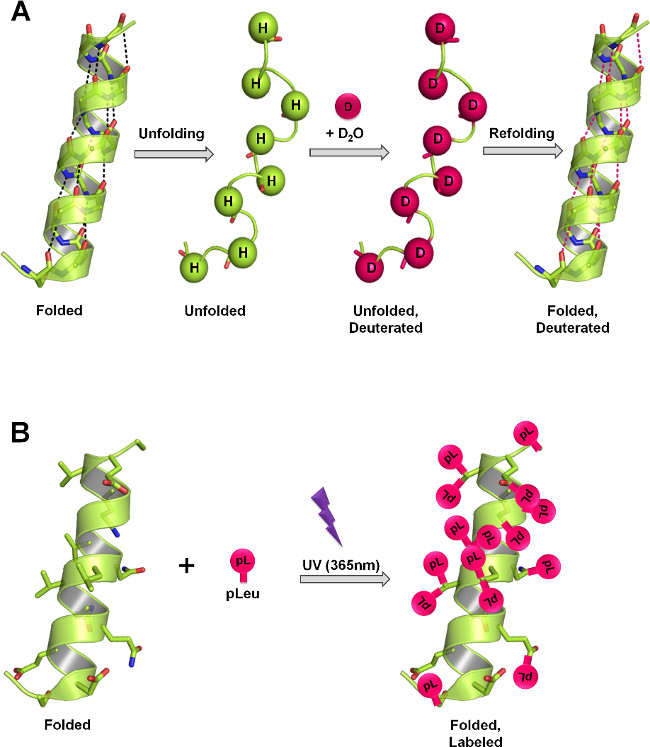
Рисунок 1:. Структура мера белок ssHDX и SSPL в лиофилизированных твердых посредством различных механизмов маркировки () В HDX, основой амид водороды обмен с дейтерием в зависимости от структуры белка и D 2 O доступности. В твердом состоянии, скорость и степень дейтерообмена зависит от уровня сорбции D 2 O, мобильность белка (разворачивающейся и рефолдинга события) и природы наполнителей, присутствующих в твердой матрице. (Б) В PL, УФ-облучение при 365 нм инициирует образование реакционноспособного промежуточного карбена с diazirine функциональной группой pLeu и вставляется неспецифически в любой XH связи (Х = любой атом), или объявлениемДед через связи С = С в непосредственной близости. В твердом состоянии, скорость и степень маркировки зависит от локальной концентрации маркировки агента, время облучения, структуры белка и природы наполнителей, присутствующих в твердой матрице. Панели А и В показывают максимальную теоретическую маркировки, которые могут возникнуть на позвоночнике и боковых цепей, соответственно, в белка.
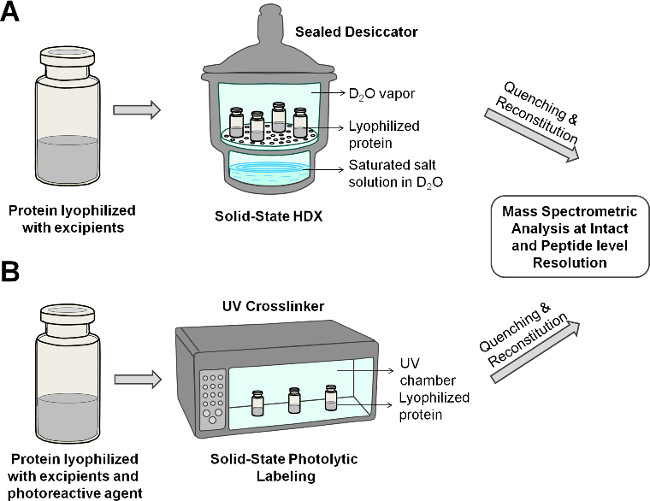
Рисунок 2: Схематическое изображение твердотельной HDX-МС (А) и PL-МС (В) для белка в лиофилизированной композиции.
протокол
1. Подготовка образцов и Лиофилизация
- Диализировать необходимый объем Mb маточного раствора с подходящим буфером и фильтром через стерильный фильтр 0,22 мкм.
- Подготовьте необходимый объем наполнителей и фото-лейцина (L-2-амино-4,4-Ази-пентановой кислоты; pLeu) маточных растворов в подходящем буфере. Фильтр фондовые решения через стерильный фильтр 0,22 мкм.
- Подготовка составы, как показано в таблице 1, с использованием исходных растворов белков, наполнителей, pLeu, и буфер.
- Образцы фильтруют через стерильный фильтр 0,22 мкм, чтобы удалить любые частицы, образованные на этапе 1.3. Заполните образцы отдельно, как 0,2 мл в стеклянные флаконы 2 мл. Использование стеклянные флаконы, которые прозрачны для УФ (365 нм) света, чтобы активировать pLeu в исследованиях SSPL-MS.
- Загрузка флаконов в лиофилизаторе и начать лиофилизации, разработав соответствующий цикл лиофилизации.
- Здесь заморозить образцы при -40 ° С, с последующимот первичной сушки под вакуумом (70 мТорр) при -35 ° С в течение 12 ч и вторичной сушки при 25 ° С в течение 12 ч. Другое циклов лиофилизации и способы сушки (например, сушки распылением) также могут быть использованы.
- Засыпьте флаконы, содержащие лиофилизированные образцы азотом до укупорки.
| Составы | Состав (мг / мл) до лиофилизации | ||||
| Мегабайт | Трегалоза | Сорбитол | pLeu с | Калия, фосфат, рН 7,4 | |
| МБТ | 1,7 | 3,4 | - | - | 0,4 |
| MBS | 1,7 | - | 3,4 | - | 0,4 |
| МБТ + pLeu б | 1,7 | 3,4 | - | 14,3 х 10 -3 до 1,43 | 0,4 |
| MBS + pLeu б | 1,7 | - | 3,4 | 14,3 х 10 -3 до 1,43 | 0,4 |
Таблица 1:... Состав лиофилизированных композиций МБ Составы, используемые для исследования ssHDX-MS B Составы, используемые для исследования SSPL-MS C L-2-амино-4,4-azipentanoic кислоты или фото-лейцин (pLeu). pLeu на пять различных концентрациях (14,3 × 10 -3 до 1,43 мг / мл), соответствующих 1x, 10x, 20x, 50x и 100x мол рный избыток по отношению к Mb были совместно лиофилизировали с бактериовыделением и MBS составов.
2. ssHDX-MS для интактного белка
- Добавить объем насыщающего (~ 440 г) K 2 CO 3 в 200 мл D 2 O previouslу помещают в нижнем отделении эксикаторе. Уплотнение эксикаторе герметичное и позволить ему не прийти в равновесие при 5 ° С до тех пор, стабильной относительной влажности (RH) в ~ 43% будет достигнута. Другие значения RH интересных может быть получено путем выбора различных насыщенные солевые растворы 23,24.
- Инициирование ssHDX реакции путем размещения колпачков флаконов, содержащих лиофилизированный белок в верхний отсек эксикаторе. Уплотнение эксикатор герметично и инкубировали при 5 ° С, чтобы позволить произойти HDX (фиг.2А).
- Соберите образцы ssHDX в разное время в трех экземплярах. Для Мбит составов, собрать образцы в девяти точках времени 1, 2, 4, 8, 16, 32, 56, 92 и 144 ч.
- Закрывают флаконы сразу после выхода из эксикаторе и потушить реакции с помощью флэш-замораживание флаконов в жидком азоте. Хранить флаконов при температуре -80 ° С до анализа масс-спектрометрического.
- Анализ образцов с помощью подходящего высокого разрешения жидкостной хроматографии-масс-spectromСпособ метрия (ЖХ-МС). Дизайн или купить подходящую охлажденный систему LC, чтобы минимизировать бэк-обмен мнениями в ходе анализа проб. Используйте настройки для столбца холодильную установку и способ LC-MS сообщалось ранее 25.
ПРИМЕЧАНИЕ: Поскольку скорость амидной протонного обмена зависит от рН и температуры, дейтронов, включенные в белке могут обмениваться водорода, присутствующего в подвижной фазе ("назад Биржа"), что привело к потере информации. Хотя кислый рН (рН 2,5) буфера быстрого охлаждения и ВЭЖХ растворителей можно свести к минимуму обратную обмена в значительной степени, снижение температуры (≤0 ° С) с помощью подходящей системы охлаждения колонки могут дополнительно защищают белок от обратного обмена , - Подключите рамочную образца и белка ловушки на клапан, который автоматически регулирует процесс обессоливания и элюции. Калибровка масс-спектрометра, вводя TOF низкой концентрации настройки смеси в масс-спектрометр в M / Z диапазоне 200-3,200. Иммобилизованныхколонка пепсин и аналитической колонке не требуются для неповрежденной анализа белков.
- Установите температуру в охлаждаемом системы ≤0 ° C и подождите, пока система достигнет стабильного рабочую температуру ~ 0 ° С.
- Быстро передавать образцы от -80 ° С в жидком азоте для массового спектрометрического анализа. Использование щипцов, тщательно снимать каждый флакон с жидким азотом, и восстановить образца путем добавления удельный объем охлажденного льдом буфера быстрого охлаждения, содержащей 0,2% муравьиной кислоты (FA) (рН 2,5) и 5% -ным раствором метанола в воде во флакон.
- Программирование подходящий высокоэффективной жидкостной хроматографии и масс-спектрометрии с использованием программного обеспечения управления. Для Мбит составов, обессоливания образец, содержащий 20 пмоль Mb в ловушке белка по 1,7 мин с 5% ацетонитрила, 95% воды и 0,1% муравьиной кислоты (FA) и элюируют с использованием градиента увеличена до 80% ацетонитрила, 20% воды и 0,1 % FA в 3,3 мин. Сбор масс-спектры в диапазоне M / Z 200-3,200.
- Для определения массы неповрежденныхБелок, получать данные для undeuterated образца белка (например, белка не подвергались ssHDX) в водном растворе с использованием метода со стадии 2.9.
- Получить массы undeuterated и дейтерированных образцов путем развертки сырые спектры с помощью программного обеспечения для анализа данных. Здесь, установите диапазон масс, чтобы 15,000-18,000 Da, разрешением по массам до 1,0 Д, и высоты пика к 90% для расчета массы Мб.
- Подсчитать количество дейтронов, входящих в состав интактного белка (здесь Мб) путем вычитания массы undeuterated белка от массы дейтерированной белка в каждой обмен момент времени.
- Рассчитать процентов дейтерия поглощения по отношению к теоретическому максимуму, используя следующее уравнение (уравнение 1)
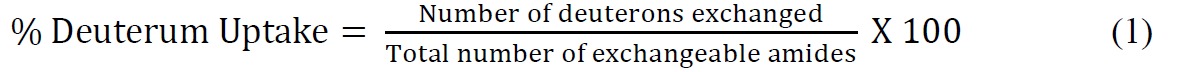
где общее количество обмениваемых амидов = общее количество аминокислот - количество остатков пролина - 2 ("2" приходится на N-концевая аминогруппа и амида водорода, которые подвергаются быстрому резервную обмен). - Установите кинетических данных ssHDX, используя подходящий показательного уравнения. Биэкспоненциальным уравнение (уравнение 2), как правило, простой, что обеспечивает достаточную подгонку к данным ssHDX. В этом исследовании, на МБТ и MBS, соответствуют данным на биэкспоненциальной модели, которая присваивает дейтроны "быстро" и "медленно" обмена бассейны.
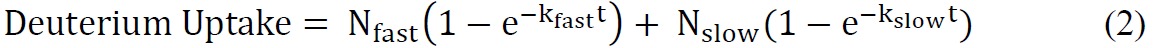
где N быстро и N медленно являются количество сменных амидов "быстро" и "замедлить" обмен бассейны, соответственно, и K быстро и к медленно константы скорости первого порядка, связанные с двумя бассейнами.
3. ssHDX-MS для белка в пептидной уровня
- Выполните ssHDX, выполнив действия 2,1 до 2,8, со следующими изменениями на этапе 2.6. Подключите иммобилизованного пепсина колУМН, и аналитическую колонку с клапаном, как сообщалось ранее 25 и заменить ловушку белка, соединенный с клапаном с пептидной ловушку. Калибровка масс-спектрометра, установив отношения массы к заряду от 100 до 1700.
Примечание: В восстанавливающей стадии (этап 2.8), восстановитель и денатурирующих агент может быть включен в буфере быстрого охлаждения для облегчения пепсином белков с дисульфидными связями (например, моноклональные антитела). - Программирование соответствующий высокоэффективной жидкостной хроматографии и масс-спектрометрии с использованием программного обеспечения управления. Для Мбит формулировок, переварить образцы, содержащие 20 пмоль Мб онлайн с 0,1% FA, ловушки и обессоливания пептидов 1,7 мин с 10% ацетонитрила, 90% воды и 0,1% ФА в пептидной ловушку. Элюируйте фрагменты на аналитической колонке с увеличением градиента к 60% ацетонитрила, 40% воды и 0,1% FA в 4,0 мин. Приобретение масс-спектры в диапазоне M / Z 100-1,700.
- Определить язвенной фрагментов MS / MS анализаundeuterated образец белка. Используйте массовой программное обеспечение спектрометрии для сравнения экспериментальных масс ионов пептидный фрагмент предсказанных масс пептидных фрагментов в пользовательской базы данных. Установите массы отсечки точку (например, 10 частей на миллион), чтобы определить массы с малой ошибкой. Для пептиды соответствуют, подготовить список, состоящий из (I) пептидной последовательности, (II) состояния заряда, и (III) временем удерживания.
- Используйте список сформированных на этапе 3.3 на карту и определить среднее число дейтронов, входящих в каждый пепсина переваривать фрагмент. Это может быть достигнуто путем использования подходящего программного обеспечения для анализа данных HDX-MS 24.
- Чтобы вычислить процент поглощения дейтерия и в соответствии кинетические данные ssHDX для каждого из пептической фрагментов, следуют шаги 2,13 и 2,14. В этом исследовании, HDX кинетических данных для каждого из шести нерезервированном пепсина переваривать фрагменты из Оплот и MBS препараты были установлены в биэкспоненциальной модели ассоциации (уравнения 2).
4. SSPL-MS неповрежденного Proбелок
- Чтобы начать фотолитической реакцию маркировки, первый переключатель на УФ сшивателя и позволяют лампы прогреться в течение 5 мин. Убедитесь, что источник УФ оснащен лампами с длиной волны 365 нм, чтобы активировать diazirine группу pLeu.
ВНИМАНИЕ: Никогда не открывайте дверь УФ сшивателя, когда лампы включены. Защищайте глаза и кожу от воздействия УФ-света, если источник не заключен в стеклянную дверь УФ-защитным. - Выключите УФ сшивателя прежде чем открыть дверь. После того, как лампы выключены, Открывать флаконов, содержащих лиофилизированный состав и поместить их в УФ сшивателя камеры, как показано на рисунке 2В. Облучать образцы с УФ-светом в течение 40 мин.
- Выполните контрольные эксперименты, следуя шаг 4,1 до 4,3 для (I) образцов лиофилизированных без pLeu и (II) образцы лиофилизированные с pLeu восстановленного в воде.
- Крышка и хранить флаконы при температуре -20 ° С до анализа масс-спектрометрического.
- ReconstitУте твердых образцов путем добавления подходящего объема масс-спектрометрии класса дистиллированной воды, чтобы довести концентрацию до 2 мкм.
- Для начала анализа проб, выполните шаги 2,6 и 2,9.
ПРИМЕЧАНИЕ: Поскольку бэк-обмен не проблема с ковалентной маркировки, SSPL-MS не требует специального охлажденного систему LC. - Чтобы определить родной массы белка, получать данные для образца белка, который не был подвергнут SSPL, следуя шаг 2,9. Получить массы немеченых и меченых проб путем развертки сырой спектры как описано в шаге 2.11.
- Рассчитать количество pLeu зарегистрирована на следующую формулу:
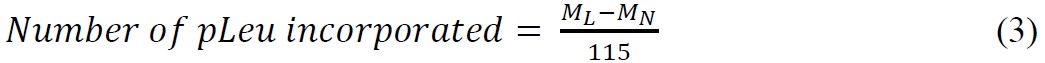
где M L является масса меченого белка, M N является масса нативного белка и 115 средняя масса (Da) добавлен в нативного белка после однократного введения pLeu. Следует отметить, что реакция происходит при маркировке ме потеря N 2 (28 Да). Моноизотопный масса pLeu является 143,07. - Рассчитать процент населения белок с различным числом этикеток с использованием высот пиков из извлеченных ионов хроматограмм.

где "I" обозначает количество меток, рН я обозначает высоту пика для меченого белка L I и рН у обозначает высоту пика в немеченого белка, наблюдали с помощью масс-спектрометрии.
5. SSPL-MS для белка в пептидной уровня
- Выполните SSPL, выполнив действия 4,1 до 4,4.
- Для анализа уровня пептид, восстановить твердые образцы в бикарбоната аммония буфера (100 мМ, рН 8,0).
- После восстановления, смешать с надписью белкового раствора с трипсином при 10: 1 молярном соотношении протеина к трипсина и инкубируют при 60 ° С в течение 16 ч.
- Quench реакцию добавлением 0,1% FAв воде в образце с получением конечной концентрации 2 мкМ белка.
- Подключите петли для образца, пептидный ловушку и аналитическую колонку с клапаном, связанных с системой ВЭЖХ.
- Программирование подходящий высокоэффективной жидкостной хроматографии и масс-спектрометрии с использованием программного обеспечения управления. Для Мбит составов, вводят 20 пмоль переваренной белка в образце петли и обессоливания пептидов в пептидной ловушку в течение 1,5 мин с 5% ацетонитрила, 95% воды и 0,1% FA, с последующим элюированием в аналитической колонке с градиентом увеличится до 55% ацетонитрила, 45% воды и 0,1% FA в 22 мин. Сбор масс-спектры в диапазоне M / Z 100-1,700.
- Подготовка теоретическую список массы для пептида-pLeu аддукты с использованием онлайн-инструмент, такой как ExPASy 26 с номерами pLeu ранее вычисленных из неповрежденного анализа белков. Включите по крайней мере 4 пропущенных расколы. Следует отметить, что реакция маркировки происходит с потерей N 2. Таким образом, масса пептида-pLeu аддукта = масса немеченого попыткиptic пептид + п (масса pLeu) - п (масса N 2), где "N" является количество pLeu включены.
ПРИМЕЧАНИЕ: Если масса анализ интактного белка показал до трех меченых популяций белка, считают до трех возможных pLeu этикеток в пептида. Для пептида с массой 1000 Да, теоретическая масса пептида-pLeu аддукта с 1 pLeu регистрации будет 1000 + 1 (143) - 1 (28) = 1115 Да. Кроме того, теоретические массы пептида-pLeu аддукты с 2 pLeu, 3 и т.д. pLeu бы 1230 Да, 1345 Да, и т.д., соответственно. - Используйте программное обеспечение Масс-анализ в соответствии с теоретической список массовое, сформированных на этапе 5.7 с массами, наблюдаемых экспериментально. Установите массы отсечки точку (например, 50 частей на миллион), чтобы определить массы с малой ошибкой.
- Для пептиды соответствуют, определить фактическое число pLeu включены по формуле в соответствии с шагом 4,8 (уравнение 3), где M L и М Н являются массы помеченыи родной пептид, соответственно.
Результаты
Здесь ssHDX-MS и SSPL-MS были использованы для изучения влияния наполнителей на конформацию и твердотельных взаимодействий лиофилизированных Мб образований. Концентрации белка и наполнителей, используемых в данном исследовании, приведены в таблице 1. Типичные результаты анализа ssHDX-MS и SSPL-MS лиофилизированных Mb, полученных с помощью вышеперечисленных протоколов представлены.
Поглощение дейтерия при неповрежденной уровня белка
ssHDX-MS способна различать Мб составов на неповрежденную уровне. Разрешенный масс-спектры интактных Mb следующих 144 ч ssHDX от разработки MBS показали более широкого внедрения дейтерия, чем формулировка МБТ (3А). В среднем, MBS показали 46% больше поглощение дейтерия, чем МБТ (таблица 2).
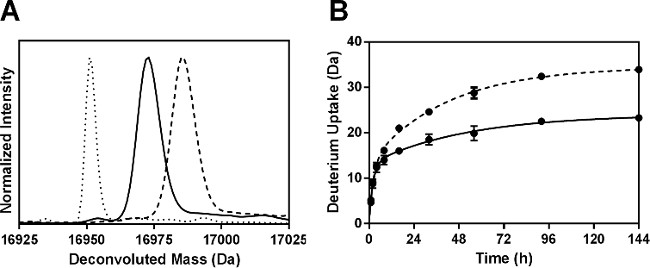
Рисунок 3: ssHDX-MS для интактных Mb: () разрешенный масс-спектры дейтерированных интактных Mb из композиций с бактериовыделением (сплошная линия) и MBS (пунктирная линия) после 144 ч ssHDX. Разрешенный масс-спектр undeuterated интактных Mb Показано также, (пунктирная линия). (B) ssHDX кинетика интактных Мб в составах МБТ (сплошная линия) и MBS (пунктирная линия). Временной ход ssHDX был установлен к уравнению для двухфазной экспоненциальной ассоциации с использованием диаграммы Pad Prism версию программного обеспечения 5 (п = 3, ± SD).
Дейтерирование кинетика интактных MBS и МБТ похожи на ранние моменты времени (1-4 ч), но MBS показали увеличение дейтерообмен с увеличением времени (8-144 ч) (рис 3Б). Это свидетельствует о важности выбора более длинные временные точки для ssHDX при более низких RH и температурных условий. Кроме того, сорбции и диффузии 2 O процесс D может влиять на скорость ssHDX на ранней временной роИнтс. Наши предыдущие исследования показали, что сорбции влаги в ssHDX завершена в течение нескольких часов, и имеет минимальную вклад в кинетику обмена за это время. Наблюдаемая скорость и степень обмена, следовательно, не просто меры D 2 O адсорбции 27,28. Маленькие слитки об ошибках в 3В, с указанием стандартных отклонений от трех независимых выборок ssHDX-MS, показывают, что эксперимент очень воспроизводимые.
| Дейтерий Поглощение (%) б | N быстро с | К быструю C | N медленно с | К медленное C | |
| МБТ | 15,9 ± 0,5 | 13.1 (0.8) | 0,43 (0,03) | 11,0 (0,9) | 0.019 (0,001) |
| MBS | 23,2 ± 0,5 | 15.4 (0.7) | 0,49 (0,04) | 19,2 (0,6) | 0,024 (0,002) |
| % Изменения d | 46% | 18% | 14% | 75% | 26% |
Таблица 2:. Количественные показатели поглощения дейтерия в исследованиях ssHDX МБ составов приведены в таблице 1 для композиции B Процент поглощения дейтерия по отношению к теоретическому максимуму интактными Мб после 144 час при HDX на 5 ° C, 43% RH (N = 3. , параметры означают ± SD). С определяется нелинейной регрессии ssHDX-MS кинетических данных. Временной ход дейтерообмена неповрежденного Mb был установлен в биэкспоненциальной ассоциации модели (Уравнение. 2). В скобках указаны стандартные ошибки параметров регрессии. D Процентное изменение измерений были Расчитатьально, как 100 х [(значение из MBS - стоимость от MBT) / (значение из MBT)].
Параметры регрессии (N быстро, N медленно, K быстро и K медленно) для поглощения дейтерия кинетики для МБТ и MBS приведены в таблице 2. Хотя N быстрые и N медленные значения больше для MBS, чем МБТ, различия в N медленно значения были выше, чем различия в N быстрых значений. В частности, Н быстрого значение в MBS только 18% больше, чем в МБТ, в то время как медленное значение N в MBS 75% больше, чем в МБТ. Это говорит о том, что чем меньше N медленные значения в МБТ может быть связано с более высокой удержания структуры защиты или амидных групп Мбит по наполнителей, которые подвергаются D 2 O в MBS. Однако подробные механизмы не ясно понимать. Константы скорости (K быстро и K медленно) для обеих композиций очень похожи.
поглощение дейтерия на уровне пептидной
После пепсином, в общей сложности 52 пептидов были определены. Шесть нерезервированные фрагменты, соответствующие 100% последовательности Мб были использованы для анализа сообщили здесь. Дополнительная информация может быть получена с помощью перекрывающихся фрагментов, как сообщалось в нашей группе ранее 24. Поглощение процентов дейтерия для каждого пептида был рассчитан, и результаты от 144 образцов ч нанесены (фиг.4А). HDX кинетики для шести язвенной фрагментов показал, биэкспоненциальной поведение (рис 4б), в соответствии с субпопуляции амидных атомов водорода, находящихся "быстрый" и "медленный" обмен.
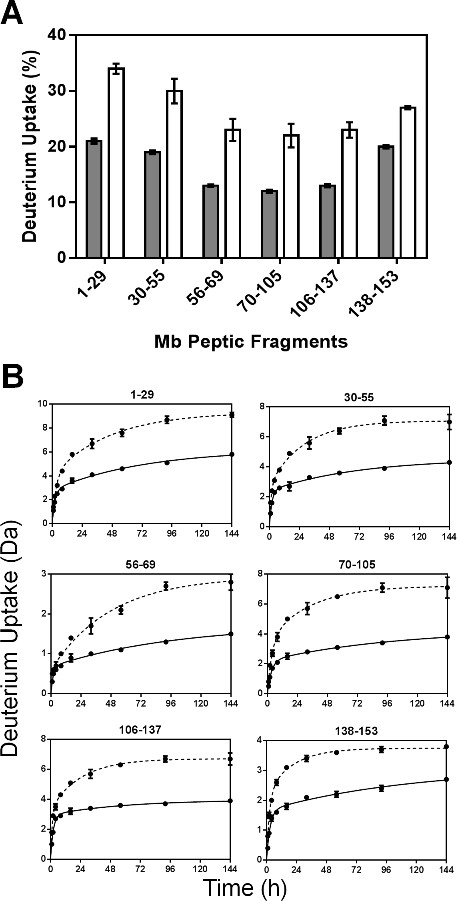
Рисунок 4: ssHDX-МС для Mb на уровне пептидной (А) захвата Процент дейтерия в течение 6 не-Редуndant язвенная фрагменты из Mb в составах, МБТ (серый) и MBS (белый) после 144 ч HDX. (B) ssHDX кинетика шести нерезервированных язвенной фрагментов из мб составов МБТ (сплошная линия) и MBS (пунктирная линия). Временной ход ssHDX был установлен к уравнению для двухфазной экспоненциальной ассоциации с использованием диаграммы Pad Prism версию программного обеспечения 5 (п = 3, ± SD).
Параметры регрессии для нерезервированных пептидов представлены на рисунке 5. Как оборудованные константы скорости пептидных фрагментов не средняя константа скорости для отдельных амидов, наблюдаемые константы скорости язвенной фрагментов не может быть линейно связана с тем, для интактного белка. В N быстро значения для большинства пептических фрагментов (за исключением фрагмента 56-69) в составах MBS были немного больше, чем в МБТ (5А). Точно так же, К быстро значения, как правило показали небольшое различие между formulatioнс и в различных регионах молекулы Мб (рис 5б). Тем не менее, N медленные и К медленные значения для MBS значительно больше во всех фрагментов, чем на МБТ (рис 5С и 5D). Значительное увеличение N медленно и к медленной для MBS может отражать большую мобильность амидных групп в "медленных" обмена бассейнов.
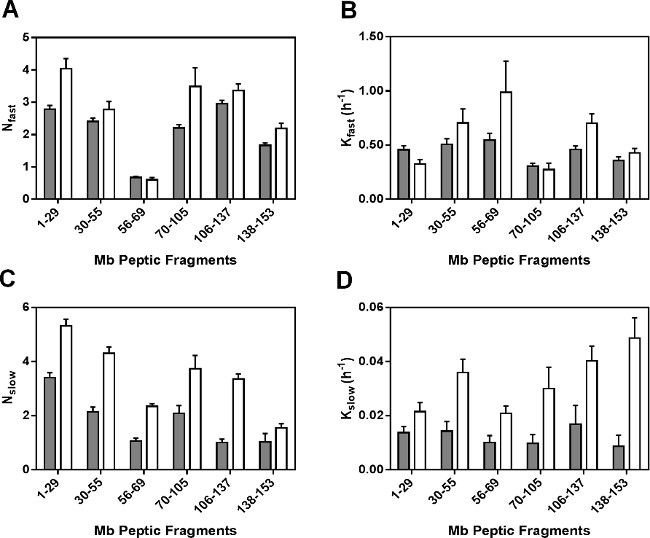
Рисунок 5: ssHDX кинетические параметры для Мбит язвенной пептидов: N быстро (), K быстрый (B), N медленно (C) и K медленно (D), полученные от нелинейной регрессии ssHDX-MS кинетических данных в течение шести нерезервированных язвенной пептидов из Mb в составах MBT (серый) и MBS ( белый) (п = 3, ± SE).
Фотолитические маркировка на уровень интактного белка
Мб облучении в присутствии 20-кратным избытком pLeu формируется множество MB-pLeu аддукты, как обнаружено с помощью ЖХ-МС (6А). Деконволюции спектров на МБТ облучали в течение 40 мин с 20-кратным pLeu показали до 3 меток с добавлением +115, +230 и +345 Da к массе немеченого Мб. MBS облученных аналогично с 20х pLeu показали меньше pLeu поглощение в неповрежденной уровне, с до 2 меченых популяций, обнаруженных методом ЖХ-МС.
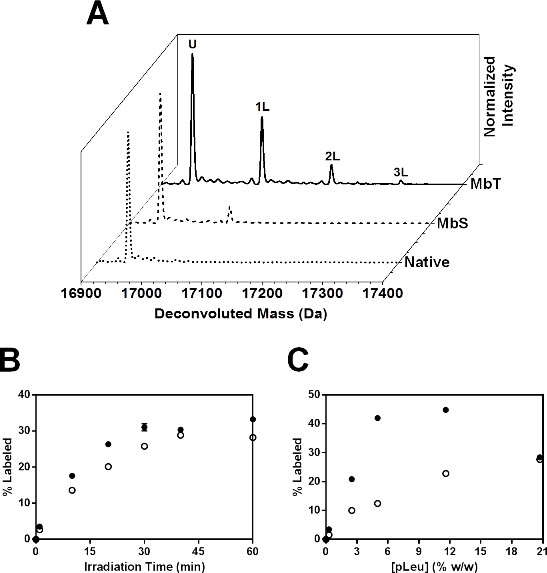
Рисунок 6: SSPL-MS для интактных Mb: () масс-спектры разрешенный для МБТ (сплошная линия) и MBS (пунктирная линия), меченных 20x избытком (5% вес / вес) pLeu. Разрешенный масс-спектр родной Mb (Мб лиофилизировали и облучали в отсутствие pLeu) показана в пунктирной линией. У обозначает население белка, который остается немеченый после облучения. Популяции белка балансовой 1, 2 и 3 pLeu этикетки представлены в виде 1L, 2L и 3L соответственно. (B) SSPL-MS кинетика интактных Mb в составах МБТ (закрашенные кружки) и MBS (открытые кружки), как функцию концентрации pLeu. Все образцы облучали в течение 40 мин. Столбики ошибок находятся в символах. (С) SSPL-MS кинетика интактных Mb в составах МБТ (закрашенные кружки) и MBS (открытые кружки) и облучали лиофилизированные в присутствии 100-кратного избытка pLeu (20,7% вес / вес) в зависимости от времени облучения. Столбики ошибок находятся в символах.
В кинетических исследований, процент меченого белка увеличивается экспоненциально как для МБТ и MBS с увеличением времени облучения (рис 6В). MBS показали меньше pLeu поглощение, чем МБТ в каждый момент времени облучения. Оба состава видимому, достигают плато при 40 мин. Таким образом, кинетическое исследование может быть для нас eful определить продолжительность облучения, необходимой для получения полной активации pLeu. Кинетика маркировки были изучены в зависимости от концентрации pLeu (фиг.6С). Процентов меченого белка увеличивается с концентрацией pLeu как для МБТ и MBS. Тем не менее, на 20,7% вес / вес pLeu, МБТ показали снижение поглощения pLeu. Это может быть из-за исключения pLeu от поверхности белка при высокой концентрации pLeu. Таким образом, исследование с различной концентрацией pLeu должны быть выполнены, чтобы выбрать соответствующую концентрацию pLeu, что позволяет в течение достаточного маркировки по поверхности белка без исключения поверхности. В этом исследовании, 20x избыток pLeu был выбран для дальнейших исследований пептид-уровня.
Общая уменьшилось маркировка наблюдается MBS предлагает плохой боковой цепи доступность для матрицы, содержащей pLeu. Это согласуется с конформационных изменений в присутствии сорбитола, что приводит к снижению маркировки.
Содержание "> фотолитические маркировка на уровне пептиднойОсновываясь на неповрежденных исследований мечения белков, 20x избыток pLeu был выбран для сравнения Оплот и MBS на уровне пептидов. Меченые пробы были расщепляли трипсином и анализировали с помощью ЖХ-МС. В общей сложности 40 пептидов, соответствующих 100% от последовательности Мбит были обнаружены на МБТ и MBS образцов. В некоторых случаях, триптическое переваривание может обеспечить ограниченное покрытие последовательность белка, если Lys и / или Arg остатки в значительной степени помечены. Для улучшения охвата последовательности, смесь трипсина и химотрипсина может быть использован для переваривания меченого белка.
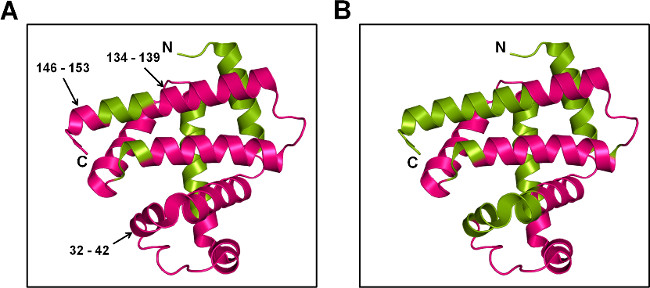
Рисунок 7: SSPL-MS для БМ на уровне пептид: мультфильм представительство Mb помечены 20x избыточного pLeu (5% вес / вес) в присутствии трегалозы (А) и сорбит (B). Меченый белок расщепляют trypsiп и меченых пептидов были нанесены на кристаллической структуре MB (PDB ID 1WLA). Меченые и немаркированные регионы окрашены пурпурный и зеленый, соответственно.
SSPL-MS с трипсина пищеварения обеспечивает качественную информацию о пептиды клеймо. С учетом различных меченых популяции в интактной уровне, беспорядочные механизм pLeu маркировки и различий в эффективности ионизации меченых пептидов и немеченого, трудно получить количественные показатели для SSPL-МС после расщепления. Тем не менее, качественная информация еще может дать представление о белковых конформационных изменений на уровне пептидов. В этом исследовании, как Оплот и MBS препараты показали поглощение pLeu на большей части поверхности белка. По сравнению с MBS, пептидные фрагменты 32-42, 134-139 и 146-153 от МБТ показали pLeu маркировки (Рисунок 7). Это говорит о том, что боковые цепи этих аминокислот подвергаются pLeu, как спиралей в этих регионс целы в матрице MBT. В отличие от этого, защита от pLeu маркировки в матрице MBS согласуется с структурных возмущений в этих регионах.
В целом, результаты ssHDX-МС и SSPL-MS показывают, что методы могут обеспечить дополнительную информацию пептида уровня с высоким разрешением о позвоночника (ssHDX-MS) и боковой цепью (SSPL-MS) воздействия и наполнителей эффектов в лиофилизированных композиций белка ,
Обсуждение
Несколько исследований показали, что локальное окружение в лиофилизированных образцов влияет деградацию белков 5,29,30. Однако установление прямой связи между структурой белка и стабильности в твердом состоянии не представляется возможным из-за отсутствия аналитических методов высокого разрешения. Применение существующих высоких методов разрешения, например, HDX и ФЛ лиофилизированных порошков требует модификации протоколов решений и осторожной интерпретации данных. HDX-MS и PL-MS были последовательно приняты для мониторинга конформации белков в твердом состоянии. Результаты, представленные здесь и в других местах 27,28,31-33 продемонстрировали способность этих методов для контроля конформацию белка с высоким разрешением в твердом окружающей среды. Хотя важные шаги в анализе данных не меняются от маркировки в растворе 34-36, важные соображения во время экспериментальной установки и интерпретации данных, необходимых для твердотельных химикокал маркировка.
Выбор маркировки реагента должно быть основано на размере и механизма маркировки. Небольшой размер позволяет дейтерия пептидный скелет, чтобы быть проверены легко, в то время как относительно больший размер pLeu ограничивает маркировку на боковых цепей. Как ssHDX и SSPL не показывают предпочтение какой-либо аминокислоте, так, чтобы маркировки зависит только от позвоночника и боковой цепи воздействия матрицы. Для эффективного исследовать конформации белков в твердом состоянии, внешние факторы, влияющие на процесс маркировки должны быть тщательно контролируется. Общее количество и пространственное распределение маркировки агентом в лиофилизированных твердых отличается от водных растворов.
В ssHDX, количество D 2 O в твердой матрице может повлиять на скорость разворачивания белка (или частичный разворачивается), повторной укладки и дейтерообмена. Это не так с раствором HDX, в котором образец белка, как правило, разбавленного с обильным объемом D 2 O.Тщательное обследование эффектов гидратации на скорость ssHDX можете сообщить выбора идеальных условиях РЗ. Для контроля скорости сорбции влаги и избежать коллапса порошка в композициях, содержащих гигроскопические наполнители (например, сахарозу и трегалозу), ssHDX можно проводить в условиях охлаждения (2-8 ° С). Наш предыдущий исследование эффектов гидратации показали увеличение скорости и степени обмена с увеличением содержания влаги, как и ожидалось. В большей части нашей работы, промежуточный относительная влажность 43% при 5 ° С оказалась идеальным различать формулировки в разумные сроки 24. Реакцию обычно проводят до тех пор, не будет достигнуто плато. Это гарантирует, что сорбция влаги и диффузия в твердой не контролировать скорость HDX. Использование малых твердых размеров выборки с объемом до лиофилизации ≤2 мл также помогает гарантировать, что сорбция паров D 2 O является практически полное начале периода обмена. Хотя ssHDX-MS обеспечиваетколичественная информация о конформации белка в твердом состоянии, есть определенные условия, в которых интерпретация данных не может быть полностью основанные на изучении ssHDX в одиночку. Вполне возможно, что уменьшилось поглощения дейтерия наблюдалось в образце (по сравнению с контролем) может быть связано с более высокой удержания структуры белка или значительного количества белковых агрегатов, присутствующих в образце. В таком случае интерпретация данных ssHDX требуется результаты других дополнительных методов. Уширение пика в дейтерированном масс-спектров наблюдается в течение нескольких Мбит формулировок 27,28. Это может быть из-за различных факторов, таких как наличие частично развернутом населения белка, пространственной неоднородности в образце или пространственных градиентов концентрации D 2 O. Тем не менее, эти факторы не были выделены в ssHDX-МС и нуждается в дальнейшем исследовании.
Как SSPL-MS является относительно новым по сравнению с другими методами, непрерывного обучения абиз ее приложений и ограничений не требуется. В SSPL, фото-сшивающий агент подвергают лиофилизации с белком. Отсутствие влаги ограничивает подвижность компонентов в матрице твердого вещества, а парциальное структурной релаксации, что может произойти с сорбции влаги в ssHDX не явление в SSPL. Это ограничивает маркировки в SSPL в непосредственной близости от фото-сшивающий агент. Тем не менее, в отличие от HDX-MS, MS / MS анализа ковалентно меченого белка может обеспечить структурную информацию Остаток уровне. С SSPL маркировка ковалентной и необратимым, обратно обмен не происходит и образцы могут быть подготовлены и проанализированы, не заботясь о потере этикетке. Для облегчения распространения маркировки агента и повысить эффективность маркировки в твердой матрицы, SSPL могут быть выполнены с увеличением% относительной влажности. Поглощение pLeu также может быть улучшена за счет повышени концентрации фотореакционноспособного агента. Молярное отношение белка к pLeu можно варьировать по желанию. В общем, 100x мол рный избыток pLeu чтобы пробелок позволит обеспечить адекватное маркировки. Тем не менее, высокая концентрация pLeu может привести к потере белка третичной структуры в твердой матрице. Таким образом, в дополнение к маркировке кинетики и разработки состава, выбор концентрации pLeu также должны быть основаны на поддержание белка структурной целостности. Как pLeu неизбирательно этикетки XH (где X = C, N, O) группа, возможно, что наполнители с аналогичных сайтов маркировки может значительно влиять на уровень маркировки белка. Вмешательство наполнителей в наличии pLeu для маркировки белка еще можно охарактеризовать. Известно, что карбеновый полученные от активации diazirine не остатка конкретных Однако одно исследование сообщает уклон в сторону Asp и Glu 36. В то время как это хорошо, чтобы узнать о взаимодействии конкретных остатков, пептида уровня информация также полезны и могут быть использованы для создания наполнители блокировать участки с высокой экспозицией матрицы в твердом состоянии. SSPL-MS предоставляет подробную качественную информацию, однаконуждается количественные данные, которые будут получены и надежные показатели должны быть разработаны для анализа рецептур различия между различными лиофилизированных систем.
Использование метки конкретных остатков в сочетании с анализом МС / МС может еще больше повысить разрешение на уровне аминокислотной. Маркировка реагенты, такие как 2,3-бутандион маркировать Arg, N производные -hydroxysuccinimide для Lys и N производных -alkylmaleimide для Cys может быть использован для точного отображения молекулярные взаимодействия в лиофилизированного порошка. Однако эти реагенты являются рН-зависимые и реакции могут быть не столь хорошо контролироваться фотолитического маркировки в твердом состоянии. Альтернативный подход состоит во введении фотографию-сшивающий агент в последовательности белка с использованием ауксотрофных клеточных линий, сайт-направленный мутагенез или боковой цепи производных.
Наши предыдущие исследования ssHDX-МС и SSPL-МС показали, что маркировка белка зависит от природы и количества вспомогательных веществиспользовать 24,27,28,31-33,37,38. ssHDX-МС Мб совместно лиофилизованы гуанидингидрохлорида (Gdn.HCl) показали более широкого внедрения дейтерия, чем Мб совместно лиофилизованы с низким молекулярным весом сахара 32. В отдельном исследовании SSPL-MS, Мб совместно лиофилизованы Gdn.HCl показали большую защиту от фотолитического маркировки, чем Мб с сахарозой 33. Кроме того, количественные измерения от ssHDX-MS были тесно связаны со стабильностью протеина при длительном хранении 28. Эти исследования показали, что ssHDX или SSPL белка отражает степень структурной удержания белка в лиофилизированного порошка. Мы считаем, что сохранение вторичной структуры в лиофилизированных порошков обеспечивает благоприятную среду для боковой цепи маркировки с pLeu и защиты амидного водорода из дейтерообмена. Тем не менее, детальное сравнение информационного контента из этих методов должна быть выполнена в будущем. Хотя создание полезность ssHDX-МС и SSPL-МСв виде препарата скрининга в конечном итоге потребует, чтобы он был применен ко многим белков, результаты наших недавних исследований поддерживает ее широкому внедрению. При дальнейшем развитии эти методы как ожидается, будет широко полезным для характеристики белковыми составами твердотельные в биофармацевтической промышленности.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The authors gratefully acknowledge financial support from NIH R01 GM085293 (PI: E. M. Topp) and from the College of Pharmacy at Purdue University.
Материалы
| Name | Company | Catalog Number | Comments |
| Equine myoglobin | Sigma-Aldrich | M0630-5G | |
| D-(+)-Trehalose dihydrate | Sigma Aldrich | #T9531 | |
| D-Sorbitol | Sigma Aldrich | #240850 | |
| L-Photo-leucine | Thermo Scientific | #22610 | |
| Potassium phosphate monobasic | Sigma-Aldrich | #P0662 | |
| Potassium phosphate dibasic | Sigma-Aldrich | #P3786 | |
| Deuterium Oxide | Cambridge Isotope Laboratories | #DLM-4-PK | Alternate (Cat. No.: 151882, Sigma-Aldrich) |
| Immobilized pepsin | Applied Biosystems | #2-3132-00 | |
| Trypsin | Promega | #V511A | Chymotrypsin (Cat. No.: #V1062, Promega) can be additionally used |
| Water, Optima LC/MS grade | Fisher Chemical | #7732-18-5 | |
| Acetonitrile | Sigma-Aldrich | #34998 | |
| Formic acid | Thermo Scientific | #28905 | |
| ESI-TOF Calibrant | Agilent Technologies | #G1969-85000 | Highly flammable liquid |
| Protein microtrap | Michrom Bioresources | TR1/25108/03 | |
| Peptide microtrap | Michrom Bioresources | TR1/25109/02 | |
| Analytical column | Agilent Technologies | Zorbax 300SB-C18 | |
| Freeze dryer | VirTis AdVantage Plus | ||
| Stratalinker equipped with five 365 nm lamps | Stratagene Corp. | Stratalinker 2400 | |
| HPLC | Agilent Technologies | 1200 series LC | Refrigerated LC system for HDX-MS |
| ESI-qTOF MS | Agilent Technologies | 6520 qTOF | |
| HDExaminer (HDX-MS data analysis software) | Sierra Analytics | http://www.massspec.com/HDExaminer.html |
Ссылки
- Lawrence, S. Billion dollar babies--biotech drugs as blockbusters. Nat. Biotechnol. 25 (4), 380-382 (2007).
- . . Global Markets and Manufacturing Technologies for Protein Drugs. , BIO021D (2013).
- Lai, M. C., Topp, E. M. Solid-state chemical stability of proteins and peptides. J. Pharm. Sci. 88 (5), 489-500 (1999).
- Carpenter, J. F., Pikal, M. J., Chang, B. S., Randolph, T. W. Rational design of stable lyophilized protein formulations: some practical advice. Pharm. Res. 14 (8), 969-975 (1997).
- Carpenter, J. F., Chang, B. S., Garzon-Rodriguez, W., Randolph, T. W. Rational design of stable lyophilized protein formulations: theory and practice. Pharm. Biotechnol. 13, 109-133 (2002).
- Wüthrich, K. Protein structure determination in solution by NMR spectroscopy. J. Biol. Chem. 265 (36), 22059-22062 (1990).
- Ilari, A., Savino, C. Protein structure determination by x-ray crystallography. Methods. Mol. Biol. 452, 63-87 (2008).
- Brunger, A. T. X-ray crystallography and NMR reveal complementary views of structure and dynamics. Nat. Struct. Biol. 4, 862-865 (1997).
- Yu, L. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv Drug. Deliv. Rev. 48 (1), 27-42 (2001).
- Manning, M. C. Use of infrared spectroscopy to monitor protein structure and stability. Expert. Rev. Proteomics. 2 (5), 731-743 (2005).
- Grohganz, H., Gildemyn, D., Skibsted, E., Flink, J. M., Rantanen, J. Rapid solid-state analysis of freeze-dried protein formulations using NIR and Raman spectroscopies. J. Pharm. Sci. 100 (7), 2871-2875 (2011).
- Bai, S., Nayar, R., Carpenter, J. F., Manning, M. C. Noninvasive determination of protein conformation in the solid state using near infrared (NIR) spectroscopy. J. Pharm. Sci. 94 (9), 2030-2038 (2005).
- Pikal, M. J., et al. Solid state chemistry of proteins: II. The correlation of storage stability of freeze-dried human growth hormone (hGH) with structure and dynamics in the glassy solid. J. Pharm. Sci. 97 (12), 5106-5121 (2008).
- Wang, B., Tchessalov, S., Cicerone, M. T., Warne, N. W., Pikal, M. J. Impact of sucrose level on storage stability of proteins in freeze-dried solids: II. Correlation of aggregation rate with protein structure and molecular mobility. J. Pharm. Sci. 98 (9), 3145-3166 (2009).
- Schule, S., Friess, W., Bechtold-Peters, K., Garidel, P. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations. Eur. J. Pharm. Biopharm. 65 (1), 1-9 (2007).
- Baerga-Ortiz, A., Hughes, C. A., Mandell, J. G., Komives, E. A. Epitope mapping of a monoclonal antibody against human thrombin by H/D-exchange mass spectrometry reveals selection of a diverse sequence in a highly conserved protein. Protein. Sci. 11 (6), 1300-1308 (2002).
- Coales, S. J., Tuske, S. J., Tomasso, J. C., Hamuro, Y. Epitope mapping by amide hydrogen/deuterium exchange coupled with immobilization of antibody, on-line proteolysis, liquid chromatography and mass spectrometry. Rapid. Commun. Mass. Spectrom. 23 (5), 639-647 (2009).
- Pacholarz, K. J., Garlish, R. A., Taylor, R. J., Barran, P. E. Mass spectrometry based tools to investigate protein-ligand interactions for drug discovery. Chem. Soc. Rev. 41 (11), 4335-4355 (2012).
- Houde, D., Peng, Y., Berkowitz, S. A., Engen, J. R. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol. Cell. Proteomics. 9 (8), 1716-1728 (2010).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. J. Pharm. Sci. 100 (6), 2071-2086 (2011).
- Dorman, G., Prestwich, G. D. Using photolabile ligands in drug discovery and development. Trends. Biotechnol. 18 (2), 64-77 (2000).
- Robinette, D., Neamati, N., Tomer, K. B., Borchers, C. H. Photoaffinity labeling combined with mass spectrometric approaches as a tool for structural proteomics. Expert. Rev. Proteomics. 3 (4), 399-408 (2006).
- Greenspan, L. Humidity fixed points of binary saturated aqueous solutions. Journal of Research of the National Bureau of Standards. 81A (1), 8 (1977).
- Sophocleous, A. M., Zhang, J., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 1. Exchange mapping. Mol. Pharm. 9 (4), 718-726 (2012).
- Keppel, T. R., Jacques, M. E., Young, R. W., Ratzlaff, K. L., Weis, D. D. An efficient and inexpensive refrigerated LC system for H/D exchange mass spectrometry. J. Am. Soc. Mass. Spectrom. 22 (8), 1472-1476 (2011).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic. Acids. Res. 31 (13), 3784-3788 (2003).
- Sophocleous, A. M., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 2. Exchange kinetics. Mol. Pharm. 9 (4), 727-733 (2012).
- Moorthy, B. S., Schultz, S. G., Kim, S. G., Topp, E. M. Predicting Protein Aggregation during Storage in Lyophilized Solids Using Solid State Amide Hydrogen/Deuterium Exchange with Mass Spectrometric Analysis (ssHDX-MS). Mol. Pharm. 11 (6), 1869-1879 (2014).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203 (1-2), 1-60 (2000).
- Sarciaux, J. M., Mansour, S., Hageman, M. J., Nail, S. L. Effects of buffer composition and processing conditions on aggregation of bovine IgG during freeze-drying. J. Pharm. Sci. 88 (12), 1354-1361 (1999).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Characterizing protein structure in amorphous solids using hydrogen/deuterium exchange with mass spectrometry. Anal. Biochem. 366 (1), 18-28 (2007).
- Sinha, S., Li, Y., Williams, T. D., Topp, E. M. Protein conformation in amorphous solids by FTIR and by hydrogen/deuterium exchange with mass spectrometry. Biophys. J. 95 (12), 5951-5961 (2008).
- Iyer, L. K., Moorthy, B. S., Topp, E. M. Photolytic labeling to probe molecular interactions in lyophilized powders. Mol. Pharm. 10 (12), 4629-4639 (2013).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. J. Vis. Exp. (81), e50839 (2013).
- Kaltashov, I. A., Bobst, C. E., Abzalimov, R. R. H/D exchange and mass spectrometry in the studies of protein conformation and dynamics: is there a need for a top-down approach. Anal. Chem. 81 (19), 7892-7899 (2009).
- Jumper, C. C., Schriemer, D. C. Mass spectrometry of laser-initiated carbene reactions for protein topographic analysis. Anal. Chem. 83 (8), 2913-2920 (2011).
- Li, Y., Williams, T. D., Topp, E. M. Effects of excipients on protein conformation in lyophilized solids by hydrogen/deuterium exchange mass spectrometry. Pharm. Res. 25 (2), 259-267 (2008).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Trehalose and calcium exert site-specific effects on calmodulin conformation in amorphous solids. Biotechnol. Bioeng. 97 (6), 1650-1653 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены