Method Article
Spectrométrie de masse approches pour étudier la structure des protéines et interactions dans lyophilisées Poudres
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Here, we present detailed protocols for solid-state amide hydrogen/deuterium exchange mass spectrometry (ssHDX-MS) and solid-state photolytic labeling mass spectrometry (ssPL-MS) for proteins in solid powders. The methods provide high-resolution information on protein conformation and interactions in the amorphous solid-state, which may be useful in formulation design.
Résumé
Amide hydrogène / échange de deutérium (ssHDX-MS) et la chaîne latérale d'étiquetage photolytique (Sspl-MS) suivie d'une analyse par spectrométrie de masse peuvent être utiles pour la caractérisation des formulations lyophilisées de protéines thérapeutiques. Marquage suivie d'une digestion protéolytique convenable permet à la structure de la protéine et des interactions à être mis en correspondance avec une résolution au niveau du peptide. Étant donné que la protéine éléments structurels sont stabilisées par un réseau de liaisons chimiques à partir des chaînes principales et des chaînes latérales d'acides aminés, un étiquetage spécifique d'atomes dans les résidus d'acides aminés donne un aperçu de la structure et la conformation de la protéine. Contrairement aux méthodes de routine utilisées pour étudier les protéines dans les solides lyophilisés (par exemple, FTIR), ssHDX-MS-MS et SSPL fournissent des informations quantitatives et spécifiques au site. L'étendue de incorporation du deutérium et les paramètres cinétiques peut être liée à l'échange rapide et lentement piscines amide (N rapide, N lent) et reflète directement les degree de repliement des protéines et de la structure dans des formulations lyophilisées. Étiquetage photolytique Stable ne subit pas de back-échange, un avantage sur ssHDX-MS. Ici, nous fournissons des protocoles détaillés pour les deux ssHDX-MS-MS et Sspl, en utilisant de la myoglobine (Mb) en tant que protéine modèle dans des formulations lyophilisées contenant soit le trehalose ou le sorbitol.
Introduction
médicaments de protéines sont le secteur le plus dynamique de l'industrie biopharmaceutique et offrent de nouveaux traitements prometteurs pour des maladies jusque-là insolubles, y compris les troubles hormonaux, cancers et maladies auto-immunes 1. En 2012, le marché mondial de produits biothérapeutiques atteint $ 138 000 000 000 et devrait atteindre $ 179 000 000 000 d'ici l'an 2018 2. Les protéines sont plus grandes et plus fragile que les médicaments à petites molécules classiques et sont donc plus sensibles à de nombreux types de dégradation 3. Pour assurer la durée de vie et la stabilité adéquate, médicaments protéiques sont souvent formulées comme lyophilisé (ie, lyophilisé) poudres solides. Toutefois, une protéine peut encore subir une dégradation à l'état solide, en particulier si sa structure native ne est pas préservée lors de la 4,5- processus de lyophilisation. Assurer que la structure a été retenue ne est possible que se il ya des méthodes d'analyse qui peut sonder la conformation des protéines dans l'état solide avec suffisant résolution.
6 spectroscopie RMN et cristallographie aux rayons X 7 sont les méthodes à haute résolution communément utilisés pour évaluer la structure des protéines en solution et des solides cristallins 8. En raison de la nature des excipients et des méthodes de traitement utilisées, les formulations de protéines lyophilisées sont habituellement amorphe plutôt que cristalline 9. Le manque d'homogénéité et de l'ordre microscopique rend les techniques mentionnées ci-dessus impraticable pour les protéines dans les solides amorphes. Spectroscopie infrarouge à transformée de Fourier (FTIR) 10, 11 spectroscopie Raman et la spectroscopie proche infrarouge (NIR) 12 ont été régulièrement utilisée par l'industrie biopharmaceutique de comparer structure secondaire des protéines en poudres lyophilisées à celle de la structure de l'État-solution native. Cependant, ces méthodes sont en basse résolution et ne peuvent fournir des informations sur les changements globaux de la structure secondaire. Caractérisation structurale à l'état solide par FTIRa montré soit faible ou pauvre 13,14 15 corrélation avec la stabilité de stockage à long terme. Ces limites soulignent la nécessité de méthodes appropriées à haute résolution pour identifier protéines perturbations structurelles à l'état solide.
Marquage chimique associée à la protéolyse et l'analyse par spectrométrie de masse a émergé comme une approche puissante à la surveillance de la structure des protéines et des interactions moléculaires en solution aqueuse. Dans le développement pharmaceutique, HDX-MS a été utilisé pour la cartographie de l'épitope dans les interactions antigène-anticorps 16,17, pour cartographier les interactions récepteur-drogue 18, pour surveiller les effets des modifications post-traductionnelles sur la conformation des médicaments protéiques 19, et de comparer variation dans le développement de biosimilaires 20 lot à lot. De même, les ligands photoactivables ont été utilisés pour identifier des cibles de médicaments et de déterminer l'affinité de liaison et la spécificité des interactions médicament-récepteur 21,22. Pour envoyerxtend l'application de ces méthodes à des formulations lyophilisées, notre groupe a développé à l'état solide échange de deutérium d'hydrogène spectrométrie de masse (ssHDX-MS) et à l'état solide spectrométrie de masse d'étiquetage photolytique (SSPL-MS) pour étudier conformations de protéines et les interactions de l'excipient dans les échantillons lyophilisés avec une grande résolution.
Dans les deux ssHDX-MS-MS et Sspl, la protéine est marquée dans des conditions réactionnelles optimales dans les solides lyophilisées, et les échantillons sont ensuite reconstitué et analysé par spectrométrie de masse avec ou sans digestion protéolytique. ssHDX-MS fournit des informations sur l'exposition principale de la chaîne à la vapeur de deutérium, tout en SSPL-MS fournit des informations sur l'environnement des chaînes latérales (Figure 1). Les deux méthodes peuvent ainsi fournir des informations complémentaires sur la conformation des protéines dans l'état solide. Ici, nous fournissons un protocole général pour étudier les protéines dans les solides lyophilisés utilisant ssHDX-MS et SSPL-MS (Figure 2), en utilisant comme Mbune protéine modèle. Nous montrons la capacité des deux méthodes pour distinguer des différences dans des formulations avec des excipients deux différents.
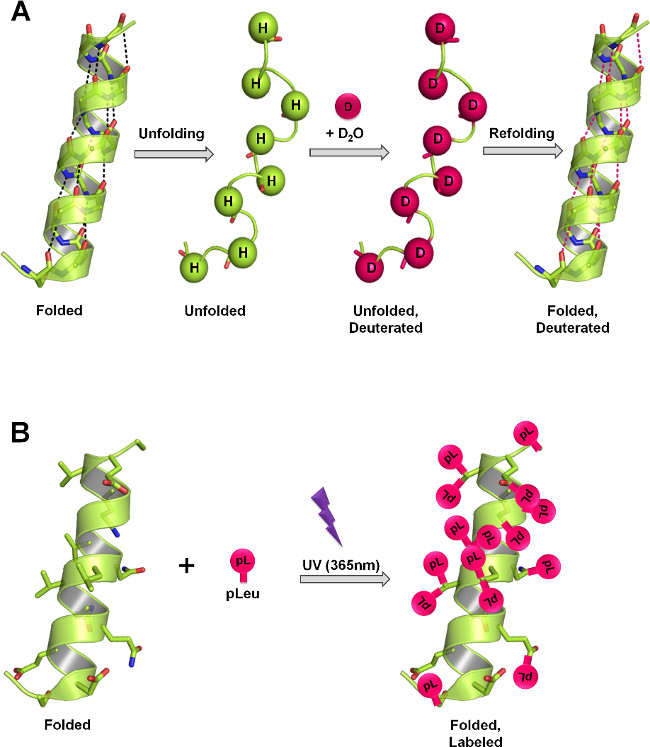
Figure 1:. La structure des protéines de mesure ssHDX et Sspl dans les solides lyophilisées au moyen de mécanismes d'étiquetage différents (A) Dans HDX, l'amide du squelette hydrogènes avec échange de deutérium en fonction de la structure des protéines et D 2 O accessibilité. Dans l'état solide, le taux et l'étendue de l'échange de deutérium dépendent du niveau de sorption D 2 O, la mobilité de la protéine (repliage et dépliage événements) et la nature des excipients présents dans la matrice solide. (B) En PL, irradiation UV à 365 nm initie la formation d'un intermédiaire réactif carbène à partir du groupe fonctionnel diazirine de pleu et est inséré de manière non spécifique dans ne importe quelle liaison de XH (X = ne importe quel atome) ou added à travers une liaison C = C dans son voisinage immédiat. Dans l'état solide, le taux et l'étendue du marquage dépendent de la concentration locale de l'agent de marquage, le temps d'irradiation, la structure des protéines et de la nature des excipients présents dans la matrice solide. Les panneaux A et B montrent l'étiquetage théorique maximale qui peut se produire sur squelette et des chaînes latérales respectivement en protéine.
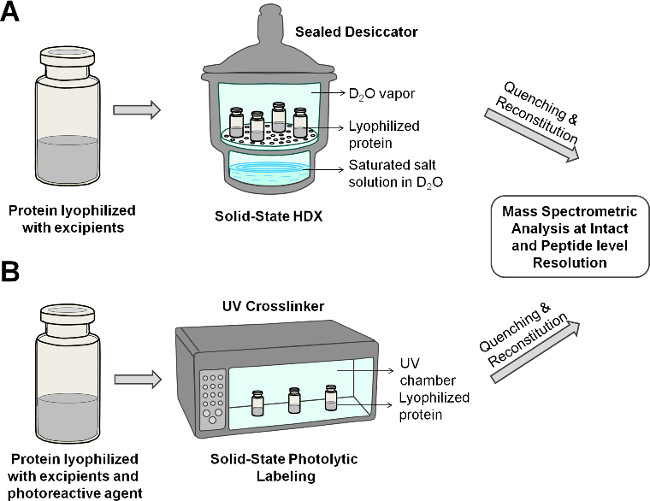
Figure 2: l'état solide de représentation schématique HDX-MS (A) et PL-MS (B) pour la protéine dans la formulation lyophilisée.
Protocole
1. Préparation de l'échantillon et de lyophilisation
- Dialyser le volume requis de solution stock Mb contre un tampon et filtre approprié à travers un filtre stérile de 0,22 um.
- Préparer le volume nécessaire des excipients et photo-leucine (acide L-2-amino-4,4-azi-pentanoïque; pleu) des solutions d'achat d'actions dans un tampon approprié. Filtrer les solutions de réserve à travers un filtre stérile de 0,22 um.
- Préparer des formulations indiquées dans le tableau 1 en utilisant les solutions mères de protéines, des excipients, pleu, et un tampon.
- Filtrer les échantillons à travers un filtre stérile de 0,22 um pour enlever les particules formées à l'étape 1.3. Remplissez les échantillons séparément 0,2 ml dans des flacons de verre de 2 ml. Utilisez des flacons de verre qui sont transparents aux UV (365 nm) pour activer les peuls dans les études SSPL-MS.
- flacons de charge en un lyophilisateur et initient lyophilisation en concevant un cycle de lyophilisation approprié.
- Ici, congeler les échantillons à -40 ° C, puispar séchage sous vide primaire (70 mTorr) à -35 ° C pendant 12 heures et séchage secondaire à 25 ° C pendant 12 heures. D'autres cycles de lyophilisation et des procédés de séchage (par exemple séchage par pulvérisation) peut également être utilisé.
- Remblayer les flacons contenant des échantillons lyophilisés avec de l'azote avant bouchage.
| Formulations | Composition (mg / ml) avant la lyophilisation | ||||
| Mb | Tréhalose | Sorbitol | pleu c | De potassium, de phosphate, pH 7,4 | |
| MBT une | 1,7 | 3.4 | - | - | 0,4 |
| MBS une | 1,7 | - | 3.4 | - | 0,4 |
| MBT + pleu b | 1,7 | 3.4 | - | 14,3 x 10 -3 à 1,43 | 0,4 |
| MBS + pleu b | 1,7 | - | 3.4 | 14,3 x 10 -3 à 1,43 | 0,4 |
Tableau 1:... Composition de formulations Mb lyophilisés un formulations utilisées pour l'étude ssHDX-MS formulations B utilisées pour l'étude SSPL-MS c L-2-amino-4,4-azipentanoic acide ou photo-leucine (peuls). pleu à cinq concentrations différentes (14,3 x 10 -3 à 1,43 mg / ml) correspondant à 1x, 10x, 20x, 50x et 100x excès molaire par rapport Mb ont été co-lyophilisé avec MBT et MBS formulations.
2. ssHDX-MS pour protéine intacte
- Ajouter une quantité de saturation (~ 440 g) de K 2 CO 3 à 200 ml de D 2 O previously placé dans le compartiment inférieur d'un dessiccateur. Sceller le hermétique dessiccateur et le laisser se stabiliser à 5 ° C jusqu'à une humidité relative stable (HR) de ~ 43% est atteint. Autres valeurs RH d'intérêt peuvent être obtenus en sélectionnant différentes solutions salines saturées 23,24.
- Initier des réactions ssHDX en plaçant les fioles contenant la protéine non écrêtées lyophilisée dans le compartiment supérieur du dessiccateur. Sceller le dessiccateur étanche à l'air et incuber à 5 ° C pour permettre HDX de se produire (figure 2A).
- Prélever des échantillons ssHDX à différents moments, en triple exemplaire. Pour les formulations Mb, prélever des échantillons à neuf points de temps 1, 2, 4, 8, 16, 32, 56, 92 et 144 h.
- Boucher les flacons immédiatement après le retrait du dessiccateur et étancher les réactions par congélation instantanée les flacons dans l'azote liquide. flacons de conserver à -80 ° C jusqu'à l'analyse par spectrométrie de masse.
- Analyser des échantillons avec une haute résolution chromatographie liquide masse Spectrom appropriéeméthode etry (LC-MS). Conception ou acheter un système de LC réfrigéré appropriée pour minimiser back-échange lors de l'analyse de l'échantillon. Utilisez la configuration de l'unité colonne de réfrigération et de la méthode LC-MS précédemment rapporté 25.
Remarque: Comme le taux d'amide échangeuse de protons dépend du pH et de la température, des deutérons incorporés dans la protéine peuvent échanger avec l'hydrogène présent dans la phase mobile ("échange back"), provoquant une perte d'information. Bien qu'un pH acide (pH 2,5), du tampon de trempe et les solvants HPLC peut minimiser arrière-échange dans une large mesure, ce qui réduit la température (≤0 ° C) au moyen d'un système colonne de réfrigération approprié peut en outre protéger la protéine de l'arrière-échange . - Connectez la boucle d'échantillon et de protéines piège pour la vanne qui contrôle automatiquement le processus de dessalement et l'élution. Étalonner le spectromètre de masse par injection d'un TOF faible concentration tuning mélange dans le spectromètre de masse dans la gamme m / z de 200-3,200. Le immobilisécolonne de pepsine et de la colonne d'analyse ne sont pas nécessaires pour l'analyse des protéines intactes.
- Réglez la température dans le système réfrigéré à ≤0 ° C et attendre que le système pour atteindre une température de fonctionnement stable de ~ 0 ° C.
- Transférez rapidement des échantillons de -80 ° C dans de l'azote liquide pour l'analyse par spectrométrie de masse. En utilisant des pinces, retirer avec soin chaque flacon de l'azote liquide et reconstituer l'échantillon par addition d'un volume spécifique de la glace tampon froid de trempe contenant de l'acide formique à 0,2% (FA) (pH 2,5) et 5% de methanol dans de l'eau dans le flacon.
- Programmer une HPLC approprié et la méthode de spectrométrie de masse en utilisant le logiciel de contrôle. Pour les formulations Mb, échantillon de dessaler contenant 20 pmol Mb dans le piège de protéine de 1,7 min à 5% d'acétonitrile, 95% d'eau et 0,1% d'acide formique (FA), et on élue en utilisant un gradient augmenté à 80% d'acétonitrile, 20% d'eau et 0,1 FA% en 3,3 min. Recueillir spectres de masse sur la plage m / z 200-3,200.
- Pour déterminer la masse de intacteprotéine, d'acquérir les données pour un échantillon de protéine non deutéré (ce est à dire, la protéine ne est pas soumis à ssHDX) en solution aqueuse selon la méthode de l'étape 2.9.
- Obtenir les masses des échantillons deutérés et non deutéré par déconvolution des spectres brutes en utilisant un logiciel d'analyse de données. Ici, réglez la plage de masse pour 15,000-18,000 Da, la résolution de masse à 1,0 Da, et la hauteur du pic à 90% pour le calcul de la masse de Mb.
- Calculer le nombre de deutérons incorporés dans la protéine intacte (ici, Mb) en soustrayant la masse de protéines non deutérié de la masse de protéines deutéré à chaque point de temps d'échange.
- Calculer l'absorption de deutérium pour cent par rapport au maximum théorique en utilisant l'équation suivante (équation 1)
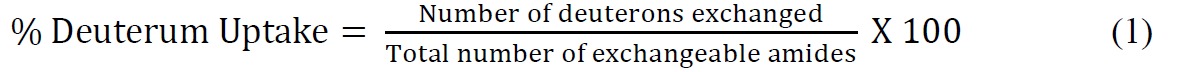
où le nombre total d'amides échangeables = nombre total d'acides aminés - nombre de résidus proline - 2 ("2" comptes de l'N-groupe terminal aminé et d'amide hydrogène qui subissent back-échange rapide). - Monter les données cinétiques ssHDX utilisant une équation exponentielle approprié. Une équation biexponentielle (équation 2) est généralement le plus simple qui donne un ajustement raisonnable aux données ssHDX. Dans cette étude, MBT et MBS, ajuster les données à un modèle qui attribue biexponentielle deutérons à "rapide" et "lent" échange piscines.
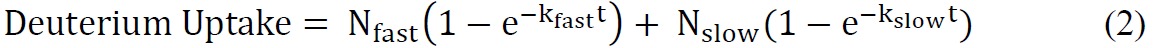
où N rapide et lente N est le nombre d'amides échangeables dans le "rapide" et "lent" échange piscines, respectivement, et k rapide et lente k sont les constantes de vitesse de premier ordre associés aux deux piscines.
3. ssHDX-MS pour la protéine au niveau Peptide
- Effectuer ssHDX en suivant les étapes 2.1 à 2.8, avec les modifications suivantes à l'étape 2.6. Connectez le col de la pepsine immobiliséelonne et la colonne analytique à la valve 25 comme indiqué précédemment et remplacent le piège de protéine reliée à la soupape d'un piège de peptide. Étalonner le spectromètre de masse en réglant le rapport masse sur charge allant de 100 à 1700.
Remarque: Au cours de l'étape de reconstitution (étape 2.8), un agent réducteur et de dénaturation peut être inclus dans le tampon de refroidissement pour faciliter la digestion de pepsine de protéines ayant des liaisons disulfure (par exemple, des anticorps monoclonaux). - Programmer une HPLC appropriée et la méthode de spectrométrie de masse en utilisant le logiciel de contrôle. Pour les formulations Mb, digérer les échantillons contenant 20 pmol Mb en ligne avec 0,1% FA, pièges et dessaler peptides pour 1,7 min avec 10% d'acétonitrile, 90% d'eau et 0,1% FA dans un piège de peptide. Éluer les fragments sur la colonne analytique, avec une augmentation du gradient de 60% d'acétonitrile, 40% d'eau et 0,1% à 4,0 FA min. Acquérir spectres de masse sur la plage m / z 100-1,700.
- Identifier les fragments peptiques par l'analyse d'un MS / MSnon deutérié échantillon de protéine. Utiliser un logiciel de spectrométrie de masse pour comparer expérimentales de masses des ions fragments peptidiques aux masses prédites des fragments peptidiques dans une base de données personnalisée. Définir un point de masse (par exemple 10 ppm) de coupure d'identifier des masses avec une faible erreur. Pour les peptides adaptés, préparer une liste composée de (i) la séquence peptidique, (ii) l'état de charge, et (iii) temps de rétention.
- Utilisez la liste générée à l'étape 3.3 de cartographier et de déterminer le nombre moyen de deutérons incorporés pour chaque fragment de pepsine digérer. Ceci peut être réalisé en employant approprié HDX-MS logiciel d'analyse de données 24.
- Pour calculer l'absorption de deutérium de pour cent et pour ajuster les données cinétiques ssHDX pour chacun des fragments peptiques, suivez les étapes 2,13 et 2,14. Dans cette étude, HDX données cinétiques pour chacun des six pepsine non redondant digèrent fragments de MBT et MBS formulations ont été ajustées à un modèle d'association biexponentielle (équation 2).
4. SSPL-MS pour Pro Intactprotéine
- Pour commencer la réaction de marquage photolytique, premier commutateur sur la réticulation UV et permettre aux lampes de se réchauffer pendant 5 min. Assurez-vous que la source d'UV est équipé de lampes de longueur d'onde 365 nm pour activer le groupe diazirine des peuls.
ATTENTION: Ne jamais ouvrir la porte de l'agent de réticulation UV lorsque les lampes sont allumées. Protéger les yeux et la peau de l'exposition à la lumière UV si la source ne est pas fermé par une porte vitrée anti-UV. - Eteignez l'agent de réticulation UV avant d'ouvrir la porte. Une fois que les lampes sont éteintes, décapsuler les flacons contenant la formulation lyophilisée et les placer à l'intérieur de la chambre d'agent de réticulation aux UV comme représenté sur la figure 2B. Irradier les échantillons avec de la lumière UV pendant 40 min.
- Effectuer des expériences de contrôle en suivant l'étape 4.1 à 4.3 pour (i) des échantillons lyophilisés sans pleu et (ii) des échantillons lyophilisés avec pleu reconstitués dans l'eau.
- Cap et stocker les flacons à -20 ° C jusqu'à l'analyse par spectrométrie de masse.
- ReconstitUte les échantillons solides par addition d'un volume approprié d'eau distillée de qualité masse par spectrométrie pour amener la concentration de 2 uM.
- Pour commencer l'analyse de l'échantillon, suivez les étapes 2,6 et 2,9.
NOTE: Depuis back-échange ne est pas un problème avec l'étiquetage covalente, SSPL-MS ne nécessite pas un système de LC réfrigéré spécial. - Pour déterminer la masse de la protéine native, à acquérir les données pour un échantillon de protéine qui n'a pas été soumis à Sspl par suite de l'étape 2.9. Obtenir les masses d'échantillons non marqués et étiquetés par déconvolution des spectres premières comme expliqué à l'étape 2.11.
- Calculer le nombre de pleu incorporés au moyen de la formule suivante:
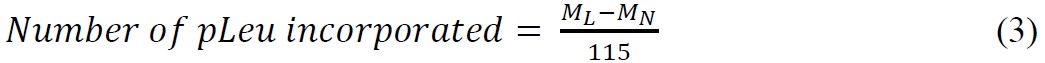
où M L est la masse de protéine marquée, M N est la masse de protéine native et 115 est la masse moyenne (Da) ajouté à la protéine native suivante seule incorporation peuls. A noter que la réaction de marquage se produit avec ee de la perte de N 2 (28 Da). La masse monoisotopique des peuls est 143,07. - Calculer le pourcentage des populations de protéines avec des nombres différents d'étiquettes à l'aide de hauteurs de pics des chromatogrammes d'ions extraits.

où «i» représente le nombre d'étiquettes, PH i représente la hauteur du pic de protéine marquée L i et u PH désigne la hauteur du pic de la protéine non marquée comme observé par spectrométrie de masse.
5. SSPL-MS pour la protéine au niveau Peptide
- Effectuer SSPL en suivant les étapes 04.01 à 04.04.
- Pour l'analyse du niveau d'un peptide, reconstituer les échantillons solides dans du tampon bicarbonate d'ammonium (100 mM, pH 8,0).
- Après reconstitution, mélanger la solution de protéine marquée avec de la trypsine à 10: 1 le rapport molaire de la protéine à la trypsine et incuber à 60 ° C pendant 16 heures.
- Stopper la réaction en ajoutant 0,1% FAdans de l'eau à l'échantillon pour donner une concentration finale de 2 uM de protéine.
- Raccorder la boucle d'échantillonnage, le peptide piège et de la colonne analytique à la soupape relié au système de HPLC.
- Programmer une HPLC approprié et la méthode de spectrométrie de masse en utilisant le logiciel de contrôle. Pour les formulations Mb, injecter 20 pmol de la protéine digérée dans la boucle d'échantillon, et dessaler les peptides dans un piège de peptide pendant 1,5 min à 5% d'acétonitrile, 95% d'eau et 0,1% de FA, suivie d'une élution dans la colonne analytique à gradient augmenter à 55% d'acétonitrile, 45% d'eau et 0,1% FA dans 22 min. Recueillir spectres de masse sur la plage m / z 100-1,700.
- Préparez une liste de masse théorique pour le peptide-pleu adducts aide d'un outil en ligne tels que ExPASy 26 avec des numéros de pleu précédemment calculés à partir de l'analyse de protéines intactes. Inclure au moins quatre manqué clivages. A noter que la réaction de marquage se produit à la perte de N 2. Par conséquent, la masse du peptide-pleu addition = masse de l'essayer sans étiquettepeptide CITP + n (masse de pleu) - n (masse de N 2), où "n" est le nombre de pleu incorporé.
NOTE: Si l'analyse de masse de protéines intactes montré jusqu'à trois populations marquées de protéines, de prendre en compte jusqu'à trois étiquettes possibles pleu par peptide. Pour un peptide ayant une masse de 1000 Da, la masse théorique de peptide-pleu produit d'addition avec une incorporation pleu serait 1000 + 1 (143) - 1 (28) = 1115 Da. De même, les masses théoriques de peptide-pleu adduits avec deux pleu, 3 pleu, etc. serait 1230 Da, Da 1345, etc., respectivement. - Utilisez le logiciel d'analyse de masse pour correspondre à la liste théorique de masse généré à l'étape 5.7 avec les masses observées expérimentalement. Définir un point de masse (par exemple, 50 ppm) de coupure d'identifier des masses avec une faible erreur.
- Pour les peptides appariées, déterminer le nombre réel de pleu incorporé en utilisant la formule à l'étape 4.8 (équation 3), où M et L M N sont les masses marquéet le peptide natif, respectivement.
Résultats
Ici, ssHDX-MS-MS et SSPL ont été utilisés pour étudier l'effet des excipients sur la conformation et l'état solide interactions de formations Mb lyophilisés. Les concentrations de protéine et excipients utilisés dans cette étude sont donnés dans le tableau 1. Les résultats représentatifs de l'analyse de Mb lyophilisés obtenus en suivant les protocoles ci-dessus sont présentés ssHDX-MS-MS et Sspl.
absorption de deutérium au niveau de la protéine intacte
ssHDX-MS est capable de distinguer entre les formulations Mb au niveau intact. Les spectres de masse des déconvolué Mb intactes suivants 144 h de ssHDX de MBS de formulation a montré une plus grande absorption de deutérium que la formulation MBT (figure 3A). En moyenne, 46% MBS ont montré une plus grande absorption de deutérium que MBT (tableau 2).
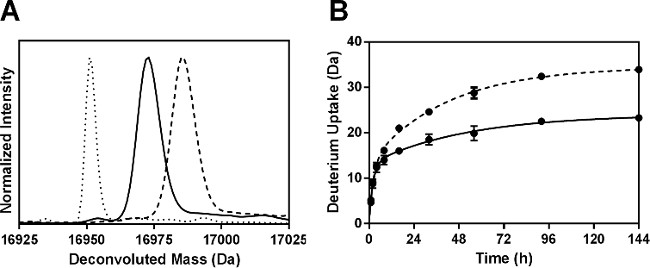
Figure 3: ssHDX-MS pour Mb intactes: (A) déconvolués spectres de masse de Mo intactes deutérés de formulations MBT (ligne solide) et MBS (ligne pointillée) suivante 144 h de ssHDX. Le spectre de masse du déconvolué Mb intactes non deutérié est également représentée (ligne pointillée). (B) cinétique de ssHDX pour Mb intactes dans les formulations MBT (ligne solide) et MBS (ligne pointillée). Le cours de temps de ssHDX a été adapté à une équation pour deux phases association exponentielle avec la version du logiciel Graph Pad Prism 5 (n = 3, ± SD).
La cinétique de deutération pour MBS intactes et MBT sont semblables à des points de temps précoces (1-4 hr), mais MBS ont montré une augmentation échange de deutérium avec une augmentation dans le temps (8-144 h) (figure 3B). Ceci suggère l'importance de la sélection des points de temps plus longues pour ssHDX au plus bas les conditions de santé reproductive et de température. En outre, le processus de sorption et de diffusion D 2 O peut affecter le taux de ssHDX au début po de tempsints. Nos études antérieures ont montré que l'humidité dans la sorption est complète ssHDX dans une période de quelques heures, et a contribution minimale pour échanger cinétique au-delà de ce temps. Le taux et l'étendue de change observé sont donc pas simplement des mesures de D 2 O adsorption 27,28. Les petites barres d'erreur sur la figure 3B, indiquant les écarts-types à partir de trois échantillons ssHDX-MS indépendantes, montrent que l'expérience est très reproductible.
| L'absorption de deutérium (%) b | N rapide c | k c rapide | N lente c | k lente c | |
| MBT une | 15,9 ± 0,5 | 13,1 (0,8) | 0,43 (0,03) | 11,0 (0,9) | 0.019 (0,001) |
| MBS une | 23,2 ± 0,5 | 15,4 (0,7) | 0,49 (0,04) | 19,2 (0,6) | 0,024 (0,002) |
| Variation en% d | 46% | 18% | 14% | 75% | 26% |
Tableau 2:. Les mesures quantitatives de l'absorption de deutérium dans les études ssHDX de formulations Mb une Voir tableau 1 pour la composition b Pourcentage absorption de deutérium par rapport au maximum théorique par Mb intactes après 144 h de HDX à 5 ° C, 43% HR (n = 3. , moyenne ± SD). c paramètres déterminés par régression non linéaire des ssHDX-MS données cinétiques. Évolution dans le temps de l'échange de deutérium pour intacte Mb a été monté sur un modèle d'association biexponentielle (équation. 2). Les valeurs entre parenthèses sont les erreurs-types des paramètres de régression. D, le changement pour cent en mesures étaient calculATED que 100 x [(valeur de MBS - valeur de MBT) / (valeur de MBT)].
Les paramètres de régression (N rapide, N lentes, k rapide et k lente) pour la cinétique du deutérium d'absorption de MBT et MBS sont donnés dans le tableau 2. Bien que la N valeurs rapides et N lents sont plus importants pour MBS que MBT, les différences dans le N lente valeurs étaient plus que les différences dans les valeurs N rapides. Plus précisément, la valeur rapide N est seulement 18% plus grande que dans dans des MBS MBT, alors que la valeur lente N est de 75% supérieure dans des MBS que dans MBT. Ceci suggère que les N valeurs lents petits dans MBT peuvent être dues à la rétention plus élevé de la structure ou de la protection de groupes amide Mb par excipients qui sont exposés à D 2 O dans des MBS. Cependant, les mécanismes détaillés ne sont pas bien comprises. Les constantes de vitesse (K rapide et lente k) pour les deux formulations sont très similaires.
absorption de deutérium au niveau peptidique
Après digestion à la pepsine, un total de 52 peptides ont été identifiés. Six fragments non redondants correspondant à 100% de la séquence Mb ont été utilisées pour l'analyse présentée ici. Des informations supplémentaires peuvent être obtenues en utilisant des fragments qui se chevauchent, tel que rapporté par notre groupe précédemment 24. L'absorption de deutérium pour cent pour chaque peptide a été calculé et les résultats des échantillons de 144 h tracé (figure 4A). cinétique de HDX pour les six fragments peptiques ont montré un comportement biexponentielle (figure 4B), compatible avec les sous-populations de hydrogènes amide subissant échange "rapide" et "lent".
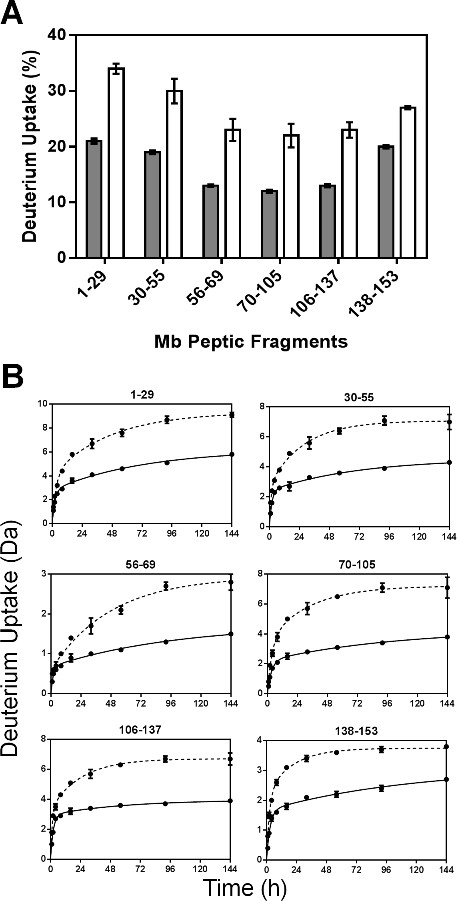
Figure 4: ssHDX-MS pour Mb au niveau peptidique: (A) Pourcentage absorption de deutérium pour 6 non-Redufragments peptiques ndant de Mo dans les formulations MBT (gris) et MBS (blanc) après 144 h de HDX. cinétique (B) ssHDX pour six fragments peptiques non redondants de Mo dans les formulations MBT (ligne solide) et MBS (ligne pointillée). Le cours de temps de ssHDX a été adapté à une équation pour deux phases association exponentielle avec la version du logiciel Graph Pad Prism 5 (n = 3, ± SD).
paramètres de régression pour les peptides non redondants sont présentés sur la figure 5. Comme les constantes de vitesse ajustés pour des fragments peptidiques ne sont pas la constante de vitesse moyenne pour les amides particuliers, les constantes de vitesse observées pour les fragments peptiques peuvent pas être linéairement liées à celles de la protéine intacte. Les valeurs N rapides pour la plupart des fragments peptiques (sauf fragment 56-69) dans les formulations MBS ont été légèrement supérieurs à ceux de MBT (figure 5A). De même, les valeurs de k rapides ont généralement montré peu de différence entre formulations et dans différentes régions de la molécule Mb (figure 5B). Toutefois, les valeurs lents lents et k N pour MBS sont significativement plus élevée dans tous les fragments que pour MBT (Figure 5C et 5D). L'augmentation considérable de N k lent et lent pour MBS peut refléter une plus grande mobilité de groupes amide dans les piscines échange "lentes".
Figure 5: paramètres cinétiques ssHDX pour Mb peptides peptiques: N rapide (A), k rapide (B), N lent (C) et K (D) des valeurs obtenues à partir lents régression non linéaire des ssHDX-MS données cinétiques pour six peptides peptiques non redondants de Mo dans les formulations MBT (gris) et MBS ( blanc) (n = 3, ± ET).
Photolytique étiquetage au niveau de protéine intacte
Mb irradié en présence d'un excès 20x pleu formé multiples MB-pleu produits d'addition, tel que détecté par LC-MS (figure 6A). Les spectres déconvolué MBT irradié pendant 40 min avec 20x pleu a montré jusqu'à trois étiquettes avec l'ajout de 115, 230 et 345 Da à la masse de Mo non étiquetés. MBS irradiés similaire avec 20x pleu montré moins absorption pleu au niveau intact, avec un maximum de deux populations marquées détectés par LC-MS.
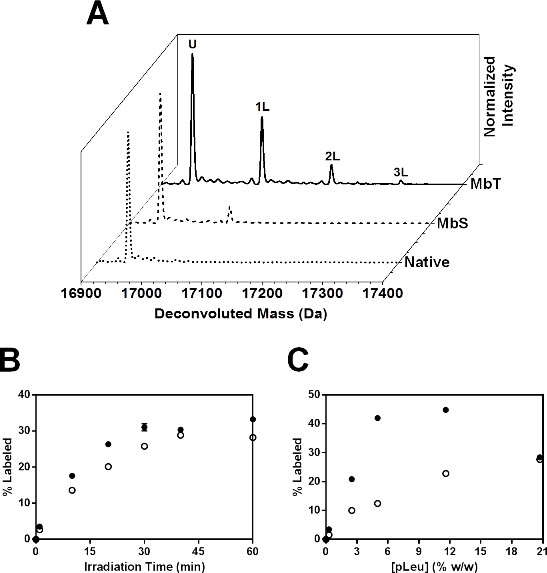
Figure 6: SSPL-MS pour Mb intactes: (A) déconvolués spectres de masse pour MBT (ligne solide) et MBS (ligne pointillée) marqués avec 20x excès (5% p / p) les peuls. Spectre de masse de déconvolué Mb natif (Mb lyophilisé et irradié en l'absence de pleu) est représenté par la ligne pointillée. U désigne une population de protéines qui reste non marqué après l'irradiation. Les populations de protéines portant 1, 2 et 3 pleu étiquettes sont représentées comme 1L, 2L et 3L, respectivement. cinétique (B) SSPL-MS pour Mb intactes dans les formulations MBT (cercles fermés) et MBS (cercles ouverts) en fonction de la concentration peuls. Tous les échantillons ont été irradiés pendant 40 minutes. Les barres d'erreur sont dans les symboles. (C) la cinétique SSPL-MS pour Mb intactes dans les formulations MBT (cercles fermés) et MBS (cercles ouverts) lyophilisé et irradiées en présence de 100x excès pleu (20,7% p / p) en fonction du temps d'irradiation. Les barres d'erreur sont dans les symboles.
Dans les études cinétiques, le pour cent de protéine marquée a augmenté de façon exponentielle à la fois MBT et MBS avec l'augmentation de la durée d'irradiation (figure 6B). MBS a montré moins d'absorption pleu MBT à chaque temps d'irradiation. Les deux formulations ont semblé atteindre un plateau à 40 min. Ainsi, une étude cinétique peut être nous eful de déterminer la durée de l'irradiation nécessaire pour obtenir une activation complète peuls. cinétiques de marquage ont également été étudiés en fonction de la concentration pleu (Figure 6C). Le pour cent de protéine marquée a augmenté avec la concentration pleu à la fois MBT et MBS. Cependant, à 20,7% p / p pleu, MBT a montré une diminution de l'absorption peuls. Cela peut être dû à l'exclusion des peuls de la surface de la protéine à une concentration élevée peuls. Ainsi, une étude avec la concentration des pleu variable devrait être effectué pour sélectionner la concentration pleu adéquat permettant de étiquetage adéquat à travers la surface de la protéine de surface sans exclusion. Dans cette étude, l'excès de 20x pleu a été choisi pour poursuivre des études de niveau peptidique.
L'ensemble a diminué étiquetage observée pour MBS suggère mauvaise accessibilité chaîne latérale à la matrice contenant les peuls. Ceci est en accord avec un changement de conformation en présence de sorbitol qui se traduit par étiquetage réduite.
contenu "> Photolytique étiquetage au niveau peptidiqueSur la base des études de marquage des protéines intactes, 20x excès pleu a été choisi pour comparer MBT et MBS au niveau peptidique. Échantillons marqués ont été digérées avec de la trypsine et analysés par LC-MS. Un total de 40 peptides correspondant à 100% de la séquence Mb ont été détectés pour échantillons MBT et MBS. Dans certains cas, la digestion trypsique peut fournir une couverture de séquence de protéine limité si les résidus Lys et / ou Arg sont fortement marquées. Pour améliorer la couverture de séquence, un mélange de trypsine et de chymotrypsine peut être utilisée pour digérer la protéine marquée.
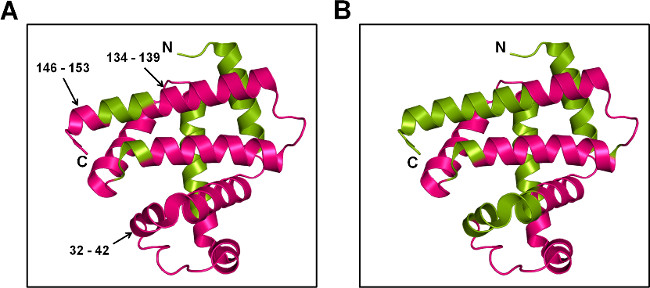
Figure 7: SSPL-MS pour Mb au niveau de peptide: la représentation de bande dessinée d'Mb marqué avec 20x excès pleu (5% p / p) en présence de tréhalose (A) et le sorbitol (B). La protéine marquée a été digéré avec trypsin et peptides marqués ont été cartographiés à la structure cristalline de Mb (APB ID 1WLA). Les régions étiquetés et non étiquetés sont en magenta et vert, respectivement.
SSPL-MS à la digestion de la trypsine fournit des informations qualitatives sur les peptides étant étiquetés. Compte tenu des différentes populations marquées au niveau intacte, le mécanisme promiscuité de l'étiquetage et des différences dans l'efficacité d'ionisation des peptides étiquetés et non étiquetés pleu, il est difficile d'obtenir des mesures quantitatives pour SSPL-MS après digestion. Cependant, l'information qualitative peut encore donner un aperçu des changements de conformation des protéines au niveau peptidique. Dans cette étude, à la fois MBT et MBS formulations ont montré pleu absorption à travers la plupart de la surface de la protéine. Par rapport à MBS, fragments peptidiques 32-42, 134-139 et 146-153 du MBT ont montré étiquetage pleu (figure 7). Ceci suggère que les chaînes latérales de ces acides aminés sont exposés à pleu, comme hélices dans ces régions sont intacts dans la matrice MBT. En revanche, la protection de l'étiquetage pleu dans la matrice MBS est conforme aux perturbations structurelles dans ces régions.
Dans l'ensemble, les résultats de ssHDX-MS et Sspl-MS indiquent que les procédés peuvent fournir des informations complémentaires au niveau du peptide à haute résolution sur squelette (ssHDX-MS) et la chaîne latérale (Sspl-MS) Les effets d'une exposition et d'excipients dans les formulations de protéines lyophilisées .
Discussion
Plusieurs études ont suggéré que l'environnement local dans les échantillons lyophilisés affecte la dégradation des protéines 5,29,30. Cependant, établir une relation directe entre la structure des protéines et de la stabilité à l'état solide n'a pas été possible en raison de l'absence de méthodes analytiques à haute résolution. L'application des méthodes de haute résolution existants tels que HDX et PL à poudres lyophilisées nécessite une modification des protocoles de solutions et une interprétation prudente de données. HDX-MS et MS-PL ont été successivement adoptées pour surveiller conformations de protéines dans l'état solide. Les résultats présentés ici et d'ailleurs 27,28,31-33 ont démontré la capacité de ces méthodes pour surveiller la conformation des protéines à haute résolution dans l'environnement solide. Bien que les étapes critiques dans l'analyse des données ne varient pas d'étiquetage en solution 34-36, des considérations importantes lors de l'installation expérimentale et l'interprétation des données sont nécessaires pour chimico-état solideétiquetage cal.
La sélection du réactif de marquage doit être basée sur la taille et le mécanisme de marquage. La petite taille du deutérium permet au squelette peptidique à palper facilement, alors que la taille relativement plus grande des pleu limite étiquetage des chaînes latérales. Les deux ssHDX Sspl et ne montrent pas de préférence pour un acide aminé quelconque, de sorte que l'étiquetage ne dépend que de squelette et des chaînes latérales exposition à la matrice. Pour sonder efficacement conformations de protéines dans l'état solide, les facteurs externes qui influent sur le processus d'étiquetage doivent être soigneusement contrôlées. La quantité totale et la distribution spatiale de l'agent de marquage dans les solides lyophilisées est différent de solutions aqueuses.
Dans ssHDX, la quantité de D 2 O dans la matrice solide peut affecter le taux de dépliement des protéines (ou dépliement partiel), le repliement, et l'échange de deutérium. Ce ne est pas le cas avec une solution HDX, dans lequel l'échantillon de protéine est normalement dilué avec un grand volume de D 2 O.Examen minutieux des effets de l'hydratation sur le taux ssHDX peut informer le choix des conditions idéales RH. Pour contrôler la vitesse de sorption de l'humidité et éviter l'effondrement de la poudre dans des formulations contenant des excipients hygroscopiques (par exemple de saccharose et le trehalose), ssHDX peut être effectuée dans des conditions réfrigérées (2-8 ° C). Notre étude précédente sur les effets d'hydratation a montré taux et l'étendue de change a augmenté avec l'augmentation de la teneur en humidité, comme prévu. Dans une grande partie de notre travail, une humidité intermédiaire de 43% à 5 ° C se est avérée idéale pour distinguer formulations dans un délai raisonnable 24. La réaction est habituellement mise en oeuvre jusqu'à ce qu'un plateau soit atteint. Cela garantit que sorption d'humidité et la diffusion dans le solide ne contrôlent pas le taux de HDX. L'utilisation de petites tailles d'échantillons solides avec le volume de pré-lyophilisation du ≤2 ml contribue également à assurer que D 2 O sorption de la vapeur est essentiellement terminée au début de la période d'échange. Bien ssHDX-MS offredes informations quantitatives sur la conformation de la protéine dans l'état solide, il ya certaines conditions où l'interprétation des données ne peut pas être entièrement basé sur l'étude ssHDX seul. Il est possible que la diminution de l'absorption de deutérium observée dans un échantillon (par rapport au contrôle) peut être due à la rétention ultérieure de la structure de la protéine ou de la quantité importante d'agrégats de protéines présentes dans l'échantillon. Dans ce cas, l'interprétation des données ssHDX nécessite résultats d'autres méthodes complémentaires. Élargissement pic de spectres de masse deutéré a été observée pour plusieurs formulations Mb 27,28. Cela pourrait être dû à divers facteurs tels que la présence de population partiellement déplié de la protéine, l'hétérogénéité spatiale dans l'échantillon, ou les gradients spatiaux de la concentration en D 2 O. Cependant, ces facteurs ne ont pas été distingués dans ssHDX-MS et doit être approfondie.
Comme SSPL-MS est relativement nouveau par rapport à d'autres méthodes, l'apprentissage continu abses applications et ses limites est nécessaire. Dans Sspl, le photo-agent de réticulation est lyophilisée avec la protéine. Le manque d'humidité limite la mobilité des composants à l'intérieur de la matrice solide, et la relaxation structurale partielle qui peut se produire avec l'humidité dans ssHDX sorption ne est pas un phénomène dans Sspl. Ceci limite l'étiquetage dans Sspl à proximité immédiate de la photo-agent de réticulation. Cependant, contrairement HDX-MS, l'analyse de la protéine marquée de manière covalente peuvent fournir des informations de structure au niveau du résidu MS / MS. Depuis étiquetage SSPL est covalente et irréversible, de retour échange ne se produit pas et les échantillons peuvent être préparé et analysé sans se préoccuper de la perte de l'étiquette. Pour faciliter la diffusion de l'agent de l'étiquetage et améliorer l'efficacité de l'étiquetage à l'état solide à matrice, SSPL peut être effectuée avec l'augmentation% HR. pleu absorption peut également être améliorée en augmentant la concentration de l'agent photoréactif. Le rapport molaire de la protéine à pleu On peut faire varier comme on le souhaite. En général, un excès 100 fois molaire de pleu à proTEIN assurer un étiquetage adéquat. Toutefois, la concentration élevée pleu peut entraîner la perte de structure tertiaire des protéines dans la matrice solide. Ainsi, en plus de la cinétique de l'étiquetage et de la composition de la formulation, la sélection de la concentration pleu doit également être fondée sur le maintien de l'intégrité structurale de protéines. Comme pleu étiquettes non sélective XH (où X = C, N, O), il est possible que des excipients avec des sites d'étiquetage similaires peut grandement influer sur le niveau de l'étiquetage des protéines. L'ingérence des excipients dans la disponibilité des peuls pour l'étiquetage de la protéine est encore à caractériser. Il est connu que le carbène généré à partir de l'activation du diazirine ne est pas à base de résidus spécifiques, cependant une étude rapporte préférence pour Asp et Glu 36. Se il est bon d'apprendre sur les interactions spécifiques de résidus, des informations de peptide-niveau est aussi utile et peut être utilisé pour concevoir des excipients pour bloquer les régions à forte exposition de la matrice à l'état solide. SSPL-MS fournit des informations qualitatives détaillées, cependantdes données quantitatives doit être obtenu et les mesures robustes doivent être développés pour analyser les différences de formulation à travers une variété de systèmes lyophilisés.
L'utilisation d'un marqueur spécifique d'résidu combinée à une analyse MS / MS peut en outre améliorer la résolution au niveau des acides aminés. des réactifs de marquage, tels que la 2,3-butanedione à étiqueter Arg, N-hydroxysuccinimide pour les dérivés de Lys et les dérivés de N -alkylmaleimide pour Cys peut être utilisé pour une cartographie précise des interactions moléculaires sous forme de poudre lyophilisée. Toutefois, ces réactifs sont tributaires du pH et les réactions peuvent ne pas être aussi bien contrôlés que l'étiquetage photolytique dans l'état solide. Une autre approche consiste à incorporer le photo-agent de réticulation dans la séquence de la protéine avec l'utilisation de lignées de cellules auxotrophes, la mutagenèse dirigée ou la chaîne latérale dérivatisation.
Nos études ssHDX-MS-MS et Sspl antérieures ont montré que le marquage de la protéine dépend de la nature et de la quantité des excipients24,27,28,31-33,37,38 utilisé. ssHDX-MS de Mb co-lyophilisé avec le chlorhydrate de guanidine (Gdn.HCl) ont montré une plus grande absorption de deutérium que Mb co-lyophilisé avec un faible poids moléculaire 32 sucres. Dans une étude séparée SSPL-MS, Mb co-lyophilisé avec Gdn.HCl a montré une plus grande protection de l'étiquetage photolytique de 33 Mb avec du saccharose. De plus, des mesures quantitatives de ssHDX-MS ont été fortement corrélée à la stabilité de la protéine au cours du stockage à long terme 28. Ces études suggèrent que ssHDX ou SSPL de protéines reflète l'étendue de rétention de la structure de la protéine en poudre lyophilisée. Nous croyons que le maintien de la structure secondaire des poudres lyophilisées fournit un environnement favorable à l'étiquetage de la chaîne latérale avec les peuls et la protection de l'amide hydrogène à partir de l'échange de deutérium. Toutefois, la comparaison détaillée du contenu informatif de ces méthodes doit être effectuée à l'avenir. Bien que l'établissement de l'utilité de ssHDX-MS-MS et SSPLcomme un outil de dépistage de la formulation sera finalement exiger qu'elle soit appliquée à de nombreuses protéines, les résultats de nos études récentes soutient son adoption plus large. Avec la poursuite du développement, ces méthodes devraient être largement utile pour caractériser formulations de protéines à l'état solide dans l'industrie biopharmaceutique.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
The authors gratefully acknowledge financial support from NIH R01 GM085293 (PI: E. M. Topp) and from the College of Pharmacy at Purdue University.
matériels
| Name | Company | Catalog Number | Comments |
| Equine myoglobin | Sigma-Aldrich | M0630-5G | |
| D-(+)-Trehalose dihydrate | Sigma Aldrich | #T9531 | |
| D-Sorbitol | Sigma Aldrich | #240850 | |
| L-Photo-leucine | Thermo Scientific | #22610 | |
| Potassium phosphate monobasic | Sigma-Aldrich | #P0662 | |
| Potassium phosphate dibasic | Sigma-Aldrich | #P3786 | |
| Deuterium Oxide | Cambridge Isotope Laboratories | #DLM-4-PK | Alternate (Cat. No.: 151882, Sigma-Aldrich) |
| Immobilized pepsin | Applied Biosystems | #2-3132-00 | |
| Trypsin | Promega | #V511A | Chymotrypsin (Cat. No.: #V1062, Promega) can be additionally used |
| Water, Optima LC/MS grade | Fisher Chemical | #7732-18-5 | |
| Acetonitrile | Sigma-Aldrich | #34998 | |
| Formic acid | Thermo Scientific | #28905 | |
| ESI-TOF Calibrant | Agilent Technologies | #G1969-85000 | Highly flammable liquid |
| Protein microtrap | Michrom Bioresources | TR1/25108/03 | |
| Peptide microtrap | Michrom Bioresources | TR1/25109/02 | |
| Analytical column | Agilent Technologies | Zorbax 300SB-C18 | |
| Freeze dryer | VirTis AdVantage Plus | ||
| Stratalinker equipped with five 365 nm lamps | Stratagene Corp. | Stratalinker 2400 | |
| HPLC | Agilent Technologies | 1200 series LC | Refrigerated LC system for HDX-MS |
| ESI-qTOF MS | Agilent Technologies | 6520 qTOF | |
| HDExaminer (HDX-MS data analysis software) | Sierra Analytics | http://www.massspec.com/HDExaminer.html |
Références
- Lawrence, S. Billion dollar babies--biotech drugs as blockbusters. Nat. Biotechnol. 25 (4), 380-382 (2007).
- . . Global Markets and Manufacturing Technologies for Protein Drugs. , BIO021D (2013).
- Lai, M. C., Topp, E. M. Solid-state chemical stability of proteins and peptides. J. Pharm. Sci. 88 (5), 489-500 (1999).
- Carpenter, J. F., Pikal, M. J., Chang, B. S., Randolph, T. W. Rational design of stable lyophilized protein formulations: some practical advice. Pharm. Res. 14 (8), 969-975 (1997).
- Carpenter, J. F., Chang, B. S., Garzon-Rodriguez, W., Randolph, T. W. Rational design of stable lyophilized protein formulations: theory and practice. Pharm. Biotechnol. 13, 109-133 (2002).
- Wüthrich, K. Protein structure determination in solution by NMR spectroscopy. J. Biol. Chem. 265 (36), 22059-22062 (1990).
- Ilari, A., Savino, C. Protein structure determination by x-ray crystallography. Methods. Mol. Biol. 452, 63-87 (2008).
- Brunger, A. T. X-ray crystallography and NMR reveal complementary views of structure and dynamics. Nat. Struct. Biol. 4, 862-865 (1997).
- Yu, L. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv Drug. Deliv. Rev. 48 (1), 27-42 (2001).
- Manning, M. C. Use of infrared spectroscopy to monitor protein structure and stability. Expert. Rev. Proteomics. 2 (5), 731-743 (2005).
- Grohganz, H., Gildemyn, D., Skibsted, E., Flink, J. M., Rantanen, J. Rapid solid-state analysis of freeze-dried protein formulations using NIR and Raman spectroscopies. J. Pharm. Sci. 100 (7), 2871-2875 (2011).
- Bai, S., Nayar, R., Carpenter, J. F., Manning, M. C. Noninvasive determination of protein conformation in the solid state using near infrared (NIR) spectroscopy. J. Pharm. Sci. 94 (9), 2030-2038 (2005).
- Pikal, M. J., et al. Solid state chemistry of proteins: II. The correlation of storage stability of freeze-dried human growth hormone (hGH) with structure and dynamics in the glassy solid. J. Pharm. Sci. 97 (12), 5106-5121 (2008).
- Wang, B., Tchessalov, S., Cicerone, M. T., Warne, N. W., Pikal, M. J. Impact of sucrose level on storage stability of proteins in freeze-dried solids: II. Correlation of aggregation rate with protein structure and molecular mobility. J. Pharm. Sci. 98 (9), 3145-3166 (2009).
- Schule, S., Friess, W., Bechtold-Peters, K., Garidel, P. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations. Eur. J. Pharm. Biopharm. 65 (1), 1-9 (2007).
- Baerga-Ortiz, A., Hughes, C. A., Mandell, J. G., Komives, E. A. Epitope mapping of a monoclonal antibody against human thrombin by H/D-exchange mass spectrometry reveals selection of a diverse sequence in a highly conserved protein. Protein. Sci. 11 (6), 1300-1308 (2002).
- Coales, S. J., Tuske, S. J., Tomasso, J. C., Hamuro, Y. Epitope mapping by amide hydrogen/deuterium exchange coupled with immobilization of antibody, on-line proteolysis, liquid chromatography and mass spectrometry. Rapid. Commun. Mass. Spectrom. 23 (5), 639-647 (2009).
- Pacholarz, K. J., Garlish, R. A., Taylor, R. J., Barran, P. E. Mass spectrometry based tools to investigate protein-ligand interactions for drug discovery. Chem. Soc. Rev. 41 (11), 4335-4355 (2012).
- Houde, D., Peng, Y., Berkowitz, S. A., Engen, J. R. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol. Cell. Proteomics. 9 (8), 1716-1728 (2010).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. J. Pharm. Sci. 100 (6), 2071-2086 (2011).
- Dorman, G., Prestwich, G. D. Using photolabile ligands in drug discovery and development. Trends. Biotechnol. 18 (2), 64-77 (2000).
- Robinette, D., Neamati, N., Tomer, K. B., Borchers, C. H. Photoaffinity labeling combined with mass spectrometric approaches as a tool for structural proteomics. Expert. Rev. Proteomics. 3 (4), 399-408 (2006).
- Greenspan, L. Humidity fixed points of binary saturated aqueous solutions. Journal of Research of the National Bureau of Standards. 81A (1), 8 (1977).
- Sophocleous, A. M., Zhang, J., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 1. Exchange mapping. Mol. Pharm. 9 (4), 718-726 (2012).
- Keppel, T. R., Jacques, M. E., Young, R. W., Ratzlaff, K. L., Weis, D. D. An efficient and inexpensive refrigerated LC system for H/D exchange mass spectrometry. J. Am. Soc. Mass. Spectrom. 22 (8), 1472-1476 (2011).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic. Acids. Res. 31 (13), 3784-3788 (2003).
- Sophocleous, A. M., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 2. Exchange kinetics. Mol. Pharm. 9 (4), 727-733 (2012).
- Moorthy, B. S., Schultz, S. G., Kim, S. G., Topp, E. M. Predicting Protein Aggregation during Storage in Lyophilized Solids Using Solid State Amide Hydrogen/Deuterium Exchange with Mass Spectrometric Analysis (ssHDX-MS). Mol. Pharm. 11 (6), 1869-1879 (2014).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203 (1-2), 1-60 (2000).
- Sarciaux, J. M., Mansour, S., Hageman, M. J., Nail, S. L. Effects of buffer composition and processing conditions on aggregation of bovine IgG during freeze-drying. J. Pharm. Sci. 88 (12), 1354-1361 (1999).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Characterizing protein structure in amorphous solids using hydrogen/deuterium exchange with mass spectrometry. Anal. Biochem. 366 (1), 18-28 (2007).
- Sinha, S., Li, Y., Williams, T. D., Topp, E. M. Protein conformation in amorphous solids by FTIR and by hydrogen/deuterium exchange with mass spectrometry. Biophys. J. 95 (12), 5951-5961 (2008).
- Iyer, L. K., Moorthy, B. S., Topp, E. M. Photolytic labeling to probe molecular interactions in lyophilized powders. Mol. Pharm. 10 (12), 4629-4639 (2013).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. J. Vis. Exp. (81), e50839 (2013).
- Kaltashov, I. A., Bobst, C. E., Abzalimov, R. R. H/D exchange and mass spectrometry in the studies of protein conformation and dynamics: is there a need for a top-down approach. Anal. Chem. 81 (19), 7892-7899 (2009).
- Jumper, C. C., Schriemer, D. C. Mass spectrometry of laser-initiated carbene reactions for protein topographic analysis. Anal. Chem. 83 (8), 2913-2920 (2011).
- Li, Y., Williams, T. D., Topp, E. M. Effects of excipients on protein conformation in lyophilized solids by hydrogen/deuterium exchange mass spectrometry. Pharm. Res. 25 (2), 259-267 (2008).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Trehalose and calcium exert site-specific effects on calmodulin conformation in amorphous solids. Biotechnol. Bioeng. 97 (6), 1650-1653 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon