Method Article
背根神经节神经元和区分脂肪干细胞:一种
摘要
背根神经节(DRG)是含有外周神经系统的感觉神经元的结构。当解离,它们可以是共培养的SC状脂肪来源的干细胞(ASC),提供了一个有价值的模型来研究在体外神经再生和髓鞘形成,模仿体内环境在损伤部位。
摘要
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
引言
周围神经损伤是常见的发生在每年的一个主要年轻约9000例,英国和就业人口1。尽管显微神经修复技术,功能恢复正常是不可能实现的与造成损害的手的感觉,减少运动功能和频繁的疼痛和不耐低温2。这种伤害对病人深刻而持久的影响,他们进行日常活动,用了不到60%的恢复工作3能力。
损伤后,表型和神经元的形态和雪旺细胞(SC),以创造一个合适的环境,以允许轴突出芽变化。如果横断,神经分为近端和远端树桩;近端残端是从再生过程发生,而远端残端点经历沃勒变性于是SC分离从受伤的轴突,脱分化和增殖。这是对消除髓鞘碎片和准备远端残端神经再生成4,5根本。轴突出芽被生产在远端残端释放的SC神经营养因子和趋化因子的支持,并通过基底层留下以下沃勒变性6,7导向。 SC对准旁边的再生轴突形成Büngner的乐队,其中援助轴突生长朝着靶器官,减少神经内膜管外的分支。以下再支配,SC形成新的髓鞘包裹再生轴突,但感觉及运动功能仅部分恢复8。
背根神经节(DRG)是位于脊柱的椎间孔结构,含有该感官神经元细胞支配周围器官。当解离,它们可以作为一个合适的体外模埃尔神经再生9的研究- 11,包括髓鞘形成调查。特别是成年DRG神经元模拟体内的特点,这些细胞,并提供了一个强大的工具来研究周围神经修复组织工程的新战略。
共培养物表示一个动态系统,它模拟在体外两个(或多个)细胞类型中特定的相互作用的体内环境。其中的一个细胞共培养模型的一个优点是灵活性和高的控制,可以在细胞外环境中发挥。 DRG神经元已被经常使用在共培养系统的SC以模仿在周围神经系统10,12的两种细胞类型之间发生的实际相互作用- 14。由此表明了SC分泌胞外基质(ECM)蛋白和生长因子,能显着提高DRG神经元的存活能力和萌芽突起15,16。然而,SC需要的时间长的期间的增殖,尽管在细胞培养技术的进步,但仍难以产生细胞用于组织工程应用的一个适当的数目。此外,一个健康的神经的牺牲是必要收获自体SC。因此,在采购SC的差为组织工程和在神经再生的体外测试重要。在此视图中,ASC可以被认为是有价值的替代的组织工程化构建体的发展,以用于外周神经修复17,18。先前的工作证明了这些细胞分化成的SC状的ASC的能力,表达特性胶质标记物,如S-100,P75,胶质纤维酸性蛋白(GFAP)19,以及髓磷脂蛋白零(P0)20 。的胶质生长因子,如脑源性神经营养因子的分泌(BDNF),神经生长因子(NGF)和神经胶质细胞源性神经营养因子(GDNF),也观察到21,22。因此,SC-像ASC可用作外周神经再生的启动子,如在体外证明既和体内研究23 - 26。此外,ASC可以通过在更高的数目相比于其它干细胞类型的微创程序收获;干细胞的脂肪组织中的频率为100至1000倍,比在骨髓27更高,并且它们具有较高的增殖率相比,SC和骨髓间充质干细胞。
这项工作的目的是提供一个详细的协议分别进行分离DRG神经元和ASC高效率的收获,后者分化为SC样细胞。因此这两种细胞类型的共培养将提供可用于未来的研究上的DRG网元的能力非常实用的系统urons发芽轴突和不同的支架用于神经组织工程髓鞘的形成机制。
研究方案
注:所有涉及动物的实验中,进行了根据英国动物(科学程序)法,1986。
1.实验装置
- 在此之前开始组织和细胞的收获,检查所有的工具都是无菌的。无论是必要的,高压灭菌一双敏锐的手术剪,非常细镊子和罚款标准镊子。还采用UV杀菌,乙醇暴露或蒸汽消毒适当的细胞接种前消毒每个基板。
- 干细胞采集和分化制备传媒
- 制备干细胞的生长培养基 ,含有最低必需培养基(α-MEM),补充有10%胎牛血清(FBS),200毫摩尔L-谷氨酰胺和1%青霉素-链霉素(PS)。
- 通过在2.436毫升无菌二甲亚砜中溶解10毫克福斯克林的制备福斯克林的10mM储备溶液。使用14微米的最终浓度。
- 通过在1.43毫升无菌二甲亚砜中溶解50毫克制备视黄酸的35毫克/毫升的储备溶液。使用在350纳克/毫升的最终浓度。
- 通过在100μl蒸馏水的无菌水将10微克的冻干粉末的制备血小板衍生的生长因子(PDGF)股(100微克/毫升)。使用在5毫微克/毫升的最终浓度。
- 通过在500μl蒸馏水的无菌水中溶解为50μg冻干粉末制备碱性成纤维细胞生长因子(bFGF)的股票(100微克/毫升)。使用以10毫微克/毫升的最终浓度。
- 制备干细胞的分化培养基 ,含有补充了14μM福斯克林,126纳克/毫升的胶质生长因子2(GGF-2),5纳克/毫升血小板衍生的生长因子(PDGF),和10毫微克的干细胞生长培养基/毫升碱性成纤维细胞生长因子(bFGF)。
- 对于神经元的收获和分离制备的媒体和股票的解决方案
- 准备BottenstEIN和佐藤(BS)中28,加入1%PS和1%N2补充火腿的F12培养基。计算出所需的每孔500μl的终体积(如果使用24孔板)。
- 在1.25%重量/体积浓度准备胶原酶IV类股在火腿的F12培养基。过滤器 - 消毒在-20℃下为200微升等分试样的溶液,并存储。
- 以2.5%重量/体积浓度的Ham的F12培养基制备牛胰蛋白酶的股票,在-20℃下为200微升等份过滤消毒和储存。
- 制备的神经生长因子(NGF),为200微升原液以5微克/毫升的过滤灭菌的1毫克的F12培养基和存储/ ml的无脂肪酸的牛血清白蛋白(BSA)溶液中的浓度在-20℃下等分。重组后,不要过滤NGF。
- 在情况下,没有表面改性已经在RT被执行时,涂层盖玻片/板用聚-D-赖氨酸(0.1mg / ml的15分钟)和/或层粘连蛋白(2-10微克/ 平方厘米为2小时,在37℃),以支持神经元附着和神经突长出适当。
- 使用之前,请务必热身水浴媒体在37℃。
2.脂肪干细胞(ASC)采收和分化成表型SC
- ASC收获成年雄性SD大鼠内脏和腹股沟脂肪
- 在此之前开始,准备一个管10-15毫升汉克斯"平衡盐溶液(HBSS)辅以PS解决方案和存储在冰上直到脂肪收获1%V / V。
- 终止大鼠颈椎脱位和斩首。剃鼠,并通过腹部皮肤做一个切口,露出内脏,避免出血。去除内脏脂肪包裹胃肠蠕动(通常特点是脂肪黄色的一致性),并从周围的成年雄性SD大鼠睾丸在腹股沟的脂肪。转让日Ë脂肪含有HBSS冰上管。
- 在生物安全柜(Ⅱ类)切碎用剪刀和无菌刀片直到细一致性脂肪到达,并将其传输到含有15毫升的0.2%的管重量/体积的胶原酶I型溶液新鲜制备和过滤灭菌的当天。
- 传送管在水浴中于37℃和离开的脂肪组织在酶的存在下消化30分钟-1下连续搅拌小时。密切监测消化和停止之前组织完全分离,这将提高细胞活力和细胞产量。通过100微米的细胞滤网过滤南屯离解的组织。
注:良好组织消化将导致脂肪,可见由眼睛的均匀一致性时轻轻摇动试管,获得为米色外观。 - 通过加入含胎牛血清15毫升干细胞生长培养基,在37℃和离心机的中和该酶在160 g下10分钟的溶液中,以便收集所述基质血管级分,包括干细胞,在管的底部。
- 在这个阶段,将沉淀可以在1ml的红血细胞被重悬于裂解缓冲液以除去血细胞污染。再悬浮和移液1分钟后,加入10ml新鲜的干细胞生长培养基并离心,在160 g下10分钟。
- 小心地从管吸出上清液,注意所沉积的细胞沉淀在底部。重悬的细胞在10ml的干细胞的生长培养基中,将其转移到75cm 2的培养瓶中,并培育在37℃,5%的CO 2。维持细胞在亚汇合的水平,直到通道1-2,改变培养基每3天。
- ASC分化为SC型
- 在通道1-2,从75cm 2的烧瓶中取出干细胞生长培养基,并将其用10ml含有1mMβ巯基乙醇新鲜编写,J新鲜培养基替换红色和过滤灭菌的当天。孵育所述细胞在37℃,5%CO 2的24小时。在这个阶段,重要的是,将细胞接种在开始分化前的低密度(30%)。
- 小心用HBSS,抽吸洗涤细胞,并将其与含有350毫微克/毫升的维甲酸10毫升介质的替换。孵育所述细胞在37℃,5%CO 2的72小时。尽量减少细胞培养基暴露于光。
- 后3天,用HBSS,吸小心洗细胞,并将其用10毫升干细胞分化培养基替换(见步骤1.2.6)。维持细胞在亚汇合的水平,改变培养基每3天。
注:关注中2周的潜伏期中,ASC分化为SC样ASC,表达自己的特征表型(主要表现在Kingham的等5)。然后,他们可以使用,直到第10代,而不在行为29显着的变化。
- 终止大鼠颈椎脱位和斩首。剃大鼠和解除皮肤暴露脊柱。使用锋利的剪刀,excide脊柱服用局限于器官和血管的格外小心。转移脊柱中使用培养皿的生物安全柜(Ⅱ类)和除去任何背侧部分。
- 划分成两半沿使用无菌和锋利的外科剪刀,以暴露脊髓组织的纵向轴线的脊柱。在这一点上,是有帮助的切脊柱在下面的肋条笼形件的水平两个较小的段,以使其更容易的DRG神经元的收获过程中处理。用细镊子,轻轻取出所有的脊髓组织,注重不拉并取出DRG根源。通过这种方式,背根神经节和根部将脊椎管内露出,仍包裹在列。观察DRG为白色丝状COMI直接从运河纳克出来。
- 通过使用非常细镊子,深入到椎运河和注意勿损伤神经节的根部拔出从脊椎管整个DRG根(不仅仅是DRG)。转移DRG到含有3-4毫升补充有1%的PS的Ham的F12培养基的小培养皿(60 平方毫米)。如果使用不同的动物,使用不同的菜肴。
- 在解剖显微镜下,清洁任何过量使用无菌镊子和手术刀,以减少神经胶质细胞污染周围的神经节神经根的DRG。转移DRG成小培养皿(35 平方毫米)1.8毫升新鲜的F12培养基。
- 加入200微升的1.25%重量/体积的胶原酶IV型储液(0.125%终浓度)孵育的DRG,在37℃,5%CO 2下1小时。小心吸用玻璃吸管的媒体,要注意不要抽吸或损坏DRG。加入新鲜的F12培养基水嫩mented用0.125%重量/体积的胶原酶IV型酶孵育1小时,如前所述。
- 吸出中,轻轻地洗F12培养基DRG。添加然后1.8毫升F12培养基和200μl的胰蛋白酶(最终浓度为0.25%重量/体积),并孵育在37℃,5%CO 2的30分钟。
- 去除胰蛋白酶和加入1 ml F12培养基中添加500微升FBS的逮捕酶促反应。吸出培养基,并轻轻洗F12培养基的DRG为3次,以除去血清的痕迹。
- 加入2毫升新鲜F12培养基并小心地用培养基转移DRG入15ml管中,使用玻璃吸管。轻轻吹打上下(约8-10倍)与玻璃吸管(塑料尖端可以作为替代)解离的DRG神经元。
- 允许沉淀沉降在管的底部,并收集在一个新的管中的介质。加入2毫升新鲜F12培养基含有该沉淀的管,并重复米器的机械解离与玻璃吸管。重复此步骤,直至停牌变得均匀(约3-4倍),并收集在新管所有分离的DRG。这种方法减少了应力从机械解离导出,提高了神经元的存活力。
- 过滤所得的悬浮液均质化到一个新的15ml试管用100微米的细胞过滤网来去除未离解的神经元和其他杂物。在这个阶段,这可能是方便的第一过滤细胞悬浮到50ml试管中,然后将溶液转移到用玻璃吸管的小管中。离心该悬浮液在110 g下5分钟。
- 通过加入500微升30%BSA溶液,以500μl的F12培养基中制备15%的牛血清白蛋白(BSA)。慢慢吸管将溶液倒15毫升管的壁以创建一个渐进蛋白路径。在这个阶段,它是有帮助的,以保持所述管以45°角和缓慢释放使用上的数字的BSA猎鹰管作为形成"轨道"的参考。
- 吸从步骤3.10离开将500μl上清液在管的底部,并且重悬细胞沉淀在相同的培养基中。慢慢吸管沿预先制备在步骤3.11(使用对管作为参考的数字),并离心分离,在500 g下5分钟的蛋白路径的悬浮液中。
- 吸出上清液,重悬在1ml改性BS培养基(或混合介质为将SC-状ASC / DRG共培养的沉淀,如在步骤4.5如下所述。
注:重新悬浮DRG神经元的体积可以由所需的实际体积,这取决于所需的最终细胞浓度和样品的数量被接种。一只动物将提供足够的细胞用于24孔板实验。 - 孵育接种的样品在37℃,5%CO 2下2小时,以允许细胞附着和最后加入补充有神经生长发50ng / ml的新鲜BS培养基构造函数(NGF)。
的SC-像ASC和DRG神经元4.直接共培养
- 如在步骤中描述2.2.3维持在培养中在亚汇合水平SC状的ASC。之前DRG收获二十四小时后,吸出干细胞的分化培养基和用HBSS洗涤细胞。抽吸和孵化在3ml胰蛋白酶在37℃,5%CO 2下3分钟。
- 检查在光学显微镜的所有细胞从烧瓶已脱离下。轻轻拍打瓶以帮助脱离。加7毫升培养基以停止胰蛋白酶反应,收集细胞悬浮液在一个15毫升管和离心机在110 g下5分钟。
- 吸出上清液和重悬细胞沉淀在5毫升的干细胞分化培养基。计数使用血球细胞,并根据所要求的最终浓度稀释的细胞悬浮液。理想的是,播种20000 SC状ASC /厘米2将保证细胞的汇合层。
- 种子对SC-状ASC上的基板,并培育在37℃,5%CO 2的24小时,以允许细胞附着。
- 经过24小时培养后,吸出培养基,并如在步骤3.14和3.15中所述的细胞的顶部添加DRG神经元。培养基改变为含50%的干细胞分化的培养基和BS培养基的50%的混合介质。此外,减少在最终的混合介质中的FBS的浓度为1-2.5%有助于避免污染来自DRG离解衍生卫星细胞的增殖。
- 孵育共培养的样品,在37℃,5%的CO 2和在培养维持为将来的测试所需的时间。
结果
分离的DRG神经元的文化代表了一个合适的体外模型神经再生的研究。然而,未经处理的基材不提供一个合适的环境DRG附件和延伸突起的。 SC状的ASC是能够产生的生长因子和趋化因子19,其可以提高DRG神经元的萌芽神经突的能力,当他们被释放在培养液中。因此,SC-像ASC在培养系统中的存在可以在调节DRG功能中发挥重要作用。
这个协议( 图1)示出了执行的SC-像ASC和DRG神经元,在此期间,神经元细胞得到与先前接种的SC状的ASC直接接触的直接共培养的过程。与此过程相关的主要困难是从不同的动物收获DRG神经元的数量的高可变性。出于这个原因,结果可能是,有时难以COMPARe和一个应特别注意的播种过程期间,以获得总是在每个实验可比较的细胞密度支付。的协议已被优化,以减少从使用的BSA梯度(步骤3.11)的背根神经节神经元的解离其余卫星细胞中的至少数。另外,胞嘧啶阿拉伯糖(ARA-C)的补充可以被添加到BS介质,为了进一步最小化卫星细胞群,如由Kingham的等 11。然而,在治疗时间的选择必须是与DRG和SC状ASC活力,也受ARA-C的补充剂在培养基中的存在小心平衡。因此,它是很难做到一个卫星的无细胞系统。
图2示出的SC-状的ASC用于DRG轴突使用未处理的和化学修饰的聚在共培养模型发芽的重要性-己内酯(PCL)薄膜作为底物。 DRG神经元迈ntained在培养中存在或不存在的SC状ASC 3天后,使用含有50%的BS培养基中,干细胞分化培养基的50%的混合溶液中,如在步骤4.5中所述。按照此期间,将细胞固定在4%多聚甲醛,并用β微管蛋白III(DRG神经元)和S100(SC状ASC)来研究细胞的形态,并研究DRG神经元的突出突起的能力。无轴突上观察到在不存在的SC状的ASC( 图2A)未处理的表面,而突起形成在共培养系统( 图2C)中的明显改善。平均来说,每单元体突起的数目显著从0中的干细胞的存在提高到3。这些结果确认还用扫描电子显微镜(SEM)分析,在图3所示给出。特别是,SEM图像显示,DRG神经元的萌芽神经突的能力优先发生结合具有SC,如ASC,如由黄色箭头如图3C所示。
应当指出的是,使用的层粘连蛋白修饰的底物(包括层粘连蛋白衍生肽)在含有DRG神经元培养系统已被频繁定义为合适的条件的神经元细胞培养物,具有对神经突形成和扩展的显着效果30 - 32 。然而,在图2D和图3D中所示的结果表明,化学和生物线索的组合,可以进一步提高DRG神经元的反应。
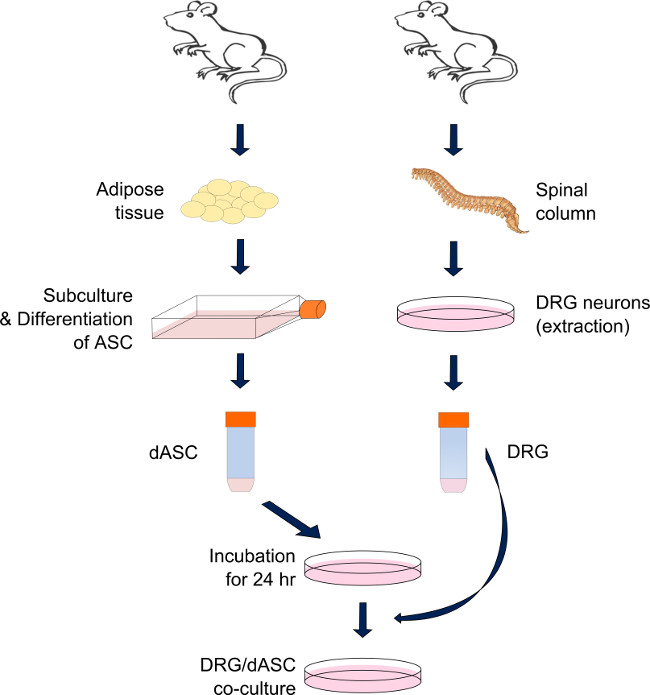
图1.制备直接DRG-SC状ASC共培养体系。DRG神经元和ASC分别从脊柱和成年发作的内脏和腹股沟脂肪衍生êSD大鼠。脂肪组织的通过酶反应的级联消化后,ASC分化成的SC样细胞和直到需要保持在亚汇合状态。 SC-像ASC是在之前的DRG收获每个基板24小时前的种子。在当天,DRG神经元被提取,并通过一系列的酶和机械作用解离。神经元,然后接种在先前接种的SC状的ASC的顶部和保持在培养直至测定(混合介质:含50%的干细胞分化培养基和改性BS培养基的50%)。 请按此查看大版本这个数字。

DRG神经元在不同的培养条件图2.荧光图像。(A)未经处理的PCL薄膜;(B)RGD改性PCL薄膜;(C)共培养与未经处理的PCL电影SC-像ASC;(D)共培养与RGD修饰PCL电影SC-像ASC。细胞维持在培养使用含有50%的改性的BS培养基和干细胞分化培养基的50%的混合溶液中3天。在此时间后,将细胞固定在4%多聚甲醛,透化在一个的Triton-X溶液,和非特异性结合位点用1%BSA封闭。那么神经细胞进行染色对β-III微管蛋白(FITC,绿色)和对S-100 SC-像ASC(AlexaFluor568;红色)抗体。最后细胞核用DAPI染色(蓝色)。使用荧光显微镜(Olympus BX60,日本)获得的图像。 (重新打印与许可德卢卡等 30。 请点击此处查看大图VERS离子这个数字。
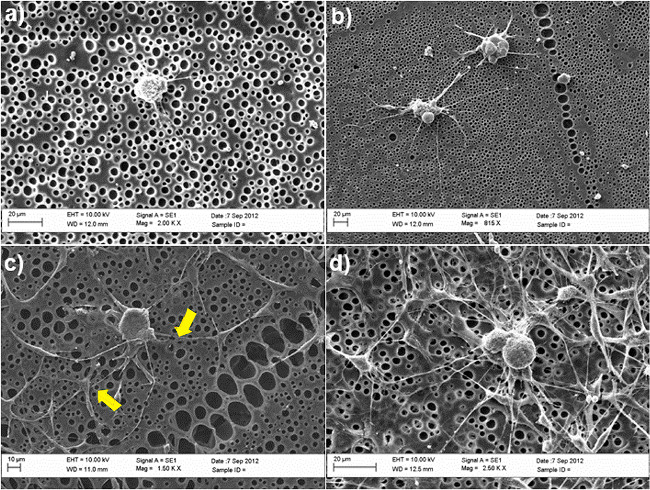
DRG神经元在不同的培养条件下的图3的SEM图像(A)未处理的PCL膜(B)的 RGD修饰的PCL膜;(C)的共培养与未处理的PCL膜的SC状ASC;(D)的共培养与RGD修饰的PCL膜的SC-状的ASC。黄色箭头指示的SC-像ASC和背根神经节之间的接触点,证实它们在共培养系统中的直接相互作用。细胞维持在培养3天,并固定在2.5%戊二醛。以下脱水梯度乙醇系列(50%,70%,90%,100%),将细胞最后漂洗中六甲基二硅和安装在存根和金溅射SEM分析前干燥。使用SEM(蔡司EVO60,英国)以加速体积分别获取的图像踏歌的10kV的。 (重新打印与德卢卡等 30权限。 请点击此处查看该图的放大版本。
讨论
DRG神经元经常用于神经元细胞中进行原代培养,以干切断体内后研究神经元的再生。这里的精确协议DRG收获从成年大鼠被提出,其目的是减少卫星细胞中周围环境的人口不损害神经元的存活。作为ASC分化成的SC样表型是一个有效的替代方案的SC用于细胞疗法中,SC-像ASC / DRG共培养系统也进行详细说明。
它被广泛已知昆布氨酸(或层粘连蛋白来源的肽序列)对神经元的存活和神经突的形成31的有益效果- 33。当执行的DRG神经元培养它因此宜预先涂覆每个衬底与层粘连蛋白,以避免的神经元细胞的功能性的任何损失。层粘连蛋白涂层的概念也适用于生物材料底物的设计组织工程构建体,如聚-己内酯(PCL)经常用于神经导管30的制造。此外,先前的工作表明,纤维蛋白基质以3维11的合适的材料的神经元培养物。
除了蛋白质涂层,共培养模型提供了对DRG神经元的存活和合适的环境以研究以下损伤的神经元和SC在周围神经系统之间发生的相互作用有价值的条件。细胞也可以通过以缩短在损伤部位的自体细胞的募集时间利用神经移植装置在体内 。这是严重的损伤,从而导致细胞衰老/死亡和肌萎缩特别重要。虽然SC是参与外周神经的再生和髓鞘形成,其有限的可用性和它们的慢扩散率的过程中最重要的神经胶质细胞,使它们不适合用于组织工程的应用34。 ASC是一个有效的替代,由于其丰度和能力分化成使SC表型,表达特定神经胶质标记物,并示出功能上的相似,以天然的SC 19。 ASC也能够产生蛋白质和生长因子5,其可以是形成和延伸突起由DRG神经元中的共培养系统是有益的。然而,两种不同的共培养系统可被设置为的实验需要的功能。在本文所提出的方法是在我们的实验室11一既定协议的修订版本,它涉及( 直接共培养 )的两种细胞类型之间的直接接触,其中,所述第二细胞类型(DRG神经元)接种上的其他人(SC状ASC)的顶部。这种方法是基于先前的发现接种神经元培养35时表现出了胶质细胞层的衬底上的存在的重要性 - 37。这种效果可能是由于通过DRG整从ASC和其他线索沉积在干细胞表面细胞 - 细胞相互作用和细胞外基质的分子。还观察到该蛋白的血清的培养基中的减少降低了污染的卫星细胞,它可以从DRG神经元的解离获得的增殖,而不影响ASC功能。然而,卫星细胞,包括一小口的SC,是很难从DRG神经元和少剩余的细胞的培养物完全消除也将存在于该共培养体系。因此,重要的要注意的是,这些小亚群也可以参与到髓鞘过程中的体外研究,回顾了自体细胞中存在的体内损伤后。第二种方法(此处未呈现)涉及使用细胞培养插入,避免( 间接共培养 )的两种不同的细胞类型之间的直接接触。 Howev呃它不是代表的神经再生(神经元细胞的发育神经突长能力降低)在体内的条件,但它是用来释放扩散因子的培养基中按一定的细胞群的影响进行调查到其他38 。
披露声明
The authors confirm that there are no conflicts of interest associated with this publication.
致谢
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
材料
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 ml plastic tubes | Sarstedt | 62.554.002 | |
| 50 ml plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200 ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| [header] | |||
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
参考文献
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558(2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a, Aa Shen, Y. -, De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a, Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015(2011).
- Seggio, aM., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001(2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。