Method Article
Ganglios de raíz dorsal neuronas y las células madre derivadas de la adiposa diferenciada: Un
En este artículo
Resumen
Ganglios de la raíz dorsal (DRG) son estructuras que contienen las neuronas sensoriales del sistema nervioso periférico. Cuando disociado, pueden ser co-cultivadas con células madre-SC como derivadas de tejido adiposo (ASC), que proporciona un valioso modelo para estudiar la regeneración in vitro en los nervios y la mielinización, imitando el entorno en vivo en el sitio de la lesión.
Resumen
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
Introducción
Lesiones de los nervios periféricos son comunes con aproximadamente 9.000 casos en el Reino Unido se producen cada año en una población predominantemente joven y 1 de trabajo. A pesar de las técnicas de reparación del nervio de microcirugía, la restauración normal de la función es inalcanzable con la consiguiente sensación de alteración de la mano, la función motora reducida y dolor frecuente e intolerancia al frío 2. Estas lesiones tienen un impacto profundo y permanente en el paciente y su capacidad para realizar actividades de la vida diaria, con menos del 60% de regresar al trabajo 3.
Después de una lesión, el fenotipo y la morfología de las neuronas y las células de Schwann (SC) el cambio con el fin de crear un entorno adecuado para permitir el surgimiento axón. En caso de transección, el nervio se divide en muñones proximal y distal; el muñón proximal ser el punto desde el que el proceso de regeneración se lleva a cabo, mientras que el muñón distal sufre degeneración walleriana con lo cual el detach SCde los axones lesionados, de-diferenciarse y proliferar. Esto es fundamental para la eliminación de restos de mielina y la preparación del muñón distal de 4,5 nervio re-generación. Axon brotación con el apoyo de la producción de factores neurotróficos y quimiocinas liberadas por SC en el muñón distal, y guiado por la lámina basal dejado atrás tras la degeneración walleriana 6,7. SC alinear junto al axón regenerar la formación de las bandas de Bungner, que ayudan al crecimiento de los axones hacia el órgano diana, reduciendo ramificación fuera del tubo endoneurial. Después de reinervación, SC formar el nuevo vaina de mielina envuelve los axones regenerados, pero la función sensorial y motor sólo se restaura parcialmente 8.
Ganglios de la raíz dorsal (DRG) son estructuras situadas en los agujeros intervertebrales de la columna vertebral, que contienen las células neuronales sensoriales que inervan los órganos periféricos. Cuando disociado, que pueden ser utilizados como un adecuado in vitro modEL para el estudio de la regeneración del nervio 9 a 11, incluidas las investigaciones de la formación de mielina. En particular, las neuronas DRG adultos imitan las características in vivo de estas células y proporcionan una herramienta formidable para estudiar nuevas estrategias para la reparación de nervios periféricos en la ingeniería de tejidos.
Co-cultivos representan un sistema dinámico que simula in vitro la interacción de dos (o más) tipos de células en un medio ambiente en particular in vivo. Una de las ventajas de estos modelos de células de co-cultivo es la flexibilidad y alto control que se puede ejercer sobre el medio ambiente extracelular. Las neuronas DRG se han utilizado con frecuencia en los sistemas de co-cultivo con SC para imitar las interacciones reales que se producen entre los dos tipos de células en el sistema nervioso periférico 10,12 - 14. Se demostró que SC secretan la matriz extracelular (ECM) proteínas y factores de crecimiento que pueden mejorar notablemente lacapacidad de las neuronas DRG para sobrevivir y brotar neuritas 15,16. Sin embargo, SC requieren largos períodos de tiempo a proliferar y, a pesar de los avances de la técnica de cultivo celular, es todavía difícil de generar un número adecuado de células para aplicaciones de ingeniería de tejidos. Además, el sacrificio de un nervio sano se requería para cosechar autólogo SC. Por lo tanto, la diferencia en la obtención SC es importante tanto para la ingeniería de tejidos y en las pruebas in vitro de la regeneración del nervio. En esta vista, ASC se puede considerar una alternativa valiosa para el desarrollo de una construcción de ingeniería de tejidos para ser utilizado para la reparación del nervio periférico 17,18. El trabajo previo demostró la capacidad de estas células para diferenciarse en-SC como ASC, expresando gliales-marcadores característicos, tales como S-100, p75 y la proteína ácida fibrilar glial (GFAP) 19, así como la proteína de la mielina cero (P0) 20 . La secreción de factores de crecimiento gliales, tales como el factor neurotrófico derivado del cerebro (BDNF), factor de crecimiento nervioso (NGF) y glial factor neurotrófico derivado de células (GDNF) también se observó 21,22. Por lo tanto, SC-como ASC puede ser utilizado como promotor de la regeneración de nervios periféricos, como se demuestra por tanto in vitro como en estudios in vivo 23-26. Además, ASC puede ser cosechado a través de procedimientos mínimamente invasivos en mayor número en comparación con otros tipos de células madre; la frecuencia de las células madre en el tejido adiposo es de 100 a 1.000 veces mayor que en la médula ósea 27, y tienen una tasa de proliferación mayor en comparación con las células madre mesenquimales SC y de médula ósea.
Este trabajo tiene como objetivo proporcionar un protocolo detallado para realizar cosechas de alta eficiencia de DRG neuronas disociadas y ASC, respectivamente, siendo este último diferenciarse en células-SC similares. El co-cultivo de estos dos tipos de células será por lo tanto, proporcionar un sistema muy práctica que se puede utilizar para futuros estudios sobre la capacidad de ne DRGurons broten las neuritas y los mecanismos de formación de la mielina en diferente andamio para la ingeniería de tejido nervioso.
Protocolo
NOTA: Todos los experimentos con animales se llevaron a cabo de acuerdo con los Animales del Reino Unido (Procedimientos Científicos), de 1986.
1. experimental
- Antes de comenzar los tejidos y células de la cosecha, comprobar que todas las herramientas son estériles. Si es necesario, el autoclave un par de tijeras quirúrgicas agudas, una muy finas pinzas y unas pinzas finas estándar. También esterilizar cada sustrato antes de la siembra de células usando la esterilización UV, la exposición etanol o la esterilización por vapor según sea apropiado.
- Preparación de los medios de comunicación para la cosecha de células madre y la diferenciación
- Preparar el medio de crecimiento de células madre, que contiene medio esencial mínimo (α-MEM) suplementado con 10% de suero fetal bovino (FBS), 200 mM L-glutamina, y 1% de penicilina-estreptomicina (PS).
- Preparar una solución madre 10 mM de forskolina disolviendo 10 mg de forskolina en 2.436 ml de sulfóxido de dimetilo estéril. Usar a una concentración final de 14 mM.
- Preparar una solución madre de 35 mg / ml de ácido retinoico mediante la disolución de 50 mg en 1,43 ml de sulfóxido de dimetilo estéril. Utilice a una concentración final de 350 ng / ml.
- Preparar el factor de crecimiento derivado de plaquetas (PDGF) existencias (100 mg / ml) disolviendo 10 g de polvo liofilizado en 100 l de agua estéril destilada. Utilice a una concentración final de 5 ng / ml.
- Preparar el factor de crecimiento de fibroblastos básico (bFGF) existencias (100 mg / ml) disolviendo 50 g de polvo liofilizado en 500 l de agua estéril destilada. Utilice a una concentración final de 10 ng / ml.
- Preparar el medio de diferenciación de células madre, que contiene medio de crecimiento de células madre suplementado con 14 mM de forskolina, 126 ng / factor de crecimiento glial-2 (GGF-2), 5 ng / ml de factor de crecimiento derivado de plaquetas ml (PDGF), y 10 ng / ml de factor de crecimiento de fibroblastos básico (bFGF).
- Preparación de medios de comunicación y soluciones de reserva para la cosecha de la neurona y disociación
- Preparar Bottenstein y de Sato (BS) medio de 28 años, mediante la adición de 1% PS y 1% de suplemento N2 a medio F12 de Ham. Calcular el volumen final necesario como 500 l por pocillo (si se utiliza una placa de 24 pocillos).
- Preparar las poblaciones de colagenasa IV en medio F12 de Ham a la concentración de 1,25% p / v. Filtro-esterilizar la solución y se almacena a -20 ° C hasta 200 alícuotas mL.
- Preparar las existencias de tripsina pancreática bovina en medio F12 de Ham en la concentración de 2,5% p / v, filtro de esterilizar y almacenar a -20 ° C hasta 200 ml de alícuotas.
- Preparar el factor de crecimiento nervioso (NGF) solución madre a la concentración de 5 mg / ml en un filtro esterilizado 1 mg / solución de albúmina de suero bovino libre de ácido graso ml (BSA) en medio F12 y almacenar a -20 C como 200 l alícuotas. No filtrado del NGF después de la reconstitución.
- En caso de modificación de la superficie no se ha realizado, cubreobjetos capa / placas con poli-D-lisina (0,1 mg / ml durante 15 min a RT) Y / o laminina (2-10 g / cm 2 durante 2 horas a 37 ° C) para soportar la unión de la neurona y el crecimiento de neuritas, según proceda.
- Siempre caliente los medios de comunicación en un baño de agua a 37 ° C antes de usar.
2. derivadas de tejido adiposo de células madre (ASC) Cosecha y diferenciación en un fenotipo SC
- Cosecha de ASC de la grasa visceral y inguinal de ratas macho adultas Sprague-Dawley
- Antes de comenzar, prepare un tubo con 10-15 ml de solución salina equilibrada de Hanks (HBSS) suplementado con 1% v / v de la solución de PS y almacenar en hielo hasta la cosecha de grasa.
- Terminar la rata por dislocación cervical y decapitación. Afeitarse la rata y hacer una incisión a través de la piel abdominal, exponiendo los órganos internos y evitar el sangrado. Retire la grasa visceral que encierra el estómago y los intestinos (por lo general se caracteriza por una consistencia de color amarillo graso) y la grasa inguinal rodea los testículos de un adulto de sexo masculino Sprague-Dawley. º Transferenciae grasa en el tubo que contiene HBSS en hielo.
- En una cabina de seguridad biológica (clase II) picar finamente la grasa usando un par de tijeras y una cuchilla de afeitar estéril hasta obtener la consistencia fina que se alcanza y la transfiere en un tubo que contiene 15 ml de 0,2% p / v solución de colagenasa tipo I recién preparada y esterilizada por filtración en el día.
- Transferir el tubo en un baño de agua a 37 ° C y dejar el tejido graso de digerir en presencia de la enzima durante 30 min-1 h bajo agitación continua. Monitorear la digestión de cerca y detenga antes de que el tejido está completamente disociado, esto mejorará la viabilidad celular y rendimiento celular. Filtro Theun-disociado del tejido a través de un filtro de células de 100 micras.
NOTA: La buena digestión tejido dará lugar a la consistencia homogénea de la grasa, visible a simple vista cuando agitando suavemente el tubo, adquiriendo un aspecto amarillento. - Neutralizar la enzima mediante la adición de 15 ml de medio de crecimiento de células madre que contienen suero fetal bovino a 37 ° C y centrifugar elsolución a 160 g durante 10 min con el fin de recoger la fracción vascular del estroma, incluyendo las células madre, en la parte inferior del tubo.
- En esta etapa, el sedimento puede ser resuspendido en 1 ml de células rojas de la sangre tampón de lisis para eliminar la contaminación de células sanguíneas. Después de la resuspensión y pipeteo durante 1 min, añadir 10 ml de medio de crecimiento de células madre fresca y centrifugar a 160 g durante 10 min.
- Aspirar cuidadosamente el sobrenadante del tubo, teniendo cuidado de la pella celular depositada en la parte inferior. Resuspender las células en 10 ml de medio de crecimiento de células madre, transferirlos en un 75 cm 2 frascos y se incuba a 37 ° C, 5% de CO 2. Mantener las células a niveles sub-confluentes hasta el paso 1-2, el cambio de medio cada 3 días.
- La diferenciación ASC a un fenotipo SC
- En el paso 1-2, retire el medio de cultivo de células madre del matraz de 75 cm2 y reemplazarlo con 10 ml de medio fresco que contiene 1 mM β-mercaptoetanol recién preparojo y esterilizada por filtración en el día. Se incuban las células a 37 ° C, 5% de CO 2 durante 24 horas. En esta etapa, es importante que las células se sembraron a baja densidad (30%) antes de iniciar la diferenciación.
- Lavar las células cuidadosamente con HBSS, aspirado y reemplazarlo con 10 ml de medio que contenía 350 ng de ácido retinoico / ml. Se incuban las células a 37 ° C, 5% de CO 2 durante 72 horas. Trate de minimizar la exposición del medio celular a la luz.
- Después de 3 días, se lavan las células con cuidado con HBSS, aspirado y reemplazarlo con 10 ml de medio de diferenciación de células madre (véase el paso 1.2.6). Mantener las células a nivel sub-confluentes, cambiando el medio cada 3 días.
NOTA: Después de 2 semanas de incubación, ASC se diferencian en-SC como ASC, expresando su fenotipo característico (como lo demuestra Kingham et al 5.). Ellos pueden ser utilizados hasta el décimo paso sin cambios notables en el comportamiento 29.
3. Cosecha y disociación de ganglios de la raíz dorsal (GRD) neuronas
- Terminar la rata por dislocación cervical y decapitación. Afeitarse la rata y levantar la piel para exponer la columna vertebral. Con unas tijeras afiladas, excide la columna vertebral teniendo especial cuidado de los órganos confinados y los vasos sanguíneos. Transferir la columna vertebral en una cabina de seguridad biológica (clase II), utilizando una placa de Petri y eliminar cualquier parte dorsal.
- Divida la columna vertebral en medio a lo largo del eje longitudinal con unas tijeras quirúrgicas estériles y afilados para exponer el tejido del cordón. En este punto, es útil para cortar la columna vertebral en dos segmentos más pequeños por debajo del nivel de la caja torácica, para que sea más fácil de manejar durante la cosecha de la neurona DRG. Con unas pinzas finas, retire con cuidado todo el tejido de la médula, prestando atención a no tirar y eliminar las raíces DRG. De esta manera el DRG y las raíces serán expuestos dentro de los canales vertebrales, todavía encerrado en la columna. Observe DRG como filamentos blancos coming directamente de los canales.
- Saque toda la raíz DRG (no sólo la DRG) de los canales vertebrales utilizando pinzas muy finas, de profundizar en los canales vertebrales y teniendo cuidado de no dañar las raíces de los ganglios. Transferir el DRG en una pequeña placa de Petri (60 mm 2) que contiene 3-4 ml de medio F12 de Ham suplementado con 1% de PS. Si el uso de diferentes animales, utilizar platos separados.
- Bajo un microscopio de disección, limpie el GRD de cualquier exceso de las raíces nerviosas que rodean los ganglios usando pinzas estériles y un bisturí para reducir la contaminación de las células gliales. Transferir el DRG en una pequeña placa de Petri (35 mm 2) con 1,8 ml de medio F12 fresco.
- Añadir 200 l de solución de p / v colagenasa tipo IV de stock 1,25% (concentración final de 0,125%) y se incuba la DRG a 37 ° C, 5% de CO 2 durante 1 hr. Aspirar con cuidado el medio con una pipeta de vidrio, teniendo cuidado de no aspirar ni dañe la DRG. Añadir medio F12 fresco flexiblementado con 0,125% p / v colagenasa tipo IV de la enzima y se incuba durante 1 hora como se describe anteriormente.
- Aspirar el medio y lavar suavemente el DRG con medio F12. Añadir a continuación 1,8 ml de medio F12 y 200 l de tripsina (concentración final de 0,25% p / v) y se incuba a 37 ° C, 5% de CO2 durante 30 min.
- Retire la tripsina y añadir 1 ml de medio F12 suplementado con 500 l de FBS para detener la reacción enzimática. Aspirar el medio y lavar suavemente el DRG con medio F12 de tres veces para eliminar las trazas de suero.
- Añadir 2 ml de medio F12 fresco y transferir cuidadosamente la DRG con el medio en un tubo de 15 ml usando una pipeta de vidrio. Disociar suavemente las neuronas DRG pipeteando arriba y abajo (cerca de 8-10 veces) con la pipeta de vidrio (puntas de plástico se pueden utilizar como alternativa).
- Dejar que el precipitado se asiente en la parte inferior del tubo y recoger el medio en un tubo nuevo. Añadir 2 ml de medio F12 fresco al tubo que contiene el sedimento y repetir el mdisociación echanical con la pipeta de vidrio. Repita este paso hasta que la suspensión se convierte homogéneos (3-4 veces) y recoger todo el DRG disociado en el nuevo tubo. Este método reduce la presión derivada de la disociación mecánica y mejora la viabilidad de las neuronas.
- Se filtra la suspensión homogeneizada resultante en un nuevo tubo de 15 ml usando un colador micras celular 100 para eliminar las neuronas disociadas-un y otros desechos. En esta etapa, puede ser conveniente filtrar primero la suspensión de células en un tubo de 50 ml y luego transferir la solución en el tubo más pequeño usando una pipeta de vidrio. Centrifugar la suspensión a 110 g durante 5 min.
- Preparar una albúmina de suero bovino al 15% (BSA) mediante la adición de 500 l de una solución de BSA al 30% a 500 l de medio F12. Poco a poco la pipeta la solución por la pared de un tubo de 15 ml para crear un rastro proteína gradual. En esta etapa, es útil para mantener el tubo en un ángulo de 45 ° y lentamente liberar el BSA usando los números deel tubo Falcon como referencia para la "pista" de formación.
- Aspirar el sobrenadante de la etapa 3.10 dejando 500 l en la parte inferior del tubo y resuspender el sedimento celular en el mismo medio. Lentamente pipetear la suspensión por el sendero de proteínas previamente preparada en el paso 3.11 (usar los números en el tubo como referencia) y se centrifuga a 500 g durante 5 min.
- Aspirar el sobrenadante y resuspender el sedimento en 1 ml de medio de BS modificado (o un medio mixto para la ASC / DRG co-cultivo-SC similares, tal como se describe a continuación en el paso 4.5.
NOTA: El volumen de volver a suspender las neuronas DRG se puede hacer hasta el volumen real requerido, dependiendo de la concentración celular final deseada y el número de muestras a ser sembradas. Un animal proporcionará suficientes células para un experimento de 24 pocillos de placas. - Incubar las muestras sembradas a 37 ° C, 5% de CO 2 durante 2 horas para permitir la unión celular y, finalmente, se añade medio fresco suplementado con BS 50 ng / ml de FA de crecimiento nerviosoctor (NGF).
4. Dirigir Co-cultura de-SC como ASC y DRG neuronas
- Mantener ASC-SC como en la cultura a nivel sub-confluente como se describe en el paso 2.2.3. Veinticuatro horas antes de la cosecha DRG, aspirar el medio de diferenciación de células madre y lavar las células con HBSS. Aspirar y se incuba en 3 ml de tripsina a 37 ° C, 5% de CO2 durante 3 min.
- Revisar bajo un microscopio de luz que todas las células se han desprendido del matraz. Golpear suavemente el frasco para ayudar a la separación. Añadir 7 ml de medio para detener la reacción tripsina, recoger la suspensión de células en un tubo de 15 ml y centrifugar a 110 g durante 5 min.
- Aspirar el sobrenadante y resuspender el sedimento de células en 5 ml de medio de diferenciación de células madre. Contar las células usando un hemocitómetro y se diluye la suspensión celular de acuerdo con la concentración final requerida. Idealmente, la siembra de 20.000 SC como ASC / cm 2 garantizaría una capa confluente de células.
- Sembrar el SC-comoASC sobre el sustrato y se incuba a 37 ° C, 5% de CO 2 durante 24 horas para permitir la unión celular.
- Después de 24 horas de incubación, aspirar el medio y agregue las neuronas DRG en la parte superior de las células como se describe en el paso 3.14 y 3.15. Cambiar el medio a un medio mixto que contiene 50% de medio de diferenciación de células madre y 50% de medio de BS. Además, la reducción de la concentración de FBS al 1-2,5% en el medio mezclada final ayuda a evitar la proliferación de contaminación de las células satélite derivados de la disociación DRG.
- Incubar las muestras co-cultivadas a 37 ° C, 5% de CO2 y mantener en cultivo durante el tiempo requerido para las pruebas futuras.
Resultados
Los cultivos de neuronas DRG disociadas representan un adecuado modelo in vitro para el estudio de la regeneración del nervio. Sin embargo, los sustratos no tratados no proporcionan un entorno adecuado para la fijación DRG y extensión de neuritas. -SC como ASC son capaces de producir factores de crecimiento y quimiocinas 19 que pueden mejorar la capacidad de las neuronas DRG a brotar neuritas cuando se liberan en el medio de cultivo. La presencia de SC-ASC como en el sistema de cultivo por lo tanto, puede desempeñar un papel importante en la regulación de las funciones de DRG.
Este protocolo (Figura 1) ilustra el procedimiento para realizar una co-cultivo directo de la ASC y DRG neuronas-SC similares, durante el cual las células neuronales se interponen en contacto directo con anterioridad sembrado ASC-SC similares. La principal dificultad asociada a este procedimiento es la alta variabilidad del número de neuronas DRG cosechadas a partir de diferentes animales. Por esta razón, los resultados pueden ser a veces difícil de COMPARcorreo y una atención especial debe ser pagado durante el procedimiento de siembra con el fin de obtener siempre una densidad celular comparable en cada experimento. El protocolo se ha optimizado para reducir al menos el número de las células satélite restantes de la disociación de las neuronas DRG usando el gradiente de BSA (paso 3,11). Además, citosina-arabinosa (Ara-C) suplemento se puede añadir al medio de BS con el fin de minimizar aún más la población de células satélite, como se describe por Kingham et al. 11. Sin embargo, la elección del tiempo de tratamiento debe ser cuidadosamente equilibrada con el DRG y SC como ASC vitalidad, también afectada por la presencia de suplemento de ARA-C en el medio de cultivo. Por lo tanto, es muy difícil de lograr un sistema libre de células satélite.
La Figura 2 muestra la importancia de ASC-SC como para las neuritas DRG brotación en un modelo de co-cultivo utilizando poli sin tratar y modificada químicamente - caprolactona (PCL) películas como sustratos. DRG neuronas eran maintained en cultivo durante 3 días en presencia o ausencia de-SC como ASC, utilizando una solución mixta que contiene 50% de medio de BS y 50% de medio de diferenciación de células madre, como se describe en el paso 4.5. Después de este período, las células fueron fijadas en paraformaldehído al 4% y se tiñeron con β-tubulina III (neuronas DRG) y S100 (SC-como ASC) para investigar la morfología celular y para estudiar la capacidad de las neuronas DRG para sobresalir neuritas. No hay neuritas se observaron en las superficies no tratadas en ausencia de-SC como ASC (Figura 2A), mientras que la formación de neuritas fue claramente mejorada en el sistema de co-cultivo (Figura 2C). En promedio, el número de neuritas por cuerpo celular aumentó significativamente de 0 a 3 en presencia de células madre. La confirmación de estos resultados también fue dada por microscopía electrónica de barrido (SEM) de análisis, que se muestra en la Figura 3. En particular, las imágenes de SEM muestran que la capacidad de las neuronas DRG a brotar neuritas se produce preferentemente en conjuncióncon-SC como ASC, como se indica por las flechas amarillas en la Figura 3C.
Cabe señalar que el uso de sustratos modificado laminina (incluyendo péptidos de laminina derivados) en sistemas de cultivo que contienen las neuronas DRG se ha definido con frecuencia como una condición adecuada para el cultivo celular neuronal, que tiene efectos notables sobre la formación de neuritas y la extensión de 30 a 32 . Sin embargo, los resultados mostrados en la Figura 2D y 3D Figura demuestra que la combinación de señales químicas y biológicas puede mejorar aún más la respuesta de las neuronas DRG.
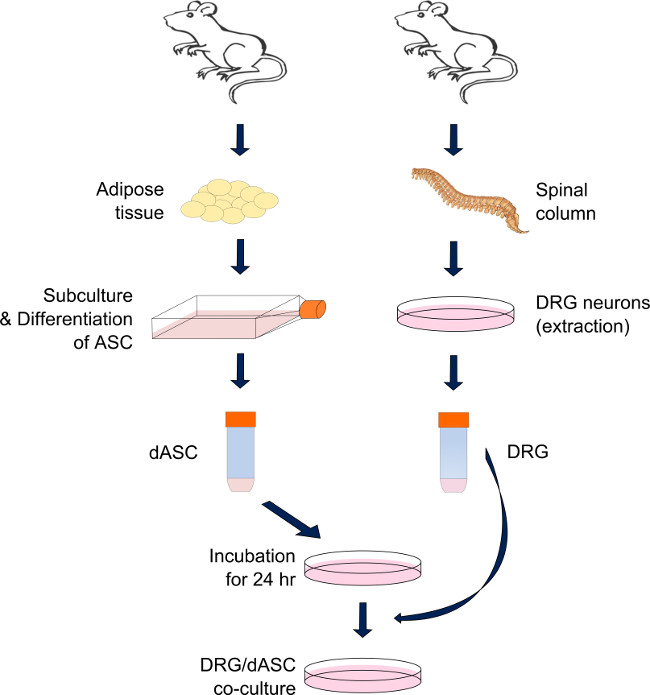
Figura 1. Preparación del sistema de ASC de co-cultivo DRG-SC-como directa. Neuronas DRG y ASC se derivan respectivamente de la columna vertebral y la grasa visceral y inguinal de mal adultose ratas Sprague-Dawley. Después de la digestión del tejido adiposo a través de una cascada de reacciones enzimáticas, ASC se diferencian en células-SC como y mantenerse en condiciones sub-confluentes hasta que se necesite. -SC como ASC son pre-sembrado en cada sustrato 24 horas antes de la cosecha DRG. En el día, las neuronas DRG se extraen y se disocian a través de una serie de acciones enzimáticas y mecánicas. Las neuronas están sembradas en la parte superior de la ASC-SC como previamente sembradas y mantienen en cultivo hasta el ensayo (técnica mixta: contiene un 50% de medio de diferenciación de células madre y el 50% de medio BS modificado). Haga clic aquí para ver una mayor versión de esta figura.

Figura 2. Las imágenes de fluorescencia de las neuronas DRG en diversas condiciones de cultivo.(A) las películas de PCL no tratadas; (B) películas PCL modificados RGD; (C) co-cultivadas con-SC como ASC en películas PCL no tratadas; (D) co-cultivadas con-SC como ASC en películas PCL modificados RGD. Las células se mantuvieron en cultivo durante 3 días utilizando una solución mixta que contiene 50% de medio de BS modificado y 50% de medio de diferenciación de células madre. Después de este tiempo, las células fueron fijadas en paraformaldehído al 4%, se permeabilizaron en una solución de Triton-X, y sitios de unión no específicos se bloquearon con 1% de BSA. Las células neuronales fueron teñidas contra β-tubulina III (FITC; verde) y ASC-SC como contra S-100 (AlexaFluor568; rojo) anticuerpos. Finalmente núcleos se tiñeron con DAPI (azul). Las imágenes fueron adquiridas utilizando un microscopio de fluorescencia (Olympus BX60, Japón). (Re-imprimir con permiso de De Luca et al. 30. Haga clic aquí para conocer el vers más grandesion de esta figura.
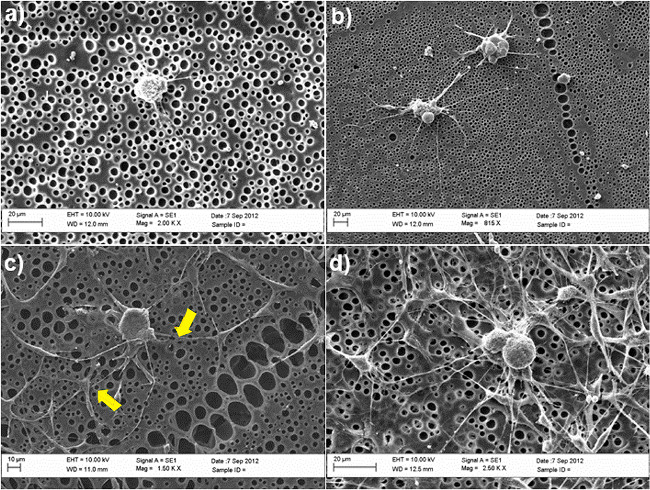
Figura 3. imágenes de SEM de las neuronas DRG en diversas condiciones de cultivo (A) películas PCL no tratados (B) películas PCL modificados RGD;. (C) co-cultivadas con ASC SC-como en las películas de PCL no tratadas; (D) co-cultivadas con-SC como ASC en películas PCL modificado RGD. Las flechas amarillas indican los puntos de contacto entre-SC como ASC y DRG, confirmando su interacción directa en el sistema de co-cultivo. Las células se mantuvieron en cultivo durante 3 días y se fijaron en glutaraldehído al 2,5%. Después de la deshidratación en series de etanol graduado (50%, 70%, 90%, 100%), las células fueron finalmente enjuagaron en hexametildisilazano y se secaron antes de su montaje en trozos y el oro de pulverización catódica para el análisis SEM. Las imágenes fueron adquiridas mediante un SEM (Zeiss EVO60, Reino Unido) con un volumen de aceleracióntaje de 10kV. (Re-imprimir con permiso de De Luca et al. 30. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
DRG neuronas se utilizan con frecuencia entre las células neuronales para el cultivo primario para el estudio de la regeneración de las neuronas después de axotomía en vivo. Aquí se presenta un protocolo precisa para la cosecha DRG de ratas adultas, destinado a reducir la población de células satélite en el ambiente circundante sin comprometer la supervivencia neuronal. Como ASC diferenciado en un fenotipo de SC como son una alternativa válida a SC para las terapias celulares, un ASC / DRG sistema de co-cultivo-SC como también se describe en detalle.
Es ampliamente conocido que la laminina (o laminina derivados de secuencias de péptidos) tienen un efecto beneficioso sobre la supervivencia de neuronas y la formación de neuritas 31-33. Al realizar cultivos de neuronas DRG se recomienda por lo tanto a la capa previamente cada sustrato con laminina con el fin de evitar cualquier pérdida de funcionalidad de las células neuronales. El concepto de recubrimientos de laminina también se aplica a sustratos de biomateriales para el diseño deconstrucciones de ingeniería de tejidos, tales como poli - caprolactona (PCL) utilizan con frecuencia para la fabricación de conductos de los nervios 30. Además, el trabajo previo demostró que las matrices de fibrina son materiales adecuados para cultivos neuronales en tres dimensiones 11.
Además de capa de proteína, los modelos de co-cultivo proporcionan condiciones valiosos para la supervivencia de neuronas DRG y un ambiente adecuado para estudiar las interacciones que se producen entre las neuronas y SC en el sistema nervioso periférico después de la lesión. Las células también se pueden trasplantar in vivo mediante el uso de dispositivos neurales con el fin de acortar el tiempo de reclutamiento de células autólogas en el sitio de la lesión. Esto es particularmente importante en lesiones graves, que pueden conducir a la senescencia celular / muerte y la atrofia muscular. Aunque SC son las células gliales más importantes que intervienen en el proceso de regeneración del nervio periférico y la mielinización, su limitada disponibilidad y su tasa de proliferación lenta que los hace inadecuadospara aplicaciones de ingeniería de tejidos 34. ASC son una alternativa válida debido a su abundancia y capacidad de diferenciarse en el fenotipo SC, expresan marcadores gliales específicos y mostrando similitudes funcionales a SC nativa 19. ASC también son capaces de producir proteínas y factores de crecimiento 5 que puede ser beneficioso para la formación y la extensión de neuritas por las neuronas DRG en un sistema de co-cultivo. Sin embargo, dos sistemas diferentes de co-cultivo se puede configurar en función de las necesidades experimentales. El método propuesto en este documento es una versión revisada de un protocolo bien establecido en nuestro laboratorio 11 e implica un contacto directo entre los dos tipos de células (co-cultivo directo), en el que el segundo tipo de células (neuronas DRG) se siembran en la parte superior de los otros (SC-como ASC). Este enfoque se basa en los hallazgos previos que demostraron la importancia de la presencia de una capa de células gliales en el sustrato cuando la siembra de cultivos neuronales 35 - 37. Este efecto es probablemente debido a las interacciones célula-célula a través de integrinas DRG y moléculas ECM depositados de ASC y otras señales en la superficie de células madre. También se observó que una reducción de suero de proteína en el medio reduce la proliferación de contaminación de las células satélite que puedan derivarse de la disociación de las neuronas DRG, sin afectar a funciones ASC. Sin embargo, las células satélite, incluyendo una pequeña población de SC, son difíciles de eliminar por completo a partir de cultivos de neuronas DRG y pocas células restantes también estará presente en el sistema de co-cultivo. Por tanto, es importante tener en cuenta que estas pequeñas sub-poblaciones también pueden participar en los procesos de mielinización durante los estudios in vitro, recordando las células autólogas que están presentes in vivo después de la lesión. El segundo enfoque (no presentado aquí) implica el uso de insertos de cultivo celular, evitando un contacto directo entre los dos tipos de células diferentes (co-cultivo indirecto). Sin embarer, no es representativo de las condiciones in vivo durante la regeneración del nervio (disminución de la capacidad de las células neuronales para desarrollar neuritas largas), pero se utiliza para investigar el efecto de los factores difusibles liberados en el medio por una población celular determinada en el otro 38 .
Divulgaciones
The authors confirm that there are no conflicts of interest associated with this publication.
Agradecimientos
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
Materiales
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 mL plastic tubes | Sarstedt | 62.554.002 | |
| 50 mL plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
Referencias
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558 (2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a., Aa Shen, Y. -., De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a., Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015 (2011).
- Seggio, a. M., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001 (2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados