Method Article
Dorsalwurzelganglien Neuronen und differenzierten Fettgewebe gewonnene Stammzellen: Eine
In diesem Artikel
Zusammenfassung
Spinalganglien (DRG) sind Strukturen, die die sensorischen Neuronen des peripheren Nervensystems. Wenn distanziert, sie co-kultiviert mit SC-wie Fettgewebe gewonnene Stammzellen (ASC) sein kann, eine wertvolle Modell zur in-vitro-Nervenregeneration und Myelinisierung zu untersuchen, imitiert die in vivo-Umgebung an der Verletzungsstelle.
Zusammenfassung
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
Einleitung
Periphere Nervenverletzungen sind häufig mit rund 9.000 Fälle im Vereinigten Königreich jedes Jahr auftreten in einem überwiegend jungen und arbeitenden Bevölkerung ein. Trotz mikrochirurgische Nervenreparaturverfahren, ist normal, Wiederherstellung der Funktion unerreichbar mit resultierenden beeinträchtigt Handgefühl, reduzierte Motorik und häufige Schmerzen und Kälteempfindlichkeit 2. Solche Verletzungen haben eine tiefe und dauerhafte Auswirkungen auf die Patienten und ihre Fähigkeit, Aktivitäten des täglichen Lebens durchzuführen, mit der Rückkehr weniger als 60% zu arbeiten 3.
Nach Verletzung, den Phänotyp und die Morphologie von Neuronen und Schwann-Zellen (SC) sich verändern, um eine geeignete Umgebung für das Axon Keimen ermöglichen erstellen. Im Falle der Durchtrennung wird der Nerv in proximalen und distalen Stümpfen unterteilt; die proximalen Stumpf der Punkt, von dem die Regenerationsprozess stattfindet, während die distalen Stumpf erfährt Waller-Degeneration woraufhin der SC detachvon den verletzten Axone, de-differenzieren und sich vermehren. Dies ist von grundlegender Bedeutung zur Beseitigung Myelin Trümmer und die Vorbereitung des distalen Stumpf für Nervenwieder Generation 4,5. Axon Keimen wird durch die Produktion von neurotrophen Faktoren und Chemokine durch SC an dem distalen Stumpf Freigabe gehalten und durch die Basallamina hinter folgenden Waller-Degeneration 6,7 links geführt. SC ausrichten neben der regenerierenden Axone bilden die Bande des Büngner, welche Hilfe das Wachstum von Axonen in Richtung des Zielorgan, die Verringerung Verzweigung außerhalb des endoneuralen Rohr. Nach Reinnervation, SC bilden die neue Myelinscheide Einwickeln der regenerierten Axone, aber sensorischen und motorischen Funktion wird nur teilweise restauriert 8.
Dorsalwurzelganglien (DRG) sind Strukturen in der Zwischenwirbellöcher der Wirbelsäule befindet, enthält die sensorischen Nervenzellen innervieren die peripheren Organe. Wenn dissoziiert sind, können sie als eine geeignete in vitro mod verwendet werdenel für die Untersuchung der Nervenregeneration 9-11, einschließlich Untersuchungen der Myelinbildung. Insbesondere Erwachsenen DRG-Neuronen imitieren die in vivo Eigenschaften dieser Zellen und eine hervorragendes Instrument, um neue Strategien für die peripheren Nervenreparatur im Tissue Engineering zu studieren.
Co-Kulturen stellen ein dynamisches System, das in vitro die Wechselwirkung von zwei (oder mehr) Zelltypen in einem bestimmten in vivo-Umgebung simuliert. Einer der Vorteile dieser Zell Kokultur Modelle ist die Flexibilität und Kontrolle, die für die extrazelluläre Umgebung ausgeübt werden können. DRG-Neuronen wurden häufig in Co-Kultur-Systeme mit SC verwendet, um die Ist-Wechselwirkungen, die zwischen den beiden Zelltypen in dem peripheren Nervensystem auftreten, nachahmen 10,12 - 14. Es wurde gezeigt, dass SC sezerextrazellulären Matrix (ECM), Proteine und Wachstumsfaktoren, die bemerkenswert verbessern kann, dieFähigkeit des DRG-Neuronen zu überleben und sprießen Neuriten 15,16. , SC erfordern jedoch längere Zeit zu proliferieren und trotz der Fortschritte in der Zellkulturtechnik ist es immer noch schwierig, eine geeignete Anzahl von Zellen für das Tissue Engineering-Anwendungen zu erzeugen. Darüber hinaus ist das Opfer eines gesunden Nerven notwendig, um autologe SC ernten. Daher ist der Unterschied in der Beschaffung SC wichtig sowohl für das Tissue Engineering und in vitro-Tests der Nervenregeneration. In dieser Ansicht kann ASC als eine wertvolle Alternative für die Entwicklung einer Gewebe-manipulierten Konstrukts für periphere Nervenreparatur 17,18 verwendet werden kann. Frühere Arbeiten zeigten die Fähigkeit dieser Zellen in SC artigen ASC Differenzierung exprimieren Kenn glial-Marker, wie S-100, p75 und gliales fibrilläres saures Protein (GFAP) 19, sowie die Myelin-Hauptprotein Null (P0) 20 . Die Sekretion von Glia-Wachstumsfaktoren, wie beispielsweise dem Gehirn stammenden neurotrophen Faktor (BDNF), war Nervenwachstumsfaktor (NGF) und von Gliazellen stammenden neurotrophen Faktor (GDNF) beobachtet 21,22. Daher kann SC artigen ASC als Promotor von peripheren Nervenregeneration verwendet werden, wie durch in vitro nachgewiesen und in vivo Studien 23-26. Zusätzlich kann ASC durch minimal-invasive Verfahren in höherer Anzahl im Vergleich zu anderen Stammzelltypen gewonnen werden; die Frequenz der Stammzellen im Fettgewebe ist 100- bis 1000-fach höher als im Knochenmark 27, und sie haben eine höhere Proliferationsrate als SC und dem Knochenmark mesenchymale Stammzellen sind.
Diese Arbeit soll ein detailliertes Protokoll zur hocheffizienten Ernten von dissoziierten DRG Neuronen und ASC bzw. durchzuführen, wobei die letztere in SC-ähnliche Zellen differenziert werden. Die Co-Kultur dieser beiden Zelltypen die daher ein sehr praktisches System, das zu weiteren Untersuchungen auf die Fähigkeit von DRG ne verwendet werden kann,Urone um Neuriten und die Mechanismen der Myelinbildung auf verschiedenen Gerüst für Nervengewebe Technik sprießen.
Protokoll
HINWEIS: Alle Experimente mit Tieren wurden in Übereinstimmung mit den britischen Animals (Scientific Procedures) Act von 1986 durchgeführt.
1. Versuchsaufbau
- Vor der Gewebe- und Zellernte beginnen, überprüfen Sie, ob alle Werkzeuge sind steril. Ob Bedarf Autoklav ein Paar scharfe chirurgische Scheren, einer sehr feinen Pinzette und einer feinen Pinzette Standard. Auch sterilisieren jedes Substrat vor Zellaussaat mit UV-Entkeimung, Ethanol Exposition oder Dampfsterilisation als angemessen.
- Vorbereitung der Medien für die Stammzellernte und Differenzierung
- Vorbereiten des Stammzellwachstumsmedium, das Minimum Essential Medium (α-MEM) mit 10% fötalem Rinderserum (FBS), 200 mM L-Glutamin und 1% Penicillin-Streptomycin (PS) ergänzt.
- Bereiten Sie eine 10 mM Stammlösung von Forskolin hergestellt, indem 10 mg von Forskolin in 2,436 ml sterilem Dimethyl sulfoxyde. Verwenden Sie in einer Endkonzentration von 14 & mgr; M.
- Bereiten Sie eine 35 mg / ml Stammlösung von Retinsäure durch Lösen von 50 mg in 1,43 ml sterilem Dimethyl sulfoxyde. Verwenden Sie in einer Endkonzentration von 350 ng / ml.
- Bereiten von Blutplättchen abgeleiteten Wachstumsfaktor (PDGF) Bestände (100 ug / ml), die durch Auflösen von 10 ug gefriergetrocknetes Pulver in 100 ul destilliertem sterilem Wasser. Verwenden Sie in einer Endkonzentration von 5 ng / ml.
- Bereiten basischen Fibroblastenwachstumsfaktor (bFGF) Bestände (100 ug / ml), die durch Auflösen von 50 ug gefriergetrocknetes Pulver in 500 ul destilliertem sterilem Wasser. Verwenden Sie in einer Endkonzentration von 10 ng / ml.
- Bereiten Sie die Stammzelldifferenzierung Medium, das Stammzellwachstumsmedium mit 14 & mgr; M Forskolin, 126 ng / ml glialen Wachstumsfaktor-2 (GGF-2), 5 ng / ml aus Blutplättchen-stammender Wachstumsfaktor (PDGF) und 10 ng / ml basischen Fibroblastenwachstumsfaktor (bFGF).
- Vorbereitung der Medien und der Stammlösungen für Neuron Ernte und Dissoziation
- Bereiten BottenstEin und Sato (BS) Medium 28, durch Zugabe von 1% PS und 1% N2 Ergänzung zur Ham-F12-Medium. Berechnen das Endvolumen 500 & mgr; l pro Well benötigt (bei Verwendung einer Platte mit 24 Vertiefungen).
- Bereiten Kollagenase IV Bestände in Ham-F12-Medium in einer Konzentration von 1,25% Gew / V. Filter-Sterilisation der Lösung und bei -20 ° C bis zu 200 ul Aliquots.
- Bereiten Rinderpankreas-Trypsin-Aktien in Ham-F12-Medium in einer Konzentration von 2,5% w / v, Filter-sterilisiert und bei -20 ° C bis zu 200 ul Aliquots.
- Vorbereiten der Nervenwachstumsfaktor (NGF) Stammlösung in einer Konzentration von 5 ug / ml in einem sterilfiltrierten 1 mg / ml fettsäurefreies Rinderserumalbumin (BSA) -Lösung in F12-Medium und bei -20 C zu 200 ul Teilmengen. Die NGF nach Rekonstitution Nicht filtern.
- Falls keine Oberflächenmodifikation wurde fällt Deck / Platten mit Poly-D-Lysin (0,1 mg / ml durchgeführt für 15 min bei RT) Und / oder Laminin (2-10 & mgr; g / cm 2 für 2 h bei 37 ° C) zu Neuron Befestigung und Neuritenwachstum gegebenenfalls unterstützen.
- Immer aufwärmen Medien in einem Wasserbad bei 37 ° C vor dem Gebrauch.
2. Fettgewebe gewonnene Stammzellen (ASC) Ernte und Differenzierung in einen SC Phänotyp
- ASC Ernte von viszeralen und Leisten Fett der erwachsenen männlichen Sprague-Dawley Ratten
- Vor Anfangs, einen Schlauch mit 10-15 ml Hanks Balanced Salzlösung (HBSS) mit 1% v / v der PS-Lösung und auf Eis aufbewahren, bis Fett Ernte ergänzt.
- Beenden Sie die Ratte durch Genickbruch und Enthauptung. Rasieren Sie die Ratte und einen Einschnitt durch die Bauchhaut, Freilegung der inneren Organe und die Vermeidung von Blutungen. Entfernen Sie das viszerale Fett umhüllt den Magen und Darm (in der Regel gekennzeichnet durch eine Fett gelb Konsistenz) und das Leisten Fett rund um die Hoden von einem erwachsenen männlichen Sprague-Dawley Ratten. Über the Fett in das Röhrchen mit HBSS auf Eis.
- In einer biologischen Sicherheitswerkbank (Klasse II) fein hacken Fett mit einer Schere und einer sterilen Rasierklinge bis feine Konsistenz erreicht ist und überträgt es in ein Röhrchen mit 15 ml 0,2% w / v Collagenase Typ I-Lösung frisch zubereitet und am Tag filtersterilisiert.
- Übertragen des Rohres in einem Wasserbad bei 37 ° C und lassen das Fettgewebe in Gegenwart des Enzyms für 30 min-1 h unter kontinuierlichem Rühren zu verdauen. Überwachen Sie die Verdauung eng und zu stoppen, bevor das Gewebe vollständig losgelöst ist, wird dies die Lebensfähigkeit der Zellen und Zellausbeute zu verbessern. Filter Theun-dissoziierten Gewebe durch eine 100 um Zellsieb.
HINWEIS: Gute Gewebe Verdauung wird in homogene Konsistenz des Fettes, sichtbar durch das Auge führen, wenn Erwärmung bewegen den Schlauch, den Erwerb einer beige Aussehen. - Neutralisieren des Enzyms durch Zugabe von 15 ml der Stammzellwachstumsmedium, das fötales Rinderserum bei 37 ° C und die ZentrifugeLösung bei 160 g für 10 min, um das stromale Gefäßanteil, einschließlich der Stammzellen zu sammeln, an der Unterseite des Rohres.
- In diesem Stadium kann das Pellet in 1 ml von roten Blutzellen suspendiert werden Lysepuffer Blutzellkontamination zu entfernen. Nach Resuspension und Pipettieren für 1 min, 10 ml frischer Stammzellwachstumsmedium und Zentrifugation bei 160 g für 10 min.
- Den Überstand vorsichtig absaugen aus der Tube, kümmert sich um die abgeschiedene Zellpellet am Boden. Resuspendieren der Zellen in 10 ml Stammzellwachstumsmedium, übertragen in einen 75 cm 2 Kolben und Inkubieren bei 37 ° C, 5% CO 2. Pflegen Sie die Zellen bei subkonfluenten Ebenen bis Passage 1-2, Ändern Medium alle 3 Tage.
- ASC Differenzierung zu einer SC-Phänotyp
- Beim Durchgang 1-2, entfernen Sie die Stammzellwachstumsmedium aus der 75 cm 2-Kolben und ersetzen sie durch 10 ml frisches Medium, das 1 mM β-Mercaptoethanol frisch preparot und am Tag filtersterilisiert. Inkubieren der Zellen bei 37 ° C, 5% CO 2 für 24 Stunden. In diesem Stadium ist es wichtig, dass die Zellen bei geringer Dichte (30%) vor dem Beginn der Differenzierung ausgesät.
- Waschen Sie die Zellen vorsichtig mit HBSS, absaugen und ersetzen Sie es mit 10 ml Medium mit 350 ng / ml Retinsäure. Inkubieren der Zellen bei 37 ° C, 5% CO 2 für 72 Stunden. Versuchen Sie, um die Exposition der Zellmedium, um Licht zu minimieren.
- Nach 3 Tagen, waschen Sie die Zellen vorsichtig mit HBSS, absaugen und ersetzen sie durch 10 ml der Stammzelldifferenzierungsmedium (siehe Schritt 1.2.6). Pflegen Sie die Zellen bei subkonfluenten Ebenen ändern Medium alle 3 Tage.
HINWEIS: Nach 2 Wochen nach der Inkubation werden die ASC in SC artigen ASC differenziert, deren charakteristische Phänotyp exprimieren (wie durch Kingham et al 5 gezeigt.). Sie können dann bis zum 10. Durchgang ohne merkliche Veränderungen im Verhalten 29 verwendet werden.
3. Ernte und Dissoziation von Spinalganglien (DRG) Neuronen
- Beenden Sie die Ratte durch Genickbruch und Enthauptung. Rasieren Sie die Ratte und heben Sie die Haut, um die Wirbelsäule aus. Mit einer scharfen Schere, excide die Wirbelsäule unter besonderer Vorsicht der begrenzten Organe und Blutgefäße. Übertragen Sie die Wirbelsäule in einer biologischen Sicherheitswerkbank (Klasse II) mit einer Petrischale und jede Rückenteil zu entfernen.
- Teilen Sie die Wirbelsäule in der Mitte entlang der Längsachse mit sterilen und scharfe chirurgische Scheren, die Marksgewebe aus. An diesem Punkt ist es hilfreich, die Wirbelsäule in zwei kleinere Segmente unter dem Niveau des Brustkorbs zu schneiden, zu erleichtern, die während der DRG Neuronen Ernte handhaben. Mit feinen Pinzette vorsichtig entfernen Sie alle Marksgewebe, die Aufmerksamkeit auf nicht ziehen und entfernen Sie die DRG Wurzeln. Auf diese Weise die DRG und Wurzeln werden in den Wirbel Kanälen ausgesetzt werden, noch in die Säule umhüllt. Beachten Sie DRG als weiße Fäden comidirekt ng aus den Kanälen.
- Ziehen Sie die gesamte DRG Wurzel (nicht nur die DRG) von den Wirbel Kanäle durch Verwendung von sehr feinen Pinzette, die tief in die Wirbel Kanäle und die Aufmerksamkeit nicht auf die Wurzeln der Ganglien beschädigen. Übertragen der DRG in eine kleine Petrischale (60 mm 2), die 3-4 ml Ham-F12-Medium mit 1% PS ergänzt. Bei der Verwendung von verschiedenen Tieren, getrennte Küche.
- Unter einem Binokular, reinigen Sie den DRG des Betrags Nervenwurzeln um die Ganglien mit einer sterilen Pinzette und Skalpell zu Gliazellen Verschmutzung zu reduzieren. Übertragen Sie die DRG in eine kleine Petrischale (35 mm 2) mit 1,8 ml frischem F12-Medium.
- Fügen Sie 200 ul von 1,25% Gew / Vol Collagenase Typ IV-Stammlösung (Endkonzentration von 0,125%) und inkubieren Sie die DRG bei 37 ° C, 5% CO 2 für 1 Stunde. Sorgfältig absaugen Medium mit einer Glaspipette, die Aufmerksamkeit nicht auf absaugen oder die DRG beschädigen. Frisches F12-Medium geschmeidigmentiert mit 0,125% w / v Collagenase Typ IV-Enzym und Inkubation für 1 Stunde wie zuvor beschrieben.
- Saugen Sie das Medium und waschen Sie sich leicht die DRG mit F12-Medium. Hinzufügen dann 1,8 ml F12-Medium und 200 & mgr; l Trypsin (Endkonzentration von 0,25% Gew / V) und bei 37 ° C, 5% CO 2 für 30 min.
- Entfernen Trypsin und 1 ml F12-Medium mit 500 ul FBS um die enzymatische Reaktion zu stoppen. Saugen Sie das Medium und waschen Sie sich leicht die DRG mit F12-Medium für drei Mal, um Spuren von Serum zu entfernen.
- 2 ml frischem F12-Medium und sorgfältig überweisen Sie die DRG mit dem Medium in einen 15-ml-Röhrchen mit einer Glaspipette. Vorsichtig distanzieren die DRG-Neuronen durch Auf- und Abpipettieren (ca. 8-10 mal) mit der Glaspipette (Kunststoffspitzen können als Alternative verwendet werden).
- Pellet an am Boden des Röhrchens absetzen und sammeln das Medium in ein neues Röhrchen. 2 ml frischem F12-Medium in das Röhrchen mit dem Pellet und wiederholen Sie den mechanische Dissoziation mit der Glaspipette. Wiederholen Sie diesen Schritt, bis die Suspension homogen (etwa 3-4 mal) wird und sammeln Sie alle dissoziierten DRG in die Röhre schieben. Dieses Verfahren reduziert die Belastung, die sich aus dem mechanischen Dissoziation und verbessert die Lebensfähigkeit der Neuronen.
- Filtern Sie die resultierenden homogenisierten Suspension in eine neue 15-ml-Röhrchen mit einem 100 um Zellsieb zu un-dissoziierten Neuronen und andere Verunreinigungen zu entfernen. In diesem Stadium kann es nützlich sein könnte, um zuerst die Zellsuspension Filter in ein 50 ml Röhrchen, und dann wird die Lösung in der kleineren Tube mit einer Glaspipette. Zentrifugieren Sie die Suspension bei 110 g für 5 min.
- Vorbereiten einer 15% Rinderserumalbumin (BSA) durch Zugabe von 500 ul einer 30% igen BSA-Lösung zu 500 & mgr; l F12-Medium. Langsam Pipette die Lösung auf der Wand einer 15-ml-Röhrchen, um eine allmähliche Protein Spur erstellen. In diesem Stadium ist es hilfreich, das Röhrchen in einem Winkel von 45 ° zu halten und langsam frei die BSA mit den NummernDie Falcon-Röhrchen als Referenz für die Bildung "Spur".
- Überstand von Schritt 3.10 Abgangs 500 ul an der Unterseite des Rohres und Zellpellet im gleichen Medium. Langsam pipettieren Suspension entlang der Protein Spur zuvor in Schritt 3.11 (mit den Zahlen auf der Röhre als Referenz) und Zentrifugieren bei 500 g für 5 min hergestellt.
- Saugt den Überstand und das Pellet in 1 ml des modifizierten BS Medium (oder einem Mischmedium für die SC-like ASC / DRG Co-Kultur, wie unten in Stufe 4.5 beschrieben.
ANMERKUNG: Das Volumen resuspendieren DRG Neuronen bis zu dem tatsächlichen Volumen benötigt werden, abhängig von der gewünschten Endkonzentration an Zellen und der Anzahl der Proben, die geimpft werden. Ein Tier wird genügend Zellen für eine Platte mit 24 Vertiefungen Experiment liefern. - Die gesetzten Proben bei 37 ° C, 5% CO 2 für 2 Stunden, um die Zellhaftung zu ermöglichen und schließlich fügen Sie frisches BS-Medium mit 50 ng / ml von Nervenwachstums fa ergänztctor (NGF).
4. Die direkten Co-Kultur der SC-ähnliche ASC und DRG-Neuronen
- Pflegen SC-ähnliche ASC in Kultur bei subkonfluenten Ebenen wie in Schritt 2.2.3 beschrieben. Vierundzwanzig Stunden vor DRG Ernte, saugen Sie den Stammzelldifferenzierungsmedium und waschen Sie die Zellen mit HBSS. Absaugen und inkubiere in 3 ml Trypsin bei 37 ° C, 5% CO 2 für 3 min.
- Prüfen unter einem Lichtmikroskop, dass alle Zellen von dem Kolben abgelöst. Die Flasche klopfen Sie leicht auf Distanz zu helfen. In 7 ml Medium, um das Trypsin Reaktion zu stoppen, sammeln Sie die Zellsuspension in ein 15 ml Zentrifugenrohr und bei 110 g für 5 min.
- Aspiration des Überstands und Resuspendieren des Zellpellets in 5 ml Stammzelldifferenzierungsmedium. Zählen der Zellen unter Verwendung eines Hämozytometers und verdünnt das Zellsuspension nach der Endkonzentration erforderlich. Idealerweise Aussaat 20.000 SC-ähnliche ASC / cm 2 würde eine konfluente Schicht von Zellen zu gewährleisten.
- Samen der SC-likeASC auf dem Substrat und bei 37 ° C, 5% CO 2 für 24 h auf die Zellbindung zu ermöglichen.
- Nach 24 Stunden Inkubation, saugen Sie den mittleren und fügen Sie die DRG-Neuronen auf der Oberseite der Zellen wie in Schritt 3.14 und 3.15 beschrieben. Ändern des Mediums, um ein gemischtes Medium, das 50% der Stammzelldifferenzierungsmedium und 50% der BS Medium. Darüber hinaus reduziert die FBS-Konzentration auf 1 bis 2,5% in der letzten Mischmedium hilft Vermeidung der Verbreitung der Kontamination Satellitenzellen aus dem DRG Dissoziation abgeleitet.
- Die co-kultivierten Proben bei 37 ° C, 5% CO 2 und aufrechtzuerhalten in der Kultur für die erforderliche Zeit für zukünftige Tests.
Ergebnisse
Kulturen von dissoziierten DRG Neuronen dar zur Untersuchung der Nervenregeneration eine geeignete in vitro-Modell. Allerdings sind unbehandelte Substrate keine geeignete Umgebung für die DRG-Befestigung und Verlängerung von Neuriten. SC artigen ASC können Wachstumsfaktoren und Chemokinen 19, der die Fähigkeit von DRG Neuronen Neuriten keimen verbessern kann, wenn sie in das Kulturmedium freigesetzt herzustellen. Die Anwesenheit von SC artigen ASC in dem Kultursystem kann daher eine wichtige Rolle bei der Regulierung der DRG-Funktionen.
Dieses Protokoll (Bild 1) zeigt die Vorgehensweise, um eine direkte Ko-Kultur von SC artigen ASC und DRG-Neuronen, während der neuronalen Zellen in direktem Kontakt mit zuvor ausgesät SC artigen ASC erhalten auszuführen. Das Hauptproblem bei diesem Verfahren ist der hohe Variabilität der Anzahl von DRG-Neuronen von unterschiedlichen Tieren geerntet. Aus diesem Grund können die Ergebnisse manchmal schwierig sein, Compare und eine besondere Aufmerksamkeit während der Saatfahrweise, um stets eine vergleichbare Zelldichte in jedem Experiment erhalten gezahlt. Das Protokoll wurde optimiert, um zumindest die Anzahl von Satellitenzellen von DRG Neuronen Dissoziation unter Verwendung der BSA-Gradienten (Schritt 3.11) verbleibenden reduzieren. Zusätzlich kann Cytosin-Arabinose (ARA-C) Ergänzung des BS Mediums, um den Satelliten-Zellpopulation weiter zu minimieren hinzugefügt werden, wie durch Kingham et al. 11 beschrieben. Die Auswahl der Behandlungszeit muss jedoch sorgfältig gegen das DRG und SC artigen ASC Vitalität, auch durch die Gegenwart von Ara-C Zusatz im Kulturmedium beeinflusst zu sein. Daher ist es sehr schwer, eine Satellitenzelle freiSystem zu erreichen.
Bild 2 zeigt die Bedeutung der SC artigen ASC für DRG Neuriten Sprießen in einem Co-Kulturmodell unter Verwendung von unbehandeltem und chemisch modifizierten Poly - Caprolacton (PCL) Folien als Substrate. DRG-Neuronen waren maiin Kultur ntained für 3 Tage in Gegenwart oder Abwesenheit von SC artigen ASC, unter Verwendung einer gemischten Lösung, die 50% der BS Medium und 50% der Stammzelldifferenzierungsmedium, wie in Schritt 4.5 beschrieben. Nach diesem Zeitraum wurden die Zellen in 4% Paraformaldehyd fixiert und mit β-Tubulin III (DRG Neuronen) und S100 (SC artigen ASC), um die Zellmorphologie zu untersuchen und um die Fähigkeit von DRG Neuronen Neuriten ragen studieren gefärbt. Keine Neuriten wurden auf unbehandelten Oberflächen in Abwesenheit von SC artigen ASC (2A) beobachtet, während die Bildung von Neuriten wurde eindeutig im Co-Kultursystem (2C) verbessert. Im Durchschnitt beträgt die Anzahl von Neuriten pro Zelle Körper deutlich von 0 bis 3 in Gegenwart von Stammzellen gesteigert. Eine Bestätigung dieser Ergebnisse wurde auch durch Rasterelektronenmikroskopie (SEM) -Analyse, in 3 gezeigt angegeben. Insbesondere sind die SEM-Bilder zeigen, dass die Fähigkeit von DRG Neuronen Neuriten keimen läuft bevorzugt in Verbindungmit SC artigen ASC, wie durch die gelbe Pfeile in Figur 3C dargestellt.
Es sollte darauf hingewiesen werden, dass die Verwendung von Laminin-modifizierte Substrate (einschließlich Laminin abgeleiteten Peptiden) in Kultursystemen, die DRG-Neuronen wurde häufig als ein geeigneter Zustand für neuronale Zellkultur definiert, mit bemerkenswerten Wirkungen auf Neuritenbildung und Verlängerungs 30-32 . Die in 2D und 3D gezeigt Ergebnisse haben jedoch gezeigt, daß die Kombination von chemischer und biologischer Signale können weiter die Reaktion der DRG-Neuronen.
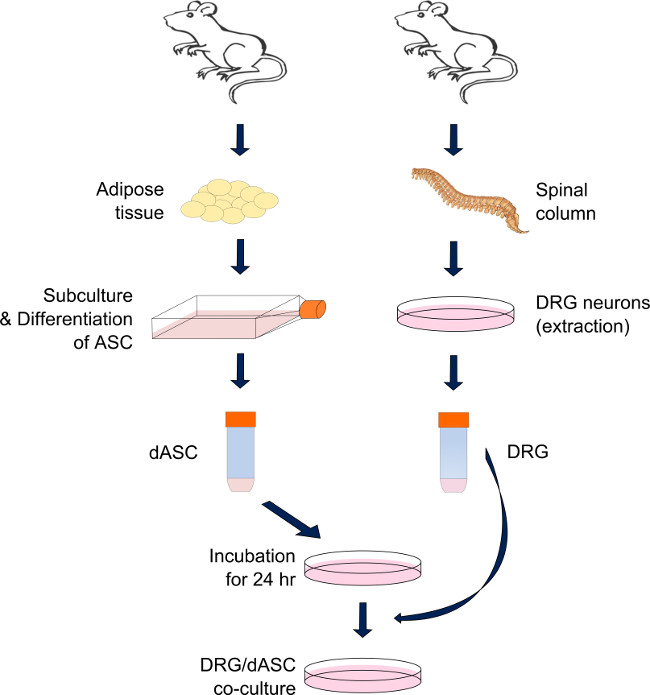
Abbildung 1. Herstellung der direkten DRG-SC artigen ASC Co-Kultursystem. DRG Neuronen und ASC werden jeweils von der Wirbelsäule und dem viszeralen Fett und inguinalen adulter mal abgeleitetene Sprague-Dawley-Ratten. Nach der Verdauung des Fettgewebes durch eine Kaskade von enzymatischen Reaktionen sind ASC in SC-ähnliche Zellen differenziert und in subkonfluenten Bedingungen gehalten, bis sie benötigt. SC-ähnliche ASC sind bereits ausgesät auf jedem Substrat 24 Stunden vor der DRG Ernte. Am Tag werden DRG Neuronen extrahiert und dissoziiert durch eine Reihe von enzymatischen und mechanischen Einwirkungen. Die Nervenzellen werden dann auf der Oberseite der zuvor ausgesät SC-ähnliche ASC ausgesät und in Kultur gehalten bis zur Analyse (Mischmedium: das 50% der Stammzelldifferenzierungsmedium und 50% der modifizierten BS Medium). Bitte klicken Sie hier ein, um zu vergrößern Version dieser Figur.

Abbildung 2. Fluoreszenzbilder von DRG-Neuronen in verschiedenen Kulturbedingungen.(A) unbehandelte PCL Folien; (B) RGD-modifizierten PCL Folien; (C) co-kultiviert mit SC-ähnliche ASC auf unbehandelten PCL Folien; (D) co-kultiviert mit SC-ähnliche ASC auf RGD-modifizierten PCL-Filme. Zellen wurden in Kultur für 3 Tage unter Verwendung einer gemischten Lösung, die 50% der modifizierten BS Medium und 50% der Stammzelldifferenzierungsmedium gehalten. Nach dieser Zeit wurden die Zellen in 4% Paraformaldehyd fixiert, in einem Triton-X-Lösung permeabilisiert, und unspezifische Bindungsstellen wurden mit 1% BSA blockiert. Und SC-ähnliche ASC gegen S-100 (AlexaFluor568; rot) Antikörper; neuronalen Zellen wurden dann gegen β-Tubulin-III (grüne FITC) gefärbt. Schließlich Kerne wurden mit DAPI (blau) gefärbt. Bilder wurden mit einem Fluoreszenzmikroskop (Olympus BX60, Japan) erworben. (Re-Print mit Genehmigung von De Luca et al. 30. Bitte klicken Sie hier, um eine größere vers anzeigenIonen dieser Figur.
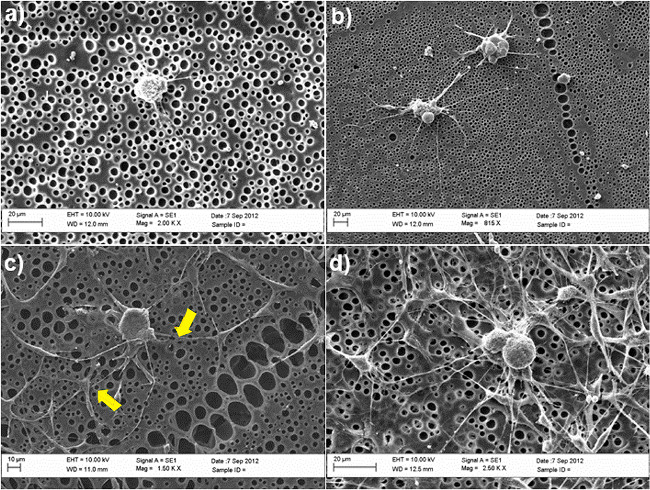
Abbildung 3. REM-Aufnahmen von DRG-Neuronen in unterschiedlichen Kulturbedingungen (A) unbehandelte PCL-Filme (B) RGD-modifizierten PCL Folien;. (C) co-kultiviert mit SC-ähnliche ASC auf unbehandelten PCL Folien; (D) co-kultiviert mit SC-ähnliche ASC auf RGD-modifizierten PCL-Filme. Die gelben Pfeile zeigen die Kontaktpunkte zwischen SC artigen ASC und DRG, bestätigt ihre direkte Wechselwirkung in dem Co-Kultursystem. Zellen wurden in Kultur für 3 Tage gehalten und in 2,5% Glutaraldehyd fixiert. Nach Dehydratation in abgestuften Ethanolreihe (50%, 70%, 90%, 100%) wurden die Zellen schließlich in Hexamethyldisilazan ausgespült und vor der Montage auf Stubs und Gold Sputtern für die SEM-Analyse getrocknet. Bilder wurden unter Verwendung eines SEM (Zeiss EVO60, UK) mit einer Beschleunigungs vol erworbenentage von 10 kV. (Re-Print mit Genehmigung von De Luca et al. 30. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Diskussion
DRG Neuronen häufig bei neuronalen Zellen zur Kultivierung, um die Regeneration von Neuronen nach Axotomie in vivo zu studieren. Hier ein genaues Protokoll für DRG Ernte von erwachsenen Ratten vorgelegt wird, auf eine Verringerung der Bevölkerung von Satelliten-Zellen in die Umgebung, ohne die das neuronale Überleben ab. Als ASC in einen SC-ähnlichen Phänotyp differenziert sind eine gute Alternative zum SC für Zelltherapien wird ein SC-ähnliche ASC / DRG-Co-Kultursystem auch im Detail beschrieben.
Es ist weithin bekannt, daß Laminin (oder Laminin abgeleiteten Peptidsequenzen) eine vorteilhafte Wirkung auf das Überleben von Neuronen und Neuritenbildung 31-33. Bei der Durchführung von DRG Neuronenkulturen wird somit zuvor Mantel jedes Substrat mit Laminin, um jeglichen Verlust von Funktionalität der neuronalen Zellen verhindern raten. Das Konzept von Laminin Beschichtungen gilt auch für Biomaterial Substrate für das Design vonTissue Engineering-Konstrukte, wie beispielsweise Poly - Caprolacton (PCL), die häufig zur Herstellung von Nervenleitungen 30 verwendet. Auch zeigte früheren Arbeiten, dass Fibrin-Matrizen sind geeignete Materialien für die neuronalen Kulturen in drei Dimension 11.
Neben Proteinbeschichtung, Co-Kulturmodellen wertvolle Bedingungen für DRG Überleben von Neuronen und eine geeignete Umgebung für die Interaktionen, die zwischen den Neuronen und SC in das periphere Nervensystem nach Verletzungen auftreten, zu untersuchen. Zellen können auch in vivo unter Verwendung von neuronalen Einrichtungen, um die Einstellungszeit von autologen Zellen an der Verletzungsstelle zu verkürzen transplantiert werden. Dies ist besonders wichtig bei schweren Verletzungen, die Zellalterung / Tod und Muskelschwund führen kann. Obwohl SC sind die wichtigsten Gliazellen in den Prozess der Regeneration peripherer Nerven und Myelinisierung, ihre begrenzte Verfügbarkeit und ihre langsame Proliferationsrate beteiligt macht sie ungeeignetTissue Engineering-Anwendungen 34. ASC sind eine gute Alternative aufgrund ihrer Vielfalt und der Fähigkeit, in die SC-Phänotyp zu differenzieren, Expression spezifischer Glia-Marker und zeigen funktionale Ähnlichkeiten mit einheimischen SC 19. ASC sind ebenfalls in der Lage, Proteine und Wachstumsfaktoren, 5, die vorteilhaft für die Bildung und Verlängerung der Neuriten von DRG-Neuronen in einer Co-Kultur-System erzeugen kann. Jedoch können zwei verschiedene Co-Kultur-Systeme als Funktion der experimentellen Anforderungen eingestellt werden. Die in diesem Papier vorgeschlagenen Verfahren ist eine überarbeitete Version eines etablierten Protokolls in unserem Labor 11 und es einen direkten Kontakt zwischen den beiden Zelltypen (direkte Co-Kultur), in der der zweite Zelltyp (DRG-Neuronen) ausgesät werden beinhaltet auf der Oberseite der anderen (SC-ähnliche ASC). Dieser Ansatz basiert auf früheren Befunden, die die Wichtigkeit der Anwesenheit einer glialen Zellschicht auf dem Substrat gezeigt, wenn Impfen neuronalen Kulturen 35 basierend - 37. Diese Wirkung ist wahrscheinlich auf die Zell-Zell-Wechselwirkungen durch DRG Integrinen und ECM-Moleküle aus ASC und andere Signale auf dem Stammzellen Oberfläche abgeschieden. Es wurde auch beobachtet, dass eine Reduzierung der Serumproteinen im Medium verringert die Vermehrung von kontaminierenden Satellitenzellen, die aus der Dissoziation von DRG Neuronen leiten kann, ohne dass dies Auswirkungen ASC Funktionen. Jedoch Satellitenzellen, einschließlich einer kleinen Population von SC, sind schwer vollständig beseitigen aus Kulturen von DRG-Neuronen und einigen restlichen Zellen werden auch in dem Co-Kultursystem vorhanden sein. Daher ist es wichtig zu beachten, dass diese kleinen Subpopulationen kann auch auf die Myelinisierung Prozesse bei in vitro-Studien teilnehmen, unter Hinweis auf die autologen Zellen, die in vivo nach Verletzungen vorhanden sind. Der zweite Ansatz (hier nicht dargestellt) umfasst die Verwendung von Zellkultureinsätzen, die Vermeidung eines direkten Kontakts zwischen den beiden verschiedenen Zelltypen (indirekte Kokultur). However ist nicht repräsentativ für die in-vivo-Bedingungen bei der Nervenregeneration (reduzierte Fähigkeit von neuronalen Zellen, lange Neuriten zu entwickeln), wird jedoch verwendet, um die Wirkung des freigesetzten diffundierbaren Faktoren im Medium durch eine bestimmte Zellpopulation auf die anderen 38 zu untersuchen .
Offenlegungen
The authors confirm that there are no conflicts of interest associated with this publication.
Danksagungen
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 ml plastic tubes | Sarstedt | 62.554.002 | |
| 50 ml plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200 ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| [header] | |||
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
Referenzen
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558(2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a, Aa Shen, Y. -, De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a, Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015(2011).
- Seggio, aM., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001(2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten