Method Article
Dorsal Root Ganglia neurônios e células-tronco diferenciadas adiposo-derivados: An
Neste Artigo
Resumo
Gânglios da raiz dorsal (DRG) são estruturas que contêm os neurónios sensoriais do sistema nervoso periférico. Quando dissociada, podem ser co-cultivadas com células estaminais do tipo SC, derivadas de tecido adiposo (ASC), proporcionando um valioso modelo para estudar a regeneração de nervos em vitro e mielinização, simulando o ambiente in vivo, no local da lesão.
Resumo
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
Introdução
As lesões nervosas periféricas são comuns com cerca de 9.000 casos no Reino Unido que ocorrem a cada ano em uma população predominantemente jovem e um trabalho. Apesar de técnicas de reparo neural microcirúrgico, a restauração normal da função é inatingível, com o consequente sensação prejudicada lado, a função motora reduzida e dor freqüente e intolerância ao frio 2. Essas lesões têm um impacto profundo e permanente sobre o paciente e sua capacidade de realizar atividades da vida diária, com menos de 60% de retorno ao trabalho 3.
Após ferimento, o fenótipo e a morfologia de neurónios e células de Schwann mudança (SC), a fim de criar um ambiente adequado para permitir a germinação do axónio. No caso do corte transversal, o nervo é dividido em cotos proximal e distal; o coto proximal sendo o ponto a partir do qual o processo regenerativo ocorre, enquanto o coto distal sofre degeneração Walleriana após o que a desanexação SCdos axônios feridos, de-diferenciar e proliferar. Isso é fundamental no sentido de remover restos de mielina e preparando o coto distal para 4,5 nervo re-geração. Axon brotação é suportada pela produção de fatores neurotróficos e quimiocinas divulgados pela SC para o coto distal, e guiado pela lâmina basal deixou para trás seguinte degeneração Walleriana 6,7. SC alinhar ao lado do axônio regenerar formando as bandas de Büngner, que ajuda o crescimento do axônio para o órgão-alvo, reduzindo ramificação fora do tubo endoneurial. Seguindo reinervação, SC formar a nova bainha de mielina envolvendo os axônios regenerados, mas a função sensorial e motora é apenas parcialmente restaurada 8.
Gânglios da raiz dorsal (DRG) são estruturas localizadas no forame intervertebral da coluna vertebral, contendo as células neuronais sensoriais que inervam os órgãos periféricos. Quando dissociado, eles podem ser usados como uma modificação in vitro adequadoel para o estudo da regeneração do nervo 9-11, incluindo investigações de formação de mielina. Em particular, os neurónios DRG adulto imitar as características in vivo destas células e fornecer uma ferramenta formidável para estudar novas estratégias para a reparação de nervos periféricos na engenharia de tecidos.
Co-culturas representam um sistema dinâmico que simula in vitro a interacção dos dois (ou mais) tipos de células em particular, um ambiente in vivo. Uma das vantagens destes modelos de co-cultura de células, é a flexibilidade e alta de controlo que pode ser exercida sobre o ambiente extracelular. Neurónios DRG têm sido utilizados frequentemente em sistemas de co-cultura com SC para imitar as interacções reais que ocorrem entre os dois tipos de células no sistema nervoso periférico 10,12 - 14. Foi demonstrado que a SC secretar matriz extracelular (ECM) proteínas e factores de crescimento que podem melhorar notavelmente ocapacidade dos neurônios DRG para sobreviver e brotar neurites 15,16. No entanto, SC requerem longos períodos de tempo para proliferar e, apesar dos avanços nas técnicas de cultura de células, ainda é difícil gerar um número adequado de células para aplicações de engenharia de tecidos. Além disso, o sacrifício de um nervo saudável é necessária para a colheita SC autólogo. Portanto, a diferença de abastecimento SC é importante tanto para a engenharia de tecidos e em ensaios in vitro, da regeneração dos nervos. Neste ponto de vista, a ASC pode ser considerado uma alternativa valiosa para o desenvolvimento de uma construção de engenharia de tecidos, a ser utilizado para a reparação de nervo periférico 17,18. Trabalhos anteriores demonstraram a capacidade destas células para se diferenciarem em SC-ASC como, expressando marcadores gliais característicos, tais como S-100, p75 e proteína ácida fibrilar glial (GFAP) 19, bem como a proteína de mielina de zero (20) P0 . A secreção de factores de crescimento gliais, tais como o factor neurotrófico derivado do cérebro (BDNF), factor de crescimento do nervo (NGF) e factor derivado de células gliais neurotrófico (GDNF) foi também observada 21,22. Portanto, ASC do tipo SC, pode ser usado como promotor da regeneração do nervo periférico, tal como demonstrado por estudos in vitro e in vivo estuda 23-26. Além disso, a ASC pode ser colhida através de procedimentos minimamente invasivos em maior número em comparação com outros tipos de células estaminais; a frequência de células estaminais em tecido adiposo é de 100 a 1.000 vezes mais elevada do que em medula óssea de 27, e têm uma taxa de proliferação mais elevada em comparação com as células estaminais mesenquimais da medula óssea e SC.
Este trabalho tem como objetivo fornecer um protocolo detalhado para realizar altas colheitas eficientes de neurônios DRG dissociados e ASC, respectivamente, sendo este último diferenciadas em células SC-like. A co-cultura destes dois tipos de células irá, por conseguinte, proporcionar um sistema muito prático que pode ser utilizado para estudos futuros na capacidade dos DRG neurons a brotar neurites e os mecanismos de formação de mielina no andaime diferente para engenharia de tecido nervoso.
Protocolo
Nota: Todos os experimentos envolvendo animais foram realizados em conformidade com os animais do Reino Unido (Scientific Procedures) Act, de 1986.
1. Experimental Set-up
- Antes de começar a colheita de tecidos e células, verifique se todas as ferramentas são estéreis. Se necessário, autoclave um par de tesouras cirúrgicas Sharp, muito finos fórceps e uma pinça fina padrão. Também esterilizar cada substrato antes da semeadura de células utilizando esterilização UV, a exposição ao etanol ou esterilização a vapor, conforme apropriado.
- Preparação dos meios para a colheita de células-tronco e diferenciação
- Preparar o meio de crescimento de células estaminais, contendo Meio Mínimo Essencial (α-MEM) suplementado com 10% de soro fetal bovino (FBS), 200 mM de L-glutamina, e 1% de penicilina-estreptomicina (PS).
- Prepara-se uma solução estoque de 10 mM de forskolin por dissolução de 10 mg de forscolina em 2.436 ml de sulfóxido de dimetilo estéril. Use a concentração final de 14? M.
- Prepara-se uma solução estoque de 35 mg / ml de ácido retinóico por dissolução de 50 mg em 1,43 ml de sulfóxido de dimetilo estéril. Utilize a concentração final de 350 ng / ml.
- Prepare o factor de crescimento derivado de plaquetas (PDGF) existências (100 ug / ml) por dissolução de 10 mg de pó liofilizado em 100 uL de água estéril destilada. Use a concentração final de 5 ng / ml.
- Prepare factor de crescimento de fibroblastos básico (bFGF) existências (100 ug / ml) por dissolução de 50 mg de pó liofilizado em 500 uL de água estéril destilada. Utilize a concentração final de 10 ng / ml.
- Preparar o meio de diferenciação de células estaminais, meio de crescimento contendo células estaminais suplementado com 14 uM de forscolina, 126 ng /, / ml de factor de crescimento glial fator-2 (GGF-2) 5 ng ml crescimento derivado de plaquetas (PDGF), e 10 ng / factor de crescimento de fibroblastos básico ml (bFGF).
- Preparação de meios e as soluções para a colheita neurônio e dissociação
- Prepare Bottenstein e Sato (BS) médio de 28, pela adição de 1% de PS e 1% suplemento N2 para meio F12 de Ham. Calcular o volume final necessário como 500 ul por cavidade (se usar uma placa de 24 poços).
- Preparar stocks de colagenase IV em meio F12 de Ham na concentração de 1,25% p / v. Filtro-esterilizar a solução e armazenar a -20 ° C como alíquotas de 200 ul.
- Prepare existências tripsina pancreática bovina em meio F12 de Ham na concentração de 2,5% p / v, filtro de esterilizar e armazenar a -20 ° C como alíquotas de 200 ul.
- Prepare o factor de crescimento do nervo (NGF) solução estoque na concentração de 5 ug / mL em uma esterilizada por filtração solução 1 / ml de albumina de soro bovino isento de ácido gordo (BSA) em meio F12 e armazenar mg a -20 ° C como a 200 ul alíquotas. Não filtrar o NGF após a reconstituição.
- No caso de nenhuma modificação da superfície foi realizada, lamelas de revestimento / placas com poli-D-lisina (0,1 mg / ml durante 15 min a RT) E / ou laminina (2-10 ug / cm 2, durante 2 horas a 37 ° C) para suportar a ligação e crescimento de neurites de neurónios como apropriado.
- Sempre aquecer media em um banho de água a 37 ° C antes de usar.
2. derivadas de tecido adiposo Stem Cell (ASC) Colheita e diferenciação em um fenótipo SC
- ASC colheita de gordura visceral e inguinal do sexo masculino adulto ratos Sprague-Dawley
- Antes de começar, preparar um tubo com 10-15 ml de solução salina equilibrada solução de Hanks (HBSS) suplementada com 1% v / v de solução de PS e armazenar em gelo até à colheita de gordura.
- Terminar o rato por deslocamento cervical e decapitação. Raspar o rato e fazer uma incisão através da pele abdominal, expondo os órgãos internos e evitar sangramento. Retirar a gordura visceral, que envolve o estômago e intestinos (geralmente caracterizada por uma consistência amarelo gordo) e a gordura inguinal em torno dos testículos de um adulto masculino Sprague-Dawley. Th de transferênciae gordura no tubo contendo HBSS em gelo.
- Em uma cabine de segurança biológica (classe II) pique finamente a gordura usando um par de tesouras e uma lâmina de barbear estéril até a consistência fina é atingido e transferi-lo para um tubo contendo 15 ml de 0,2% p / v solução colagenase tipo I preparados e filtrar esterilizado no dia.
- Transferir o tubo num banho de água a 37 ° C e deixar o tecido adiposo para digerir em presença da enzima durante 30 min-1 h sob agitação contínua. Monitorar a digestão de perto e parar antes que o tecido é totalmente dissociados, isso irá melhorar a viabilidade celular e rendimento celular. Filtrar Theun tecido dissociado através de um filtro de células de 100 mm.
NOTA: digestão do tecido Bom resultará na consistência homogênea da gordura, visível a olho nu quando rodando suavemente o tubo, adquirindo uma aparência bege. - Neutraliza-se a enzima por adição de 15 ml de meio de crescimento de células estaminais, contendo soro bovino fetal a 37 ° C e centrifuga-se asolução a 160 g durante 10 minutos a fim de recolher a fracção do estroma vascular, incluindo as células estaminais, no fundo do tubo.
- Nesta fase, o sedimento pode ser ressuspendido em 1 mL de células vermelhas do sangue de tampão de lise para remover a contaminação de células do sangue. Após ressuspensão e pipetagem durante 1 min, adicionar 10 ml de meio de crescimento de células estaminais fresco e centrifugar a 160 g durante 10 min.
- Aspirar cuidadosamente o sobrenadante do tubo, tendo o cuidado de o agregado de células depositado no fundo. Ressuspender as células em 10 ml de meio de crescimento de células estaminais, transferi-los para uma frascos de 75 cm2 e incubar a 37 ° C, 5% de CO 2. Manter as células nos níveis de sub-confluência até passagem 1-2, mudando meio a cada 3 dias.
- ASC diferenciação para um fenótipo SC
- Na passagem 1-2, remover o meio de crescimento de células estaminais a partir do frasco de 75 cm2 e substituí-la com 10 ml de meio fresco contendo 1 mM de β-mercaptoetanol recentemente prepavermelho e filtro esterilizado no dia. Incubar as células a 37 ° C, 5% de CO 2 durante 24 horas. Nesta fase, é importante que as células são semeadas a baixa densidade (30%) antes de iniciar a diferenciação.
- Lavam-se as células cuidadosamente com HBSS, aspirado e substituí-la com 10 ml de meio contendo 350 ng / ml de ácido retinóico. Incubar as células a 37 ° C, 5% de CO 2 durante 72 horas. Tente minimizar a exposição do meio de células à luz.
- Após 3 dias, as células de lavar cuidadosamente com HBSS, aspirado e substituí-la com 10 ml de meio de diferenciação de células estaminais (ver o passo 1.2.6). Manter as células em níveis sub-confluentes, mudando meio a cada 3 dias.
NOTA: Após 2 semanas de incubação, ASC são diferenciadas em ASC SC-like, expressando seu fenótipo característico (como demonstrado por Kingham et al. 5). Eles podem então ser usados até a 10ª passagem, sem alterações visíveis no comportamento 29.
3. Colheita e dissociação de raiz dorsal Gânglios (DRG) Neurônios
- Terminar o rato por deslocamento cervical e decapitação. Raspar o rato e levantar a pele para expor a coluna vertebral. Usando uma tesoura afiada, excide a coluna vertebral tomando cuidado extra dos órgãos confinados e vasos sanguíneos. Transfira a coluna vertebral em uma cabine de segurança biológica (classe II), utilizando uma placa de Petri e remover qualquer parte dorsal.
- Divida a coluna vertebral ao meio ao longo do eixo longitudinal usando tesouras cirúrgicas estéreis e abruptos para expor o tecido do cordão. Neste ponto, é útil para cortar a coluna vertebral em dois segmentos mais pequenos abaixo do nível da caixa torácica, para torná-lo mais fácil de manipular durante a colheita de neurónios de DRG. Usando uma pinça fina, remova cuidadosamente todo o tecido do cordão, prestando atenção para não puxar e retirar as raízes DRG. Desta forma, o DRG e raízes será exposto dentro dos canais vertebrais, ainda envolto na coluna. Observe DRG como filamentos brancos coming out diretamente dos canais.
- Retire toda a raiz DRG (não apenas o DRG) dos canais vertebrais usando uma pinça muito finas, aprofundando nos canais vertebrais e prestando atenção para não danificar as raízes dos gânglios. Transferir o DRG em uma pequena placa de Petri (60 mm 2) contendo 3-4 mL de meio F12 de Ham suplementado com 1% de PS. Se utilizando animais diferentes, usar pratos separados.
- Sob um microscópio de dissecação, limpe o DRG de qualquer excesso de raízes nervosas que rodeiam os gânglios usando uma pinça estéril e um bisturi para reduzir a contaminação de células gliais. Transferir o DRG em uma pequena placa de Petri (35 mm 2) com 1,8 ml de meio F12 fresco.
- Adicionar 200 ul de solução p / v de colagenase tipo IV estoque 1,25% (concentração final de 0,125%) e incubar a 37 DRG ° C, 5% de CO 2 durante 1 h. Aspirar cuidadosamente o meio com uma pipeta de vidro, prestando atenção para não aspirar ou danificar o DRG. Adicionar meio F12 fresco flexíveltadas com 0,125% p / v enzima colagenase de tipo IV e incubar durante 1 hora, tal como descrito anteriormente.
- Aspirar o meio e lavar cuidadosamente o DRG com meio F12. Adicionar, em seguida, 1,8 ml de meio F12 e 200 ul de tripsina (concentração final de 0,25% p / v) e incuba-se a 37 ° C, 5% de CO 2 durante 30 min.
- Remover tripsina e adicionar 1 ml de meio F12 suplementado com 500 uL de SBF para prender a reacção enzimática. Aspirar o meio e lava-se cuidadosamente a DRG com meio F12 por três vezes para remover vestígios de soro.
- Adicionar 2 ml de meio F12 fresco e transferir cuidadosamente o DRG com o meio para um tubo de 15 ml usando uma pipeta de vidro. Gentilmente dissociar os neurônios do GRD por pipetagem cima e para baixo (cerca de 8-10 vezes) com a pipeta de vidro (pontas de plástico pode ser usado como alternativa).
- Permitir que o sedimento para assentar no fundo do tubo e recolher o meio em um novo tubo. Adicionar 2 ml de meio F12 fresco ao tubo contendo o sedimento e repetir o mdissociação echanical com a pipeta de vidro. Repita este passo até que a suspensão torna-se homogêneos (cerca de 3-4 vezes) e recolher todo o DRG dissociada no novo tubo. Este método reduz o stress decorrente da dissociação mecânica e melhora a viabilidade dos neurónios.
- Filtra-se a suspensão homogeneizada resultante para um novo tubo de 15 mL, utilizando um filtro pm célula 100 para remover os neurónios não-dissociados e outros detritos. Nesta fase, pode ser conveniente para a primeira filtrar a suspensão de células para um tubo de 50 ml e, em seguida, transferir a solução para o tubo mais pequeno utilizando uma pipeta de vidro. Centrifugar a suspensão a 110 g durante 5 min.
- Prepara-se uma albumina de soro de bovino 15% (ASB) pela adição de 500 ul de uma solução de BSA a 30% para 500 mL de meio F12. Pipetar lentamente a solução para baixo a parede de um tubo de 15 ml a criar uma fuga gradual proteína. Nesta fase, é útil para manter o tubo num ângulo de 45 ° e libertam lentamente a BSA utilizando os númeroso tubo falcon como referência para a formação de "faixa".
- Aspirar o sobrenadante do passo 3.10 deixando 500 ul na parte inferior do tubo e ressuspender o sedimento de células no mesmo meio. Lentamente pipetar a suspensão ao longo da trilha proteína previamente preparado no passo 3,11 (use os números sobre o tubo como referência) e centrifugar a 500 g por 5 min.
- Aspirar o sobrenadante e ressuspender o pellet em 1 ml de meio BS modificada (ou uma forma mista, para a ASC / DRG de co-cultura do tipo SC, como descrito abaixo no passo 4.5.
NOTA: O volume de re-suspender os neurónios DRG pode ser feita até o volume real necessário, dependendo da concentração celular final desejado e o número de amostras a serem semeadas. Um dos animais irá fornecer células suficientes para uma placa de 24 poços experimento. - Incubar as amostras inoculadas a 37 ° C, 5% de CO 2 durante 2 h, para permitir a fixação das células e, finalmente, adicionar meio BS fresco suplementado com 50 ng / ml de fa de crescimento do nervoctor (NGF).
4. Direta Co-cultura de ASC SC-like e DRG Neurônios
- Manter ASC do tipo SC, em cultura em níveis sub-confluentes, como descrito no passo 2.2.3. Vinte e quatro horas antes da colheita de DRG, aspirar o meio de diferenciação de células-tronco e lavar as células com HBSS. Aspirar e incubar em 3 ml de tripsina a 37 ° C, 5% de CO 2 durante 3 min.
- Verificar sob um microscópio de luz que todas as células terem destacado do balão. Bata levemente no frasco para ajudar desapego. Adicionar 7 ml de meio para parar a reacção de tripsina, recolher a suspensão celular num tubo de 15 ml e centrifugar a 110 g durante 5 min.
- Aspirar o sobrenadante e ressuspender o sedimento de células em 5 ml de meio de diferenciação das células estaminais. Contar as células utilizando um hemocitómetro e diluir a suspensão de células de acordo com a concentração final requerida. Idealmente, semeando 20.000 SC-like ASC / cm 2 garantiria uma camada confluente de células.
- Semente da SC-likeASC sobre o substrato e incuba-se a 37 ° C, 5% de CO 2 durante 24 h, para permitir a fixação das células.
- Após 24 horas de incubação, aspirar o meio e adicionar os neurónios DRG em cima das células tal como descrito no passo 3.14 e 3.15. Mudar a forma de uma forma mista, contendo 50% de meio de diferenciação de células-tronco e 50% de meio BS. Além disso, a redução da concentração de 1-2,5% de FBS em meio misto final ajuda a evitar a proliferação de células satélites contaminantes derivados da dissociação DRG.
- Incubar as amostras co-cultivadas a 37 ° C, 5% de CO 2 e manter em cultura durante o tempo requerido para testes futuros.
Resultados
As culturas de neurónios DRG dissociados representam um modelo in vitro apropriado para o estudo da regeneração dos nervos. No entanto, substratos não tratados não proporcionar um ambiente adequado para fixação DRG e extensão de neurites. SC-like ASC são capazes de produzir fatores de crescimento e quimiocinas 19 que podem melhorar a capacidade dos neurônios do GRD a brotar neurites quando são liberados no meio de cultura. A presença de ASC do tipo SC, no sistema de cultura pode, por conseguinte, desempenham um papel importante na regulação das funções de DRG.
Este protocolo (Figura 1) ilustra o procedimento para realizar uma co-cultura directa de ASC e neurónios DRG SC-semelhantes, durante o qual as células neuronais entrar em contacto directo com o anteriormente semeadas ASC do tipo SC,. A principal dificuldade associada com este processo é a elevada variabilidade do número de neurónios DRG colhidas de diferentes animais. Por esta razão, os resultados podem ser, por vezes, difícil de Compare e uma atenção especial deve ser dada durante o procedimento de sementeira de modo a obter sempre uma densidade celular comparável em cada experiência. O protocolo foi optimizado para reduzir pelo menos o número de células restantes de satélite a partir da dissociação de neurónios DRG utilizando o gradiente de ASB (passo 3.11). Além disso, citosina-arabinose (Ara-C) suplemento pode ser adicionada ao meio BS, a fim de minimizar ainda mais a população de células satélite, como descrito por Kingham et ai. 11. No entanto, a escolha do tempo de tratamento deve ser cuidadosamente equilibrada com a DRG e do tipo SC, ASC vitalidade, também afectada pela presença de suplemento ARA-C no meio de cultura. Portanto, é muito difícil de realizar um sistema isento de células satélite.
A Figura 2 mostra a importância de ASC do tipo SC, para germinação de neurites DRG em um modelo de co-cultura utilizando poli não tratada e quimicamente modificados - caprolactona (PCL), os filmes como substratos. Neurônios DRG foram maintained em cultura durante 3 dias na presença ou ausência de ASC SC-semelhantes, utilizando uma solução de mistura contendo 50% de meio BS e 50% de meio de diferenciação das células estaminais, tal como descrito na etapa 4.5. Após este período, as células foram fixadas em paraformaldeído a 4% e coradas com β-tubulina III (neurónios DRG) e S100 (do tipo SC, ASC) para investigar a morfologia das células e para estudar a capacidade dos neurónios DRG a sobressair neurites. Não foram observadas neurites em superfícies não tratada na ausência de do tipo SC, ASC (Figura 2A), enquanto que a formação de neurites foi claramente melhorada no sistema de co-cultura (Figura 2C). Em média, o número de neurites por corpo da célula significativamente aumentada de 0 a 3 na presença de células estaminais. A confirmação desses resultados foi também determinado por microscopia electrónica de varrimento (MEV), mostrado na Figura 3. Em particular, as imagens SEM mostram que a capacidade de neurónios DRG de germinar neurites ocorre preferencialmente em conjuntocom a ASC do tipo SC,, como indicado pelas setas na Figura 3C amarelo.
Deve salientar-se que o uso de substratos modificados com laminina (incluindo péptidos derivados de laminina), em sistemas de cultura que contêm neurónios DRG tem sido frequentemente definido como uma condição adequada para a cultura de células neuronais, com efeitos notáveis sobre a extensão de neurite e formação de 30-32 . No entanto, os resultados apresentados na Figura 2D e a Figura 3D mostra que a combinação de estímulos químicos e biológicos pode aumentar ainda mais a resposta de neurónios de DRG.
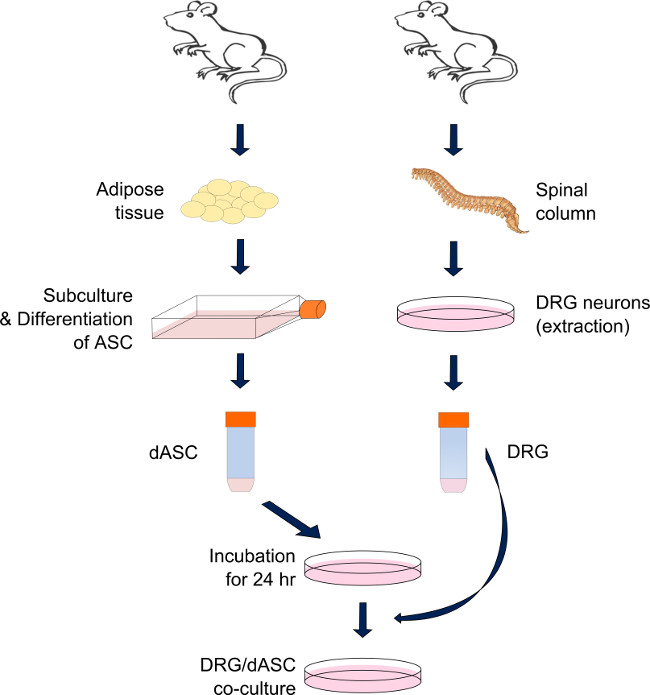
Figura 1. Preparação da DRG-SC-like sistema ASC co-cultura direta. Neurônios DRG e ASC são derivados respectivamente da coluna vertebral e da gordura visceral e inguinal do adulto male ratos Sprague-Dawley. Após a digestão do tecido adiposo, por uma cascata de reacções enzimáticas, a ASC são diferenciadas em células do tipo SC, e mantidas em condições sub-confluentes até ser necessário. ASC SC-like são pré-semeado em cada substrato 24 horas antes da colheita DRG. No dia, neurónios DRG são extraídos e dissociados por meio de uma série de acções enzimáticas e mecânicas. Os neurónios são, em seguida semeado na parte superior da ASC do tipo SC, previamente semeada e mantida em cultura até ao ensaio (meio misturado: contendo 50% de meio de diferenciação de células-tronco e 50% de meio BS modificado). Por favor clique aqui para ver um maior versão desta figura.

Figura 2. Imagens de fluorescência de neurônios DRG em diversas condições de cultivo.(A) filmes PCL não tratados; (B) filmes PCL RGD-modificados; (C) co-cultivados com ASC SC-como em filmes de PCL não tratados; (D) co-cultivados com ASC SC-como em filmes de PCL RGD-modificados. As células foram mantidas em cultura durante 3 dias, utilizando uma solução de mistura contendo 50% de meio BS modificado e 50% de meio de diferenciação das células estaminais. Após este tempo, as células foram fixadas em 4% de paraformaldeído, permeabilizadas em uma solução de Triton-X, e sítios de ligação não específicos foram bloqueados com BSA a 1%. Células neuronais foram então coradas contra β-tubulina III (FITC; verde) e ASC SC-like contra S-100 (AlexaFluor568; vermelhas) anticorpos. Finalmente núcleo foi corado com DAPI (azul). As imagens foram obtidas utilizando um microscópio de fluorescência (Olympus BX60, Japão). (Re-print com a permissão de de Luca et al 30.. Por favor, clique aqui para ver uma vers maioresion desta figura.
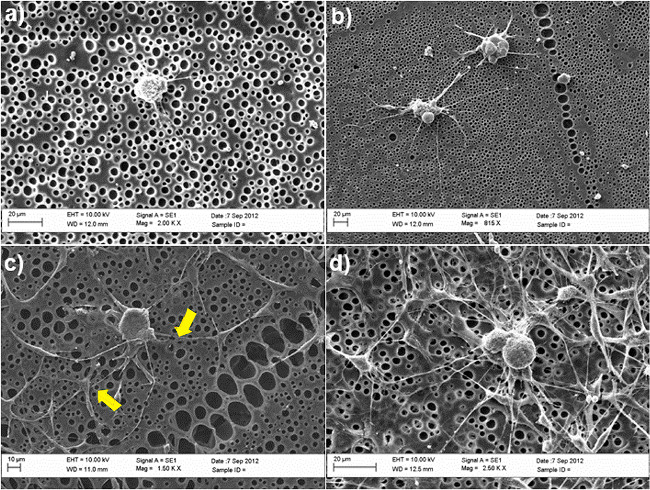
Figura 3. MEV de neurônios DRG em diversas condições de cultura (a) filmes de PCL não tratados (B) Longas PCL RGD-modificados;. (C) co-cultivados com ASC SC-como em filmes de PCL não tratados; (D) em co-cultura com ASC SC-like sobre modificado com RGD filmes PCL. As setas amarelas indicam os pontos de contato entre ASC e DRG SC-like, confirmando a sua interação direta no sistema de co-cultura. As células foram mantidas em cultura durante 3 dias e fixadas em glutaraldeído a 2,5%. Após a desidratação em séries de etanol graduado (50%, 70%, 90%, 100%), as células foram finalmente lavadas em hexametildissilazano e seco antes da montagem em bases e ouro sputtering para análise em MEV. As imagens foram obtidas utilizando uma SEM (Zeiss EVO60, UK) com um vol acelerandotage de 10kV. (Re-print com a permissão de 30 de Luca et al.. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Neurônios do GRD são frequentemente utilizados entre as células neuronais para a cultura primária para estudar a regeneração de neurônios após axotomia in vivo. Aqui um protocolo preciso para DRG colheita de ratos adultos é apresentada, que visa reduzir a população de células satélites no ambiente circundante, sem comprometer a sobrevivência neuronal. Como ASC diferenciadas em um fenótipo do tipo SC, são uma alternativa válida para SC para terapias celulares, uma ASC / DRG sistema de co-cultura do tipo SC, também está descrito em detalhe.
É amplamente conhecido que a laminina (ou sequências peptídicas derivadas de laminina) têm um efeito benéfico sobre a sobrevivência de neurónios e a formação de neurites 31-33. Ao realizar as culturas de neurónios DRG, portanto, é aconselhável para revestir cada substrato previamente com laminina, de modo a evitar qualquer perda de funcionalidade das células neuronais. O conceito de revestimentos laminina também se aplica aos substratos de biomateriais para a concepção deconstruções de engenharia de tecidos, tais como poli - caprolactona (PCL) freqüentemente usado para a fabricação de condutas nervosas 30. Além disso, trabalhos anteriores demonstraram que as matrizes de fibrina são materiais adequados para culturas neuronais em três dimensões 11.
Além disso a camada de proteína, os modelos de co- cultura de proporcionar condições valiosos para a sobrevivência de neurónios de DRG e um ambiente adequado para estudar as interacções que ocorrem entre os neurónios e SC no sistema nervoso periférico após uma lesão. As células também podem ser transplantadas in vivo usando dispositivos neurais, a fim de encurtar o tempo do recrutamento de células autólogas no local da lesão. Isto é particularmente importante em lesões graves, o que pode levar a senescência celular / morte e atrofia muscular. Embora SC são as células gliais mais importantes envolvidos no processo de regeneração do nervo periférico e mielinização, a sua disponibilidade limitada e a sua taxa de proliferação lenta torna inadequadospara aplicações de engenharia de tecidos 34. ASC são uma alternativa válida, devido à sua abundância e capacidade de se diferenciar em fenótipo SC, expressando marcadores gliais específicas e mostrando semelhanças funcionais para SC nativo 19. ASC são também capazes de produzir proteínas e factores de crescimento 5, que pode ser benéfico para a formação e extensão de neurites por neurónios DRG em um sistema de co-cultura. No entanto, dois sistemas de co-cultura diferente pode ser configurado como função das necessidades experimentais. O método proposto neste artigo é uma versão revisada de um protocolo bem estabelecido em nosso laboratório 11 e que envolve um contato direto entre os dois tipos de células (co-cultura directa), em que o segundo tipo de células (neurônios do GRD) são semeadas no topo dos outros (ASC) do tipo SC,. Esta abordagem é baseada nos resultados anteriores que demonstraram a importância da presença de uma camada de células da glia no substrato ao semear as culturas neuronais 35 - 37. Este efeito é provavelmente devido a interacções célula-célula através de integrinas DRG e moléculas de ECM depositadas a partir da ASC e outros sinais na superfície das células estaminais. Também foi observado que uma redução de soro de proteína no meio reduziu a proliferação de células satélites contaminantes que podem derivar a dissociação de neurónios DRG, sem afectar as funções ASC. No entanto, as células satélites, incluindo uma pequena população de SC, são difíceis de eliminar completamente a partir de culturas de neurónios DRG e poucas células restantes, também estará presente no sistema de co-cultura. Por conseguinte, é importante notar que estas pequenas subpopulações também podem participar nos processos mielinização durante estudos in vitro, as células autólogas recordando que estão presentes in vivo após a lesão. A segunda abordagem (não apresentado aqui) envolve a utilização de inserções de cultura de células, evitando um contacto directo entre os dois tipos de células diferentes (co-cultura indirecta). However, não é representativa das condições in vivo durante a regeneração do nervo (diminuição da capacidade das células neuronais para desenvolver neurites longas), mas é usado para investigar o efeito de factores difusíveis libertados no meio por uma população de células determinado para os outros 38 .
Divulgações
The authors confirm that there are no conflicts of interest associated with this publication.
Agradecimentos
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 mL plastic tubes | Sarstedt | 62.554.002 | |
| 50 mL plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
Referências
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558 (2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a., Aa Shen, Y. -., De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a., Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015 (2011).
- Seggio, a. M., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001 (2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados