Method Article
根神経節ニューロンと差別化された脂肪由来幹細胞を背:
要約
後根神経節(DRG)、末梢神経系の感覚ニューロンを含む構造である。解離した場合、それらは損傷部位でのインビボ環境を模倣し、in vitroでの神経再生及び髄鞘形成を研究するための貴重なモデルを提供し、SC-ような脂肪由来幹細胞(ASC)と共培養することができる。
要約
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
概要
末梢神経損傷は、英国で約9000例が圧倒的に若く、労働人口1で毎年起こると共通です。顕微神経修復技術にもかかわらず、機能の正常な回復が損なわ手の感覚、削減運動機能と頻繁に痛みや寒不寛容2を生じたと達成不可能である。このような損傷は深遠かつ永続的な患者への影響と、60%未満が3仕事に戻って、日常生活の活動を実行する能力を持っている。
損傷後、表現型および軸索発芽を可能にするために、適切な環境を作成するために、神経細胞とシュワン細胞(SC)の変化の形態。離断の場合には、神経は、近位端と遠位端に分割されている。近切り株は、遠位切り株がSCデタッチところウォーラー変性を受けながら、再生過程が起こり、そこから点である負傷した軸索から、脱分化と増殖する。これは、ミエリン破片を除去し、神経再生成-4,5-ための遠位断端の準備に向けての基本である。軸索発芽は、遠位断端にSCによって放出神経栄養因子およびケモカインの産生に支持され、ウォラー変性6,7次残し基底膜によって案内される。 SCは、神経内膜管の外側分岐削減、Büngnerのバンドを形成する軸索再生と一緒に標的臓器に向かっている援助軸索成長に合わせます。神経再生に続いて、SCは、再生軸索を包む新しい髄鞘を形成するが、感覚および運動機能が部分的にしか8を復元されます。
後根神経節(DRG)の感覚神経細胞は、末梢臓器を支配含む脊柱の椎間孔を内に配置構造である。解離した場合、それらは、適切なインビトロのMODとして使用することができミエリン形成の調査を含む11、 -神経再生9の研究のためのEL。特に、成体DRGニューロンは、これらの細胞のインビボでの特性を模倣し、組織工学における末梢神経修復のための新しい戦略を研究するための素晴らしいツールを提供する。
共培養は、 インビトロで 、特に、2つの(またはそれ以上)の細胞型の相互作用のインビボ環境をシミュレートする動的システムを表す。これらの細胞の共培養モデルの利点の一つは、細胞外環境に作用することができる柔軟性と高い制御である。 14 - DRGニューロンは、末梢神経系10,12内の2つの細胞型間で発生する実際の相互作用を模倣するSCとの共培養系において頻繁に使用されてきた。これは、SCを著しく改善することができる細胞外マトリックス(ECM)タンパク質および成長因子を分泌することが実証された神経突起15,16を生き残り、発芽するDRGニューロンの能力。しかし、SCは、細胞培養技術の進歩にもかかわらず、それは組織工学用途のための好適な数の細胞を生成することは困難で、増殖する時間の長い期間を必要とする。また、健全な神経の犠牲は自家SCを収穫する必要とされている。そのため、ソーシングSCの差は、組織工学と神経再生のin vitro試験において、両方のために重要である。このビューでは、ASCは、末梢神経修復17,18に使用される組織工学構築物の開発のための貴重な代替手段と考えることができる。以前の研究は、S-100、のp75およびグリア線維性酸性タンパク質(GFAP)19、ならびにミエリンタンパク質ゼロ(P0)20などの特徴グリアマーカーを発現し、SC-様ASCに分化するこれらの細胞の能力を実証した。脳由来神経栄養因子としてグリア成長因子の分泌(BDNF)、神経成長因子(NGF)、グリア細胞由来神経栄養因子(GDNF)も21,22を観察した。 26 - インビトロの両方で実証し、インビボで 23を研究したがって、SC-様ASCは、末梢神経再生の促進剤として使用することができる。また、ASCは、他の幹細胞型と比較してより高い数の最小侵襲性手順によって採取することができる。脂肪組織における幹細胞の頻度は、100-の骨髄27より1,000倍であり、それらは、SC及び骨髄間葉系幹細胞と比較して、より高い増殖速度を有している。
この作品は、後者は、SC-様細胞に分化され、それぞれ解離したDRGニューロンとASCの高い効率的な収穫を行うために、詳細なプロトコルを提供することを目的とする。これら2つの細胞型の共培養は、したがってDRGね能力に将来の研究のために使用することができる非常に実用的なシステムを提供する神経組織工学のための別の足場上の神経突起及びミエリン形成のメカニズムを発芽するurons。
プロトコル
注記:動物を含むすべての実験は、英国動物(科学的処置)法1986に従って実施した。
1.実験の設定
- 組織および細胞収穫を開始する前に、すべてのツールが無菌であることを確認してください。必要かどうかは、鋭い外科はさみ、非常に細かい鉗子と細かい標準鉗子のペアをオートクレーブ。また、UV殺菌、エタノール曝露または必要に応じて蒸気滅菌を用いた細胞播種前に、各基材を滅菌する。
- 幹細胞の採取および分化のための培地の調製
- 10%ウシ胎児血清(FBS)、200 mM L-グルタミン、および1%ペニシリン-ストレプトマイシン(PS)を補充した最小必須培地(α-MEM)を含む、 幹細胞増殖培地を準備する。
- 無菌ジメチルスルホキシドの2.436ミリリットルでフォルスコリン10mgを溶解することによってフォルスコリンの10 mMストック溶液を調製する。 14μMの最終濃度で使用してください。
- 無菌ジメチルスルホキシドの1.43ミリリットルで50ミリグラムを溶解することにより、レチノイン酸の35 mg / mlのストック溶液を準備します。 350 NG / mlの最終濃度で使用してください。
- 滅菌蒸留水100μl中の凍結乾燥粉末を10μgを溶解させることにより、血小板由来増殖因子(PDGF)ストック(100μg/ ml)を調製する。 5 ngの/ mlの最終濃度で使用してください。
- 滅菌蒸留水500μlの凍結乾燥粉末を50μgを溶解させることにより、塩基性線維芽細胞増殖因子(bFGF)ストック(100μg/ ml)を調製する。 10ng / mlの最終濃度で使用してください。
- 14μMフォルスコリン、126 / mlのグリア成長因子-2(GGF-2)、5 ng / mLでの血小板由来増殖因子(PDGF)、および10ng /補充した幹細胞増殖培地を含む、 幹細胞分化培地を調製mlの塩基性線維芽細胞増殖因子(bFGF)。
- ニューロン収穫および解離のためのメディアとストック溶液の調製
- Bottenstを準備HamのF12培地に1%PS、1%N2サプリメントを添加することにより、28アインと佐藤(BS)培地。ウェルあたり500μlのように必要な最終容量を計算する(24ウェルプレートを使用している場合)。
- 重量/ V 1.25%の濃度でハムF12培地中でコラゲナーゼIVストックを準備します。 200μlのアリコートとして-20℃で溶液とストアをフィルター滅菌する。
- 、2.5%重量/ Vの濃度でハムF12培地にウシ膵臓トリプシンの株式を準備し、200μlのアリコートとして-20℃でフィルター滅菌とストア。
- 200μlのような-20℃でのF12培地とストア内のフィルター滅菌し、1mg / mlの脂肪酸不含ウシ血清アルブミン(BSA)溶液中に5μg/ mLの濃度で神経成長因子(NGF)ストック溶液を調製しアリコート。再構成後NGFをフィルタリングしないでください。
- ケースでない表面改質をRTで15分間、コートカバーガラス/ポリ-D-リジンプレート(0.1 mg / mlの行われていない)及び/又はラミニン(37°Cで2時間2-10μgの/ cm 2)を適切なニューロン結合および神経突起伸長をサポートする。
- 常に使用前に37℃の水浴中でメディアを温める。
2.脂肪由来幹細胞(ASC)の収穫と分化のSC表現型へ
- 大人の雄Sprague-Dawleyラットの内臓と鼠径脂肪からASCの収穫
- 開始ハンクス平衡食塩溶液脂肪収穫まで氷上でPS溶液およびストアの1%v / vのを補充した(HBSS)10~15 mlのチューブを準備する前に。
- 頸椎脱臼と断頭によりラットを終了します。内臓を露出させ、出血を避け、ラットを剃ると腹部の皮膚を介して切開する。胃と腸(通常は脂肪黄色一貫性を特徴とする)と大人の雄Sprague-Dawley系ラットから睾丸を囲む鼠径部脂肪を包む内臓脂肪を除去します。転送番目氷上でHBSSを含むチューブ内の電子脂肪。
- 微細な稠度に達するまで、生物学的安全キャビネット(クラスII)に細かくハサミおよび滅菌カミソリの刃を使用して脂肪を切ると、新たに調製した0.2%重量/容量型コラゲナーゼI溶液15mlを含むチューブにそれを転送し濾過滅菌の日に。
- 37℃の水浴中でチューブを移し、連続撹拌下で30分〜1時間、酵素の存在下で消化する脂肪組織を残す。密接に消化を監視し、組織が完全に解離する前に停止し、これは、細胞生存率および細胞収率を改善する。 100μmのセルストレーナーを通してフィルタ·トゥン·解離した組織。
注:優しくチューブを渦巻く時グッド組織消化はベージュの外観を取得し、目で見える、脂肪の均質な一貫性になります。 - 幹細胞増殖の37℃でのウシ胎児血清を含む培地と遠心15mlを添加することによって酵素を中和10分間、160グラムの溶液をチューブの底に、幹細胞を含む間質血管画分を収集するためである。
- この段階では、ペレットは、赤血球1 mlに再懸濁させることができる血液細胞の混入を除去するための溶解緩衝液。 1分間再懸濁し、ピペッティングした後、10分間、160×gで、新鮮な幹細胞増殖培地および遠心分離機を10ml加える。
- 慎重に底に堆積した細胞ペレットの世話をして、チューブから上清を吸引除去する。 、幹細胞成長培地10ml中で細胞を再懸濁し75cm 2のフラスコ中にそれらを転送し、37℃、5%CO 2でインキュベートする。 3日ごとに培地を交換、流路1-2までサブコンフルエントレベルで細胞を維持する。
- SC表現型への分化ASC
- 継代1~2において、75cm 2のフラスコからの幹細胞増殖培地を除去し、prepa新たに1mMのβメルカプトエタノールを含有する新鮮な培地10mlに置き換える赤と日にフィルター滅菌。 24時間、37℃、5%CO 2で細胞をインキュベートする。この段階では、細胞が分化を開始する前に、低密度(30%)で播種することが重要である。
- 慎重にHBSS、吸引で細胞を洗浄し、350 / mlのレチノイン酸を含む培地10mlと交換してください。 72時間37℃、5%CO 2で細胞をインキュベートする。光への細胞中の露出を最小限に抑えるようにしてください。
- 3日後、HBSSで丁寧に細胞を洗浄、吸引と(ステップ1.2.6を参照)、幹細胞分化培地10mlと交換してください。 3日ごとに培地を交換、サブコンフルエントレベルで細胞を維持する。
注:(。キンガムら 5によって示されるように)インキュベーションの2週間後に、ASCは、それらの特徴的な表現型を発現する、SC-様ASCに分化している。次いで、これらの行動29の顕著な変化なしに10回継代まで使用することができる。
- 頸椎脱臼と断頭によりラットを終了します。ラットを剃ると脊柱を露出するために皮膚を持ち上げる。鋭いハサミを使用して、閉じ込められた臓器や血管の余分な世話をして脊柱をexcide。ペトリ皿を使用して生物学的安全キャビネット(クラスII)で脊柱を移し、すべての背の部分を削除します。
- 臍帯組織を露出させるために、滅菌鋭い外科用ハサミを使用して、長手方向軸に沿って半分に脊柱を分割する。この時点で、それが簡単にDRGニューロンの収穫時に処理するようにするために、胸郭のレベル以下の2小さなセグメントに脊柱をカットすると便利です。細かい鉗子を使用して、静かにDRGの根を引き、削除しないように注意を払って、すべてのコードの組織を除去する。 DRGと根が椎骨の運河内に露出されます。このようにして、まだ列に包まれた。白いフィラメントコミとしてDRGを観察運河から直接ngの。
- 、非常に微細な鉗子を使用して深いの椎運河に入ると神経節の根を傷つけないように注意を払うことで、椎運河から全体のDRGルート(だけでなく、DRG)を引き出します。 1%のPSを補足したハムF12培地3-4 mlを含む小さなペトリ皿(60ミリメートル2)にDRGを転送します。異なる動物を用いた場合は、別々の皿を使用しています。
- 解剖顕微鏡下で、グリア細胞の混入を低減するために滅菌ピンセットとメスを用いて神経節周囲の神経根の余分のDRGをきれい。新鮮なF12培地の1.8ミリリットルの小さなペトリ皿(35ミリメートル2)にDRGを転送します。
- 1.25%重量/体積のコラゲナーゼIV型ストック溶液(0.125%の最終濃度)を200μl添加し、1時間37℃、5%CO 2でDRGをインキュベートする。慎重にDRGを吸引か傷つけないように注意を払って、ガラスピペットで培地を吸引除去する。しなやかな新鮮なF12培地を追加します。前述のように0.125%重量/体積のコラゲナーゼIV型酵素とmentedと1時間インキュベートする。
- メディアを吸引し、軽くF12培地でDRGを洗う。その後、F12培地1.8 mlを加え、トリプシン(0.25%重量/体積の最終濃度)を200μlと30分間37℃、5%CO 2でインキュベートする。
- トリプシンを除去し、酵素反応を停止させるために、FBSの500μlの補充したF12培地の1ミリリットルを追加します。メディアを吸引し、軽く血清の痕跡を除去する3回F12培地でDRGを洗う。
- 新鮮なF12培地2mlを追加し、慎重にガラスピペットを用いて、15ミリリットルチューブに培地でDRGを転送する。静かに(プラスチックチップが代替として使用することができます)をガラスピペットでピペッティング(約8〜10倍)でDRGニューロンを解離。
- ペレットがチューブの底に沈降し、新しいチューブに培地を収集できる。ペレットを含むチューブに新鮮なF12培地2mlを追加し、Mを繰り返すガラスピペットでechanical解離。懸濁液が均一になるまで、この手順を繰り返し(約3〜4倍)と新しいチューブ内の全ての解離DRGを収集します。この方法は、機械的解離に由来する応力を低減し、神経細胞の生存率を向上させる。
- 未解離したニューロンと他の破片を除去するために100μmのセルストレーナーを使用して、新しい15ミリリットルチューブに生じた均質化されたサスペンションをフィルタリングします。この段階では、最初の50 mlチューブに細胞懸濁液をフィルタリングした後、ガラスピペットを用いて、小さなチューブに溶液を転送するために便利かもしれない。 5分間110グラムでサスペンションを遠心。
- F12培地を500μlの30%BSA溶液500μlを加えることにより、15%のウシ血清アルブミン(BSA)を調製する。ゆっくりと段階的なタンパク質証跡を作成するために15ミリリットルチューブの壁ダウンソリューションをピペット。この段階では、45°の角度でチューブを保持し、ゆっくりと数字を使用して、BSAを放出することが有用である形成「トラック」の基準とファルコンチューブ。
- チューブの底に500μlのを残すステップ3.10からの上清を吸引し、同じ培地で細胞ペレットを再懸濁します。ゆっくりと前に5分間、500gでステップ3.11(基準となるチューブに番号を使用)し、遠心機で調製したタンパク質道に沿ってサスペンションをピペット。
- ステップ4.5で、以下に説明するように、上清を吸引除去し、修正されたBS媒体(またはSC-様ASC / DRG共培養のための混合媒体の1ミリリットル中にペレットを再懸濁。
NOTE:DRGニューロンを再懸濁するためにボリュームを播種するために所望の最終細胞濃度とサンプル数に応じて、実際に必要な容積にすることができる。 1匹の動物が、24ウェルプレートの実験のために十分な細胞を提供する。 - 細胞接着を可能にするために2時間37℃、5%CO 2で播種し、サンプルをインキュベートし、最終的に神経成長faを50 ng / mlを補充した新鮮なBS培地を追加ctorの(NGF)。
4. SC-様ASCの直接共培養し、DRGニューロン
- ステップ2.2.3で説明したように、サブコンフルエントレベルでの培養でのSC-様ASCを維持します。 DRGの収穫の前に二十四時間、幹細胞分化培地を吸引し、HBSSで細胞を洗浄する。吸引し、3分間37℃、5%CO 2でトリプシン3ml中でインキュベートする。
- すべての細胞がフラスコから分離した光顕微鏡下で確認してください。静かに剥離を助けるために、フラスコをタップします。 5分間、110×gで15mlチューブと遠心分離機で細胞懸濁液を回収し、トリプシン反応を停止させる培地7mlのを追加する。
- 上清を吸引し、幹細胞分化培地5ml中に細胞ペレットを再懸濁する。血球計数器を用いて細胞をカウントし、必要な最終濃度に応じて、細胞懸濁液を希釈する。理想的には20,000 SC-様ASCを播種/ cm 2の細胞の融合層を保証する。
- SC-様をシード基板上のASCおよび細胞接着を可能にするために24時間37℃、5%CO 2でインキュベートする。
- 24時間のインキュベーション後、培地を吸引し、ステップ3.14及び3.15に記載されているように、細胞の上にDRGニューロンを追加する。幹細胞分化培地の50%、BS培地の50%を含有する混合培地に培地を変える。また、最終的な混合媒体中で1から2.5パーセントのFBS濃度を低減することDRG解離から誘導衛星細胞を汚染するの増殖を回避することに役立つ。
- 37℃、5%CO 2で共培養したサンプルをインキュベートし、将来のテストのために必要な時間培養において維持する。
結果
解離したDRGニューロンの培養物は、神経再生の研究のためのインビトロモデルにおける適当を表す。ただし、未処理基板はDRGの付着および神経突起の伸展に適した環境を提供していない。 SC-様ASCは培養培地中に放出された場合、神経突起を発芽するDRGニューロンの能力を向上させることができる成長因子及びケモカイン19を生成することができる。培養系におけるSC-様ASCの存在が故にDRG機能の調節に重要な役割を果たすことができる。
このプロトコル( 図1)は、神経細胞が以前に播種したSC-様ASCと直接接触し得るその間SC-様ASCとDRGニューロンの直接共培養を行うための手順を示す。この手順に関連する主な困難は、異なる動物から採取さDRGニューロンの数の高い変動性である。このため、結果は、比較例ことが時には難しいことができe及び特に注意が常に各実験において同等の細胞密度を得るために、播種手順の間に支払われるべきである。プロトコルは、BSA勾配(ステップ3.11)を使用して、DRGニューロンの解離から、残りの衛星細胞の少なくとも数を低減するように最適化されている。キンガムら 11によって記載されるように加えて、シトシンアラビノース(ARA-C)サプリメントは、さらに衛星細胞集団を最小限にするために、BS培地に添加することができる。しかし、処理時間の選択は、培養培地中のARA-Cサプリメントの存在によって影響DRG及びSC-様ASCの活力と注意深くバランスする必要がある。したがって、衛星細胞フリーシステムを実現することは非常に困難である。
基質としてカプロラクトン(PCL)フィルム- 図2は 、未処理および化学的に修飾されたポリを使用して共培養モデルで発芽のDRG神経突起のためのSC-様ASCの重要性を示している。 DRGニューロンであった舞ステップ4.5で説明したように、BS培地の50%、幹細胞分化培地の50%を含む混合溶液を用いて、SCのようなASCの存在下または非存在下で3日間培養ntained。この期間の後、細胞を4%パラホルムアルデヒドで固定し、細胞の形態を調査し、神経突起を突出するDRGニューロンの能力を研究するためにβチューブリンIII(DRGニューロン)およびS100(SC-様ASC)で染色した。神経突起の形成が明らかに共培養系( 図2C)に改善した一方でない神経突起は、SC-様ASC( 図2A)の非存在下での未処理表面上に観察されなかった。平均して、細胞体当たりの神経突起の数が大幅に幹細胞の存在下で、0から3まで増加した。これらの結果の確認は、 図3にも示す電子顕微鏡(SEM)分析を、走査することによって与えられた。具体的には、SEM画像は神経突起を発芽するDRGニューロンの能力に関連して優先的に起こることを示しているSC-様ASCと、 図3Cに黄色の矢印で示すように。
32 -これは、DRGニューロンを含む培養系(ラミニン由来のペプチドを含む)ラミニン修飾基質の使用が頻繁に神経突起形成及び延長部30に顕著な効果を有する神経細胞の培養に適した条件として定義されていることを指摘すべきである。しかしながら、 図2Dおよび図3Dに示された結果は、化学的および生物学的手がかりの組み合わせがさらにDRGニューロンの応答性を高めることができることを示している。
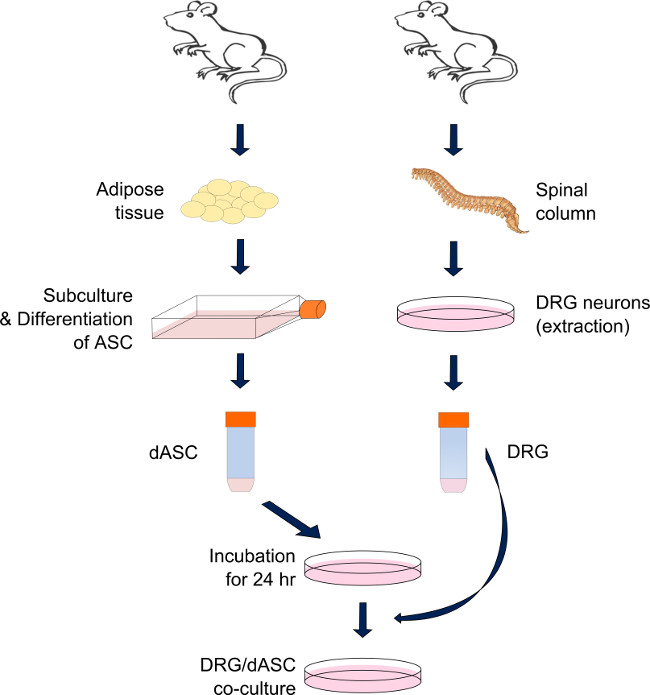
直接DRG-SC-様ASCの共培養系の図1.準備。DRGニューロンとASCは脊柱と大人のMALの内臓と鼠径部脂肪からそれぞれ導出されているE SDラット。酵素反応のカスケードを経て脂肪組織の消化の後、ASCは、SC-様細胞に分化され、必要になるまで、サブ集密状態で維持した。 SC-様ASCはDRGの収穫前に、各基板の24時間に事前に播種する。当日は、DRGニューロンが抽出され、酵素的及び機械的な一連の行動を通じて解離する。ニューロンは、以前に播種SC-様ASCの上に播種し、アッセイするまで培養で維持されている(混合媒体:幹細胞分化培地の50%と変更されたBS培地の50%を含む)。 拡大表示するには、ここをクリックしてくださいこの図のバージョン。

多様な培養条件におけるDRGニューロンの図2蛍光画像。(A)未処理PCLフィルム;(B)RGD変性PCLフィルム;(C)共培養SCのような未処理のPCLフィルム上のASCと;(D)とを共培養したRGD変性PCLフィルム上のSCのようなASCと。細胞は、改変BS培地の50%と、幹細胞分化培地の50%を含む混合液を用いて3日間培養維持した。この時間の後、細胞を、4%パラホルムアルデヒドで固定し、トリトンX溶液中で透過処理し、非特異的結合部位を1%BSAでブロックした。神経細胞は、その後βチューブリンIII(FITC、緑)に対して染色し、S-100に対してSC-様ASC(AlexaFluor568、赤)抗体。最後に、核をDAPI(青色)で染色した。画像は、蛍光顕微鏡(オリンパスBX60、日本)を用いて得た。からの許可を得て(再印刷·デ·ルカら 30。 大きなVERSを見るにはこちらをクリックしてくださいこの図のイオン。
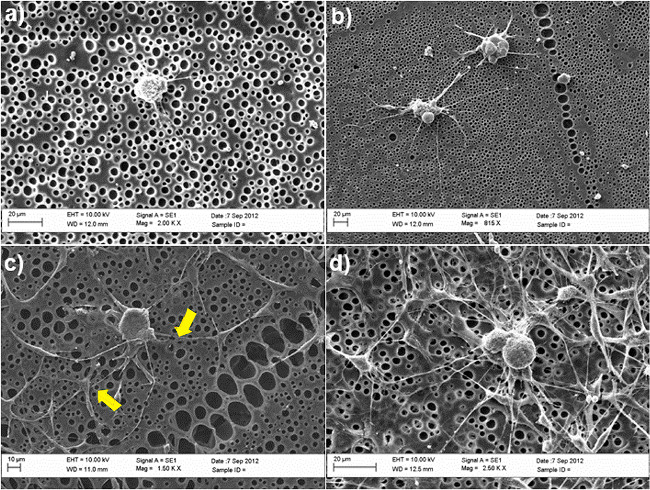
多様な培養条件におけるDRGニューロンの図3のSEM像(A)未処理PCLフィルム(B)RGD変性PCLフィルム;(C)共培養未処理PCLフィルム上のSCのようなASCと;(D)共培養RGD修飾されたPCLフィルム上のSC-様ASCと。黄色の矢印は、共培養系での直接的な相互作用を確認し、SC-様ASCとDRGとの間の接触点を示している。細胞を3日間培養維持し、2.5%グルタルアルデヒドで固定した。段階的なエタノール系列(50%、70%、90%、100%)で脱水後、細胞を最終的にヘキサメチルジシラザンでリンスし、SEM分析のためにスパッタリングスタブと金に取り付ける前に、乾燥した。画像は、加速体積でSEM(ツァイスEVO60、UK)を用いて得た10kVのの田下。 (デ·ルカら 30から許可を得て再印刷。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
初代培養は、 生体内での軸索切断後に神経細胞の再生を研究するためのDRGニューロンは、頻繁に神経細胞の中で使用されている。ここでは、成体ラットDRGからの収穫のための正確なプロトコルは、提示され、ニューロンの生存を損なうことなく、周囲の環境における衛星細胞の集団を減少させることを目的とする。 SC様表現型に分化ASCとして細胞治療のためのSCへの有効な代替物である、SC-様ASC / DRG共培養系はまた、詳細に説明する。
33 -これは、広くラミニン(またはラミニン由来のペプチド配列)はニューロンの生存及び神経突起形成31に有益な効果を有することが知られている。 DRGニューロン培養を行う際には、したがって、神経細胞の機能性の損失を回避するために、ラミニンで先にコーティングするために、各基板に助言される。ラミニンコーティングの概念は、設計のための生体材料の基材に適用される例えば、ポリ組織工学構築物、 -カプロラクトン(PCL)は、しばしば神経導管30の製造に使用した。また、以前の研究は、フィブリンマトリックスは、三次元11における神経細胞培養に適した材料であることを実証した。
タンパク質コーティングに加えて、共培養モデルは、DRGニューロンの生存および損傷後の末梢神経系のニューロンとSCとの間で生じる相互作用を研究するのに適した環境に有益な条件を提供する。細胞はまた、損傷部位での自己細胞の動員時間を短縮するために、神経のデバイスを使用して、in vivoで移植することができる。これは、細胞老化/死及び筋萎縮につながる深刻な傷害、特に重要である。 SCは、末梢神経再生および髄鞘形成のプロセスに関与する最も重要なグリア細胞であるが、それらの制限された状況とその遅い増殖速度は、それらが不適当組織工学アプリケーション34のために。 ASCは、その豊かさとSC表現型に分化する能力、特定のグリアマーカーを発現し、ネイティブSC 19に機能的類似性を示すに有効な代替である。 ASCはまた、共培養系におけるDRGニューロンによって形成及び神経突起の伸長に有益であることができる、タンパク質及び成長因子5を生成することができる。しかし、二つの異なる共培養システムは、実験の必要性の関数として設定することができる。本論文で提案する手法は、私たちの研究室11で十分に確立されたプロトコルの改訂版であり、それは第二の細胞型(DRGニューロン)が播種されている2つの細胞型( ダイレクト共培養 )、との直接接触を伴うその他(SC-様ASC)の上に。このアプローチは、ニューロン培養35を播種時に基板上にグ リア細胞層の存在の重要性を実証した以前の知見に基づいている - 37。この効果は、幹細胞表面上のASCおよび他の手がかりから堆積DRGインテグリンを介して細胞 - 細胞相互作用とECM分子に起因する可能性がある。また、培地中のタンパク質の血清の減少は、ASC機能に影響を与えずに、DRGニューロンの解離から導出することができる衛星細胞を汚染するの増殖を減少することが観察された。しかしながら、SCの小集団を含む衛星細胞は、また、共培養系に存在する完全にDRGニューロンおよび少数の残りの細胞の培養物から排除することが困難である。これらの小さなサブ集団はまた、損傷後にインビボで存在する自己細胞をリコールインビトロ研究中に髄鞘形成のプロセスに参加することができることに注意することが重要である。 (ここでは示されていない)第二のアプローチは、2つの異なる細胞型( 間接共培養 )との間の直接接触を回避する、細胞培養インサートの使用を含む。 Howevえー、それは神経再生(長い神経突起を開発するための神経細胞の能力の低下)中のインビボ条件を表していないが、他の38の上に特定の細胞集団によって培地中に放出され、拡散性因子の影響を調査するために使用され。
開示事項
The authors confirm that there are no conflicts of interest associated with this publication.
謝辞
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
資料
| Name | Company | Catalog Number | Comments |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 ml plastic tubes | Sarstedt | 62.554.002 | |
| 50 ml plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200 ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| [header] | |||
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
参考文献
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558(2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a, Aa Shen, Y. -, De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a, Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015(2011).
- Seggio, aM., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001(2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved