Method Article
Спинных нейронов и дифференцированных жировой стволовых клеток, полученных:
В этой статье
Резюме
Спинной корень ганглиев (DRG) являются структуры, содержащие сенсорные нейроны периферической нервной системы. При диссоциации, они могут быть совместно культивировали с SC, как полученные из жировой ткани стволовые клетки (ASC), обеспечивая ценную модель для изучения в пробирке регенерацию нерва и миелинизации, имитируя среду в естественных условиях в месте повреждения.
Аннотация
Dorsal root ganglia (DRG) neurons, located in the intervertebral foramina of the spinal column, can be used to create an in vitro system facilitating the study of nerve regeneration and myelination. The glial cells of the peripheral nervous system, Schwann cells (SC), are key facilitators of these processes; it is therefore crucial that the interactions of these cellular components are studied together. Direct contact between DRG neurons and glial cells provides additional stimuli sensed by specific membrane receptors, further improving the neuronal response. SC release growth factors and proteins in the culture medium, which enhance neuron survival and stimulate neurite sprouting and extension. However, SC require long proliferation time to be used for tissue engineering applications and the sacrifice of an healthy nerve for their sourcing. Adipose-derived stem cells (ASC) differentiated into SC phenotype are a valid alternative to SC for the set-up of a co-culture model with DRG neurons to study nerve regeneration. The present work presents a detailed and reproducible step-by-step protocol to harvest both DRG neurons and ASC from adult rats; to differentiate ASC towards a SC phenotype; and combines the two cell types in a direct co-culture system to investigate the interplay between neurons and SC in the peripheral nervous system. This tool has great potential in the optimization of tissue-engineered constructs for peripheral nerve repair.
Введение
Повреждений периферических нервов являются общими с примерно 9000 случаев в Великобритании происходит каждый год в основном молодые и работающего населения 1. Несмотря микрохирургической техники ремонт нерва, нормально восстановление функции недостижимо с в результате больной руки ощущение, снижение двигательной функции и частые боли и непереносимость холода 2. Такие травмы глубокое и постоянное воздействие на пациента и их способность выполнять действия в повседневной жизни, с менее чем 60% возвращаются к работе 3.
После травмы, фенотипа и морфологии нейронов и клеток Шванн (SC) изменения для того, чтобы создать подходящую среду, чтобы позволить аксона прорастания. В случае рассечения, нерв делится на проксимальных и дистальных пни; Проксимальный пень быть точка, с которой процесс восстановления происходит, в то время как дистальной культи подвергается валлеровский дегенерации после чего SC Весь текстсо стороны потерпевших аксонов, де-дифференцировать и размножаться. Это основное по устранению миелина мусора и подготовке дистального пень для нервов повторной генерации 4,5. Axon всходов поддерживается производства нейротрофических факторов и хемокинов, опубликованным СК на дальнем пень, и руководствуясь базальной мембраны оставленных после валлеровский вырождение 6,7. SC выровнять наряду с регенерирующим аксона, образующего полосы Büngner, которые помогают рост аксонов к органу-мишени, сокращение разветвлению их за пределами endoneurial трубки. После реиннервации, SC сформировать новый миелиновой оболочки упаковка регенерированных аксонов, но сенсорные и моторные функции лишь частично восстановлены 8.
Спинной корень ганглиев (DRG) представляют собой структуры, расположенные в межпозвоночных отверстий позвоночника, содержащие чувствительные нервные клетки, иннервирующие периферийные органы. При диссоциации, они могут быть использованы в качестве пригодных в пробирке модэль для изучения регенерации нерва 9 - 11, в том числе исследований формирования миелина. В частности, для взрослых DRG нейроны имитировать характеристики в естественных условиях эти клетки и надежным средством инструмент для изучения новых стратегий, периферической восстановления нерва в тканевой инженерии.
Со-культуры представляют собой динамическую систему, которая имитирует в пробирке взаимодействие двух (или более) типов клеток в определенной среде в естественных условиях. Одним из преимуществ этих моделей сотовых совместное культивирование является гибкость и высокую управления, который может быть оказано на внеклеточную среду. DRG нейроны были часто используется в системах совместного культивирования с SC, чтобы имитировать фактические взаимодействие, которое происходит между этими двумя типами клеток в периферической нервной системе 10,12 - 14. Было показано, что СК секретируют внеклеточный матрикс (ECM) белков и факторов роста, которые могут заметно улучшитьСпособность DRG нейронов, чтобы выжить и прорастают невриты 15,16. Тем не менее, SC требуют длительных периодов времени, чтобы размножаться и, несмотря на прогресс в технике культивирования клеток, это по-прежнему трудно создать необходимое количество клеток для тканевой инженерии. Кроме того, жертва здорового нерва необходимость собрать аутологичных СК. Таким образом, разница в поиске SC важно как для тканевой инженерии и в пробирке тестирования регенерации нерва. С этой точки зрения, АСК можно считать ценной альтернативой для развития в тканевой инженерии конструкции, которые будут использоваться для периферической нервных ремонта 17,18. Предыдущие работы показали способность этих клеток дифференцироваться в SC-ASC как, выражая характерные глиальные-маркеры, такие как S-100, P75 и глиальных фибриллярного кислого белка (GFAP) 19, а также миелина белка нулю (P0) 20 , Секреция глиальных факторов роста, таких как мозговой нейротрофический фактор (BDNF), фактор роста нервов (ФРН) и глиальных клеток нейротрофический фактор (GDNF) также наблюдалось 21,22. Таким образом, как СК-АСК могут быть использованы в качестве промотора периферической регенерации нерва, как продемонстрировано, как в пробирке и в естественных условиях исследования 23 - 26. Кроме того, по возрастающей могут быть собраны с помощью минимально-инвазивных процедур в большее число по сравнению с другими типами стволовых клеток; частота стволовых клеток в жировой ткани 100 до 1000 раз выше, чем в костном мозге 27, и они имеют более высокую скорость пролиферации по сравнению с SC, и костного мозга мезенхимальных стволовых клеток.
Эта работа призвана обеспечить подробный протокол на выполнение высокоэффективные урожаи диссоциированных DRG нейронов и ASC соответственно, причем последний дифференцированы в SC-подобных клеток. Таким образом, совместное культивирование этих двух типов клеток обеспечит очень практическую систему, которую можно использовать для будущих исследований о способности DRG NEurons прорастать невриты и механизмы формирования миелиновой на разных лесов для нервов тканевой инженерии.
протокол
Примечание: Все эксперименты с участием животных были проведены в соответствии с Великобританией животных (научные процедуры) Закона 1986 года.
1. Экспериментальная установка
- Перед началом тканей и клеток урожай, убедитесь, что все инструменты должны быть стерильными. Если необходимо, автоклав пару острых хирургических ножниц, очень тонким пинцетом и штраф стандартных щипцов. Также стерилизовать каждый субстрат до посева клеток с помощью УФ-стерилизации, экспозицию этанол или паровой стерилизации, как это необходимо.
- Подготовка массовой информации для сбора урожая и дифференцировки стволовых клеток
- Подготовка среды роста стволовых клеток, содержащий минимальную поддерживающую среду (α-MEM), дополненной 10% фетальной бычьей сыворотки (FBS), 200 мМ L-глутамина и 1% пенициллина-стрептомицина (PS).
- Подготовка 10 мМ маточного раствора форсколина путем растворения 10 мг форсколина в 2,436 мл стерильной диметилового sulfoxyde. Использование при конечной концентрации 14 мкМ.
- Подготовка 35 мг / мл исходного раствора ретиноевой кислоты путем растворения 50 мг в 1,43 мл стерильной диметилсульфоксид sulfoxyde. Использование при конечной концентрации 350 нг / мл.
- Подготовка тромбоцитарный фактор роста (PDGF) запасов (100 мкг / мл) путем растворения 10 мкг лиофилизированного порошка в 100 мкл стерильной дистиллированной воды. Используйте до конечной концентрации 5 нг / мл.
- Подготовка основной фактор роста фибробластов (bFGF) запасов (100 мкг / мл) путем растворения 50 мкг лиофилизированного порошка в 500 мкл стерильной дистиллированной воды. Использование при конечной концентрации 10 нг / мл.
- Подготовка дифференцировки стволовых клеток среду, содержащую среду роста стволовых клеток, дополненной 14 мкМ форсколина, 126 нг / мл фактора роста глиальных-2 (GGF-2), 5 нг / мл тромбоцитарного фактора роста (PDGF), и 10 нг / мл основной фактор роста фибробластов (bFGF).
- Подготовка информации и фондовых решений для урожая нейронов и диссоциации
- Подготовка BottenstEin и Сато (BS) средний 28, путем добавления 1% PS и 1% N2 дополнение к F12, Хама. Рассчитать конечный объем, необходимый в 500 мкл на лунку (при использовании 24-луночного планшета).
- Подготовьте запасы коллагеназы IV в среде F12 Хама в концентрации 1,25% мас / об. Фильтр-стерилизовать решения и хранить при температуре -20 ° C до 200 мкл аликвоты.
- Подготовка бычьей поджелудочной железы запасов трипсина в среде F12 Хама в концентрации 2,5% мас / об, фильтр-стерилизовать и хранить при -20 ° С в 200 мкл аликвоты.
- Подготовка фактор роста нервов (NGF) маточного раствора при концентрации 5 мкг / мл в стерилизованным фильтрацией 1 мг / мл жирной кислоты, свободной бычьего сывороточного альбумина (БСА) раствора в среде F12 и хранить при -20 ° С в 200 мкл аликвоты. Не фильтровать NGF после восстановления.
- В случае не модификация поверхности не была выполнена, флаг покровные / пластины с поли-D-лизином (0,1 мг / мл в течение 15 мин при комнатной температуре) И / или ламинин (2-10 мкг / см 2 в течение 2 ч при 37 ° С) для поддержки нейронов прикрепление и рост аксонов в соответствующих случаях.
- Всегда разогреть носитель на водяной бане при 37 ° С перед использованием.
2. полученные из жировой ткани стволовых клеток (ASC) Сбор и дифференциация в SC фенотипа
- Урожай ASC от висцерального и паховой жира взрослого самца Sprague-Dawley крыс
- Перед началом, подготовить трубку с 10-15 мл Хэнкса сбалансированного солевого раствора (HBSS) с добавкой 1% объем / объем раствора и магазина PS на льду до сбора жира.
- Завершить крысу путем смещения шейных позвонков и обезглавливание. Бритье крысу и сделать надрез через кожу живота, выставляя внутренние органы и избежать кровотечения. Удалить висцерального жира, окружающую желудок и кишечник (обычно характеризуется жировой желтый консистенции) и паховая жир, окружающий яички от взрослого мужского Sprague-Dawley крысы. Передача йе жира в пробирку, содержащую HBSS на льду.
- В кабинете биологической безопасности (класс II) мелко нарезать сало, используя ножницы и стерильный лезвие до нежной консистенцией достигается и передать его в пробирку, содержащую 15 мл 0,2% вес / v тип коллагеназы I решение свежеприготовленного и фильтр-стерилизовать в день.
- Передача трубки в водяной бане при 37 ° С и оставляют на жировую ткань, чтобы переварить в присутствии фермента в течение 30 мин-1 час при непрерывном перемешивании. Следить за пищеварение тесно и остановиться перед ткань полностью диссоциированы, это позволит улучшить жизнеспособность клеток и выход клеток. Фильтр Theun-диссоциированных ткани через сито 100 мкм клеток.
ПРИМЕЧАНИЕ: Хороший ткани пищеварение приведет к однородной консистенции жира, видимого на глаз, когда мягко закрученной трубки, приобретая бежевый внешний вид. - Нейтрализовать добавлением фермента 15 мл среды роста стволовых клеток, содержащих фетальной бычьей сыворотки при 37 ° С и центрифугируютРаствор при 160 г в течение 10 мин, чтобы собрать стромальных сосудов фракции, в том числе стволовых клеток, в нижней части трубы.
- На этой стадии осадок может быть повторно суспендируют в 1 мл эритроцитов буфера для лизиса для удаления загрязнений клеток крови. После ресуспендирования и пипеткой в течение 1 мин, добавить 10 мл свежей среды для роста стволовых клеток и центрифуге при 160 г в течение 10 мин.
- Тщательно аспирата супернатант из трубки, заботясь осажденного осадка клеток в нижней части. Ресуспендируют клеток в 10 мл среды для роста стволовых клеток, передавать их в 75 см 2 колбы и инкубируют при 37 ° С, 5% СО 2. Поддерживать клетки при суб-сливающийся уровнях до прохода 1-2, изменение среды каждые 3 дня.
- ASC дифференциации к фенотипу, SC
- При прохождении 1-2, удалить среду роста стволовых клеток из 75 см 2 колбу и заменить его 10 мл свежей среды, содержащей 1 мМ β-меркаптоэтанола только что прекрасный и фильтр стерилизуют в день. Инкубируйте клетки при 37 ° С, 5% СО 2 в течение 24 ч. На этой стадии очень важно, что эти клетки высевали при низкой плотности (30%) перед началом дифференциации.
- Вымойте клетки тщательно с HBSS, аспирация и заменить его 10 мл среды, содержащей 350 нг / мл ретиноевой кислоты. Инкубируйте клетки при 37 ° С, 5% СО 2 в течение 72 ч. Постарайтесь свести к минимуму воздействие на клеточную среду к свету.
- После 3 дней, промыть клетки тщательно с HBSS, аспирация и заменить его 10 мл дифференцирование стволовых клеток среды (см шаг 1.2.6). Поддерживать клетки при суб-сливающийся уровнях, изменяя среду каждые 3 дня.
ПРИМЕЧАНИЕ: После 2 недель инкубации, ASC дифференцированы в SC, как ASC, выражая свою характерную фенотип (как показано на Кингем и др. 5). Они затем могут быть использованы вплоть до 10-го прохода без заметных изменений в поведении 29.
3. Урожай и диссоциации спинальных ганглиях (DRG) нейронов
- Завершить крысу путем смещения шейных позвонков и обезглавливание. Бритье крысу и снять кожу, чтобы выставить позвоночник. Использование острыми ножницами, подакцизных позвоночник, принимая дополнительный уход из закрытых органов и кровеносных сосудов. Передача позвоночника в кабинете биологической безопасности (класс II) с использованием чашки Петри и удалите спинной части.
- Разделите позвоночника пополам вдоль продольной оси, используя стерильные и острые хирургические ножницы, чтобы разоблачить мозга ткани. В этот момент, было бы полезно, чтобы отрезать позвоночник в двух небольших сегментов ниже уровня грудной клетки, чтобы сделать его проще в обращении во время уборки DRG нейронов. Использование тонких щипцов, осторожно удалите всю шнур ткани, обращая внимание, чтобы не тянуть и удаления корней DRG. Таким образом, DRG и корни будут подвергаться в позвоночных каналах, по-прежнему заключен в колонке. Соблюдайте DRG как белых нитях ЦОИнг непосредственно из каналов.
- Вытяните весь корень DRG (а не только DRG) из позвонков каналов с помощью очень тонких щипцов, углубляясь в позвоночных каналов и уделяя внимание, чтобы не повредить корни ганглиев. Передача DRG в небольшую чашку Петри (60 мм 2), содержащей 3-4 мл среды F12 Хэма, дополненной 1% PS. При использовании других животных, использовать отдельные блюда.
- Под микроскопом рассекает, очистить DRG от избытка нервных корешков, окружающих ганглиев с помощью стерильного пинцета и скальпеля для снижения загрязнения глиальных клеток. Передача DRG в небольшую чашку Петри (35 мм 2) с 1,8 мл свежей среды F12.
- Добавить 200 мкл 1,25% мас / об Тип коллагеназы IV маточного раствора (конечная концентрация 0,125%) и инкубируют в DRG при 37 ° С, 5% СО 2 в течение 1 часа. Тщательно аспирата среду со стеклянной пипетки, обращая внимание, чтобы не аспирата или повредить DRG. Добавить свежие F12, эластичнойтаджи с 0,125% мас / об типа коллагеназы IV фермента и инкубировали в течение 1 ч, как описано ранее.
- Аспирируйте среды и аккуратно мыть DRG с F12 средой. Добавить затем 1,8 мл среды F12 и 200 мкл трипсина (конечная концентрация 0,25% мас / об) и инкубировали при 37 ° С, 5% СО 2 в течение 30 мин.
- Удалить трипсин и добавить 1 мл среды F12, дополненной 500 мкл ФБС, чтобы арестовать ферментативной реакции. Аспирируйте среды и осторожно мыть DRG с F12 средой три раза, чтобы удалить следы сыворотки.
- Добавить 2 мл свежей среды F12 и тщательно передачи DRG со средой в 15 мл пробирку с помощью стеклянной пипетки. Аккуратно отделить ГВС нейроны с помощью пипетки вверх и вниз (около 8-10 раз) со стеклянной пипетки (пластиковые советы могут быть использованы в качестве альтернативы).
- Разрешить осадок, чтобы осесть на дно пробирки и собирают среду в новую пробирку. Добавить 2 мл свежей среды F12 с трубкой, содержащей осадок и повторите мechanical диссоциации с стеклянной пипетки. Повторите этот шаг, пока подвеска не становится гомогенным (примерно 3-4 раз) и собрать все диссоциированную DRG в новую пробирку. Этот метод уменьшает стресс, вытекающий из механической диссоциации и повышает жизнеспособность нейронов.
- Фильтр полученного гомогенизированной суспензии в новую пробирку 15 мл с помощью мкм клеточный фильтр 100 для удаления не-диссоциированных нейронов и другого мусора. На этой стадии, может быть удобно, чтобы первый фильтр клеточной суспензии в 50 мл пробирку, а затем передать решение в меньший трубки с помощью стеклянной пипетки. Центрифуга суспензии при 110 г в течение 5 мин.
- Подготовка 15% бычьего сывороточного альбумина (BSA) путем добавления 500 мкл 30% BSA раствора к 500 мкл среды F12. Медленно пипетки раствор вниз по стенке 15 мл пробирку, чтобы создать постепенное след белка. На этом этапе, было бы полезно, чтобы удерживать трубу под углом 45 ° и медленно высвобождают BSA с использованием номера насокол трубка в качестве эталона для формирования «дорожки».
- Аспирата супернатант со стадии 3,10 уходящую 500 мкл на дне пробирки, и ресуспендируют осадок клеток в той же среде. Медленно пипетки подвески вдоль белка след ранее полученного на стадии 3,11 (используйте цифры на трубы в качестве эталона) и центрифуге при 500 г в течение 5 мин.
- Аспирата супернатант и ресуспендируют осадок в 1 мл модифицированного BS среды (или смешанной среде для SC-подобный ASC / DRG совместного культивирования, как описано ниже на этапе 4.5.
ПРИМЕЧАНИЕ: объем вновь приостановить DRG нейроны могут быть сделаны до фактического объема требуется, в зависимости от концентрации последней ячейки нужного и количество образцов для заполнена. Одно животное будет обеспечивать достаточное количество клеток для эксперимента пластины 24-а. - Инкубируйте семенами образцов при 37 ° С, 5% СО 2 в течение 2 часов, чтобы позволить прикрепление клеток и, наконец, добавить свежий BS среду, дополненную 50 нг / мл фа роста нервовCTOR (NGF).
4. Прямая Co-культура SC-как ASC и DRG нейронов
- Поддержание SC-как ASC в культуре на суб-сливающийся уровнях, как описано в шаге 2.2.3. Двадцать четыре часа в до сбора урожая DRG, аспирации дифференциации среду стволовых клеток и промыть клетки с HBSS. Аспирируйте и инкубировать в 3 мл трипсина при 37 ° С, 5% СО 2 в течение 3 мин.
- Проверка под световым микроскопом, что все клетки были отделены от колбы. Слегка постучите колбу, чтобы помочь отряд. Добавить 7 мл среды, чтобы остановить реакцию трипсина, собирают суспензию клеток в 15 мл пробирку и центрифугируют при 110 г в течение 5 мин.
- Аспирата супернатант и ресуспендируют осадок клеток в 5 мл дифференцировки стволовых клеток среды. Количество клеток с использованием гемоцитометра и разбавленной клеточной суспензии в соответствии с требуемой конечной концентрации. В идеале, посев 20000 SC-как ASC / см 2 будет гарантировать сливающийся слой клеток.
- Семенной SC-какASC на подложке и инкубировать при 37 ° С, 5% СО 2 в течение 24 ч, чтобы позволить прикрепление клеток.
- После 24 ч инкубации аспирации среды и добавить DRG нейроны в верхней части клеток, как описано в стадии 3,14 и 3,15. Изменение среды в смешанной среде, содержащей 50% стволовых клеток дифференцировки среды и 50% от BS среды. Кроме того, снижение концентрации FBS в 1-2,5% в конечном смешанной среде помогает избежать распространения загрязняющих спутниковые клетки, полученные из КСГ диссоциации.
- Инкубируйте совместном культивировании образцов при 37 ° С, 5% СО 2 и поддерживать в культуре в течение необходимого времени для будущих испытаний.
Результаты
Культуры диссоциированных нейронов DRG, представляют подходит в модели пробирке для изучения регенерации нерва. Тем не менее, необработанные подложки не обеспечивают благоприятных условий для крепления DRG и расширение нейритов. SC-как ASC способны производить факторы роста и хемокины 19, которые могут улучшить способность DRG нейронов прорастают невриты, когда они будут освобождены в культуральной среде. Поэтому наличие SC-как ASC в системе культуры могут играть важную роль в регуляции функций DRG.
Этот протокол (Рисунок 1) иллюстрирует процедуру для выполнения прямого сотрудничества культуру SC-как ASC и DRG нейронов, в течение которых нервные клетки получают в непосредственном контакте с ранее посеянного SC-как ASC. Основная трудность, связанная с этой процедурой, является высокая изменчивость количества нейронов DRG собранных из различных животных. По этой причине, результаты могут быть иногда трудно COMPARе и особое внимание должно быть уделено в процессе сева, чтобы получить всегда сравнимую плотность клеток в каждом эксперименте. Протокол был оптимизирован для уменьшения меньшей мере такое число сателлитных клеток, оставшихся с DRG нейронов диссоциации с использованием градиента BSA (шаг 3,11). Кроме того, цитозин-арабинозы (Ara-C) добавки могут быть добавлены к среде BS, с тем чтобы в дальнейшем свести к минимуму спутника популяции клеток, как описано Кингем соавт. 11. Тем не менее, выбор времени обработки должна быть тщательно сбалансированы с DRG и SC-как ASC жизненной силы, также зависит от наличия ARA-C дополнения в культуральной среде. Таким образом, это очень трудно выполнить штрафной спутниковой системы клеток.
Рисунок 2 показывает важность SC-как ASC для DRG нейрита прорастания в модели сокультуры использованием необработанного и химически модифицированный поли - капролактоном (PCL) фильмы в качестве субстратов. DRG нейроны почтаntained в культуре в течение 3 дней в присутствии или в отсутствие SC-ASC как, используя смешанный раствор, содержащий 50% BS среды и 50% стволовых клеток дифференцировки среде, как описано в стадии 4,5. После этого периода клетки фиксировали в 4% параформальдегида и окрашивали β-тубулина III (DRG нейронов) и S100 (SC-как ASC), чтобы исследовать морфологию клеток и изучение способности DRG нейронов, чтобы выступать невриты. Нет невриты не наблюдалось на необработанных поверхностей в отсутствии SC-как ASC (рис 2а), в то время как формирование нейритов явно улучшилось в системе сокультуры (рис 2С). В среднем, количество нейритов в теле клетки значительно увеличилось от 0 до 3, в присутствии стволовых клеток. Подтверждение этих результатов была также методом сканирующей электронной микроскопии (СЭМ анализ), как показано на рисунке 3. В частности, изображения СЭМ показывают, что способность нейронов DRG прорастать нейритов происходит преимущественно в сочетаниис SC-как ASC, как указано желтыми стрелками на фиг.3С.
Следует отметить, что использование модифицированного ламинина субстратов (в том числе ламинин, полученных пептидов) в культуральных системах, содержащих нейронов DRG был часто определяется как состояние, пригодное для культуры клеток нейронов, имеющих значительные эффекты на нейритов формирования и расширения 30 - 32 , Тем не менее, результаты, показанные на рисунке 2D и 3D фиг показывает, что сочетание химических и биологических сигналов может еще больше повысить реакцию DRG нейроны.
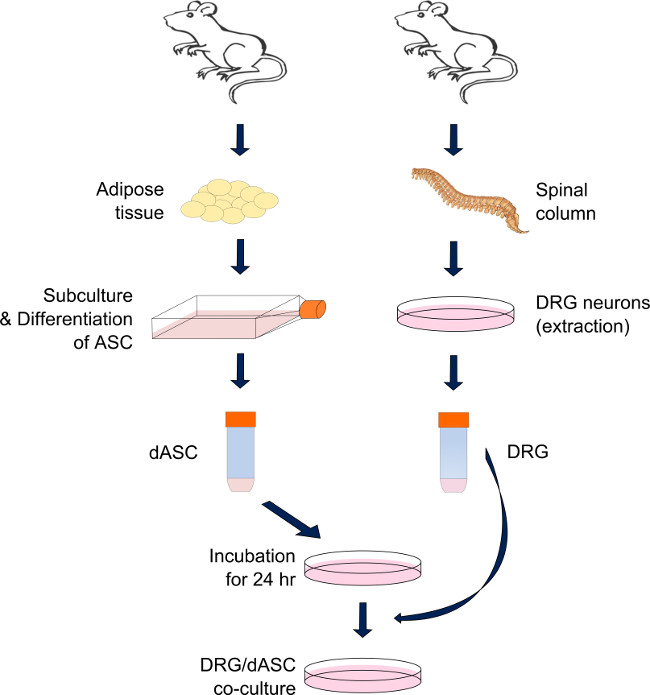
Рисунок 1. Получение прямого DRG-SC-подобной системе возрастанию совместным культивированием. DRG нейроны и возрастанию получены соответственно из позвоночного столба и висцерального жира и паховой взрослых Malе Sprague-Dawley крыс. После переваривания жировой ткани через каскад ферментативных реакций, ASC дифференцированы в SC-подобных клеток и поддерживается в суб-сливающихся условиях, пока не понадобится. SC-как ASC предварительно отобранный на каждой подложки 24 ч предварительного урожая DRG. В день, DRG нейроны извлекаются и диссоциированных через серию ферментативных и механических воздействий. Нейроны затем высевают на верхней части ранее посеянного SC-как ASC и не поддерживали в культуре до проведения анализа (смешанной среде: содержащие 50% дифференцирование стволовых клеток среды и 50% модифицированного BS среды). Пожалуйста, нажмите здесь, чтобы смотреть больше версия этой фигуры.

Рисунок 2. Флуоресцентные изображения DRG нейронов в различных условиях культуры.() Необработанные PCL фильмы, РГД-модифицированные фильмы PCL (B), (C) совместно культивировали с SC-как ASC на необработанных PCL фильмов, (D) совместно культивировали с SC-как ASC на РГД-модифицированных пленок PCL. Клетки поддерживали в культуре в течение 3 дней с использованием смешанного раствора, содержащего 50% модифицированного BS среды и 50% дифференцировки стволовых клеток среды. После этого времени клетки фиксировали в 4% параформальдегида, проницаемыми в Тритон-X раствором, а неспецифические сайты связывания блокировали 1% BSA. Нервные клетки затем окрашивали против β-тубулина III (FITC, зеленый) и SC-как ASC против S-100 (AlexaFluor568, красный) антител. Наконец ядра окрашивали DAPI (синий). Изображения были получены с использованием флуоресцентного микроскопа (Olympus BX60, Япония). (Повторная печать с разрешением от де Лука и др. 30. Пожалуйста, нажмите здесь, чтобы посмотреть большие версионный этой фигуры.
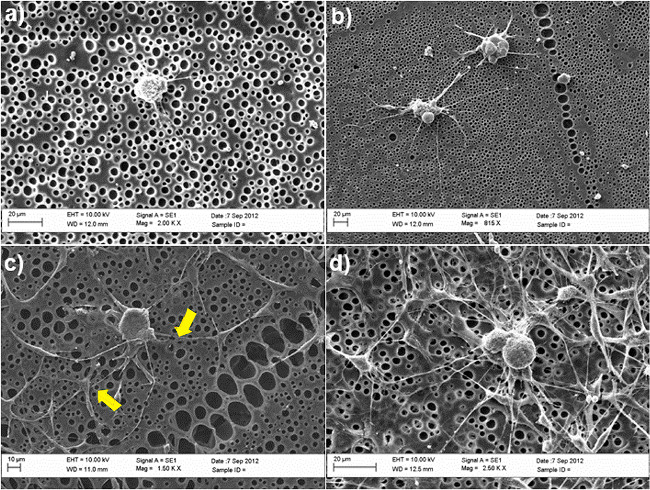
Рисунок 3. СЭМ изображения DRG нейроны в различных условиях культивирования РГД-модифицированные пленки PCL (A) необработанные PCL пленки (B);. (С) совместно культивировали с SC-типа ASC на необработанных PCL пленок, (D) совместно культивировали с SC-как ASC на RGD-модифицированных PCL фильмов. Желтые стрелки указывают на точки соприкосновения между НК-как ASC и DRG, подтверждающие их прямое взаимодействие в системе сокультуры. Клетки поддерживали в культуре в течение 3 дней и фиксировали в 2,5% глутарового альдегида. После дегидратации в градуированной серии этанола (50%, 70%, 90%, 100%), клетки, наконец, промывают в гексаметилдисилазана и сушат перед установкой на заглушки и золотое напыление для анализа SEM. Изображения были получены с помощью сканирующего электронного микроскопа (Zeiss EVO60, Великобритания) с ускоряющим общество 10кВ. (Повторная печать с разрешением от де Лука и др. 30. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Обсуждение
DRG нейроны часто используется среди нервных клеток для первичной культуры для изучения регенерации нейронов после аксотомии в естественных условиях. Вот точный протокол для урожая DRG от взрослых крыс представлены, направленных на сокращение населения сателлитных клеток в окружающую среду без ущерба выживаемость нейронов. Как ASC дифференцировались в фенотип SC-подобные реальной альтернативой SC для клеточной терапии, АСК / DRG Система совместное культивирование СК, как также описано подробно.
Широко известно, что ламинин (или ламинин полученные пептидные последовательности) имеют положительный эффект на выживаемость нейронов и образование нейритов 31 - 33. При выполнении DRG нейронов культур Поэтому рекомендуется, чтобы покрыть каждую ранее подложки с ламинин, чтобы избежать какой-либо потери функциональных нейрональных клеток. Концепция ламинином покрытий также относится к биоматериала субстратов для проектированияТканевая инженерия конструкции, такие как поли - капролактоном (PCL) часто используется для изготовления нервных каналах 30. Кроме того, предыдущая работа показала, что фибрин матрицы подходящие материалы для нейронов культур в трёхмерную 11.
В дополнение к белка покрытием, модели со-культуры дают ценные условий для выживания нейронов DRG и подходящей среды для изучения взаимодействий, которые происходят между нейронами и SC в периферической нервной системе после травмы. Клетки также могут быть пересажены в естественных условиях с помощью нейронных устройств для того, чтобы сократить время набора аутологичных клеток в месте повреждения. Это особенно важно в тяжелых травм, которые могут привести к клеточного старения / смерти и атрофии мышц. Хотя СК являются наиболее важными глиальные клетки, участвующие в процессе регенерации нервов периферической и миелинизации, их ограниченной доступности и их медленной скорости пролиферации делает их непригоднымидля тканевой инженерии 34. ASC являются реальной альтернативой из-за их обилия и способности дифференцироваться в фенотип SC, выражая определенные глиальные маркеры и показывая функциональные сходства в родной SC 19. ASC также способны производить белки и факторы роста 5, которые могут быть полезны для формирования и расширения нейритах по DRG нейронов в системе сокультуры. Тем не менее, две системы отличаются одним из культуры могут быть установлены в зависимости от потребностей эксперимента. Метод, предложенный в этой статье, пересмотренный вариант хорошо установленным протоколом в нашей лаборатории 11 и включает в себя непосредственный контакт между двумя типами клеток (прямой совместной культуры), в котором второй тип клеток (DRG нейроны) высевают на верхней части других (SC-подобный ASC). Этот подход основан на предыдущих выводов, которые продемонстрировали важность наличия глиальных слоя клеток на подложке при посеве культуры нейронов 35 - 37. Этот эффект, вероятно, из-за межклеточных взаимодействий через DRG интегринов и молекул ECM, осажденных из ASC и других сигналов на поверхности стволовых клеток. Было также отмечено, что уменьшение белка сыворотки в среде уменьшается пролиферацию загрязняющих спутниковые клетки, которые могут получить в результате диссоциации DRG нейроны, не затрагивая функции ASC. Тем не менее, спутниковые клетки, в том числе небольшой популяции СК, трудно полностью исключить из культур DRG нейроны и несколько остальных элементов будет также присутствовать в системе со-культуры. Поэтому важно отметить, что эти небольшие подгруппы населения могут также участвовать в миелинизации процессов во время учебы в пробирке, вспоминая аутологичных клеток, которые находятся в естественных условиях после травмы. Второй подход (не представлены) включает использование клеточных культур пластин, избежать непосредственного контакта между двумя разными типами клеток (непрямой совместное культивирование). Howevэ-э, это не представитель условий в естественных условиях процессе регенерации нерва (снижение способности нервных клеток разработать долгосрочные невриты), но оно используется для исследования влияния выпускаемой диффундирующих факторов в среде в определенном клеточной популяции на другой 38 ,
Раскрытие информации
The authors confirm that there are no conflicts of interest associated with this publication.
Благодарности
This work is supported by the National Institute for Health Research, Academy of Medical Sciences and the British Society for Surgery of the Hand. We also gratefully acknowledge the continuing supply of GGF-2 from Acorda Therapeutics, USA. The authors would finally like to acknowledge Prof. Giorgio Terenghi for his valuable support and guidance in our group over the past years that led to the development and optimization of this protocol.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 100 µm cell strainer | BD Biosciences | 352360 | 70 μm strainers (ref. 352350) can be used as alternative |
| 15 mL plastic tubes | Sarstedt | 62.554.002 | |
| 50 mL plastic tubes | Sarstedt | 62.547.004 | |
| 75 cm2 flasks | Corning | BC301 | |
| Retinoic Acid >98% HPLC | Sigma | R2625 | |
| ARA-C supplement | Sigma | C6645 | |
| Recombinant Human FGF-basic (154 aa) | Peprotech | 100-18B | |
| Bovine Serum Albumin (BSA) | Sigma | A9205 | |
| Collagenase type I | Gibco | 17100-017 | Note: this collagenase is only used for fat tissue digestion |
| Collagenase type IV | Worthington Biochemical | LS004188 | Note: this collagenase is only used to dissociate DRG explants |
| Foetal Bovine Serum (FBS) | Biosera | FB-1001 | |
| Forskolin | Sigma | F3917 | |
| Glass pipettes | Fisher Scientific | FB50253 | Sharp material to be disposed accordingly |
| Glial Growth Factor-2 (GGF-2) | Acorda Therapeutics | GGF-2 was kindly donated by Acorda Therapeutics. For a commercially available alternative, we recommend NRG1-β1 (R & D Systems, Abingdon) for stem cell differentiation to be used at the final concentration of 200ng/ml | |
| Nutrient Mix F12 HAM | Sigma | N6658 | Warm at 37 °C in a water bath unless specified |
| Hank’s Balanced Salt Solution (HBSS) | Sigma | H9394 | Warm at 37 °C in a water bath unless specified |
| N-2 supplement (100x) | Invitrogen | 17502 | |
| Nerve Growth Factor 2.5s Protein, Mouse Submaxillary Glands (NGF) | Millipore | NC011 | |
| Penicillin-Streptomycin (PS) | Sigma | P0781 | |
| Petri dishes | Corning | 430165 | |
| Recombinant Human PDGF-AA | Peprotech | 100-13A | |
| Trypsin | Invitrogen | 25200-056 | Warm at 37 °C in a water bath. This is used for cell detachment from tissue culture flasks |
| Trypsin (2x bovine pancreatic) | Worthington Biochemical | LS003703 | This is used for DRG dissociation |
| Minimum Essential Medium Eagle (MEM) | Sigma | M8042 | Warm at 37 °C in a water bath unless specified |
| 2-mercaptoethanol | Sigma | M3148 | Prepare the solution in the biological cabinet |
Ссылки
- Wiberg, M., Terenghi, G. Will it be possible to produce peripheral nerves. Surg Technol Int. 11, 303-310 (2003).
- Terzis, J. K., Sun, D. D., Thanos, P. K. Historical and basic science review: past, present, and future of nerve repair. J Reconstr Microsurg. 13 (3), 215-225 (1997).
- Bruyns, C. N., Jaquet, J. B., Schreuders, T. A., Kalmijn, S., Kuypers, P. D., Hovius, S. E. Predictors for return to work in patients with median and ulnar nerve injuries. J Hand Surg Am. 28 (1), 28-34 (2003).
- Geuna, S., Raimondo, S., et al. Chapter 3: Histology of the peripheral nerve and changes occurring during nerve regeneration. Int Rev Neurobiol. 87 (09), 27-46 (2009).
- Kingham, P. J., Kalbermatten, D. F., Mahay, D., Armstrong, S. J., Wiberg, M., Terenghi, G. Adipose-derived stem cells differentiate into a Schwann cell phenotype and promote neurite outgrowth in vitro. Exp Neurol. 207 (2), 267-274 (2007).
- Stoll, G., Jander, S., Myers, R. R. Degeneration and regeneration of the peripheral nervous system: From Augustus Waller’s observations to neuroinflammation. J Peripher Nerv Syst. 7 (1), 13-27 (2002).
- Schmidt, C. E., Leach, J. B. Neural tissue engineering: strategies for repair and regeneration. Annu Rev Biomed Eng. 5, 293-347 (2003).
- Johnson, E. O., Zoubos, A. B., Soucacos, P. N. Regeneration and repair of peripheral nerves. Injury. 36S (4), S24-S29 (2005).
- Liu, R., Lin, G., Xu, H. An efficient method for dorsal root ganglia neurons purification with a one-time anti-mitotic reagent treatment. PloS One. 8 (4), e60558 (2013).
- Stettner, M., Wolffram, K., et al. A reliable in vitro model for studying peripheral nerve myelination in mouse. J Neurosci Meth. 214 (1), 69-79 (2013).
- Kingham, P. J., Mantovani, C., Terenghi, G. Stem cell and neuron co-cultures for the study of nerve regeneration. Method Mol Biol. 695, 115-127 (2011).
- Nissinen, M., et al. Myelination in mouse dorsal root ganglion/Schwann cell cocultures. Mol Cell Neurosci. 37 (3), 568-578 (2008).
- Daud, M. F. B., Pawar, K. C., Claeyssens, F., Ryan, A. J., Haycock, J. W. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 33 (25), 5901-5913 (2012).
- Lewallen, K. a., Aa Shen, Y. -., De la Torre, A. R., Ng, B. K., Meijer, D., Chan, J. R. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci. 31 (8), 3032-3043 (2011).
- Evans, G. R. Challenges to nerve regeneration. Semin Surg Oncol. 19 (3), 312-318 (2000).
- Webber, C., Zochodne, D. The nerve regenerative microenvironment: early behavior and partnership of axons and Schwann cells. Exp Neurol. 223 (1), 51-59 (2010).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived stem cells: current findings and future persperctives. Discov Med. 11 (57), 160-170 (2011).
- Faroni, A., Terenghi, G., Reid, A. J. Adipose-derived stem cells and nerve regeneration: promises and pitfalls. Int Rev Neurobiol. 108, 121-136 (2013).
- Strem, B. M., Hicok, K. C., et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 54 (3), 132-141 (2005).
- Xu, Y., Liu, L., et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro. Brain Res. 1239, 49-55 (2008).
- Tomita, K., Madura, T., Sakai, Y., Yano, K., Terenghi, G., Hosokawa, K. Glial differentiation of human adipose-derived stem cells: implications for cell-based transplantation therapy. Neuroscience. 236, 55-65 (2013).
- Clauser, L., Tieghi, R., Palmieri, A., Carinci, F. Adipose-derived stem cells secrete neurotrophic factors. Annals of Oral and Maxillofacial Surgery. 1 (2), 1-5 (2013).
- Di Summa, P. G., Kingham, P. J., Raffoul, W., Wiberg, M., Terenghi, G., Kalbermatten, D. F. Adipose-derived stem cells enhance peripheral nerve regeneration. Journal of Plastic, Reconstructive & Aesthetic Surgery. 63 (9), 1544-1552 (2010).
- Di Summa, P. G., Kalbermatten, D. F., Pralong, E., Raffoul, W., Kingham, P. J., Terenghi, G. Long-term in vivo regeneration of peripheral nerves through bioengineered nerve grafts. Neuroscience. 181, 278-291 (2011).
- Sun, F., Zhou, K., Mi, W., Qiu, J. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats. Biomaterials. 32 (32), 8118-8128 (2011).
- Zhang, Y., Luo, H., et al. A nerve graft constructed with xenogeneic acellular nerve matrix and autologous adipose-derived mesenchymal stem cells. Biomaterials. 31 (20), 5312-5324 (2010).
- Gomillion, C. T., Burg, K. J. L. Stem cells and adipose tissue engineering. Biomaterials. 27 (36), 6052-6063 (2006).
- Bottenstein, J. E., Sato, G. H. Growth of a rat neuroblastoma cell line in serum-free supplemented medium. Proc Natl Acad Sci U S A. 76 (1), 514-517 (1979).
- Mantovani, C., Raimondo, S., et al. Morphological, molecular and functional differences of adult bone marrow- and adipose-derived stem cells isolated from rats of different ages. Exp Cell Res. 318 (16), 2034-2048 (2012).
- Luca, A. C., Faroni, A., Downes, S., Terenghi, G. Differentiated adipose-derived stem cells act synergistically with RGD-modi fi ed surfaces to improve neurite outgrowth in a co-culture model. J Tissue Eng Regen Med. , (2013).
- Summa, P. G., Kalbermatten, D., Raffoul, W., Terenghi, G., Kingham, P. J. Extracellular Matrix Molecules Enhance the Neurotrophic Effect of Schwann Cell-Like Differentiated. Tissue Eng. 19 (3-4), 368-379 (2013).
- Fudge, N. J., Mearow, K. M. Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neurosci. 14 (15), 1-19 (2013).
- Stabenfeldt, S. E., LaPlaca, M. C. Variations in rigidity and ligand density influence neuronal response in methylcellulose-laminin hydrogels. Acta Biomater. 7 (12), 4102-4108 (2011).
- Terenghi, G., Wiberg, M., Kingham, P. J. Chapter 21: Use of stem cells for improving nerve regeneration. Inl Revi Neurobiol. 87 (09), 393-403 (2009).
- Richardson, J. a., Rementer, C. W., Bruder, J. M., Hoffman-Kim, D. Guidance of dorsal root ganglion neurites and Schwann cells by isolated Schwann cell topography on poly(dimethyl siloxane) conduits and films. J Neural Eng. 8 (4), 046015 (2011).
- Seggio, a. M., Narayanaswamy, A., Roysam, B., Thompson, D. M. Self-aligned Schwann cell monolayers demonstrate an inherent ability to direct neurite outgrowth. J Neural Eng. 7 (4), 046001 (2010).
- Xu, F. J., Wang, Z. H., Yang, W. T. Surface functionalization of polycaprolactone films via surface-initiated atom transfer radical polymerization for covalently coupling cell-adhesive biomolecules. Biomaterials. 31 (12), 3139-3147 (2010).
- Armstrong, S. J., Wiberg, M., Terenghi, G., Kingham, P. J. ECM molecules mediate both Schwann cell proliferation and activation to enhance neurite outgrowth. Tissue Eng. 13 (12), 2863-2870 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены