需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种用于评价大鼠乙醇的补强性能没有禁水,糖精衰落或扩展访问训练方法
摘要
本协议描述为一种新型快捷的方法来快速启动操作性的,相反,标准方法,不需要水剥夺或糖精/蔗糖衰落的开始响应响应大鼠乙醇。
摘要
操作性口服自我施用方法通常用于研究的动物的乙醇补强性。然而,标准方法需要糖精/蔗糖衰落,禁水和/或延长培训发起操作性大鼠响应。本文介绍一种新颖且有效的方法来快速启动操作性响应的乙醇也方便实验者和不需要水剥夺或糖精/蔗糖衰落,从而消除在乙醇操作性自我施用研究使用甜味剂的电位变乱。用这种方法,将Wistar大鼠通常获得并维持20%的乙醇溶液的自我施用在不到两周的训练。此外,血液中乙醇浓度和奖励一个30分钟的自我管理会话是正相关的。此外,纳曲酮,已被证明酒精依赖FDA批准的药物来抑制乙醇的自我管理在啮齿动物,剂量依赖性减少酒精摄入和动力消耗对大鼠自我施用20%乙醇的醇,从而验证使用这种新方法的研究在大鼠醇的补强性能。
引言
动物模型来研究药物的增强效果的发展已经证明研究人类药物成瘾的重要工具。更具体地,操作性自我施用是一种广泛使用的行为模型,这是最有效的手段,以评估口服消耗乙醇溶液的阳性增强效果之一。与开发这样一个模型的早期问题是高浓度的乙醇对大多数鼠类主厌恶味道,即,可以在与醇1很少或没有经验的人类共享的现象。一个标准的协议来克服这一障碍需要禁水和/或糖精或蔗糖衰落收购和自我管理的维护。然而,这两种方法都不是有利的。他们需要的培训长时间简单地启动响应为乙醇和收购取得的相对成功率。使用甜味剂还引入了一个潜在的偏见自我管理数据的解释。这些限制并不适用于以下协议。
简单地说,参孙和同事2表明,溶解在20%蔗糖的甜美乙醇溶液中,然后在4周的训练淡出了甜头需要发起水响应的10%的乙醇。此外,可靠乙醇摄入6至8周1-3通常实现。这种方法是很成问题。首先,它要求的训练长时间之前研究者可以开始测量乙醇自身给药。相比之下,可卡因或海洛因静脉自身给药需要0 -在限食动物食品提供杠杆药物前培训1天,稳定的响应药物通常是在10实现- 1天4,5。该方法的另一限制是,糖精和蔗糖是高度有益的大鼠和引发脑激活图形Similar滥用药物,从而带来了潜在的的困惑在乙醇的自我管理研究6-9。最后,由于不成功的采集和/或应答率不足大鼠取得使用在获得和反应率1,10-此方法显示变性的乙醇溶液,与实验一致排除大鼠相当比例的自我给药。
相比之下,有此协议,我们提出收购,并在水中的解决方案,并不需要禁水,蔗糖/糖精的衰落和扩展访问培训20%乙醇的口腔自我管理维护一个简单而有效的方法。最近的调查发现,在20%的乙醇浓度的自我管理期间,自我给药用于口服乙醇显示具有最高乙醇摄取一个倒U形的剂量反应曲线,从而为在我们的experim选择20%的乙醇溶液中提供理ental设计11。
研究方案
所有程序都符合美国国立卫生研究院指南实验动物的护理和使用进行。
1.动物护理和房屋
- 当在菌落到来,房子的雄性Wistar大鼠,体重200 - 在一个温度(21℃)和湿度控制的环境有一个扭转12小时明暗周期到达成对225克。
注:根据实验的基本原理,老鼠可以是单住。 - 允许大鼠适应环境的动物饲养和光周期为至少一个星期开始实验之前和每天处理它们。称量动物每周一次。
- 给大鼠自由获取食物和自来水为实验期间(禁水是没有必要发起响应12)。在光暗周期在一个黑暗的检测室的黑暗阶段进行的所有行为测试。
注意:尽管我们经常使用年轻成年雄性Wistar大鼠(出生后62天 - 65),这名Protocol理论上可以是适用于研究大鼠的其它菌株,以及性别和/或年龄的差异。
2.操作性培训
- 开展以相同的操作室的所有行为训练和测试测量30.5×29.2×24.1厘米和含床上用品内衬格子地板和废盘(改变了动物之间,以减少气味线索),安置在装有排风扇通风声音衰减柜。
注意:大鼠被操作性调节从训练1天受训(上一杠杆的应答是必要的,以获得一个加强件)+ 1 H和暗循环的+ 8小时之间。没有预先接触酒精,也不是食品或液体酒精整形赛前训练。 - 装备有刺激灯,注射泵和横向移动到液体容器杯收放2杠杆每个操作性室。接口室和控制使用适当的软件的计算机。
注意:大多数供应商将提供包含所有必要的组件需要控制腔自我管理包以及软件和接口。 - 写发起根据制造商的说明在20%乙醇加固的固定比率(FR)调度(一个操作性日程表,其中,响应只响应一个指定的数量后强化)的操作性调节程序。例如,在一个固定比率1,大鼠必须产生一个响应,以获得加强件(见用于FR1程序的一个例子的补充编码文件部分)。执行以下命令。
- 扩展两个杠杆,以纪念在会议开始和信号酒精可用性。
注意:用乙醇(活动)相关联的杆的一个杠杆按由100微升20%乙醇的体积的水在相邻饮用井水输送奖励并启动由信号伴随5 - S的超时周期的照明线索光杆之上。该线索光介绍了关于训练的第一天。 - 在超时期间,记录响应虽然它没有排定的后果。另一杆(未激活)记录的反应,虽然他们从来没有行为后果。注意:非活性杠杆作为控制,以评估非特定行为。
- 记录在主动杆(反应率)和挣得20%乙醇的奖励的数量的响应次数。
- 30分钟已经过去之后,收回两个杠杆信号会话的结束和对信号的醇可用性结束。
- 保存和归档的所有数据。
- 扩展两个杠杆,以纪念在会议开始和信号酒精可用性。
- 在开始训练之前,先检查每个操作性室所有设备的正常功能(可伸缩的杠杆,流体分配器)。
- 制备190证明(95%)乙醇在自来水中稀释的20%V / V乙醇溶液。
注意:乙醇溶液可保持在室温。根据上的制造商,库存乙醇溶液可高达99.98%。还要注意的是,虽然在大多数发表的手稿,乙醇浓度通常作为体积/体积,一些可呈现它们作为重量/体积。 - 填用20%乙醇溶液的注射器,并确保有在输液线没有泄漏或气泡。手动推乙醇小体积过输注线路,以确保乙醇将被正确地输送到容器从第一增强响应。干后用纸巾插座中,并确保它是启动会话之前空。
- 加载控制20%乙醇加固的FR日程表软件
- 在30分钟的会议下FR1时间表,列车operant-和药物天真大鼠的自我管理20%乙醇无禁水。
- 从动物饲养到使用传输笼考场运输的影响。
- 每只大鼠分配到一个房间。就拿从运输笼每个老鼠,并把它在分配的自我管理室。
- 尽量保持实验,每天保持一致的条件。因此,总是每天测试的大鼠以相同的自我管理室在大致相同的时间。
- 开始发起20%的乙醇加固FR1时间表软件。
- 在会议结束时,从自我管理室取出老鼠,并将其退回到动物饲养。
- 为了手动确认的酒精溶液被消耗的动物,用纸巾和检查插座干燥。或者,使用1或2毫升的注射器,并收集残留在容器来估计未消耗的体积的流体。
注意:对于一个更精确的测量(但也更贵),所以可以装备每个室连接到所述液体杯容器中的舔食测试器系统,使舔的精确的计数■通过自我管理会话期间大鼠产生的。 - 清洁用表面消毒剂各室的壁和格栅地板。
- 使用后,通过用70%的乙醇溶液清洗他们保持输液线。在不使用时,插入所述盖,以避免模具和灰尘。
- 每次会议之后,收集和分析产生的数据。更具体地说,计算主动杆压力机的平均数,得到的醇的奖励的平均数以及非活性杠杆压力机的平均数。
注意:在大部分纸,酒精消耗也呈现为克/公斤(体重)乙醇的摄入量。乙醇摄入可以使用下列公式计算:
用消耗的体积(毫升) - 0.789克/毫升 - 在室温下获得±酉体积/奖励和乙醇密度奖励数量。
例如,如果一个老鼠称重400克获得20雷瓦的20%V / V乙醇溶液RDS: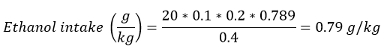
- 进行会话5/6天每周直到性能(定义为至少15的会话,并没有变化,在过去3次会话赢得奖励的总数大于15%)稳定。
注意:一旦大鼠已经在FR1达到稳定的基线,所述操作条件反射程序可根据制造商的说明,以增加的必要,以获得醇奖励响应的数量进行修改。固定比例可以例如,以最小化意外加固增加到FR2或FR3制作的。 - 测量血液中乙醇浓度:
- 以确认以自管理会话得到的奖励是由大鼠消耗时,测量以下自我施用血液乙醇浓度。一旦老鼠已经达到了一个稳定的基线,收集来自横向尾静脉取血后立即会话。插入23政针插入血管,并收集用毛细管50微升血样。
- 转移50微升血样至10ml顶空小瓶中,并添加50微升的1:1000的异丙醇作为内标。从乙醇标准准备的标准曲线10〜300毫克/分升。过程的样品与根据制造商设置的层析柱13的顶空取样。
- 渐进比
- 使用累进比率(PR)的时间表来评估动物的动力消耗的奖励14。公关是一个操作性的时间表中的反应获得强化物的数量逐渐增加(在其他方面,老鼠要更努力为每个连续的奖励)。
注:相反,FR会议,公关会话不定时的,只会被终止后30分钟没有完成比例已过。- 将大鼠分配给他们的操作性箱,并允许他们为下加强件的PR时间表20%乙醇响应:保持相同的那些对FR调度所使用的所有的实验条件(见步骤2.3),除了增加内会话的响应要求或成本( 即 ,杠杆按压的次数1,2,3,4,6,8,10,12,16,20,24,28,32 ...注意:的一个例子,根据下面的公式来接收单个乙醇奖励)上需要主动杆PR程序在补充编码文件部分提供。
- 终止PR会议一次30分钟后没有奖励过去了。
注意:断点被定义为PR会议期间最后完成的响应的要求。
- 使用累进比率(PR)的时间表来评估动物的动力消耗的奖励14。公关是一个操作性的时间表中的反应获得强化物的数量逐渐增加(在其他方面,老鼠要更努力为每个连续的奖励)。
3.测试酒精自我管理的操作性模型的预测效度
注意:一旦大鼠已经获得了稳定的自给药基线(见步骤2)中,有可能通过以评估该模型的预测效测试纳曲酮的功效,一个目前FDA批准用于减少20%乙醇自身给药酒精依赖的药物。我们建议在做培训(FR2)期间所取得的最高FR这个测试,如果反应是可靠的高。一旦预测效度的建立,该模型可以用来评估新的候选药物。
- 测试前一天,给大鼠皮下注射盐水注射之前自我管理会话最少两个连续的自我管理的会话期间将它们habituate到注射或直到响应的乙醇不会受盐水注射(定义为没有变化30分钟在过去的2会议期间获得的奖励)的总人数超过15%。
- 溶解纳曲酮在盐水中并调节pH达到中性,以便于注射至动物。注射药物以1.0毫升/体积公斤30分钟的会话之前,使用给药的皮下途径。注:升ATURE提供了良好的证据0.1范围之间的剂量的选择 - 为1mg / kg的,所以0.1,0.3和1mg / kg的在这个协议中被使用。
注:研究表明使用的管理的纳曲酮皮下和腹腔内的路线,虽然其效力可皮下注射是不同的30倍更有效的腹腔注射15。出于这个原因,建议使用皮下途径的使用为纳曲酮的注入此路线的已被验证,并在一范围0.1和1mg之间浓度的各种实验室复制/ kg的12,15,16。 - 在测试当天,注入大鼠以平衡/随机顺序在受试者间设计横过自管理会话前30分钟的四个纳曲酮给药周期(0,0.1,0.3和1毫克/千克)中的一个。
- 每个给药周期之间,只允许以最小的两个连续的自我管理会话或直到响应的洗出的药物乙醇是回到基线。注意:作为一个结果,在试验结束时,所有的大鼠被注射每四个剂量。
- 这个阶段后,选择最有效的剂量(1毫克/千克)和测试对动物的动机纳曲酮的使用效果渐进比时间表消耗酒精(见步骤2.12)。
结果
图1显示了operant-和药物天真大鼠代表自我管理行为(八个不同的队列数额总计为239只)训练了FR1时间表进行自我管理20%乙醇停水剥夺或糖精/蔗糖衰落在30分钟的会议。有了这个协议,只启动杆挤压很快得到乙醇的奖励,已经获得第一届( 图1A)在10多个奖励。它们通过自我管理的会议10到达上主动杆稳定响应率,从而获得的在FR1( 图1B)23....
讨论
有了这个协议,我们提出一种新的方法来获得并维持20%乙醇的稳定口服自我管理的,相反,乙醇自我管理的经典机型,不需要使用禁水,扩展访问训练大鼠,或糖精/蔗糖衰落12。此外,纳曲酮,当前FDA批准用于酒精依赖药物治疗,成功地降低酒精的自我管理和消费这一协议训练有素的Wistar大鼠酒精的动机。这个结果提供了协议的一个重要的药理学验证,因为它是与表示纳曲酮是有效减少...
披露声明
作者什么都没有透露。
致谢
这项工作是由瑞典研究理事会的支持。
材料
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
参考文献
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。