JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
물 박탈, 사카린 페이딩 또는 확장 액세스 교육을받지 않은 쥐에 에탄올의 강화 속성을 평가하는 방법
요약
이 프로토콜은 빨리 물 부족하거나 응답을 시작하는 페이딩 사카린 / 크로스를 필요로하지 않는 표준 방법과 달리, 쥐에서 에탄올에 대한 응답 조건화를 시작하는 새롭고 효율적인 방법을 설명합니다.
초록
조작 적 경구 자기 관리 방법은 일반적으로 동물의 에탄올 보강 특성을 연구하는 데 사용됩니다. 그러나, 표준 방법은 쥐에 응답 조건화을 시작 사카린 / 크로스 페이딩, 물 부족 및 / 또는 확장 훈련이 필요합니다. 이 논문은 신속하게 실험자에 편리하고, 따라서 에탄올 조작 적 자기 관리 연구에서 감미료를 사용하는 잠재적 인 혼란을 제거, 물 부족 또는 사카린 / 크로스 페이딩을 필요로하지 않습니다 에탄올에 대한 응답 조건화를 시작하는 새롭고 효율적인 방법을 설명합니다. 이 방법의 Wistar 래트는 일반적으로 취득 훈련 2 주 미만으로 20 % 에탄올 용액 자체 투여를 유지한다. 또한, 혈중 에탄올 농도와 보상을 적극적으로 30 분 자기 관리 세션에 상관 관계가있다. 또한, 날트렉손은 밝혀졌다 알코올 의존에 대한 FDA 승인 약물은 에탄올 자기 관리를 억제설치류에서, 투여 량 의존적으로하여 쥐에서 알코올의 강화 특성을 연구하는 새로운 방법의 사용을 검증, 쥐의 자기 관리 20 % 에탄올 알코올을 소비하는 알코올 섭취와 의욕을 감소시킨다.
서문
약물의 강화 효과를 연구하기위한 동물 모델의 개발은 인간의 약물 중독을 연구하는 중요한 도구를 입증했다. 구체적으로는, 조작 적자가 투여는 경구 섭취 에탄올 용액의 양의 보강 효과를 평가하기위한 가장 효과적인 방법 중 하나이며 광범위하게 사용되는 행동 모델이다. 이러한 모델의 개발과 초기 문제는 대부분의 설치류 용 에탄올의 높은 농도의 주요 혐오 맛, 알코올 1 거의 또는 전혀 경험이있는 사람에서 공유하는 현상이었다. 이 장벽을 극복하기위한 표준 프로토콜은 물 부족을 필요로 및 / 또는 사카린 또는 자당의 수집 및 자기 관리의 유지 보수를 위해 페이딩. 그러나 이러한 두 가지 접근 방법은 유리하지 않다. 이들은 단순히 에탄올 개시 응답 및 획득의 상대 성공률을 얻기 위해 트레이닝 장시간을 필요로한다. 감미제의 사용은 전위 바이어스를 소개자기 관리 데이터의 해석. 이러한 제한은 다음과 프로토콜에 적용되지 않습니다.
간단히, 삼손과 동료 2는 20 % 자당의 달콤한 용액에 에탄올을 용해하고 훈련 4 주 동안 단맛을 페이드 아웃하는 것은 물에 10 % 에탄올에 대한 응답을 시작하는 데 필요한 것으로 나타났습니다. 또한, 안정적인 에탄올 섭취는 통상 6~8 주 1-3에 달성된다. 이 접근법은 매우 문제가된다. 연구자들은 에탄올 자기 관리를 측정하기 위해 시작하기 전에 첫째, 교육의 오랜 기간을 필요로한다. 음식 제한 동물의 음식 제공 레버를 사전에 약물 교육의 일일 및 약물에 대한 응답 안정은 종종 10 달성 - - 반면, 코카인이나 헤로인 정맥 자기 관리는 0을 필요로 십이일 4,5. 이 방법의 또 다른 한계는 사카린 자당 쥐에 매우 보람 뇌의 활성화 패턴들을 유도한다는 사실따라서 에탄올 자기 관리에 교란 가능성을 도입 남용 약물에 imilar는 6-9을 연구. 마지막으로 인해 실패 수집 및 / 또는 불충분 한 응답 속도로 지속적으로 실험에서 제외 쥐의 상당 부분과 수집 및 응답 속도, 10에서이 방법 쇼 변동성을 이용하여 에탄올 용액, 자기 관리를 취득 쥐.
대조적으로,이 프로토콜, 우리는 수집 물 부족, 수 크로스 / 사카린 페이딩 또는 확장 된 액세스 훈련을 필요로하지 않는 수용액을 20 % 에탄올을 경구자가 투여 유지하기위한 단순하지만 효율적인 방법을 제안한다. 최근의 연구는 경구 에탄올 그 자체 투여 따라서 우리 experim 20 % 에탄올 용액을 선택하기위한 이론적 근거를 제공하고, 20 %의 에탄올 농도에서 자기 - 투여시 최고 에탄올 섭취 역 U 자형 투여 량 반응 곡선을 표시 발견ental 디자인 11.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 절차는 실험 동물의 관리 및 사용에 대한 NIH 가이드에 따라 실시된다.
1. 동물 관리 및 주택
- 반전 12 시간 명암주기와 온도 (21 ° C) 및 습도 제어 환경에서 쌍으로 도착에서 225g - 식민지에 도착하면, 집 남성의 Wistar 쥐 200 무게.
참고 : 실험의 이론적 근거에 따라 쥐 단일 수용 할 수있다. - 쥐 실험을 시작하기 전에 최소 1 주일 동안 동물 사육장 광 사이클에 적응 일상을 처리 할 수있다. 1 회 동물의 무게를.
- 쥐에게 Chow 및 실험 기간 동안 수돗물 무료로 액세스 권한을 부여 (물 부족 12 응답을 개시 할 필요가 없습니다). 어두운 테스트 룸의 명암 사이클의 어두운 단계에서 모든 행동 테스트를 실시한다.
참고 : 우리가 일상적으로 젊은 성인 남성의 Wistar 쥐 (출생 후 일 62-65)를 사용하지만,이 페이지를rotocol은 이론적으로 다른 쥐의 변종뿐만 아니라 성별 / 나이 차이를 조사하기에 적합 할 수있다.
2. 조작 적 교육
- 30.5 × 29.2 × 24.1 cm를 측정하고 침구 늘어서 그리드 바닥과 폐기물 팬을 포함하는 동일한 조작 적 챔버의 모든 행동 훈련과 테스트를 수행 환기 배기 팬이 장착 사운드 감쇠 칸막이에 수납, (냄새 신호를 줄이기 위해 동물 사이에서 변경) .
주 : 랫트는 훈련 일 1 조건화 조절하여 훈련 한 H +와 어두운주기 + 8 시간 사이에 (a 레버 응답은 보강제를 획득 할 필요가있다). 알코올 훈련 전에 알코올이나 음식 또는 유체 형성에 아무런 사전 노출이 없습니다. - 자극 조명, 주사기 펌프 및 액체 컵 콘센트 옆에 위치 두 개폐식 레버를 각 조작 적 챔버를 착용. 적절한 소프트웨어를 사용하여 컴퓨터에 의해 인터페이스 챔버 및 제어.
노트:대부분의 공급 업체는 챔버를 제어하는 데 필요한 자기 관리에 필요한 모든 구성 요소를 포함하는 패키지뿐만 아니라 소프트웨어와 인터페이스를 제공합니다. - 제조업체의 지침에 따라 20 % 에탄올 강화의 고정 비율 (FR) 일정 (응답 만 응답 지정된 수의 후 강화 된에 조건화 일정을) 시작 조작 적 조절 프로그램을 작성합니다. 예를 들어, 고정 된 비율 1, 래트는 증강제를 (a FR1 프로그램의 예를 들면, 기업 코드 파일 섹션 참조) 수득 한 응답을 생성한다. 다음 명령을 실행합니다.
- 상기 세션의 시작을 표시하기 위해, 알코올 가용성 신호를 두 개의 레버를 연장한다.
에탄올 (활성)과 관련된 레버에 하나의 레버를 눌러 잘 마시는 인접 물에 20 % 에탄올 100 μL의 볼륨의 전달에 의해 보상과에 의해 신호 수반 5의 제한 시간을 시작 참고 : 의 조명레버 위의 큐 - 빛. 큐 라이트는 훈련의 1 일에 도입된다. - 가 더 예약 된 결과가 없음에도 불구하고 제한 시간 동안 기록이 응답. 다른 레버 (비활성)에 기록 응답은 그들이 행동 결과를하지 않는다. 주 : 비활성 레버 비 특정 행동을 평가하는 제어부로서 기능한다.
- 활성 레버 (응답 속도) 및 적립 20 % 에탄올 보상의 수에 응답 수를 기록한다.
- 30 분 경과 후, 상기 세션의 종료를 알리기 위해, 알코올 가용성의 끝을 표시하는 두 개의 레버 철회.
- 저장 한 모든 데이터를 보관.
- 상기 세션의 시작을 표시하기 위해, 알코올 가용성 신호를 두 개의 레버를 연장한다.
- 교육 세션을 시작하기 전에 각각의 조작 적 실의 모든 장치의 적절한 기능 (개폐식 레버, 유체 분배기)를 확인합니다.
- (190) 증거 (95 %) 수돗물에 희석 에탄올의 20 % v / V를 에탄올 용액을 준비합니다.
참고 : 에탄올 용액을 실온에서 유지 될 수있다. 따라제조 업체에 재고 에탄올 솔루션은 최대 99.98 %까지 할 수있다. 또한 대부분의 출판 원고에서, 에탄올 농도는 일반적으로 볼륨 / 볼륨으로 제시하면서, 일부는 중량 / 부피로 제시 수 있습니다. - 20 % 에탄올 용액으로 주사기를 입력하고 주입 라인의 누출이나 기포가 없는지 확인합니다. 수동으로 에탄올이 제대로 최초의 강화 응답에서 콘센트에 배달됩니다 있는지 확인 주입 라인을 통해 에탄올의 작은 볼륨을 누릅니다. 종이 타월로 용기를 건조하고 세션을 시작하기 전에 비어 있는지 확인합니다.
- 20 % 에탄올 강화의 FR 일정을 제어하는 소프트웨어를로드
- 에 FR1 일정에서 기차 operant- 및 약물 순진 쥐 30 분 세션 동안 물 부족없이 20 %의 에탄올을 자기 - 관리합니다.
- 전송 케이지를 사용하여 테스트 룸에 동식물 사육장에서 쥐를 전송.
- 하나의 챔버에 각각 쥐를 할당합니다.전송 케이지에서 각각의 쥐를 가지고 할당 된 자기 관리 챔버에 넣어.
- 매일 일관된 실험의 조건을 유지하십시오. 따라서, 항상 매일 같은 자기 관리 챔버에서 거의 같은 시간을 쥐를 테스트합니다.
- 20 % 에탄올 강화의 FR1 일정을 시작하는 소프트웨어를 시작합니다.
- 세션의 끝에, 자기 관리 챔버에서 래트를 제거한 동물 사육장에 반환.
- 위해 수동으로 알코올 용액은 동물에 의해 소비되는 것을 확인하기 위해, 종이 타월을 사용하고 용기가 건조되었는지 확인합니다. 다르게는, 1 또는 2 mL를 주사기를 사용하여 소비되지 않은 양을 추정하기 위해 상기 용기 내에 남아있는 유체를 수집한다.
보다 정밀한 측정을 위해 (또한 더 비싸다), 소량의 정확한 계산을 허용하는 액체 수용 컵에 접속 lickometer 시스템과 각 챔버를 장착 할 수있다 : 참고자기 관리 세션 동안 래트 s의 제조. - 표면 살균제 각 챔버의 벽과 그리드 바닥을 청소합니다.
- 사용 후 70 % 에탄올 용액을 세정함으로써 주입 라인을 유지한다. 사용하지 않을 때에는, 몰드와 먼지를 방지하기 위해 캡을 삽입한다.
- 각 세션 후에 수집하고 생성 된 데이터를 분석한다. 특히, 활성 레버를 누를의 평균 수, 얻어진 알코올 보상의 평균 개수뿐만 아니라 비활성 레버 프레스의 평균 수를 계산한다.
참고 : 대부분의 논문에서, 알코올 소비도 g / kg (체중)의 에탄올 섭취로 제시됩니다. 에탄올 섭취는 다음 식을 이용하여 계산 될 수있다 :
소비 볼륨 (ML) - 0.789 g / mL의 - 실온에서 단일 볼륨 / 보상과 에탄올의 밀도 ± 얻은 보상의 수입니다.
예를 들어, 쥐 400g 무게 경우 20 rewa를 받았습니다20 % v / V를 에탄올 용액의 RDS :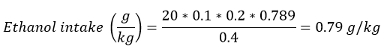
- (15 세션의 최소 변화없이 마지막 3 세션에서 얻은 보상의 총 수의 15 % 이상으로 정의)의 성능 안정화 될 때까지 일주일 세션을 5/6 일 실시.
주 : 쥐 FR1에 안정된 기준에 도달하면, 조건화 프로그램 알코올 상을 수득하는데 필요한 반응의 수를 증가 제조업체의 지시에 따라 변경 될 수있다. 고정 율은, 예를 들어 우발적 인 보강을 최소화하기 위해 FR2 FR3 또는 증가 될 수있다. - 혈액 에탄올 농도를 측정한다 :
- 자기 관리 세션에서 얻은 보상이 쥐에 의해 소비되어 있는지 확인하려면 자기 투여 후 혈중 에탄올 농도를 측정한다. 쥐가 안정 기준에 도달하면 즉시 다음과 같은 측면 꼬리 정맥에서 혈액을 수집세션. 혈관 내로 23 G 바늘을 삽입하고 모세관을 사용하여 50 μL의 혈액 샘플을 수집한다.
- 10 ML의 헤드 스페이스 바이알에 50 μL 혈액 샘플을 전송하고 (1) 50 μL 추가 : 내부 표준으로 1,000 이소 프로필 알코올을. 에탄올 표준에서 300 밀리그램 / dL 이상으로 표준 곡선 (10)을 준비합니다. 제조사의 설정에 따라 컬럼 크로마토 그래피 (13) 헤드 스페이스 샘플러 프로세스 샘플.
- 진보적 인 비율
- 보상 (14)을 소비하는 동물의 의욕을 평가하는 진보적 인 비율 (PR) 일정을 사용합니다. PR은 보강제를 얻는 반응의 수가 점차적으로 증가되는 조건화에서 일정하다 (다른 측면에서, 래트를 각각의 연속적인 보상을 위해 열심히 할).
참고 : 달리가 PR 세션이 시간 초과되지 않고, 세션 FR하고 30 분 완성 된 비율없이 경과 한 번 종료됩니다.- 할당 된 조건화 상자에 쥐를 놓고 수그들이 보강의 홍보 일정에 따라 20 % 에탄올에 대한 응답 : 내 세션 응답 요구 사항이나 비용 (레버 프레스 즉, 수를 증가를 제외하고는 FR 일정에 사용 된 것과 동일한 모든 실험 조건을 유지, (단계 2.3 참조) ... 1, 2, 3, 4, 6, 8, 10, 12, 16, 20, 24, 28, 32 주 : 다음의 예는 다음 식에 따라) 단일 에탄올 혜택을받을 활성 레버에 필요한 PR 프로그램은 기업 코드 파일 섹션에서 제공된다.
- 30 분은 보상하지 않고 경과되면 PR 세션을 종료합니다.
참고 : 브레이크 포인트가 PR 세션 동안 마지막으로 완료 응답 요구 사항으로 정의된다.
- 보상 (14)을 소비하는 동물의 의욕을 평가하는 진보적 인 비율 (PR) 일정을 사용합니다. PR은 보강제를 얻는 반응의 수가 점차적으로 증가되는 조건화에서 일정하다 (다른 측면에서, 래트를 각각의 연속적인 보상을 위해 열심히 할).
3. 테스트 알코올 자기 관리의 조작 적 모델의 예측 타당성
주 : 래트 안정적인 자기 관리 기준을 취득한 후 (공정 2 참조), 그것으로 예측 모델의 타당성을 평가할 수있다날트렉손의 효능, 20 % 에탄올 자기 관리를 감소시키는 알코올 의존에 대한 현재 FDA 승인 약물 테스트. 응답이 확실하게 높을 때 우리는 교육 (FR2) 동안 달성 가장 높은 FR에서이 테스트를 수행하는 것이 좋습니다. 예측 유효성이 확립되면, 모델은 새로운 약물 후보를 평가할 수있다.
- 시험 하루 전에 피하 식염수 주사를 쥐에게 이전에 두 개의 연속적인 자기 관리 세션의 최소 중에 주입을 길들하는 자기 관리 세션 또는 에탄올에 대해 응답하는 변화 없음으로 정의 된 식염수 주사 (에 의해 영향을받지 때까지 30 분을 제공 마지막 2 세션에서 얻은 보상)의 총 수의 15 % 이상.
- 날트렉손 식염수에 용해하고 동물에게 주사를 용이하게하기 위해 중립 도달하도록 pH를 조절한다. 1.0 ㎖ / 부피의 약물 주입은 투여의 피하 경로를 사용하여 세션 전에 30 분 kg이다. 참고 : 리터그래서 0.1, 0.3 및 1 ㎎ / ㎏이 프로토콜에 사용되는, 1 ㎎ / kg - ature 0.1의 범위 사이의 용량 선택에 대한 좋은 증거를 제공합니다.
참고 : 자신의 힘이 피하 주사가되는과 다를 수 있지만 연구, 날트렉손에 대한 관리 모두 피하 및 복강 내 경로의 사용을 나타냅니다 더 강력한 30 배 복강 내 주사 (15) 그. 날트렉손의 주입이 라우트의 사용이 유효 0.1 및 1 mg의 농도 사이의 범위에있는 각종의 실험실에 의해 복제 된 바와 같이 이러한 이유로, 우리는 피하 경로를 사용하는 것이 / 12,15,16을 kg이다. - 시험 당일시 30 분 자기 관리 세션 전에 네 날트렉손 투여주기 (0, 0.1, 0.3 및 1 ㎎ / ㎏) 중 하나를 가로 질러 간 주제 디자인에 균형 잡힌 / 임의의 순서로 쥐를 주입.
- 각 투여주기 사이에 쥐가 두 개의 연속적인 자기 관리 세션의 최소 또는 동안 응답 할 때까지 약을 세척 할 수 있습니다에탄올은 다시 기준선이다. 주 :이 결과, 테스트의 끝에서, 모든 쥐 네 선량 각각 주입 하였다.
- 이 단계 후에, 가장 효과적인 투여 량 (1 ㎎ / ㎏)을 선택하고 진보적 인 비 일정을 사용하여 알코올 섭취 동물의 동기에 날트렉손의 효과를 시험한다 (단계 2.12 참조).
Access restricted. Please log in or start a trial to view this content.
결과
그림 1에 FR1 일정에 훈련 operant- 및 약물 순진 위 스타 쥐의 대표적인 자기 관리 행동 (8 개 집단이 239 쥐의 총 금액)를 보여줍니다 물 부족 또는 사카린 / 크로스 페이딩없이 20 %의 에탄올을 자기 - 관리 30 분 세션 동안. 이 프로토콜로, 쥐가 레버 이미 매우 빠르게 에탄올 보상을 얻기 위해 눌러 첫 번째 세션 (그림 1A) 동안 10 개 이상의 보상을 획득?...
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜, 우리가 얻고, 물 부족, 확장 액세스 훈련의 사용을 요구하지 않는 에탄올자가 투여 고전 모델과 달리, 래트에서 20 % 에탄올 안정한 경구자가 투여를 유지하는 새로운 방법을 제시하고 있으며, 또는 사카린 / 자당 12 페이딩. 또한, 날트렉손, 알코올 의존에 대한 현재 FDA 승인 약물 치료는 성공적으로 알코올 자기 관리 및이 프로토콜과 훈련의 Wistar 쥐의 알코올을 소비하는 의욕...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 아무것도 없어.
감사의 말
이 작품은 스웨덴 연구위원회에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
참고문헌
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유