É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método para avaliar as propriedades de reforço de etanol em ratos sem água Privação, Sacarina desvanecimento ou treinamento de Acesso Ampliado
Neste Artigo
Resumo
Este protocolo descreve um método novo e eficiente para iniciar rapidamente operante de responder por etanol em ratos, que, contrariamente aos métodos convencionais, não necessitam de privação de água ou sacarina / sacarose desvanecimento para iniciar a responder.
Resumo
métodos de auto-administração oral operantes são comumente usados para estudar as propriedades de reforço de etanol em animais. No entanto, os métodos convencionais exigem a sacarina / desvanecimento sacarose, privação de água e / ou formação estendida para iniciar responder operante em ratos. Este artigo descreve um método novo e eficiente para iniciar rapidamente responder operante para o etanol que seja conveniente para experimentadores e não necessita de privação de água ou sacarina / desvanecimento sacarose, eliminando assim a confundem potencial do uso de adoçantes em etanol estudos de auto-administração operante. Com este método, ratos Wistar tipicamente adquirir e manter a auto-administração de uma solução de etanol a 20% em menos de duas semanas de formação. Além disso, as concentrações de etanol no sangue e recompensas são correlacionados positivamente para uma sessão de auto-administração 30 min. Além disso, a naltrexona, um medicamento aprovado pela FDA para a dependência do álcool que tem sido mostrado para suprimir a auto-administração de etanolem roedores, dependente da dose, diminui o consumo de álcool e a motivação para consumir álcool em ratos auto-administração de 20% de etanol, validando assim a utilização deste novo método para estudar as propriedades de reforço de álcool em ratos.
Introdução
O desenvolvimento de modelos animais para estudar os efeitos reforçadores da droga provou uma ferramenta importante para estudar a toxicodependência humano. Mais especificamente, a auto-administração operante é um modelo comportamental amplamente utilizado que é um dos meios mais eficazes para a avaliação dos efeitos de reforço positivo de uma solução de etanol consumida por via oral. Um problema inicial com o desenvolvimento de um modelo desse tipo era o gosto aversivo primário de altas concentrações de etanol para a maioria dos roedores, um fenómeno que também é compartilhada em seres humanos com pouca ou nenhuma experiência com o álcool 1. Um protocolo padrão para superar essa barreira exige a privação de água e / ou a sacarina ou sacarose desbotamento durante a aquisição e manutenção de auto-administração. No entanto, estas duas abordagens não são vantajosas. Eles exigem longos períodos de treinamento para iniciar simplesmente respondendo para o etanol e obter uma taxa de sucesso relativo de aquisição. A utilização de adoçantes também introduz uma polarização potencial ema interpretação dos dados auto-administração. Essas limitações não se aplicam com o protocolo seguinte.
Resumidamente, Sansão e colegas 2 mostraram que a dissolução de etanol em uma solução doce de 20% de sacarose e, em seguida, desaparecendo a doçura ao longo de 4 semanas de treinamento é necessário para iniciar a responder por 10% de etanol em água. Além disso, a ingestão de etanol fiável é geralmente conseguido em 6 a 8 semanas 1-3. Esta abordagem é altamente problemática. Primeiro, exige longos períodos de treinamento antes de os investigadores podem começar a medir o etanol auto-administração. Em contraste, intravenosa auto-administração de cocaína ou heroína requer 0 - 1 dias de treinamento pré-droga em uma alavanca de entrega de alimentos em animais de produção restrita, e estável de responder por droga é muitas vezes conseguida em 10 - 12 dias 4,5. Uma outra limitação deste método é o facto de a sacarina e sacarose são altamente compensador para ratos e induzir padrões de activação cerebral similar para drogas de abuso, introduzindo assim o potencial para confunde em etanol auto-administração estuda 6-9. Finalmente, os ratos adquirem auto-administração de uma solução de etanol usando este método mostra variabilidade na aquisição e resposta taxa de 1,10, com uma proporção substancial de ratos consistentemente excluídas experimentos devido a aquisição bem sucedida e / ou taxa de resposta insuficiente.
Por outro lado, com este protocolo, apresentamos um método simples mas eficaz para a aquisição e manutenção de auto-administração oral de uma de etanol a 20% em solução de água que não necessitam de privação de água, sacarose / desvanecimento sacarina ou formação de acesso estendida. Um estudo recente constatou que a auto-administração por via oral de etanol exibe uma curva de resposta à dose em forma de U invertido com maior ingestão de etanol durante a auto-administração, a uma concentração de etanol a 20%, proporcionando assim uma base lógica para a selecção de uma solução de etanol 20% no nosso experimenprojeto ental 11.
Protocolo
Todos os procedimentos são realizados de acordo com o Guia NIH para Cuidado e Uso de Animais de Laboratório.
1. Animal Care e Habitação
- Após a chegada na colônia, os ratos casa machos Wistar pesando 200-225 g à chegada em pares em uma temperatura (21 ° C) e meio ambiente com humidade controlada, com um ciclo claro-escuro de 12 h revertida.
Nota: Dependendo da lógica dos experimentos, os ratos podem ser alojados individualmente. - Permitir que os ratos para se aclimatar ao biotério e o ciclo de luz por pelo menos uma semana antes de iniciar uma experiência e lidar com eles diariamente. Pesar os animais uma vez por semana.
- Dê ratos livre acesso à comida e água da torneira para a duração do experimento (privação de água não é necessário iniciar responder 12). Realizar todos os testes de comportamento durante a fase escura do ciclo claro-escuro de uma sala de testes escuro.
Nota: Embora nós usam rotineiramente jovens ratos Wistar machos adultos (dias pós-natal 62 - 65), este protocolo pode, teoricamente, ser adequado para investigar outras estirpes de ratos, assim como as diferenças de sexo e / ou idade.
2. Formação Operant
- Realizar todo o treinamento comportamental e testes em câmaras operantes idênticos medindo 30,5 × 29,2 × 24,1 cm e contendo pisos de arame e panelas de resíduos alinhados com roupa de cama (trocadas entre animais para reduzir marcas olfactivas), alojados em cubículos de atenuação de som equipados com exaustores para ventilação .
Nota: Os ratos são treinados por operante condicionado a partir de um dia de formação (uma resposta numa alavanca é necessária para obter um reforçador) entre + + 1 h e 8 h de escuro no ciclo. Não há pré-exposição ao álcool, nem comida ou a elaboração de líquidos antes do treino álcool. - Equipar cada câmara operante com luzes de estímulo, bombas de seringa e duas alavancas retrácteis posicionado lateralmente para um receptáculo copo de líquido. câmaras de interface e controle de um computador utilizando o software apropriado.
Nota:A maioria dos fornecedores irá fornecer pacotes de auto-administração que contêm todos os componentes necessários, bem como software e interfaces necessárias para controlar as câmaras. - Escrever um programa operante condicionado que inicia o esquema de razão fixa (FR) de reforço 20% de etanol (a programação operante no qual uma resposta é reforçada só depois de um determinado número de respostas) de acordo com as instruções do fabricante. Por exemplo, em uma proporção fixa 1, os ratos têm uma resposta para produzir obter um reforçador (ver a secção suplementar arquivos de código para um exemplo de um programa de FR1). Execute os seguintes comandos.
- Estender duas alavancas para marcar o início da sessão e para sinalizar a disponibilidade do álcool.
Nota: Uma pressão da alavanca sobre a alavanca associada com etanol (activa) é recompensado através da entrega de um volume de 100 uL de 20% de etanol em água no adjacente beber bem e inicia a 5 s período de tempo limite concomitante assinalado pela iluminação docue-luz acima da alavanca. O cue-luz é introduzido no dia 1 do treinamento. - Durante o período de tempo limite, ficha responder ainda que não tem consequências programadas. Registre as respostas na outra alavanca (inativo), embora eles nunca ter consequências comportamentais. Nota: A alavanca inactiva serve como um controlo para avaliar o comportamento não-específica.
- Grave o número de respostas na alavanca ativa (taxas de resposta) e o número de 20% de etanol recompensas ganhos.
- Após 30 minutos terem decorrido, retrair as duas alavancas para sinalizar o fim da sessão e para sinalizar o fim da disponibilidade de álcool.
- Salvar e arquivar todos os dados.
- Estender duas alavancas para marcar o início da sessão e para sinalizar a disponibilidade do álcool.
- Antes de iniciar a sessão de treinamento, verificar o bom funcionamento de todos os dispositivos em cada câmara operante (alavancas retrácteis, distribuidor de fluidos).
- Preparar a solução de etanol v / v de 20% a partir de 190 de prova (95%) de etanol diluído em água da torneira.
Nota: Etanol solução pode ser guardada à temperatura ambiente. dependendosobre o fabricante, as soluções estoque de etanol pode ser de até 99,98%. Note também que, enquanto em manuscritos mais publicados, as concentrações de etanol são geralmente apresentados como volume / volume, alguns podem apresentá-los como peso / volume. - Encha a seringa com a solução de etanol a 20% e se certificar de que não há vazamentos ou bolhas de ar nas linhas de infusão. empurrar manualmente um pequeno volume de etanol por meio das linhas de infusão para se certificar de que o etanol será correctamente entregue no receptáculo a partir da primeira resposta reforçada. Secar o recipiente com uma toalha de papel e certifique-se de que ele está vazio antes de iniciar a sessão.
- Carregar o software que controla a programação FR de reforço de etanol a 20%
- Train operant- e ratos virgens de tratamento sob um cronograma FR1 para auto-administrar 20% de etanol sem privação de água durante 30 sessões min.
- Transportar os ratos provenientes do biotério para a sala de ensaios utilizando uma jaula de transporte.
- Atribuir cada rato para uma câmara.Tome cada rato individual da jaula de transporte e colocá-lo na câmara de auto-administração atribuído.
- Tente manter as condições da experiência consistente cada dia. Portanto, sempre testar ratos na mesma câmara auto-administração ou menos na mesma hora todos os dias.
- Inicie o software que inicia a programação FR1 de reforço de etanol a 20%.
- No final da sessão, remover os ratos das câmaras de auto-administração e devolvê-las para o viveiro.
- A fim de confirmar que manualmente a solução de álcool é consumido pelos animais, usar uma toalha de papel e verificar se o recipiente é seco. Em alternativa, usar um 1 ou 2 ml da seringa e recolher o fluido remanescente no receptáculo para estimar o volume que não é consumido.
Nota: Para uma medição mais precisa (mas também mais caro), é possível equipar cada uma das câmaras com um sistema lickometer ligado ao receptáculo copo de líquido que permite uma contagem precisa do pingos produzidos por os ratos durante a sessão de auto-administração. - Limpar as paredes e o piso de grade de cada câmara, com um desinfectante de superfície.
- Após a utilização, manter as linhas de infusão limpando-os com uma solução de etanol a 70%. Quando não estiver em uso, coloque a tampa para evitar mofo e poeira.
- Após cada sessão, coletar e analisar os dados gerados. Mais particularmente, calcular o número médio de prensas alavanca activa, o número médio de frutos obtidos de álcool, bem como o número médio de prensas alavanca inactiva.
Nota: Na maioria dos papéis, o consumo de álcool também é apresentado como o consumo de etanol em g / kg (peso corporal). A ingestão de etanol pode ser calculada usando a seguinte fórmula:
Com volume consumido (mL) - número de recompensas ganhas ± unitária de volume / recompensa e densidade de etanol à temperatura ambiente - 0,789 g / mL.
Por exemplo, se um rato pesa 400 g ganhou 20 rewaRDS de solução a 20% v / v etanol: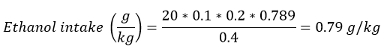
- Realizar sessões de 5/6 dias por semana, até a estabilização do desempenho (definido como um mínimo de 15 sessões e nenhuma alteração superior a 15% do número total de recompensas ganhas durante as últimas 3 sessões).
Observação: Uma vez que os ratos tenham atingido uma linha de base estável em FR1, o programa de condicionamento operante pode ser modificado de acordo com as instruções do fabricante para aumentar o número de respostas necessárias para obter uma recompensa de álcool. A proporção fixa pode por exemplo ser aumentado para FR2 ou FR3, a fim de minimizar o reforço acidental. - Medir as concentrações de etanol no sangue:
- Para confirmar que os frutos obtidos de uma sessão de auto-administração são consumidos pelos ratos, medir as concentrações de etanol no sangue a seguir a auto-administração. Uma vez que os ratos tenham atingido uma linha de base estável, recolha de sangue a partir da veia lateral da cauda imediatamente depoisa sessão. Inserir uma agulha G 23, para dentro do vaso sanguíneo e recolher amostras de sangue de 50 uL utilizando um tubo capilar.
- Transferir as amostras de sangue de 50 ul e 10 frascos de headspace ml e adicionar 50 uL de 1: 1000 de álcool isopropílico como padrão interno. Prepara-se uma curva padrão de 10 a 300 mg / dL a partir de padrões de etanol. Amostras de processo com um amostrador headspace com uma coluna de cromatografia 13 de acordo com as definições do fabricante.
- razão progressiva
- Use cronogramas progressivos relação (PR) para avaliar a motivação dos animais para consumir uma recompensa de 14. PR é uma programação operante em que o número de respostas para obter um reforçador é aumentada gradualmente (em outros termos, os ratos têm de trabalhar mais para cada recompensa sucessiva).
Nota: Ao contrário do FR sessões, uma sessão PR não é cronometrado e só vai ser encerrado, uma vez 30 min tenha decorrido sem um rácio concluída.- Coloque ratos em suas caixas operantes atribuídos e permitir-lhes responder por 20% de etanol sob uma programação PR de reforço: Mantenha todas as condições experimentais idênticas às utilizadas no cronograma FR (ver passo 2.3), excepto aumentar o requisito de resposta ou de custos dentro de sessões (isto é, o número de pressões da alavanca necessária sobre a alavanca activa para receber uma única recompensa etanol) de acordo com a fórmula seguinte: 1, 2, 3, 4, 6, 8, 10, 12, 16, 20, 24, 28, 32 ... Nota: um exemplo do programa de RP é fornecido na seção Supplemental arquivos de código.
- Encerrar a sessão PR uma vez 30 min tiver decorrido sem uma recompensa.
Nota: O ponto de ruptura é definida como a última exigência resposta completado durante a sessão de PR.
- Use cronogramas progressivos relação (PR) para avaliar a motivação dos animais para consumir uma recompensa de 14. PR é uma programação operante em que o número de respostas para obter um reforçador é aumentada gradualmente (em outros termos, os ratos têm de trabalhar mais para cada recompensa sucessiva).
3. Teste a validade preditiva de um modelo operante de álcool auto-administração
Nota: Uma vez que os ratos adquiriram uma linha de base auto-administração estável (ver passo 2), é possível avaliar a validade preditiva do modelo detestar a eficácia de naltrexona, um fármaco actualmente aprovado pela FDA para a dependência de álcool na redução de 20% de etanol a auto-administração. Recomendamos fazer este teste no mais alto FR alcançado durante o treinamento (FR2), quando as respostas são seguramente alta. Uma vez validade preditiva é estabelecida, o modelo pode ser usado para avaliar os novos candidatos a fármacos.
- Antes do dia de teste, dar ratos injecções de solução salina subcutânea 30 minutos antes das sessões de auto-administração de habituar-los para a injecção durante um mínimo de duas sessões de auto-administração consecutiva ou até responder por etanol não é afectada pelas injecções de solução salina (definida como qualquer alteração superior a 15% do número total de recompensas ganhas durante os últimos 2 sessões).
- Dissolver naltrexona em solução salina e ajustar o pH a atingir a neutralidade para facilitar as injecções aos animais. Injectar a droga a um volume de 1,0 ml / kg 30 minutos antes da sessão, utilizando a via de administração subcutânea. Nota: O litrotura proporciona uma boa evidência de uma escolha de dose entre os intervalos de 0,1 - 1 mg / kg, de modo que 0,1, 0,3 e 1 mg / kg são utilizados no presente protocolo.
Nota: A pesquisa indica o uso de ambas as vias subcutânea e intraperitoneal de administração para a naltrexona, embora a sua potência pode diferir com a injecção subcutânea sendo 30 vezes mais potente do que 15 injecções intraperitoneais. Por esta razão, recomenda-se utilizar a via subcutânea como a utilização desta via para a injecção de naltrexona foi validado e replicado por vários laboratórios, a um intervalo de concentrações entre 0,1 e 1 mg / kg 12,15,16. - Durante o dia do teste, ratos injectar numa ordem equilibrada / aleatório num desenho entre sujeitos através de um dos quatro ciclos de naltrexona dosagem (0, 0,1, 0,3 e 1 mg / kg) 30 minutos antes da sessão de auto-administração.
- Entre cada ciclo de dosagem, permite ratos à lavagem do fármaco com um mínimo de duas sessões de auto-administração consecutiva ou até para responderetanol está de volta à linha de base. Observação: Como resultado, no final do ensaio, todos os ratos foram injectados com cada uma das quatro doses.
- Após esta fase, seleccionar a dose mais eficaz (1 mg / kg) e testar o efeito da naltrexona na motivação dos animais de consumir álcool, usando um programa de razão progressiva (ver passo 2.12).
Resultados
A Figura 1 mostra o comportamento auto-administração representante de ratos Wistar operant- e virgens de tratamento (oito coortes diferentes perfazendo um total de 239 ratos) treinados em uma programação FR1 para auto-administrar 20% de etanol, sem privação de água ou sacarina / desvanecimento sacarose durante sessões de 30 minutos. Com este protocolo, os ratos iniciar alavanca pressionando para obter uma recompensa de etanol muito rapidamente, já a obtenção d...
Discussão
Com este protocolo, estamos apresentando um novo método para adquirir e manter a auto-administração oral estável de 20% de etanol em ratos que, contrariamente aos modelos clássicos de etanol auto-administração, não requerem o uso de privação de água, formação de acesso estendida, ou sacarina / sacarose 12 desvanecimento. Além disso, a naltrexona, um medicamento atualmente aprovado pelo FDA para dependência de álcool, diminui com sucesso álcool auto-administração e a motivação para consumi...
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho foi financiado pelo Conselho de Pesquisa sueco.
Materiais
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
Referências
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados