Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine Methode zur Bewertung der verstärkenden Eigenschaften von Ethanol bei Ratten ohne Wasser Deprivation, Saccharin Verblassen oder Extended Access Schulung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine neue und effiziente Methode, um schnell reagieren operant für Ethanol bei Ratten, die, im Gegensatz zu Standardverfahren einzuleiten, nicht Wasserentzug oder Saccharin / Saccharose erfordern Verblassen reagieren zu initiieren.
Zusammenfassung
Operant orale Selbstverwaltung Methoden werden häufig zur Untersuchung der verstärkenden Eigenschaften von Ethanol bei Tieren verwendet. Allerdings erfordern die Standardmethoden Saccharin / Saccharose-Fading, Wasserentzug und / oder erweiterte Ausbildung operant reagiert bei Ratten zu initiieren. Dieses Dokument beschreibt ein neuartiges und effizientes Verfahren, um schnell zu reagieren operant für ethanol initiieren, die für Experimentatoren bequem ist und keine Wasserentzug oder Saccharin / Saccharose-Fading erfordern, wodurch das Potential der Verwendung confound Süßstoffe in Ethanol operant Selbstverabreichung Studien eliminieren. Bei diesem Verfahren wird typischerweise Wistar Ratten erwerben und Selbstverabreichung einer 20% igen Ethanollösung in weniger als zwei Wochen Training erhalten. Außerdem Blutethanolkonzentrationen und Belohnungen sind positiv für eine 30 min Selbstverwaltung Sitzung korreliert. Darüber hinaus Naltrexon, ein von der FDA zugelassenes Medikament für Alkoholabhängigkeit, die Ethanol Selbstverwaltung zu unterdrücken, hat sich gezeigt,in Nagetieren, nimmt dosisabhängig Alkoholkonsum und Motivations Alkohol für Ratten Selbstverabreichung von 20% Ethanol zu verbrauchen, wodurch die Verwendung dieser neuen Methode Validierung der verstärkenden Eigenschaften von Alkohol bei Ratten zu untersuchen.
Einleitung
Die Entwicklung von Tiermodellen, die Verstärkungswirkungen von Medikamenten zu untersuchen hat ein wichtiges Instrument zu studieren menschliche Drogensucht erwiesen. Genauer gesagt ist operant Selbstverabreichung ein weit Verhaltensmodell verwendet, das für die Beurteilung der positiven Verstärkungseffekte einer oral verbrauchten Ethanollösung eines der wirksamsten Mittel ist. Ein frühes Problem mit einem solchen Modell zu entwickeln war der primäre aversiven Geschmack von hohen Konzentrationen von Ethanol für die meisten Nagetiere, ein Phänomen , das auch bei Menschen mit wenig oder keine Erfahrung mit Alkohol 1 geteilt wird. Ein Standardprotokoll, diese Barriere zu überwinden, erfordert Wasserentzug und / oder Saccharin oder Saccharose Verblassen für den Erwerb und die Aufrechterhaltung der Selbstverwaltung. Jedoch sind diese beiden Ansätze nicht vorteilhaft. Sie erfordern lange Ausbildungszeiten einfach zu initiieren für Ethanol reagiert und eine relative Erfolgsrate der Akquisition erhalten. Die Verwendung von Süßstoffen führt auch eine mögliche Verzerrung indie Interpretation der Selbstverwaltungsdaten. Diese Einschränkungen gelten nicht für das folgende Protokoll.
Kurz gesagt, haben 2 Samson und Kollegen gezeigt , dass Ethanol in einer süßen Lösung von 20% Saccharose gelöst und dann wird die Süße über 4 Wochen Training Ausblendung erforderlich für 10% Ethanol zu initiieren in Wasser reagiert. Darüber hinaus wird zuverlässig Ethanolaufnahme üblicherweise in 6 bis 8 Wochen 1-3 erreicht. Dieser Ansatz ist sehr problematisch. Erstens erfordert es längere Zeit der Ausbildung, bevor Ermittler beginnen kann Ethanol Selbstverwaltung zu messen. Im Gegensatz dazu erfordert intravenöse Selbstverabreichung von Kokain oder Heroin 0 - 1 in Tagen vor der Droge Training auf einem Lebensmittel liefernde Hebel in Lebensmitteln beschränkt Tiere und stabil für Arzneimittel reagiert wird oft in 10 erreicht - 12 Tage 4,5. Eine weitere Einschränkung dieses Verfahrens ist die Tatsache, dass Saccharin und Saccharose Ratten sehr lohnend sind und Gehirnaktivierungsmuster s entlockenimilar zu Drogenmissbrauch und damit das Potenzial für verwechselt in Ethanol Selbstverwaltung Einführung Studien 6-9. Schließlich Ratten Erwerb Selbstverwaltung einer Ethanollösung , diese Methode zeigen Variabilität in Erwerb und Ansprechrate mit 1,10, mit einem erheblichen Anteil an Ratten konsequent aus Experimenten ausgeschlossen wegen erfolgloser Erwerb und / oder unzureichende Ansprechrate.
Im Gegensatz dazu mit diesem Protokoll stellen wir eine einfache, aber effiziente Methode zur Erfassung und Pflege der oralen Selbstverabreichung von 20% Ethanol in Wasser-Lösung, die Wasserentzug, Saccharose / Saccharin Verblassen oder erweiterten Zugang Training nicht erforderlich machen. Eine aktuelle Untersuchung ergab, dass die Selbstverwaltung für die orale Ethanol zeigt eine umgekehrte U-förmige Dosis-Wirkungs-Kurve mit dem höchsten Alkoholaufnahme bei Selbstverabreichung bei einer 20% igen Ethanolkonzentration und damit eine rationale Bereitstellung von 20% Ethanollösung in unserem Experim Auswahlental Design 11.
Protokoll
Alle Vorgänge werden in Übereinstimmung mit dem NIH Leitfaden für Pflege und Verwendung von Labortieren durchgeführt.
1. Tierpflege und Wohnen
- Bei der Ankunft in der Kolonie, Wiegen Haus männliche Wistar-Ratten von 200 bis 225 g bei der Ankunft in Paaren in einer Temperatur (21 ° C) und Feuchtigkeit kontrollierten Umgebung mit umgekehrtem 12 h Licht-Dunkel-Zyklus.
Hinweis: Je nach dem Grundprinzip der Experimente, Ratten können einzeln untergebracht werden. - Lassen Sie die Ratten auf das Vivarium und dem Lichtzyklus für mindestens eine Woche zu akklimatisieren, bevor ein Experiment starten und verarbeiten sie täglich. Wiegen Sie die Tiere einmal wöchentlich.
- Geben Ratten freien Zugang zum Chow - Chow und Leitungswasser für die Dauer des Experiments (Wasserentzug ist nicht notwendig , zu initiieren 12 reagiert). Führen Sie alle Verhaltenstests während der Dunkelphase des Hell-Dunkel-Zyklus in einem dunklen Testraum.
Hinweis: Obwohl routinemäßig wir jungen erwachsenen männlichen Wistar-Ratten (postnatalen Tag 62 bis 65) zu verwenden, um dieses protokoll kann theoretisch für die Untersuchung von anderen Stämmen von Ratten geeignet sein, sowie Geschlecht und / oder Altersunterschiede.
2. Operanten Ausbildung
- Führen Sie alle Verhaltenstraining und Tests in identischen operant Messkammern 30,5 × 29,2 × 24,1 cm und enthält Gitterböden und Abfall Pfannen mit Bettwäsche ausgekleidet (geändert in zwischen Tieren Geruch Cues zu reduzieren), untergebracht in schalldämpfenden Kabinen mit Abluftventilatoren für die Belüftung ausgestattet .
Hinweis: Die Ratten werden trainiert von operant Anlage von Tag 1 der Ausbildung (eine Antwort auf einen Hebel ist notwendig, eine Bestärkung zu erhalten) zwischen + 1 h und + 8 h des Dunkel-Zyklus. Es gibt keine vorge Exposition gegenüber Alkohol, noch Nahrung oder Flüssigkeit Formgebung vor Alkohol Ausbildung. - Anlegen jede operant Kammer mit Reizlichter, Spritzenpumpen und zwei versenkbaren Hebel, der seitlich mit einem Flüssigkeitsschalenaufnahme. Interface-Kammern und Steuerung durch einen Computer die entsprechende Software.
Hinweis:Die meisten Anbieter werden Selbstverwaltung Pakete bieten alle notwendigen Komponenten sowie Software und Schnittstellen enthält erforderlich sind, um die Kammern zu steuern. - Schreibe eine operant Anlage Programm, das den Festverhältnis (FR) Plan von 20% Ethanol Verstärkungs einleitet (an operant Plan, in dem eine Reaktion erst nach einer bestimmten Anzahl von Antworten verstärkt ist) gemäß den Anweisungen des Herstellers. Zum Beispiel in einem Fest Verhältnis 1, haben Ratten eine Reaktion, um eine Bestärkung zu erhalten (siehe Ergänzenden Code Abschnitt Dateien für ein Beispiel eines FR1-Programm). Führen Sie die folgenden Befehle ein.
- Erstrecken sich zwei Hebel um den Beginn der Sitzung zu markieren und Alkohol Verfügbarkeit zu signalisieren.
Hinweis: Ein Hebel drücken Sie auf den Hebel mit Ethanol (aktiv) verbunden sind durch die Lieferung von einem Volumen von 100 & mgr; l 20% Ethanol in Wasser in dem benachbarten belohnt trinkt gut und initiiert eine gleichzeitige 5-s Zeitlimit durch die signalisierte Beleuchtung dercue-Licht über dem Hebel. Der Cue-Licht wird am Tag 1 eingeführt des Trainings. - Während der Zeitperiode, reagiert Rekord, obwohl es keine geplanten Folgen hat. Nehmen Sie Antworten auf der anderen Hebel (inaktiv), obwohl sie nie Verhaltenskonsequenzen haben. Hinweis: Der inaktive Hebel als Kontrolle dient nicht-spezifische Verhalten zu beurteilen.
- Notieren Sie die Anzahl der Antworten auf den aktiven Hebel (Ansprechrate) und die Anzahl der 20% Ethanol Belohnungen verdient.
- Nach 30 Minuten vergangen sind, ziehen sich die beiden Hebel am Ende der Sitzung zu signalisieren, und das Ende des Alkohol Verfügbarkeit zu signalisieren.
- Speichern Sie und alle Daten zu archivieren.
- Erstrecken sich zwei Hebel um den Beginn der Sitzung zu markieren und Alkohol Verfügbarkeit zu signalisieren.
- Vor dem Training beginnen, überprüfen Sie die einwandfreie Funktion aller Geräte in jeder operant Kammer (einziehbare Hebel, Flüssigkeitsspender).
- Bereiten Sie die 20% v / v Ethanol-Lösung von 190 Proof (95%) Ethanol in Leitungswasser verdünnt.
Hinweis: Ethanol-Lösung kann bei Raumtemperatur aufbewahrt werden. Abhängignach Hersteller Lager Ethanollösungen bis zu 99,98% betragen. Beachten Sie auch, dass, während in den meisten veröffentlichten Manuskripten, Ethanolkonzentrationen in der Regel als Volumen / Volumen präsentiert werden, einige sie als Gewicht / Volumen darstellen können. - Füllen Sie die Spritze mit der 20% igen Ethanollösung und stellen Sie sicher, dass es keine Lecks oder Luftblasen in den Infusionsleitungen sind. drücken Sie manuell ein kleines Volumen von Ethanol durch die Infusionsleitungen, um sicherzustellen, dass Ethanol korrekt in die Aufnahme aus dem ersten verstärkten Antwort geliefert werden. Trocknen Sie die Behälter mit einem Papiertuch und stellen Sie sicher, dass es vor dem Start der Sitzung leer ist.
- Laden Sie die Software, die die FR Zeitplan von 20% Ethanol Verstärkung steuert
- Zug operant- und Drogen-naive Ratten unter einem FR1 Zeitplan selbst zu verabreichen 20% Ethanol ohne Wasserentzug während 30 Minuten-Sitzungen.
- Transportieren Sie die Ratten aus dem Vivarium zu den Testraum einen Transportkäfig mit.
- Weisen Sie jede Ratte zu einer Kammer.Nehmen Sie jede einzelne Ratte aus dem Transportkäfig und legte sie in der zugeordneten Selbstverwaltung Kammer.
- Versuchen Sie, die Bedingungen des Experiments konsequent jeden Tag zu halten. Daher testen immer Ratten in der gleichen Selbstverwaltung Kammer bei etwa zur gleichen Zeit jeden Tag.
- Starten Sie die Software, die die FR1 Zeitplan von 20% Ethanol Verstärkung initiiert.
- Am Ende der Sitzung, entfernen Sie die Ratten aus den Selbstverwaltung Kammern und wieder auf das Vivarium.
- Um zu bestätigen, um manuell, dass die Alkohollösung von den Tieren verzehrt wird, verwenden Sie ein Papiertuch und prüfen, ob der Behälter getrocknet wird. Alternativ können Sie eine 1 oder 2-ml-Spritze verwenden und die Flüssigkeit sammeln sich in dem Behälter verbleibende das Volumen zu schätzen, die nicht verbraucht wird.
Anmerkung: Für eine genauere Messung (aber auch teurer), ist es möglich, jede Kammer mit einem lickometer System zum Flüssigkeitsschalenaufnahme verbunden auszustatten, die eine genaue Zählung der Lick ermöglichts durch die Ratten während der Selbstverwaltung Sitzung erzeugt. - Reinigen Sie die Wände und Gitterboden jeder Kammer mit einem Flächendesinfektionsmittel.
- die Infusionsleitungen nach dem Gebrauch aufrechtzuerhalten, indem sie mit einer 70% igen Ethanollösung reinigen. Wenn sie nicht in Gebrauch ist, legen Sie die Kappe Schimmel und Staub zu vermeiden.
- Nach jeder Sitzung, zu sammeln und die gewonnenen Daten zu analysieren. Insbesondere die mittlere Zahl der aktiven Hebel drückt, die mittlere Anzahl von Alkohol erhalten Belohnungen sowie die mittlere Anzahl von inaktiven Hebelpressen berechnen.
Anmerkung: In den meisten Papiere, wird der Alkoholkonsum auch als Ethanolaufnahme in g / kg (Körpergewicht) dargestellt. Ethanolaufnahme kann mit folgender Formel berechnet werden:
Mit Volumen verbraucht (ml) - Zahl der Belohnungen ± Einheitsvolumen / Belohnung und Dichte von Ethanol bei Raumtemperatur verdient - 0,789 g / ml.
Wenn beispielsweise eine Ratte mit einem Gewicht von 400 g hat 20 rewards von 20% v / v Ethanol-Lösung: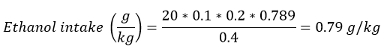
- Durchführen von Sitzungen 5/6 Tage pro Woche bis zur Stabilisierung der Leistung (definiert als mindestens 15 Sitzungen und keine Veränderung mehr als 15% in der Gesamtzahl der Belohnungen während der letzten drei Sitzungen verdient).
Hinweis: Wenn Ratten eine stabile Basislinie auf FR1, die operanten Konditionierung Programm geändert werden können erreicht haben gemäß den Anweisungen des Herstellers, die Anzahl der Antworten zu erhöhen, notwendig, einen Alkohol Belohnung zu erhalten. Der Festverhältnis kann zum Beispiel zu FR2 oder FR3 erhöht werden, um ein versehentliches Verstärkung zu minimieren. - Messen Sie Blut Ethanolkonzentrationen:
- Um zu bestätigen, dass die erhaltenen Belohnungen in einer Selbstverwaltung Sitzung, die von den Ratten konsumiert werden, messen die Blutethanolkonzentrationen folgende Selbstverwaltung. Sobald Ratten eine stabile Basislinie erreicht haben, sammeln Blut aus der laterale Schwanzvene unmittelbar nachdie Sitzung. Legen Sie eine 23 G-Nadel in das Blutgefäß und sammeln 50 & mgr; l Blutproben unter Verwendung eines Kapillarröhrchens.
- Übertragen Sie die 50 & mgr; l Blutproben zu 10 ml Headspace-Flaschen und 50 & mgr; l von 1: 1000 Isopropylalkohol als interner Standard. Bereiten Sie eine Standardkurve 10 bis 300 mg / dl aus Ethanol-Standards. Prozessproben mit einem Headspace - Proben mit einer Chromatographiesäule 13 entsprechend den Herstellereinstellungen.
- Progressive-Verhältnis
- Verwenden Sie progressive Verhältnis (PR) plant die Motivation der Tiere zu beurteilen , eine Belohnung 14 zu konsumieren. PR ist ein operant Plan, in dem die Anzahl der Antworten eine Ansporner zu erhalten allmählich erhöht wird (in anderen Worten, haben Ratten härter für jede aufeinanderfolgende Belohnung zu arbeiten).
Hinweis: Im Gegensatz zu Sitzungen FR, eine PR-Sitzung nicht abgelaufen ist und wird nur einmal 30 Minuten ohne ein abgeschlossenes Verhältnis Ablauf gekündigt werden.- Legen Ratten in ihren zugewiesenen operant Boxen und ermöglichensie für 20% Ethanol unter einer PR - Verstärkungsplan zu reagieren: Halten Sie alle experimentellen Bedingungen identisch mit denen in der FR Zeitplan (siehe Schritt 2.3), mit Ausnahme erhöhen die Antwortpflicht oder Kosten innerhalb-Sitzung (dh die Anzahl der Hebelpressen erforderlich, auf dem aktiven Hebel einen einzigen ethanol reward) gemäß der folgenden Formel zu erhalten: 1, 2, 3, 4, 6, 8, 10, 12, 16, 20, 24, 28, 32 ... Hinweis: ein Beispiel für die PR-Programm wird in den Ergänzenden Code Abschnitt Dateien zur Verfügung gestellt.
- Beenden Sie die PR-Sitzung einmal 30 Minuten ohne Belohnung abgelaufen ist.
Hinweis: Der Haltepunkt als das letzte abgeschlossene Antwort Anforderung während der PR-Sitzung definiert ist.
- Verwenden Sie progressive Verhältnis (PR) plant die Motivation der Tiere zu beurteilen , eine Belohnung 14 zu konsumieren. PR ist ein operant Plan, in dem die Anzahl der Antworten eine Ansporner zu erhalten allmählich erhöht wird (in anderen Worten, haben Ratten härter für jede aufeinanderfolgende Belohnung zu arbeiten).
3. Prüfung der Vorhersagevalidität eines Operanten Modell von Selbstverabreichung von Alkohol
Hinweis: Wenn Ratten eine stabile Selbstverwaltung Basis erworben haben (siehe Schritt 2) ist es möglich, die prognostische Validität des Modells zur Beurteilung vonPrüfung der Wirksamkeit von Naltrexon, ein zur Zeit der FDA zugelassene Medikament für Alkoholabhängigkeit 20% Ethanol Selbstverwaltung zu reduzieren. Wir empfehlen Ihnen, diese Prüfung auf dem höchsten FR während des Trainings (FR2) erreicht, wenn Antworten zuverlässig hoch sind. Sobald prognostische Validität hergestellt ist, kann das Modell verwendet werden, um neue Wirkstoffkandidaten zu bewerten.
- Vor dem Testtag geben Ratten, welche subkutane Kochsalzinjektionen 30 Minuten vor der Selbstverwaltung Sitzungen, um sie während mindestens zwei aufeinander folgenden Selbstverwaltung Sitzungen oder bis zu reagieren für Ethanol auf die Injektion eingewöhnen wird nicht durch die Saline-Injektionen betroffen (wie keine Änderung definiert mehr als 15% in der Gesamtzahl der Belohnungen während der letzten 2 Sitzungen verdient).
- Man löst Naltrexon in Kochsalzlösung und der pH-Wert der Neutralität zu erreichen, die Injektionen an die Tiere zu erleichtern. Spritzen Sie das Medikament mit einem Volumen von 1,0 ml / kg 30 min vor einer Sitzung, die mittels subkutaner Verabreichung verwendet wird. Hinweis: Der Literature liefert gute Hinweise für eine Dosis Wahl zwischen den Bereichen von 0,1 - 1 mg / kg, so 0,1, 0,3 und 1 mg / kg in diesem Protokoll verwendet werden.
Hinweis: Forschung Verwendung beider subkutane und intraperitoneale Verabreichungswege für Naltrexon gibt an , obwohl ihre Wirksamkeit bei subkutaner Injektion ist 30-fach stärker , dass intraperitoneale Injektionen 15 unterscheiden. Aus diesem Grund empfehlen wir , den subkutanen Weg als die Verwendung dieser Route für die Injektion von Naltrexon von verschiedenen Laboratorien in einem Konzentrationsbereich zwischen 0,1 und 1 mg / kg 12,15,16 validiert und repliziert wurde mit. - Während Testtag injizieren Ratten in einem ausgewogenen / zufälliger Reihenfolge in einem Zwischensubjekt Design über einen der vier Naltrexon Dosiervorgänge (0, 0,1, 0,3 und 1 mg / kg) 30 Minuten vor der Selbstverwaltung Sitzung.
- Zwischen jedem Dosierungszyklus erlauben Ratten das Medikament mit einem Minimum von zwei aufeinander folgenden Selbstverwaltung Sitzungen der Auswaschung oder bis zu reagieren fürEthanol ist zurück zum Ausgangswert. Hinweis: Im Ergebnis am Ende des Tests werden alle Ratten, die mit jeder der vier Dosen injiziert wurden.
- Nach dieser Phase, wählen Sie die effizienteste Dosis (1 mg / kg) und testen Sie die Wirkung von Naltrexon auf die Motivation der Tiere Alkohol mit einem progressiven Verhältnis Zeitplan zu verbrauchen (siehe Schritt 2.12).
Ergebnisse
Abbildung 1 zeigt die repräsentative Selbstverwaltung Verhalten von operant- und drogen naive Wistar - Ratten (acht verschiedene Kohorten auf insgesamt 239 Ratten in Höhe) trainiert auf einem FR1 Zeitplan selbst zu verabreichen 20% Ethanol ohne Wasserentzug oder Saccharin / Saccharose - Fading während 30-Minuten-Sitzungen. Mit diesem Protokoll Ratten initiieren Hebel drücken eine Ethanol Belohnung sehr schnell zu erhalten, bereits mehr als 10 Belohnungen zu erhalten ...
Diskussion
Mit diesem Protokoll präsentieren wir eine neue Methode zu erwerben und zu pflegen stabile orale Selbstverabreichung von 20% Ethanol bei Ratten, die, im Gegensatz zu den klassischen Modellen von Ethanol Selbstverwaltung, nicht die Verwendung von Wasserentzug erfordern, erweiterten Zugang zur Ausbildung oder Saccharin / Saccharose - Fading 12. Darüber hinaus Naltrexon, ein zur Zeit der FDA zugelassene Medikament für Alkoholabhängigkeit, nimmt erfolgreich Selbstverabreichung von Alkohol und die Motivation A...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der schwedischen Research Council unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
Referenzen
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten