Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método para evaluar las propiedades reforzantes de etanol en ratas sin privación de agua, la sacarina o el desvanecimiento de Formación Extended Access
En este artículo
Resumen
Este protocolo describe un nuevo y eficiente método para iniciar rápidamente operante de responder durante etanol en ratas que, contrariamente a los métodos estándar, no requiere privación de agua o sacarina / sacarosa desvanecimiento para iniciar de responder.
Resumen
métodos de auto-administración oral operantes se utilizan comúnmente para estudiar las propiedades de refuerzo de etanol en los animales. Sin embargo, los métodos convencionales requieren la sacarina / desvanecimiento sacarosa, privación de agua y / o de formación extendida para iniciar operante de responder en ratas. En este trabajo se describe un nuevo y eficiente método para iniciar rápidamente operante de responder durante el etanol que sea conveniente para los experimentadores y no requiere privación de agua o sacarina / desvanecimiento sacarosa, eliminando así el factor de confusión potencial del uso de edulcorantes en los estudios de autoadministración operante de etanol. Con este método, las ratas Wistar típicamente adquirir y mantener la auto-administración de una solución de etanol al 20% en menos de dos semanas de entrenamiento. Además, las concentraciones y las recompensas de etanol en sangre se correlacionan positivamente para una sesión de autoadministración 30 min. Por otra parte, la naltrexona, un medicamento aprobado por la FDA para la dependencia del alcohol que se ha demostrado que suprimir el etanol autoadministraciónen roedores, dependiente de la dosis disminuye la ingesta de alcohol y la motivación para consumir alcohol en las ratas la auto-administración de etanol 20%, validando así el uso de este nuevo método para estudiar las propiedades de refuerzo de alcohol en ratas.
Introducción
El desarrollo de modelos animales para el estudio de los efectos reforzantes de las drogas ha demostrado ser una herramienta importante para estudiar la adicción a las drogas humano. Más específicamente, operante autoadministración es un modelo de comportamiento ampliamente utilizado que es uno de los medios más eficaces para la evaluación de los efectos de refuerzo positivos de una solución de etanol consume por vía oral. Una cuestión temprano con el desarrollo de un modelo de este tipo era el sabor aversivo primaria de altas concentraciones de etanol para la mayoría de los roedores, un fenómeno que también se comparte en seres humanos con poca o ninguna experiencia con alcohol 1. Un protocolo estándar para superar esta barrera requiere privación de agua y / o sacarina o sacarosa decoloración durante la adquisición y mantenimiento de auto-administración. Sin embargo, estos dos enfoques no son ventajosas. Se requieren largos periodos de entrenamiento para iniciar simplemente responder de etanol y obtener una tasa de éxito relativo de adquisición. El uso de edulcorantes también introduce un sesgo potencial enla interpretación de los datos de la auto-administración. Estas limitaciones no se aplican con el siguiente protocolo.
En pocas palabras, Samson et al 2 han demostrado que la disolución de etanol en una solución dulce de sacarosa al 20% y luego desapareciendo la dulzura más de 4 semanas de entrenamiento se requiere para iniciar la respuesta de 10% de etanol en agua. Además, la ingesta de etanol fiable se consigue normalmente en 6 a 8 semanas 1-3. Este enfoque es muy problemático. En primer lugar, se requiere de largos períodos de entrenamiento antes investigadores pueden comenzar a medir el etanol autoadministración. Por el contrario, intravenosa autoadministración de cocaína o heroína requiere el 0 - 1 días de entrenamiento antes del fármaco en una palanca de la entrega de alimentos en animales destinados al consumo restringido y estable de responder durante la droga se consigue a menudo en 10 - 12 días 4,5. Otra limitación de este método es el hecho de que la sacarina y la sacarosa son altamente gratificante a ratas y provocan patrones de activación cerebral similar a drogas de abuso, introduciendo de este modo la posibilidad de factores de confusión en etanol autoadministración estudia 6-9. Por último, las ratas adquisición de la auto-administración de una solución de etanol mediante este método muestran variabilidad en la velocidad de adquisición y la respuesta de 1,10, con una proporción sustancial de las ratas excluidos consistentemente a partir de experimentos debido a la adquisición de éxito y / o tasa de respuesta insuficiente.
Por el contrario, con este protocolo, se presenta un método simple pero eficiente para la adquisición y mantenimiento de auto-administración por vía oral de un etanol al 20% en solución acuosa que no requieran la privación de agua, sacarosa / sacarina desvanecimiento o formación de acceso extendida. Una investigación reciente encontró que la auto-administración de etanol por vía oral muestra una curva de respuesta a la dosis en forma de U invertida con la más alta la ingesta de etanol durante la auto-administración en una concentración de etanol 20%, proporcionando así una base lógica para la selección de solución de etanol al 20% en nuestra experimdiseño ental 11.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos se llevaron a cabo de acuerdo con la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio.
1. Cuidado de Animales y Vivienda
- A su llegada a la colonia, las ratas macho Wistar casa peso de 200 g - 225 g a la llegada de dos en dos en una temperatura (21 ° C) y humedad controladas con un ciclo de luz-oscuridad de 12 h invertido.
Nota: Dependiendo de la razón de ser de los experimentos, las ratas pueden ser alojados sola. - Permitir que las ratas se aclimaten a los viveros y el ciclo de luz durante al menos una semana antes de iniciar un experimento y manejan a diario. Pesar los animales una vez por semana.
- Dar libre acceso a las ratas Chow y agua del grifo durante la duración del experimento (privación de agua no es necesario iniciar responder 12). Llevar a cabo todas las pruebas de comportamiento durante la fase oscura del ciclo de luz-oscuridad en una habitación oscura prueba.
Nota: A pesar de que habitualmente utilizamos jóvenes adultos ratas Wistar machos (días postnatales 62 - 65), esta pROTOCOLO puede teóricamente ser adecuado para la investigación de otras cepas de ratas, así como las diferencias de sexo y / o edad.
2. Formación operante
- Llevar a cabo todo el entrenamiento del comportamiento y las pruebas en cámaras operantes idénticos medición de 30,5 × 29,2 × 24,1 cm y que contiene suelos de rejilla y sartenes de residuos alineados con ropa de cama (se cambia entre los animales para reducir señales del olor), alojados en cubículos que atenúan el sonido equipados con extractores de aire para la ventilación .
Nota: Las ratas son entrenados por operante acondicionado de día 1 de formación (una respuesta sobre una palanca es necesario obtener un reforzador) entre + 1 h y + 8 h del ciclo de oscuridad. No hay pre-exposición al alcohol, ni alimentos o conformación de líquidos antes de la formación de alcohol. - Equipar cada cámara operante con luces de estímulo, bombas de jeringa y dos palancas retráctiles colocados lateralmente a un receptáculo de copa líquido. cámaras de interfaz y control por parte de un ordenador con el software adecuado.
Nota:La mayoría de los vendedores ofrecerán paquetes de auto-administración que contienen todos los componentes necesarios, así como el software y las interfaces necesarias para controlar las cámaras. - Escribir un programa operante acondicionado que inicia el programa de razón fija (FR) de 20% de etanol refuerzo (un calendario operante en el que se refuerza una respuesta solamente después de un número especificado de respuestas) según las instrucciones del fabricante. Por ejemplo, en una razón fija 1, las ratas tienen para producir una respuesta para obtener un reforzador (ver la sección de archivos de código suplementario para un ejemplo de un programa FR1). Ejecute los siguientes comandos.
- Se extienden dos palancas para marcar el inicio de la sesión y para indicar la disponibilidad de alcohol.
Nota: Una prensa de palanca de la palanca asociada con etanol (activo) es recompensado por la entrega de un volumen de 100 l de etanol al 20% en agua en el adyacente pozo de agua potable e inicia a 5 s período de tiempo de espera concomitante señalado por el iluminación de lacue-luz por encima de la palanca. La señal de luz se introduce en el día 1 del entrenamiento. - Durante el período de tiempo de espera, ficha responder aunque no tiene consecuencias programadas. Anote las respuestas en la otra palanca (inactivo) a pesar de que nunca tienen consecuencias en el comportamiento. Nota: La palanca inactiva sirve como control para evaluar el comportamiento no específica.
- Registre el número de respuestas en la palanca activa (tasa de respuesta) y el número de 20% de etanol premios ganados.
- Después de que hayan transcurrido 30 minutos, retire las dos palancas para indicar el final de la sesión y para señalar el final de la disponibilidad de alcohol.
- Guardar y archivar todos los datos.
- Se extienden dos palancas para marcar el inicio de la sesión y para indicar la disponibilidad de alcohol.
- Antes de iniciar la sesión de entrenamiento, verificar el buen funcionamiento de todos los dispositivos en cada cámara operante (palancas retráctiles, dispensador de fluido).
- Preparar la solución de etanol v / v 20% a partir de 190 Proof (95%) de etanol diluido en el agua del grifo.
Nota: La solución de etanol se puede mantener a temperatura ambiente. Dependientedel fabricante, las soluciones de stock de etanol pueden ser de hasta el 99,98%. También tenga en cuenta que, si bien en los manuscritos más publicados, las concentraciones de etanol se suelen presentar como volumen / volumen, algunos pueden presentarlos como peso / volumen. - Llene la jeringa con la solución de etanol al 20% y asegurarse de que no hay fugas o burbujas de aire en los conductos de infusión. Empuje manualmente un pequeño volumen de etanol a través de las líneas de infusión para asegurarse de que el etanol será entregado correctamente en el receptáculo de la primera respuesta reforzada. Secar el recipiente con una toalla de papel y asegúrese de que está vacío antes de iniciar la sesión.
- Cargar el software que controla el programa de FR de refuerzo etanol 20%
- Tren operant- y ratas ingenuo con las drogas bajo un horario FR1 para autoadministrarse 20% de etanol sin privación de agua durante 30 sesiones min.
- El transporte de las ratas del vivero a la sala de pruebas utilizando una jaula de transporte.
- Asignar a cada rata a una cámara.Tome cada rata individual de la jaula de transporte y lo puso en la cámara de auto-administración asignado.
- Trate de mantener las condiciones del experimento consistente cada día. Por lo tanto, se recomienda probar las ratas en la misma cámara autoadministración aproximadamente a la misma hora todos los días.
- Iniciar el software que inicia el programa de FR1 de refuerzo de etanol 20%.
- Al final de la sesión, eliminar las ratas de las cámaras de auto-administración y devolverlos a los viveros.
- Con el fin de confirmar manualmente que la solución de alcohol es consumido por los animales, usar una toalla de papel y compruebe si se seca el receptáculo. Alternativamente, utilice una jeringa de 1 ml o 2 y recoger el fluido que queda en el recipiente para estimar el volumen que no se consume.
Nota: Para obtener una medición más precisa (pero también más caro), es posible equipar cada cámara con un sistema de lickometer conectado al receptáculo de copa líquido que permite un recuento exacto de la lamers producida por las ratas durante la sesión de autoadministración. - Limpiar las paredes y el suelo de rejilla de cada cámara con un desinfectante de superficies.
- Después de su uso, mantener las líneas de infusión, limpiándolas con una solución de etanol al 70%. Cuando no está en uso, inserte la tapa para evitar el moho y polvo.
- Después de cada sesión, recopilar y analizar los datos generados. Más en particular, el cálculo de la media del número de pulsaciones de palanca activa, el número medio de recompensas de alcohol obtenido, así como el número medio de prensas de palanca inactivos.
Nota: En la mayoría de los papeles, el consumo de alcohol también se presenta como la ingesta de etanol en g / kg (peso corporal). la ingesta de etanol se puede calcular utilizando la siguiente fórmula:
Con el volumen consumido (ml) - número de premios ganados ± unitaria volumen / recompensa y la densidad del etanol a temperatura ambiente - 0,789 g / ml.
Por ejemplo, si una rata con un peso 400 g ganado 20 rewards de solución v / v de etanol 20%: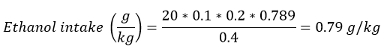
- Llevar a cabo sesiones de 5/6 días a la semana hasta que se estabilice el rendimiento (que se define como un mínimo de 15 sesiones y ningún cambio mayor del 15% en el número total de premios ganados durante las últimas 3 sesiones).
Nota: Una vez ratas han alcanzado una línea de base estable en FR1, el programa de condicionamiento operante puede ser modificado de acuerdo con las instrucciones del fabricante para aumentar el número de respuestas necesarias para obtener una recompensa alcohol. El de proporción fija puede, por ejemplo, puede aumentar a FR2 o FR3 el fin de minimizar refuerzo accidental. - Medir las concentraciones de etanol en la sangre:
- Para confirmar que los premios obtenidos en una sesión de autoadministración son consumidos por las ratas, medir las concentraciones de etanol en la sangre después de autoadministración. Una vez que las ratas han alcanzado una línea de base estable, recoger la sangre de la vena lateral de la cola inmediatamente después deLa sesión. Inserte una aguja 23 G en el vaso sanguíneo y recoger muestras de sangre de 50 l usando un tubo capilar.
- La transferencia de las muestras de sangre 50 mu l a 10 viales de espacio de cabeza ml y añadir 50 l de 1: 1.000 alcohol de isopropilo como patrón interno. Preparar una curva patrón de 10 a 300 mg / dl a partir de los estándares de etanol. Muestras de proceso con un muestreador de espacio de cabeza con una columna de cromatografía de 13 acuerdo con los ajustes del fabricante.
- relación progresiva
- Utilizar los programas progresivos relación (PR) para evaluar la motivación de los animales para consumir una recompensa de 14. PR es un calendario operante en el que se incrementa el número de respuestas para obtener un refuerzo gradual (en otros términos, las ratas tienen que trabajar más duro para cada recompensa sucesivas).
Nota: Al contrario de FR sesiones, una sesión de PR no se mide el tiempo y sólo se dará por terminada una vez que haya transcurrido 30 minutos sin una relación completado.- Coloque las ratas en sus cajas operantes asignados y permitirque les permite responder de etanol al 20% en virtud de un programa de relaciones públicas de refuerzo: Mantener todas las condiciones experimentales idénticas a las utilizadas en el programa de FR (véase el paso 2.3), excepto aumentar el requisito de respuesta o de costos dentro del período de sesiones (es decir, el número de prensas de palanca requerida en la palanca activa para recibir una sola recompensa etanol) de acuerdo con la siguiente fórmula: 1, 2, 3, 4, 6, 8, 10, 12, 16, 20, 24, 28, 32 ... Nota: un ejemplo de la programa de RP se proporciona en la sección de archivos de código suplementario.
- Terminar la sesión de relaciones públicas, una vez que haya transcurrido 30 minutos sin una recompensa.
Nota: El punto de ruptura se define como el último requisito de respuesta completado durante la sesión de PR.
- Utilizar los programas progresivos relación (PR) para evaluar la motivación de los animales para consumir una recompensa de 14. PR es un calendario operante en el que se incrementa el número de respuestas para obtener un refuerzo gradual (en otros términos, las ratas tienen que trabajar más duro para cada recompensa sucesivas).
3. Comprobación de la validez predictiva de un modelo operante de la autoadministración de alcohol
Nota: Una vez que las ratas han adquirido una línea de base autoadministración estable (ver paso 2), es posible evaluar la validez predictiva del modelo deprobar la eficacia de la naltrexona, un medicamento aprobado actualmente por la FDA para la dependencia del alcohol en la reducción de 20% de etanol autoadministración. Se recomienda realizar esta prueba en el más alto alcanzado durante el entrenamiento FR (FR2), cuando las respuestas son confiablemente alta. Una vez que se establece la validez predictiva, el modelo se puede usar para evaluar nuevos candidatos a fármacos.
- Antes de días de prueba, dar ratas inyecciones de solución salina subcutánea 30 minutos antes de las sesiones de auto-administración a habituarse a la inyección durante un mínimo de dos sesiones de auto-administración consecutiva o hasta que la respuesta para el etanol no se ve afectada por las inyecciones de solución salina (definidos como ningún cambio superior al 15% en el número total de premios ganados durante las últimas 2 sesiones).
- Disolver naltrexona en solución salina y ajustar el pH para alcanzar la neutralidad para facilitar las inyecciones a los animales. Inyectar el fármaco en un volumen de 1,0 ml / kg 30 min antes de una sesión, utilizando la vía de administración subcutánea. Nota: El litrotura proporciona una buena evidencia de una elección dosis entre los rangos de 0,1 - 1 mg / kg, por lo que 0,1, 0,3 y 1 mg / kg se utilizan en este protocolo.
Nota: La investigación indica uso de ambas vías subcutánea e intraperitoneal de administración de naltrexona, aunque su potencia puede diferir con ser la inyección subcutánea 30 veces más potente que las inyecciones intraperitoneales 15. Por esta razón, se recomienda utilizar la vía subcutánea como el uso de esta ruta para la inyección de naltrexona ha sido validado y replicado por varios laboratorios en un rango de concentración entre 0,1 y 1 mg / kg 12,15,16. - Durante día de la prueba, se inyectan las ratas en un orden equilibrado / random en un diseño entre sujetos a través de uno de los cuatro ciclos de naltrexona de dosificación (0, 0,1, 0,3 y 1 mg / kg) 30 min antes de la sesión de autoadministración.
- Entre cada ciclo de dosificación, permiten que las ratas al lavado con el fármaco con un mínimo de dos sesiones de auto-administración consecutivos o hasta que responder duranteel etanol es de nuevo a la línea de base. Nota: Como resultado de ello, al final de la prueba, todas las ratas se han inyectado con cada una de las cuatro dosis.
- Después de esta fase, seleccionar la dosis más eficiente (1 mg / kg) y probar el efecto de la naltrexona sobre la motivación de los animales para consumir alcohol utilizando un programa de razón progresiva (véase el paso 2,12).
Access restricted. Please log in or start a trial to view this content.
Resultados
La Figura 1 muestra la conducta de autoadministración representante de ratas Wistar operant- y las drogas ingenuo (ocho cohortes diferentes que asciende a un total de 239 ratas) formados en un horario FR1 la autoadministración de etanol al 20% y sin privación de agua o sacarina / desvanecimiento sacarosa durante sesiones de 30 minutos. Con este protocolo, las ratas inician presionar una palanca para obtener una recompensa de etanol muy rápidamente, ya la obtención d...
Access restricted. Please log in or start a trial to view this content.
Discusión
Con este protocolo, estamos presentando un nuevo método para adquirir y mantener estable oral de la autoadministración de 20% de etanol en ratas que, contrariamente a los modelos clásicos de etanol autoadministración, no requieren el uso de la privación de agua, la formación de acceso extendida, o sacarina / sacarosa desvanecimiento 12. Por otra parte, la naltrexona, un medicamento aprobado actualmente por la FDA para la dependencia del alcohol, disminuye eficazmente la autoadministración de alcohol y ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Consejo de Investigación sueco.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
Referencias
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados