Method Article
隔离和脂肪干细胞分化的猪从皮下脂肪组织
摘要
This protocol describes the isolation of pig adipose-derived stem cells (pADSC) from subcutaneous adipose tissues with examination of multipotency. The multipotent pADSC are used to delineate processes of adipocyte differentiation and study transdifferentiation into multiple cell lineages of mesodermal mesenchyme or further lineages of ectoderm and endoderm for regenerative studies.
摘要
Obesity is an unconstrained worldwide epidemic. Unraveling molecular controls in adipose tissue development holds promise to treat obesity or diabetes. Although numerous immortalized adipogenic cell lines have been established, adipose-derived stem cells from the stromal vascular fraction of subcutaneous white adipose tissues provide a reliable cellular system ex vivo much closer to adipose development in vivo. Pig adipose-derived stem cells (pADSC) are isolated from 7- to 9-day old piglets. The dorsal white fat depot of porcine subcutaneous adipose tissues is sliced, minced and collagenase digested. These pADSC exhibit strong potential to differentiate into adipocytes. Moreover, the pADSC also possess multipotency, assessed by selective stem cell markers, to differentiate into various mesenchymal cell types including adipocytes, osteocytes, and chondrocytes. These pADSC can be used for clarification of molecular switches in regulating classical adipocyte differentiation or in direction to other mesenchymal cell types of mesodermal origin. Furthermore, extended lineages into cells of ectodermal and endodermal origin have recently been achieved. Therefore, pADSC derived in this protocol provide an abundant and assessable source of adult mesenchymal stem cells with full multipotency for studying adipose development and application to tissue engineering of regenerative medicine.
引言
肥胖,目前人口在美国,与身体质量指数的约30%,比30,已经成为一个普遍的世界性的现象1。肥胖容易导致并发症包括心血管疾病,2型糖尿病和癌症2-4。因此,对付肥胖是一个重要的优先事项。肥胖是由脂肪组织的大规模扩张显现出来,是由于过多的食物消费,并在现代社会久坐不动的生活方式。因此,破译脂肪形成和脂肪生成的转录调控可能有希望来治疗肥胖或糖尿病5。
在3T3-L1,3T3-F442A和其它小鼠成脂细胞系已应用于脂肪组织发育过程中,研究脂肪生成或脂肪生成。但是,也有在体外细胞系和动物体内 6之间的调节机制的一些差异。原发性脂肪DERIVED干细胞(ADSC)中的基质血管细胞级分可以直接从白色脂肪组织中分离和诱导分化。 ADSC分化为脂肪细胞很可能概括在脂肪组织发育脂肪形成和脂肪生成的体内 7的过程。
猪在脂肪组织发育研究脂肪形成和脂肪生成一个合适的动物模型。我们以前的猪的研究8-10表明,固醇调节元件结合转录因子1C(SREBP1c),已知调节脂肪生成脂肪酸合酶的转录的重要转录因子的表达,由多不饱和脂肪酸(PUFA)中的猪肝脏抑制和脂肪组织。猪SREBP1c由多不饱和脂肪酸在体内和体外降低的表达是类似的其他物种,例如人类和小鼠11-13。 在体外 ,这些猪的研究主要在差异从猪ADSC(pADSC)衍生erentiated脂肪细胞。因此,pADSC这种初级细胞培养可用于充当可靠的蜂窝系统来研究脂肪组织发育或其它干细胞的应用。
研究方案
注意:此方法已经建立,并在研究中使用先前报道的来自这个实验室14-17;随着时间的推移的方法进行了修改。使用60g的猪皮下脂肪组织的平均从一个仔猪(7-9天龄)与6孔组织培养板中接种,进行当前过程。在RT,除非另有指定进行的所有过程。所有动物实验的机构动物护理和使用委员会(IACUC)在台大批准。
1.准备中消化
- 获得从颈部和背部的皮下脂肪组织; 40至80%的仔猪克(7-9天龄),视猪的大小。在这里,使用60克从一头猪获得皮下脂肪组织中。
- 制备消化介质:称胶原酶II粉末共54,000单位和在90ml的Dulbecco改良Eagle培养基溶解(DMEM,在100毫升血清瓶中60克脂肪)(900个单位的胶原酶/ 1.5的10ml DMEM / g的脂肪)。
- 轻轻搅动上的振动台(100转)消化介质至少15分钟以溶解,然后通过0.22μm过滤器进行灭菌通过消化介质。使用前在4℃保存。
2.解剖皮下脂肪组织从猪
- 在使用前消毒所有仪器,玻璃和塑料制品和温暖所有的媒体至37℃。
- 牺牲与电击晕和放血或通过根据本地IACUC规使用的方法中的仔猪。仔细立即执行清扫仔猪被牺牲了。
- 躺在干净的手术台上的小猪(背面朝上和腹部向下)。从仔猪背面除去从颈部所有头发尾部和两侧向下中线剃去毛发。
- 擦洗7.5%聚维酮猪的背部皮肤碘三次(具有三个新的独立-磨砂),然后使碘坐皮肤的表面上约10分钟。
- 用70%乙醇的多个喷雾剂除去碘伏。用纱布垫或含70%的乙醇擦拭皮肤在一个方向上,重复直到碘伏没有明显的颜色被观察到的组织的文件。
- 使用手术刀皮下脂肪组织的猪背脂肪层与来自肌肉,同时使用镊子皮肤阻碍了脂肪和连接的皮肤层一起分离。
- 立即浸入附着皮肤的皮下脂肪组织中的脂肪层在含有无血清DMEM的无菌烧杯(200毫升)中。
- 喷洒含有用70%的乙醇和发生在一个层流细胞培养罩脂肪层烧杯的外部。放置一个大(40厘米×30厘米)灭菌三层盖处于罩箔。 [A三层是用来确保持续的完整性。]
- 放置组织与皮肤朝下到盖箔。
- 修剪剩余肌肉组织关闭使用镊子和剪刀,以避免与肌肉组织的污染的脂肪组织的。
- 切脂肪转化为见方的小块(〜7厘米×7厘米)用手术刀或剪刀。将这些碎片脂肪层进入含无血清DMEM新灭菌烧杯(200毫升)中。
- 上设置与碳钢切片机刀片( 图1)装配在覆盖箔定制片保持器。拿一块肥肉了烧杯,并把它切片机(下面顶部和脂肪层皮肤层)。
- 切片皮下脂肪组织的脂肪层到大约1mm厚的片。切片从皮肤尽可能接近脂肪层,但避免切片皮肤。
- 剁碎切片脂肪组织用剪刀尽可能细。
- 含有胶原酶过滤消化培养基添加到250毫升三角瓶中或血清学瓶剁碎脂肪组织(54000单位胶原酶/ 90的10ml DMEM / 60克脂肪)。
- 孵育,并在37℃下摇动Erlenmeyer烧瓶在45转在轨道摇床90分钟,以允许胶原酶消化组织。
注意:检查每15至30分钟,以避免过度消化。如果消化培养基是无显著组织团块的浆料的消化过程完成。 - 添加含有DMEM / F12,用10%胎牛血清(FBS)的培养基等体积(等于消化培养基)以停止胶原酶消化。

从猪背部皮下脂肪组织图1.用于pADSC的隔离定制的限幅器。解剖的脂肪组织组成附着皮肤层的脂肪层。切片机需要切片脂肪层约为1毫米厚与避免过度切片进入皮肤层。从左至右依次为:切片持有人,切片机垫,碳钢切片机刀片,和螺丝。切片机刀片插入片架和组装时切片垫之间。 请点击此处查看该图的放大版本。
从间质血管分数pADSC的3集
- 通过薄纱的单层到干净无菌250ml锥形烧瓶或250毫升血清瓶中传递包含消化脂肪组织的消化培养基。使用镊子按压雪纺中间的指导和协助消化通过。
- 排水和捻雪纺用镊子来完成通道。
- 分发消化介质分为四个50ml锥形离心管(每个管40毫升培养基)。
- 离心机在700×g离心10分钟以收集基质血管细胞的沉淀。
- 倒出上清,而不会干扰颗粒除去大部分含有成熟脂肪细胞上的脂肪层。通过加入10ml的DMEM到每个管中重悬以移液和管轻轻摇动沉淀洗涤沉淀。
- 离心在700 xg离心6分钟。倒出上清液。
- 加入10 mL ACK裂解液,然后悬浮吹打沉淀。让它静置在RT 7分钟(5至10分钟)以裂解红血细胞中的基质血管级分。
- 添加的DMEM(10毫升)中的等量停止与管轻轻摇动反应,然后在700 xg离心离心10分钟。
- 倒出上清液,加入10 mL的DMEM到每个管中,重悬反复吹打沉淀,并离心分离,在700×g离心6分钟。重复两次。
- 收集并通过100微米的过滤器通过与悬浮的细胞的DMEM(从代表60克脂肪4管总为40ml DMEM)到一个新的50ml锥形管中。
- 轻轻吸管MEDI嗯几次在一个新的1.5毫升的微量试管拌匀等分试样20微升180微升的0.4%台盼蓝溶液(1:10稀释)混合含有细胞的培养基。
- 计数与血球然后种子pADSC将细胞在60,000个细胞/ cm 2的密度到培养皿或板用含有DMEM / F12,10%胎牛血清(FBS)和青霉素的1%的抗生素的培养基所希望的大小-streptomycin-两性霉素B溶液(P / S / A)。一般地,种子上为脂肪细胞或骨细胞分化的6孔组织培养板的pADSC。种子10厘米的菜干细胞或软骨细胞分化的表面标志物染色pADSC。
- 孵育在37℃培养箱中空气,5%CO 2将板或菜肴,以允许细胞附着于板。
4.识别干细胞表面流式细胞仪pADSC的标记
- 24小时后,彻底清除介质,洗个用磷酸盐缓冲盐水(PBS),并收获细胞用1ml 0.25%胰蛋白酶-EDTA的5分钟,在37℃E-10-cm培养皿两次。
- 中和胰蛋白酶-EDTA用等量培养基(1ml)中的,收集细胞在新的15毫升锥形管,然后在400×g下离心7分钟。
- 倒出上清液。在400 xg离心移液加上离心7分钟洗涤沉淀两次3毫升冰冷FCS洗涤缓冲液(含有10%FBS的PBS),使用再悬浮。
- 悬浮,计数,并在冰冷FCS的洗涤缓冲液调整pADSC至10 6个细胞/ ml。位置细胞(100微升/每个管)成多个新的15毫升锥形管中,并培育含有pADSC管在4℃下用抗藻红蛋白缀合的CD4A(CD4A-PE),CD29-PE,CD31-PE抗体30分钟,CD44-PE,CD45-PE,CD90-PE,MHC I-PE或MHC II-PE直接染色。通过在10毫升的FCS的洗涤缓冲液加上400×g下centrifugat洗涤细胞两次终止反应离子为7分钟。
- 固定,并根据制造商的说明,我们的先前出版物18悬浮在固定缓冲液的细胞(PBS含0.01%FBS和1%甲醛)进行流式细胞。
5.分化pADSC的成脂肪细胞,骨细胞和软骨细胞
- pADSC分化成脂肪细胞
- 准备脂肪细胞诱导培养基和脂肪细胞维持培养基
- 为脂肪细胞诱导培养基,制备1升的无血清的DMEM / F12(具有1%的抗生素的P / S / A)含有以下内容:1毫升胰岛素库存(10毫克/毫升的HEPES缓冲液,pH 8),终浓度= 10微克/毫升; 1μl的T3库存(3,3',5-三碘左旋甲腺氨酸,1mM的在DMSO中),终浓度= 1nM的; 200微升转股票(50毫克/毫升双蒸H 2 O),终浓度= 10微克/毫升; 100微升地塞米松原料(10毫米乙醇),终浓度= 1μM; 100微升罗格列酮的股票(10毫米DMSO),终浓度= 1μM。
- 制备脂肪细胞维持培养基使用相同的增补的诱导培养基,但与地塞米松的遗漏。
- 对于脂肪细胞分化过程
注意:在6孔板接种pADSC后,pADSC将72小时内汇合。- 3天后,完全除去介质,然后添加3毫升脂肪细胞诱导培养基的每孔。返回所述板的孵化器, 这是分化的零天。
- 3天后,完全除去脂肪细胞诱导培养基并用3ml的脂肪细胞维持培养基的每三天更换。成熟脂肪细胞将约9天终末分化。脂肪细胞的90%以上都采用这种协议高分。这些脂肪细胞已经准备好油红O染色。
- 准备脂肪细胞诱导培养基和脂肪细胞维持培养基
- pADSC分化成骨细胞
- 准备骨细胞诱导培养基:完全培养mediu米(DMEM / F12有10%FBS和1%P / S / A),含有1μM的地塞米松,10mM的β-甘油和50μg/ ml的抗坏血酸-2-磷酸。
- 对骨细胞分化过程
注意:在6孔板接种pADSC后,pADSC将72小时内汇合。- 3天后,完全除去介质并加入3毫升骨细胞诱导培养基的每孔。返回所述板到37℃培养箱。这是分化的零天。
- 与骨细胞诱导培养基替换每三天。成熟的骨细胞将分化后的14天内形成。这些骨细胞已经准备好茜素红S染色。
- pADSC分化为软骨细胞
- 制备软骨细胞诱导培养基:含有αMEM1%FBS,6.25微克/毫升的胰岛素,50μg/ ml的抗坏血酸-2-磷酸,和10ng / ml的转化生长因子β1。
- 软骨细胞分化过程
- 上10厘米培养皿播种pADSC 24小时后,完全除去培养基并用PBS洗碗两次。
- Trypsinize pADSC用1ml 0.25%胰蛋白酶-EDTA的5分钟,然后中和用1ml培养基。收集,计数并在15ml锥形管中,每管2.5×10 5个细胞的密度调整pADSC。使用血细胞计数器计数细胞。
- 在400×g下进行7分钟离心后,弃去上清液而不扰乱小球,并在15毫升管加入1ml软骨细胞诱导培养基。该管被返回到37℃培养箱。这是分化的零天。
- 更换软骨细胞诱导培养基每三天没有在底部移除细胞。成熟软骨细胞将形成在大约14天。这些软骨细胞准备好甲苯胺蓝O染色。
6.有区别的脂肪细胞,Osteocy染色TES和软骨细胞
- 油红O染色脂肪细胞分化
- 在第9天,除去脂肪细胞维持培养基中分化的脂肪细胞的6孔培养板,然后用PBS洗涤板两次。 [在以下步骤中,添加足够的指定的试剂,以覆盖6孔板的每个孔中。]
- 固定,用10%福尔马林溶液脂肪细胞至少10分钟。
- 除去10%福尔马林溶液中,用双蒸水洗涤板两次。
- 洗涤两次后,加入100%丙二醇的培养板并静置1分钟。
- 除去100%丙二醇,然后加入油红O溶液(在丙二醇中的0.5%),向培养板上。静置上轻摇(100rpm)下一个摇臂摇动至少10分钟。
- 去除油红O溶液,然后用60%丙二醇替换。静置1分钟。
- 除去60%的丙二醇,然后与D洗板两次ouble蒸馏水。
- 用10%福尔马林溶液替换。脂肪细胞内染色脂滴已经准备好通过光学显微镜观察。
- 细胞内的油红O的定量(以下可选步骤):显微镜观察后,取出10%福尔马林溶液中,用双蒸水冲洗两次盘。
- 完全排空板,并添加500μl的异丙醇中,以6孔板。
- 让异丙醇站在6孔板上的平缓摇杆摇床(100rpm)下至少10分钟,以溶解油红O的染料
- 吸入包含油红O的异丙醇并在96孔板分发。采用分光光度法读数在510 nm处量化提取的油红O。
- 茜素红S染色骨细胞分化
- 在第14天,从分化骨细胞6孔板除去骨细胞诱导培养基,并用PBS洗涤板两次。 [在followi纳克步骤,添加足够的指定的试剂,以覆盖6孔板的每个孔中。]
- 固定在10%福尔马林溶液骨细胞至少10分钟。
- 除去从每个孔的10%福尔马林溶液中,用双蒸水洗涤板两次。
- 洗涤两次后,加入2%茜素红S溶液(pH = 4.1-4.3)的6孔板,静置至少15分钟,在温和摇动摇动器(100转)。
- 去除茜素红S溶液,然后用双蒸水洗涤板两次。
- 用10%福尔马林溶液替换。骨细胞已经准备好通过光学显微镜观察。
- 甲苯胺蓝O染色的软骨细胞分化
- 在第14天,从15毫升锥形管吸出软骨细胞诱导培养基没有在管的底部用PBS除去分化的软骨细胞的沉积物和洗管两次。 [在下面的步骤,补充足够的指定试剂湾ř软骨在管子上或节幻灯片的底部。]
- 固定在10%福尔马林溶液软骨细胞至少10分钟。
- 除去从每个管的10%的福尔马林溶液中,用双蒸水洗涤管两次。
- 洗涤两次后,在厚度为5微米的嵌入OCT化合物中和部分用低温恒温器粒料。
- 染色用甲苯胺蓝O解决方案(0.1%使用pH 4.1)的冷冻切片的滑动。
- 除去甲苯胺蓝O解决方案,然后用双蒸水冲洗两次部分。
注:在幻灯片上软骨已经准备好通过光学显微镜观察。
结果
从猪背部皮下脂肪来源的pADSC接种在培养板或菜肴和图2中所示。从基质血管级分得到的pADSC的形态类似于小鼠或人的ADSC。播种后二十四小时,汇合pADSC附着并具有扩大的成纤维细胞样形态( 图2A)。该pADSC将在72小时内成为融合,并准备脂肪细胞或其他间质型分化( 图2B)。 pADSC呈现后化学诱导和成熟脂肪细胞可以分化后第9天观察到表示成脂分化( 图2C)的pADSCs超过90%的强生脂潜力。
为了解决这个协议衍生pADSC的特点,pADSC的表面标志物用流式细胞仪肛门评估ysis。正如图3所示,对于间充质干细胞,包括CD29,CD44,CD90和MHC I(或HLAⅠ)表面标记,高表达。负的表面标志物,如CD4A,CD31,CD45和MHC II类(或HLA II)为在协议( 图3)衍生pADSC几乎检测不到。这些结果表明,没有显著内皮或造血干细胞污染,包括骨髓或淋巴祖这些pADSC展览间质型干细胞的特性。
为了进一步证实pADSC代表间质干细胞,pADSC的多能进行了检查由分化成脂肪细胞,骨细胞和软骨细胞。这些脂肪细胞,骨细胞和软骨细胞被特定染料,油红O,茜素红S,和甲苯胺蓝0,分别( 图4)染色。这些数据表明,该协议生成pADSC所保留亩ltipotency以饱满的特点类似间充质祖细胞类型。
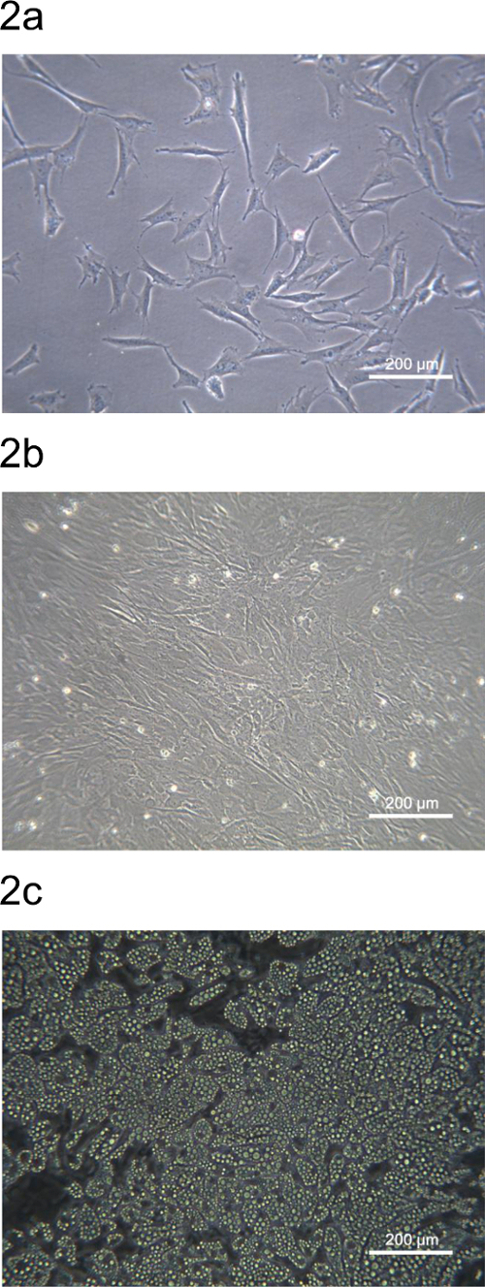
图2.从猪背膘区域pADSC形态。(A)亚汇合pADSC坚持和之后在6孔培养板24小时接种扩大。 (B)的pADSC成为后在6孔培养板72小时接种汇合。之后,从pADSC成脂分化9天的观察(C)成熟的脂肪细胞。图片拍摄于用相差显微镜放大100倍。 请点击此处查看该图的放大版本。
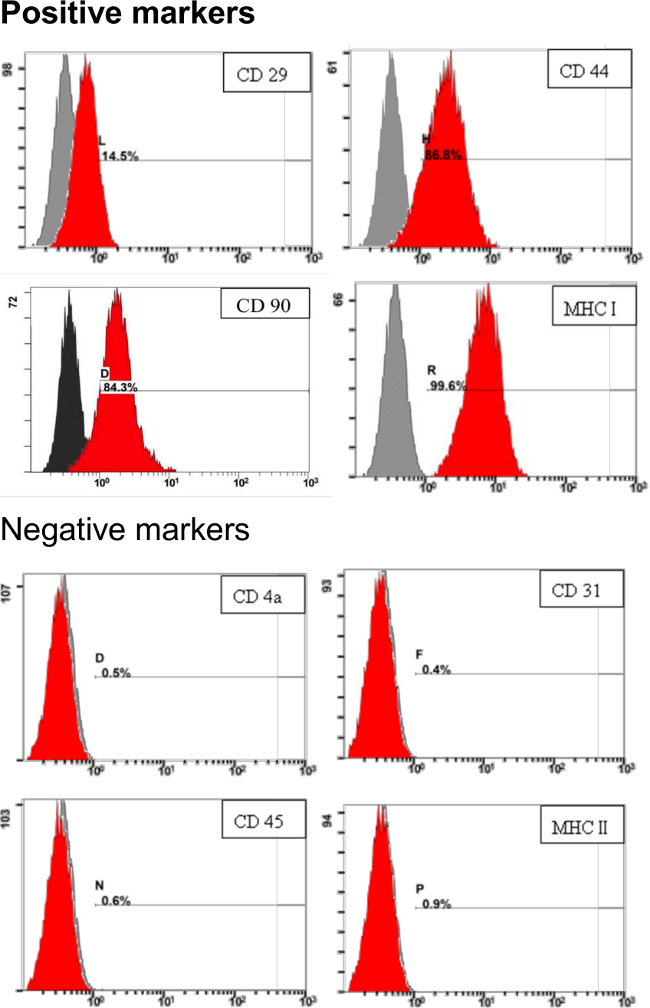
图3.干细胞的鉴定为pADSC表面标记。1×10 pADSC 5与特异性抗体反应,并通过流式细胞仪分析干细胞标记物进行分析。数字表示与未染色的对照相比染色的细胞中的人口(红色)的百分率。 x轴表示相对荧光强度。 Y轴代表细胞群体。 请点击此处查看该图的放大版本。
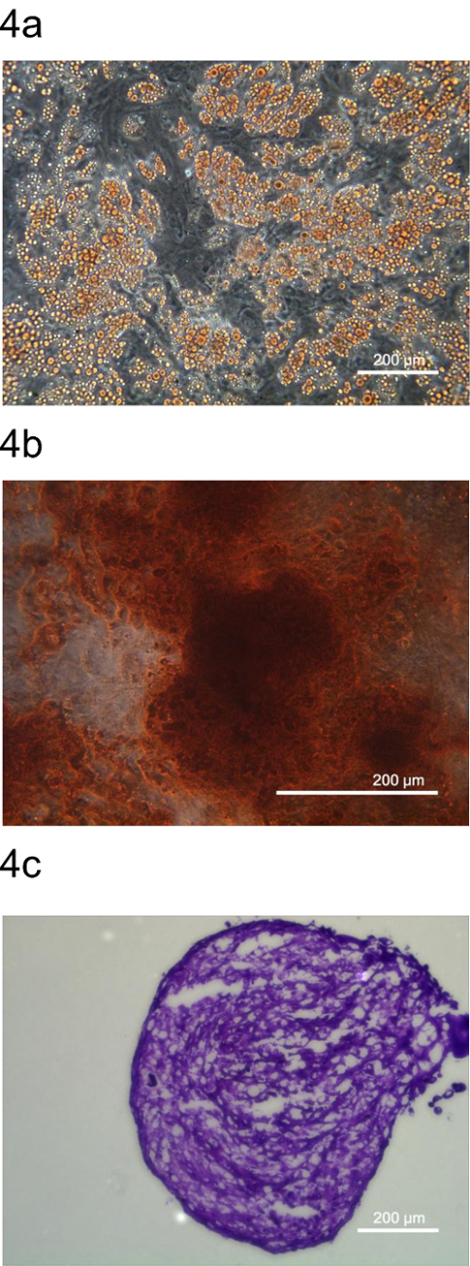
图4. pADSC的pADSC。多能的多向分化被分化成pADSC(A)脂肪细胞,(B)骨(C)确定软骨细胞和代表性的染料,分别油红O,茜素红和甲苯胺蓝0,染色。伊玛GES采取在(A)100×(B)200×,用相差显微镜(C)放大100倍,分别为。 请点击此处查看该图的放大版本。
讨论
在这里,我们提出了一个可靠的蜂窝系统来研究pADSC的原代培养脂肪组织发育。相比其他永生化细胞系,这种方法提供了一种方便的方法以分离大量可用于研究脂肪细胞或体内的相关动物发展的其他间充质细胞谱系的分化过程的高品质的成人间充质干细胞。在这个协议中的临界改性步骤是,我们使用的是7到9日龄小猪因为它很容易相比较旧的猪来处理小仔猪和类似的其他物种19,20,产量和pADSC的多能派生pADSC作为猪的年龄21降低。
潜在的干细胞的来源包括胚胎干细胞(ESC),诱导多能干细胞(IPSC)和出生后的成体干细胞。 ADSC的约束,列为成人多能干细胞,是成体干细胞的多能在区分不同谱系相对有限与ESC和iPSC的比较。然而,关于的iPSC的ESC和致癌性衍生的伦理问题制约ESC和iPSC的22,23的应用。因此,许多研究者都集中在成体干细胞,努力提高多能性。成人间充质干细胞(MSC),这早已进行了研究,其中最常见的原因是骨髓来源的间质干细胞24。然而,收获的骨髓被认为是一个比较痛苦的过程。另一个值得关注的是,干细胞从骨髓的产率有限。骨髓抽吸收率每ml 6×10 6个有核细胞的平均值,和MSC仅代表所有有核细胞的0.001〜0.01%。考虑到这些缺点后,ADSC建议作为那么突兀源获得多能干细胞25,26。
在regenera利用ADSC的限制略去药依赖,对细胞的产量和质量在很大程度上。因此,使用猪在这个协议中隔离ADSC的意义在于获得高质量的成人干细胞量大。猪是代表,因为物种间27-30可比器官大小和许多生理生化相似之处人类有益的动物模型。从商业公司获取hADSC是昂贵的,在许多情况下,细胞已被操纵,传代或冻存。获取人类临床样品是比较困难的,因为伦理问题和生产ADSC的是有限的。我们得出胶原酶消化后,每克脂肪约6×10 5 hADSC。用100g女性乳房的脂肪组织(平均取样),共6×10 7个细胞的可收获。使用单个鼠标,收率更为有限。共1×10 6个细胞可以从0.4克皮下鼠标我的收获从成年小鼠FVB的双腿nguinal脂肪组织(6-8周龄)。然而在一个单独的猪(7-9天龄),共2×10 8个细胞可以容易地由60得自背侧脂肪库获得皮下脂肪组织的收集。在这个协议产生的pADSC有充分的间充质型多能和适当的间充质干细胞标志物。因此,pADSC是有利的源获得大量的成体干细胞,而不会影响干细胞质量。
pADSC的应用并不限于破译脂肪细胞分化,包括脂肪形成和脂肪生成。最近,ADSC已成为干细胞在再生医学22,31,32领域的普遍来源。相比其他干细胞来源,ADSC保留的是方便和丰富的得天独厚的优势,以及其强大的多能已被证明是干细胞治疗和组织Ë一个有前途的来源ngineering 22,33,34。脂肪组织容易获得,使ADSC最少的侵入途径获得多能祖细胞之一。最近,我们分化pADSC成葡萄糖反应性的胰岛素分泌簇,表明pADSC不限于间叶分化(未公布的数据)。其他人也已经证明,ADSC可以分化成来自其它胚层衍生的许多细胞类型如内胚肝细胞(从hADSC 35或pADSC 36)或外胚层神经元(从hADSC 37或pADSC 38)。因此,pADSC可以通过引导细胞发散分化过程以产生期望的谱系用于高通量药物或生物材料筛选。因此,在这个协议衍生pADSC对再生医学研究,干细胞治疗和组织移植的潜在应用。
披露声明
The authors have nothing to disclose.
致谢
作者想表达感谢所有实验室成员的广泛讨论和技术,该协议支持。在实验室进行的研究是由来自科技部的资金支持(MOST 103-2314-B-002-126和MOST 102-2313-B-002-026-MY3)和从目标赠款一流大学计划国立大学,台湾(104R350144)。
材料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Collagenase, Type II | Sigma-Aldrich | C6885 | |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-001-1 | |
| Penicillin-Streptomycin-Amphotericin B (P/S/A) solution | Biological Industries | 03-033-1 | For antibiotics and antimycotic usage |
| αMEM, no nucleosides | Life Technologies | 12561-049 | |
| ACK lysis buffer | Life Technologies | A10492-01 | |
| Trypsin-EDTA (0.25%), phenol red | Life Technologies | 25200072 | |
| CD4a-PE | Sigma-Aldrich | SAB4700063 | |
| CD29-PE | Sigma-Aldrich | SAB4700398 | |
| CD31-PE | Sigma-Aldrich | SAB4700467 | |
| CD44-PE | Sigma-Aldrich | SAB4700183 | |
| CD45-PE | Sigma-Aldrich | SAB4700483 | |
| CD90-PE | Sigma-Aldrich | SAB4700686 | |
| HLA Class I-PE (MHC I) | Sigma-Aldrich | SAB4700640 | |
| HLA-DR-PE (MHC II) | Sigma-Aldrich | SAB4700662 | |
| Insulin | Sigma-Aldrich | I9278 | |
| 3,3',5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| Transferrin | Sigma-Aldrich | T2036 | |
| 3-isobutyl-1-methylxanthine (IBMX) | Sigma-Aldrich | I7018 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Rosiglitazone | Cayman | 71740 | |
| β-Glycerophosphate | Sigma-Aldrich | G9422 | |
| 2-Phospho-L-ascorbic acid | Sigma-Aldrich | 49752 | |
| TGFB1 Recombinant Human Protein | R&D Systems | 240-B-002 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Carbon Steel Blades | Thomas Scientific | 6727C18 | |
| Falcon 100 µm cell strainer | Corning | 352360 | |
| Falcon 6-well plate | Corning | 353046 | |
| Falcon 100 mm dish | Corning | 353003 |
参考文献
- Farese, R. V., Zechner, R., Newgard, C. B., Walther, T. C. The Problem of Establishing Relationships between Hepatic Steatosis and Hepatic Insulin Resistance. Cell Metab. 15, 570-573 (2012).
- Taubes, G. Cancer research. Unraveling the obesity-cancer connection. Science. 335 (28), 30-32 (2012).
- Apovian, C. M., Gokce, N. Obesity and cardiovascular disease. Circulation. 125, 1178-1182 (2012).
- Glass, C. K., Olefsky, J. M. Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metab. 15, 635-645 (2012).
- Rosen, E. D., Spiegelman, B. M. Adipocytes as regulators of energy balance and glucose homeostasis. Nature. 444, 847-853 (2006).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metabolism. 4, 263-273 (2006).
- Aune, U. L., Ruiz, L., Kajimura, S. Isolation and Differentiation of Stromal Vascular Cells to Beige/Brite Cells. J Vis Exp. , (2013).
- Hsu, J. M., Ding, S. T. Effect of polyunsaturated fatty acids on the expression of transcription factor adipocyte determination and differentiation-dependent factor 1 and of lipogenic and fatty acid oxidation enzymes in porcine differentiating adipocytes. Brit J Nutr. 90, 507-513 (2003).
- Hsu, J. M., Wang, P. H., Liu, B. H., Ding, S. T. The effect of dietary docosahexaenoic acid on the expression of porcine lipid metabolism-related genes. J Anim Sci. 82, 683-689 (2004).
- Liu, B. H., Kuo, C. F., Wang, Y. C., Ding, S. T. Effect of docosahexaenoic acid and arachidonic acid on the expression of adipocyte determination and differentiation-dependent factor 1 in differentiating porcine adipocytes. J Anim Sci. 83, 1516-1525 (2005).
- Ou, J. F., et al. Unsaturated fatty acids inhibit transcription of the sterol regulatory element-binding protein-1c (SREBP-1c) gene by antagonizing ligand-dependent activation of the LXR. P Natl Acad Sci USA. 98, 6027-6032 (2001).
- Sekiya, M., et al. Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP-1 suppression. Hepatology. 38, 1529-1539 (2003).
- Xu, J., Nakamura, M. T., Cho, H. P., Clarke, S. D. Sterol regulatory element binding protein-1 expression is suppressed by dietary polyunsaturated fatty acids - A mechanism for the coordinate suppression of lipogenic genes by polyunsaturated fats. J Biol Chem. 274, 23577-23583 (1999).
- Ding, S. T., McNeel, R. L., Mersmann, H. J. Conjugated linoleic acid increases the differentiation of porcine adipocytes in vitro. Nutr Res. 20, 1569-1580 (2000).
- Ding, S., Mersmann, H. J. Fatty acids modulate porcine adipocyte differentiation and transcripts for transcription factors and adipocyte-characteristic proteins. J Nutr Biochem. 12, 101-108 (2001).
- Liu, L. R., et al. Serum amyloid A induces lipolysis by downregulating perilipin through ERK1/2 and PKA signaling pathways. Obesity (Silver Spring. 19, 2301-2309 (2011).
- Chen, Y. J., et al. Docosahexaenoic acid suppresses the expression of FoxO and its target genes. J Nutr Biochem. 23, 1609-1616 (2012).
- Lin, Y. Y., et al. Modulation of glucose and lipid metabolism by porcine adiponectin receptor 1-transgenic mesenchymal stromal cells in diet-induced obese mice. Cytotherapy. 15, 971-978 (2013).
- Schipper, B. M., Marra, K. G., Zhang, W., Donnenberg, A. D., Rubin, J. P. Regional anatomic and age effects on cell function of human adipose-derived stem cells. Ann Plast Surg. 60, 538-544 (2008).
- Efimenko, A., et al. Adipose-Derived Mesenchymal Stromal Cells From Aged Patients With Coronary Artery Disease Keep Mesenchymal Stromal Cell Properties but Exhibit Characteristics of Aging and Have Impaired Angiogenic Potential. Stem Cell Transl Med. 3, 32-41 (2014).
- Akanbi, K. A., Brodie, A. E., Suryawan, A., Hu, C. Y. Effect of age on the differentiation of porcine adipose stromal-vascular cells in culture. J Anim Sci. 72, 2828-2835 (1994).
- Mizuno, H., Tobita, M., Uysal, A. C. Concise Review: Adipose-Derived Stem Cells as a Novel Tool for Future Regenerative Medicine. Stem Cells. 30, 804-810 (2012).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Cir Res. 100, 1249-1260 (2007).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived Stem Cells: Current Findings and Future Perspectives. Discov Med. 57, 160-170 (2011).
- Baer, P. C. Adipose-Derived Stem Cells and Their Potential to Differentiate into the Epithelial Lineage. Stem Cell Dev. 20, 1805-1816 (2011).
- Kakudo, N., et al. Adipose-derived regenerative cell (ADRC)enriched fat grafting: optimal cell concentration and effects on grafted fat characteristics. J Transl Med. 11, (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. Int J Biol Sci. 3, 179-184 (2007).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically Engineered Pig Models for Human Diseases. Annu Rev Anim Biosci. 1, 203-219 (2013).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Ann Ny Acad Sci. 1049, 161-171 (2005).
- Wolf, E., et al. Transgenic pigs as models for translational biomedical research. Transgenic Res. 20, 1150-1150 (2011).
- Lindroos, B., Suuronen, R., Miettinen, S. The Potential of Adipose Stem Cells in Regenerative Medicine. Stem Cell Rev Rep. 7, 269-291 (2011).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Circ Res. 100, 1249-1260 (2007).
- Cignarelli, A., et al. Human adipose tissue stem cells: relevance in the pathophysiology of obesity and metabolic diseases and therapeutic applications. Expert Rev Mol Med. 14, (2012).
- Cawthorn, W. P., Scheller, E. L., MacDougald, O. A. Adipose tissue stem cells: the great WAT hope. Trends Endocrinol Metab. 23, 270-277 (2012).
- Banas, A., et al. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 46, 219-228 (2007).
- Bruckner, S., et al. A fat option for the pig: hepatocytic differentiated mesenchymal stem cells for translational research. Exp Cell Res. 321, 267-275 (2014).
- Anghileri, E., et al. Neuronal Differentiation Potential of Human Adipose-Derived Mesenchymal Stem Cells. Stem Cells Dev. 17, 909-916 (2008).
- Huang, T. T., He, D. S., Kleiner, G., Kuluz, J. Neuron-like differentiation of adipose-derived stem cells from infant piglets in vitro. J Spinal Cord Med. 30, S35-S40 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。