Method Article
El aislamiento y la diferenciación de células madre derivadas de tejido adiposo subcutáneo de la especie porcina tejidos adiposos
En este artículo
Resumen
This protocol describes the isolation of pig adipose-derived stem cells (pADSC) from subcutaneous adipose tissues with examination of multipotency. The multipotent pADSC are used to delineate processes of adipocyte differentiation and study transdifferentiation into multiple cell lineages of mesodermal mesenchyme or further lineages of ectoderm and endoderm for regenerative studies.
Resumen
Obesity is an unconstrained worldwide epidemic. Unraveling molecular controls in adipose tissue development holds promise to treat obesity or diabetes. Although numerous immortalized adipogenic cell lines have been established, adipose-derived stem cells from the stromal vascular fraction of subcutaneous white adipose tissues provide a reliable cellular system ex vivo much closer to adipose development in vivo. Pig adipose-derived stem cells (pADSC) are isolated from 7- to 9-day old piglets. The dorsal white fat depot of porcine subcutaneous adipose tissues is sliced, minced and collagenase digested. These pADSC exhibit strong potential to differentiate into adipocytes. Moreover, the pADSC also possess multipotency, assessed by selective stem cell markers, to differentiate into various mesenchymal cell types including adipocytes, osteocytes, and chondrocytes. These pADSC can be used for clarification of molecular switches in regulating classical adipocyte differentiation or in direction to other mesenchymal cell types of mesodermal origin. Furthermore, extended lineages into cells of ectodermal and endodermal origin have recently been achieved. Therefore, pADSC derived in this protocol provide an abundant and assessable source of adult mesenchymal stem cells with full multipotency for studying adipose development and application to tissue engineering of regenerative medicine.
Introducción
La obesidad, presente en aproximadamente el 30% de la población en los EE.UU., con un índice de masa corporal superior a 30, se ha convertido en un fenómeno mundial prevalente 1. La obesidad tiende a conducir a complicaciones relacionadas, incluyendo las enfermedades cardiovasculares, la diabetes tipo 2 y cáncer de 2-4. Por lo tanto, se trata de la obesidad es una prioridad importante. La obesidad se manifiesta por la expansión masiva de los tejidos adiposos, y se atribuye al consumo excesivo de alimentos y un estilo de vida sedentario en la sociedad moderna. Por lo tanto, el desciframiento de la regulación transcripcional de la adipogénesis y la lipogénesis podría ser prometedoras para el tratamiento de la obesidad o la diabetes 5.
El 3T3-L1, 3T3-F442A y otras líneas celulares de ratón adipogénica se han aplicado al estudio de la adipogénesis o lipogénesis durante el desarrollo del tejido adiposo. Sin embargo, hay algunas discrepancias en los mecanismos de regulación entre las líneas celulares in vitro y animales in vivo 6. Primaria adiposo-dericélulas madre ved (ADSC) en la fracción de células del estroma vascular se pueden aislar directamente a partir de tejido adiposo blanco y inducidas a diferenciarse. La diferenciación de ADSC en adipocitos más probable recapitula el proceso de la adipogénesis y la lipogénesis en el desarrollo de tejido adiposo in vivo 7.
Los cerdos son un modelo animal adecuado para el estudio de la adipogénesis y la lipogénesis en el desarrollo del tejido adiposo. Nuestros estudios anteriores porcina 8-10 demuestran que la expresión de esterol regulador del factor de transcripción 1c elemento vinculante (SREBP1c), un importante factor de transcripción conocido para modular la transcripción de sintasa de ácidos grasos lipogénica, se inhibe por los ácidos grasos poliinsaturados (PUFA) en el hígado porcino y los tejidos adiposos. La expresión de SREBP1c porcino disminuido en PUFA in vivo e in vitro es similar a otras especies tales como los seres humanos y ratones 11-13. Estos estudios de cerdo in vitro son principalmente en difadipocitos erentiated derivados de ADSC porcino (pADSC). Por lo tanto, este cultivo de células primarias de pADSC se puede utilizar para servir como un sistema celular fiable para estudiar el desarrollo de tejido adiposo o en otras aplicaciones de células madre.
Protocolo
Nota: Este método se ha establecido y utilizado en la investigación se informó anteriormente 14-17 de este laboratorio; con el tiempo se modificó la metodología. El procedimiento actual se realizó con un promedio de 60 g de los tejidos adiposo subcutáneo de la especie porcina de un cochinillo (de 7 a 9 días de edad) con siembra en placas de cultivo de tejidos de 6 pocillos. Todos los procedimientos se realizaron a RT menos que se designe de otra manera. Todos los experimentos con animales fueron aprobados por el Comité de Cuidado y Uso de Animales Institucional (IACUC) de la Universidad Nacional de Taiwán.
1. Preparar la digestión Medio
- Obtener tejidos adiposo subcutáneo del cuello y la espalda; 40 a 80 g por lechón (7 a 9 días de edad), en función del tamaño de los cerdos. Aquí, usar 60 g de los tejidos adiposo subcutáneo obtenidos a partir de un cerdo.
- Para preparar el medio de digestión: se pesan polvo de colagenasa II con un total de 54.000 unidades y se disuelven en 90 ml de Eagle modificado por Dulbecco (DMEM,60 g de grasa) en una botella de 100 ml serológica (900 unidades de colagenasa / 1,5 ml de DMEM / g de grasa).
- Agitar suavemente el medio de digestión en una mesa de agitación (100 rpm) durante al menos 15 min para disolver y luego pasar el medio de digestión a través de un filtro de 0,22 micras para la esterilización. Almacenar a 4 ° C antes de su uso.
2. Dissect adiposo subcutáneo tejidos de cerdos
- Esterilizar todos los instrumentos, vidrio y artículos de plástico y caliente todos los medios a 37 ° C antes de su uso.
- Sacrificar los lechones con desangramiento eléctrica impresionante y o mediante el uso de un método de acuerdo con las regulaciones locales IACUC. Realizar la disección cuidadosamente e inmediatamente después se sacrifican los lechones.
- Coloque el lechón en una mesa quirúrgica limpia (de nuevo hacia arriba y boca abajo). Afeitarse el pelo de la espalda de los lechones eliminar todo el vello desde el cuello hasta la cola y en ambos lados hacia abajo a la línea media.
- Frote la piel dorsal del cerdo con el 7,5% povidonayodo tres veces (con tres nuevos friega-independientes) y luego permitir que el yodo se siente en la superficie de la piel durante aproximadamente 10 minutos.
- Retire la povidona yodada con múltiples chorros de etanol al 70%. Use almohadillas de gasa o papel de seda que contienen 70% de etanol para limpiar la piel en una dirección, repitiendo hasta que no se observa el color evidente de povidona-yodo.
- Utilice un bisturí para separar la capa de grasa dorsal porcino de los tejidos adiposo subcutáneo junto con la capa de piel adjunta de los músculos mientras que soporta la grasa y la piel usando fórceps.
- Inmediatamente sumerja la capa de grasa de los tejidos adiposo subcutáneo de la piel con adjunto en un vaso de precipitados esterilizado (200 ml) que contiene DMEM libre de suero.
- Pulverizar el exterior del vaso de precipitados que contiene la capa de grasa con 70% de etanol y el lugar en una campana de cultivo de célula de flujo laminar. Colocar una grande (40 cm x 30 cm) esterilizado lámina de cubierta de triple capa en la campana. [A triple capa se utiliza para asegurar la integridad continua.]
- Colocar eltejido con la piel hacia abajo sobre la lámina de cubierta.
- Recorte el tejido muscular que queda fuera del tejido adiposo utilizando pinzas y tijeras para evitar la contaminación con el tejido muscular.
- Cortar la grasa en trozos cuadrados (~ 7 cm x 7 cm) con un bisturí o tijeras. Ponga estas piezas de la capa de grasa en un nuevo vaso de precipitados esterilizado (200 ml) que contiene DMEM libre de suero.
- Establecer un soporte personalizado rebanada sobre la lámina de tapa montada con una cuchilla de la máquina de cortar acero al carbono (Figura 1). Tome un pedazo de grasa del vaso de precipitados y colocarlo en la máquina de cortar (capa de piel en la parte superior y la capa de grasa debajo).
- Cortar la capa de grasa de los tejidos adiposos subcutáneos en aproximadamente 1 mm de espesor piezas. Cortar la capa de grasa de la piel lo más cerca posible, pero evitar cortar la piel.
- De carne picada en rodajas tejidos adiposos con unas tijeras finas como sea posible.
- Se añade medio de la digestión filtrada que contiene colagenasa a un matraz Erlenmeyer de 250 ml o una botella serológica con picadatejidos adiposos (54.000 unidades de colagenasa / 90 ml de DMEM / 60 g de grasa).
- Incubar y agitar el matraz Erlenmeyer a 45 rpm en un agitador orbital durante 90 minutos a 37 ° C para permitir la colagenasa para digerir los tejidos.
Nota: Compruebe cada 15 a 30 minutos para evitar el exceso de digestión. El proceso de digestión se completa si el medio de la digestión es una pasta sin grumos de tejido importantes. - Añadir un volumen igual (igual al medio de digestión) de medio de cultivo que contiene DMEM / F12 con suero bovino fetal al 10% (FBS) para detener la digestión con colagenasa.

Figura 1. Una máquina de cortar a medida utilizada para el aislamiento de pADSC. Disecado tejidos adiposos de dorsales porcina tejidos adiposo subcutáneo se componen de la capa de grasa de la piel con capas unidas. Se requiere una máquina de cortar para cortar la capa de grasa de aproximadamente 1 mm de espesor con la evitación de excesorebanar en las capas de la piel. De izquierda a derecha: titular de la rebanada, la almohadilla de la máquina de cortar, hoja de acero máquina de cortar de carbono, y los tornillos. Se inserta la cuchilla máquina de cortar entre el titular de la rebanada y la almohadilla de la máquina de cortar cuando está montado. Por favor, haga clic aquí para ver una versión más grande de esta figura.
3. Recogida de pADSC de la fracción del estroma vascular
- Pasar el medio de digestión que contiene los tejidos adiposos digeridos a través de una sola capa de gasa esterilizada en un Erlenmeyer de 250 ml matraz limpio o una botella de 250 ml serológico. Utilice unas pinzas para deprimir el medio de la gasa de guiar y ayudar al paso de la digestión.
- Escurrir y torcer la gasa con un fórceps para completar el paso.
- Distribuir el medio de digestión en cuatro tubos de centrífuga de 50 ml cónicos (~ 40 ml por medio tubo).
- Centrifugar a 700 xg durante 10 min para recoger el sedimento de células del estroma-vascular.
- Decantar el sobrenadante sin perturbar los gránulos para eliminar la mayor parte de la capa de grasa superior que contiene adipocitos maduros. Lavar el sedimento por adición de 10 ml de DMEM en cada tubo para resuspender el pellet con pipeteo y agitación suave del tubo.
- Centrifugar a 700 xg durante 6 minutos. Se decanta el sobrenadante.
- Añadir 10 ml de tampón de lisis ACK y luego volver a suspender el sedimento con la pipeta. Se deja reposar durante 7 min (5 a 10 min) a temperatura ambiente para lisar las células rojas de la sangre en la fracción estromal-vascular.
- Añadir cantidades iguales de DMEM (10 ml) para detener la reacción con agitación suave del tubo y centrifugar a 700 xg durante 10 min.
- Se decanta el sobrenadante, añadir 10 ml de DMEM en cada tubo, resuspender el precipitado con pipeteo repetido, y se centrifuga a 700 g durante 6 min. Repetir dos veces.
- Recoger y pasar el DMEM (total de 40 ml de DMEM a partir de 4 tubos que representan 60 g de grasa) con células suspendidas a través de un filtro de 100 micras en un nuevo tubo cónico de 50 ml.
- Suavemente medi pipetaum varias veces para mezclar bien y alícuota de 20 l de medio que contiene células se mezcla con 180 l de 0,4% de solución de azul de tripano (dilución 1:10) en un nuevo 1,5 ml tubo Eppendorf.
- Contar las células con un pADSC semilla hemocitómetro y luego a una densidad de 60.000 células / cm 2 en un tamaño deseado de placa de cultivo o placa con medio de cultivo que contiene DMEM / F12, 10% de suero bovino fetal (FBS) y 1% de antibióticos de penicilina -streptomycin solución B-anfotericina (P / S / A). En general, las semillas de la pADSC en las placas de cultivo de tejidos de 6 pocillos para los adipocitos o la diferenciación osteocitos. Sembrar el pADSC en placas de 10 cm para la tinción de marcadores de superficie de las células madre o diferenciación de los condrocitos.
- Incubar las placas o platos en el incubador a 37ºC en aire con 5% de CO 2 para permitir la unión celular a las placas.
4. Identificación de células madre de la superficie de marcadores pADSC por Citometría de Flujo
- Después de 24 horas, eliminar completamente el medio, lavar THe 10-cm plato dos veces con solución salina tamponada con fosfato (PBS), y las células de la cosecha con 1 ml de 0,25% de tripsina-EDTA durante 5 minutos a 37 ° C.
- Neutralizar la tripsina-EDTA con cantidades iguales de medio de cultivo (1 ml), recoger las células en un nuevo tubo cónico de 15 ml y centrifugar a 400 xg durante 7 min.
- Se decanta el sobrenadante. Lavar el sedimento dos veces en 3 ml de tampón de FCS-lavado enfriado con hielo (PBS que contiene 10% de FBS) con re-suspensión mediante pipeteo junto con centrifugación a 400 xg durante 7 min.
- Volver a suspender, cuenta, y ajustar pADSC a 10 6 células / ml en tampón FCS-lavado enfriado con hielo. células de lugar (100 l / cada tubo) en múltiples tubos cónicos nuevos 15 ml e incubar los tubos que contienen pADSC a 4 ° C durante 30 min con anticuerpos contra cualquiera CD4a conjugado con ficoeritrina (CD4a-PE), CD29-PE, CD31-PE , CD44-PE, CD45-PE, CD90-PE, MHC I-PE o MHC II-PE para la tinción directa. Detener la reacción por lavado de las células dos veces en 10 ml de tampón de lavado-FCS junto con 400 × g centrifugation durante 7 minutos.
- Fijar y resuspender las células en tampón de fijación (PBS con 0,01% de FBS y 1% de formaldehído) para citometría de flujo de acuerdo con las instrucciones del fabricante y nuestra publicación anterior 18.
5. Diferenciación de pADSC en adipocitos, condrocitos y osteocitos
- La diferenciación de pADSC en adipocitos
- Preparar medio de inducción de los adipocitos y de un medio de mantenimiento de adipocitos
- Por medio de inducción de los adipocitos, preparar 1 l de DMEM / F12 libre de suero (con antibióticos de 1% P / S / A) que contiene lo siguiente: 1 ml madre de insulina (10 mg / ml de tampón HEPES, pH 8), concentración final = 10 mg / ml; 1 l de stock T3 (3,3 ', 5-triyodo-L-tironina, 1 mM en DMSO), concentración final = 1 nM; 200 l de transferrina de valores (50 mg / ml de H 2 O doblemente destilada), Concentración Final = 10 mg / ml; 100 l dexametasona madre (10 mM en etanol), Concentración Final = 1 M; 100 l rosiglitazona madre (10 mM en DMSO), conc= 1 mM.
- Preparar medio de mantenimiento de adipocitos con las mismas adiciones como el medio de inducción, pero con omisión de la dexametasona.
- La diferenciación de los adipocitos proceso
Nota: Después de sembrar pADSC en placas de 6 pocillos, pADSC será confluentes en 72 h.- Después de 3 días, se elimina el medio completo y luego añadir 3 ml de medio de inducción de adipocitos en cada pocillo. Volver las placas a la incubadora. Este es el día cero de la diferenciación.
- Después de 3 días, se elimina el medio de inducción de adipocitos por completo y reemplazarlo con 3 ml de medio de mantenimiento de adipocitos cada tres días. adipocitos maduros serán diferenciadas terminalmente por unos 9 días. Más del 90% de los adipocitos están bien diferenciadas usando este protocolo. Estos adipocitos están listos para Oil Red O tinción.
- Preparar medio de inducción de los adipocitos y de un medio de mantenimiento de adipocitos
- La diferenciación de pADSC en osteocitos
- Preparar medio de inducción osteocitos: mediu de cultivo completom (DMEM / F12 con 10% de FBS y 1% P / S / A) que contiene 1 mM de dexametasona, 10 mM β-glicerofosfato y 50 mg / ml ascorbato-2-fosfato.
- proceso de diferenciación de los osteocitos
Nota: Después de sembrar pADSC en placas de 6 pocillos, pADSC será confluentes en 72 h.- Después de 3 días, retire completamente el medio y añadir 3 ml de medio de inducción osteocitos en cada pocillo. Volver las placas a la incubadora a 37ºC. Este es el día cero de la diferenciación.
- Sustituir por medio de inducción osteocitos cada tres días. osteocitos maduros se forman por 14 días de diferenciación. Estos osteocitos están listos para el rojo de alizarina S tinción.
- La diferenciación de pADSC en condrocitos
- Preparar medio de inducción de condrocitos: aMEM que contiene 1% de FBS, 6,25 mg / ml de insulina, 50 mg / ml ascorbato-2-fosfato, y 10 ng / ml factor de crecimiento transformante-β1.
- proceso de diferenciación de los condrocitos
- Después de sembrar pADSC en placas de cultivo de 10 cm por 24 h, eliminar el medio de cultivo por completo y lavar los platos dos veces con PBS.
- Trypsinize pADSC con 1 ml de 0,25% de tripsina-EDTA durante 5 min, y después neutralizar con medio de cultivo 1 ml. Recopilar, contar y ajustar pADSC en tubos de 15 ml cónicos con una densidad de 2,5 × 10 5 células por tubo. Use un hemocitómetro para contar las células.
- Después de centrifugación a 400 xg durante 7 min, descartar el sobrenadante sin perturbar el sedimento y se añade 1 ml de medio de inducción de condrocitos en un tubo de 15 ml. El tubo se devuelve a la incubadora a 37ºC. Este es el día cero de la diferenciación.
- Sustituir el medio de inducción de condrocitos cada tres días sin la eliminación de las células en la parte inferior. condrocitos maduros se forman en aproximadamente 14 días. Estos condrocitos están listos para el azul de toluidina O tinción.
6. La tinción de adipocitos diferenciados, Osteocytes y condrocitos
- Oil Red O tinción de adipocitos diferenciados
- Al día 9, eliminar medio de mantenimiento de adipocitos en placas de cultivo de 6 pocillos con adipocitos diferenciados y a continuación se lava la placa dos veces con PBS. [En los pasos siguientes, añada suficientes reactivos designados para cubrir cada pocillo de la placa de 6 pocillos.]
- Fijar los adipocitos con formalina al 10% durante al menos 10 min.
- Eliminar la solución de formalina al 10% y se lava la placa dos veces con agua bidestilada.
- Después de dos lavados, se añaden 100% de glicol de propileno a la placa de cultivo y se deja reposar durante 1 minuto.
- Retire el propilenglicol 100% y luego añadir la solución Oil Red O (0,5% en propilenglicol) a la placa de cultivo. Dejar reposar durante al menos 10 minutos en un agitador oscilante con agitación suave (100 rpm).
- Eliminar la solución de rojo aceite O y luego vuelva a colocar con un 60% de propilenglicol. Dejar reposar durante 1 minuto.
- Retire el propilenglicol al 60% y luego se lava la placa dos veces con dOBLE agua-destilada.
- Reemplazar con formalina al 10%. Las gotas de lípidos teñidas dentro de los adipocitos están listas para su observación al microscopio óptico.
- La cuantificación de intracelular Oil Red O (pasos opcionales siguientes): después de la observación microscópica, eliminar 10% de solución de formalina y se lava la placa dos veces con agua bidestilada.
- Escurrir la placa por completo y añadir 500 l de isopropanol a la placa de 6 pocillos.
- Deje reposar isopropanol en la placa de 6 pocillos en un agitador oscilante suave (100 rpm) durante al menos 10 minutos para disolver el colorante de Aceite Rojo O.
- Aspirar el isopropanol que contiene Oil Red O y distribuir en una placa de 96 pocillos. Cuantificar el extraída Oil Red O usando una lectura espectrofotométrica a 510 nm.
- Rojo de alizarina S tinción para osteocitos diferenciado
- En el día 14, retire el medio de inducción osteocitos a partir de placas de 6 pocillos con osteocitos diferenciadas y se lavan las placas dos veces con PBS. [En las following pasos, añadir suficientes reactivos designados para cubrir cada pocillo de la placa de 6 pocillos.]
- Fijar osteocitos en solución de formalina al 10% durante al menos 10 min.
- Eliminar la solución de formalina al 10% de cada pocillo y se lava la placa dos veces con agua bidestilada.
- Después de dos lavados, añadir 2% de solución de rojo de alizarina S (pH = 4,1-4,3) a la placa de 6 pocillos y dejar reposar durante al menos 15 minutos en un agitador oscilante suave (100 rpm).
- Eliminar la solución de rojo de alizarina S y luego lavar la placa dos veces con agua bidestilada.
- Reemplazar con formalina al 10%. Osteocitos están listas para su observación al microscopio óptico.
- Azul de toluidina O tinción de condrocitos diferenciados
- Al día 14, el medio aspirado de condrocitos inducción del tubo cónico de 15 ml sin la eliminación de los sedimentos de condrocitos diferenciados en el fondo del tubo y se lava el tubo dos veces con PBS. [En los pasos siguientes, añada suficientes reactivos designados en calar condrocitos en la parte inferior del tubo o de la sección de diapositivas.]
- Fijar condrocitos en solución de formalina al 10% durante al menos 10 min.
- Eliminar la solución de formalina al 10% de cada tubo y se lava el tubo dos veces con agua bidestilada.
- Después de dos lavados, incrustar pellets en octubre Compuesto y la sección con un criostato con un espesor de 5 micras.
- Tinción de la corredera de las secciones de criostato con una solución de azul de toluidina O (0,1% con pH 4,1).
- Eliminar la solución de azul de toluidina O y luego lavar la sección dos veces con agua bidestilada.
Nota: Los condrocitos en las diapositivas están listas para su observación al microscopio óptico.
Resultados
El pADSC derivado de la grasa subcutánea dorsal cerdo se sembraron en las placas de cultivo o los platos y se muestra en la Figura 2. La morfología de la pADSC derivado de la fracción estromal-vascular es similar a la del ratón o ADSC humano. Veinticuatro horas después de la siembra, pADSC subconfluent se adhirieron y tienen un ampliado similar a fibroblastos morfología (Figura 2A). El pADSC se convertirá en confluente dentro de las 72 h y están listos para adipocitos u otra diferenciación de tipo mesenquimal (Figura 2B). pADSC exhibir un fuerte potencial adipogénico después de la inducción química y adipocitos maduros se pueden observar después de 9 días de diferenciación con más del 90% de los pADSCs que muestran la diferenciación adipogénica (Figura 2C).
Para hacer frente a las características de pADSC derivada en este protocolo, los marcadores de superficie de pADSC fueron evaluados por citometría de flujo analanalysis. Como se muestra en la Figura 3, los marcadores de superficie de las células madre mesenquimales, incluyendo CD29, CD44, CD90 y MHC I (o HLA I), fueron altamente expresado. Marcadores de superficie negativas, tales como CD4a, CD31, CD45 y MHC II (o HLA II) eran apenas detectables en pADSC derivado en el protocolo (Figura 3). Estos resultados demuestran que estas características de células madre pADSC exposición de tipo mesenquimal sin endotelial significativa o contaminación de células madre hematopoyéticas, incluyendo mieloides o linfoides progenitores.
Para confirmar aún más que pADSC representan células madre mesenquimales, la multipotencia de pADSC fue examinado por la diferenciación en adipocitos, osteocitos y condrocitos. Estos adipocitos, condrocitos y osteocitos se tiñeron por colorantes específicos, Oil Red O, rojo de alizarina S y azul de toluidina O, respectivamente (Figura 4). Estos datos indican que este protocolo genera pADSC que retiene multipotency con características que se asemejan completos progenitores de tipo mesenquimal.
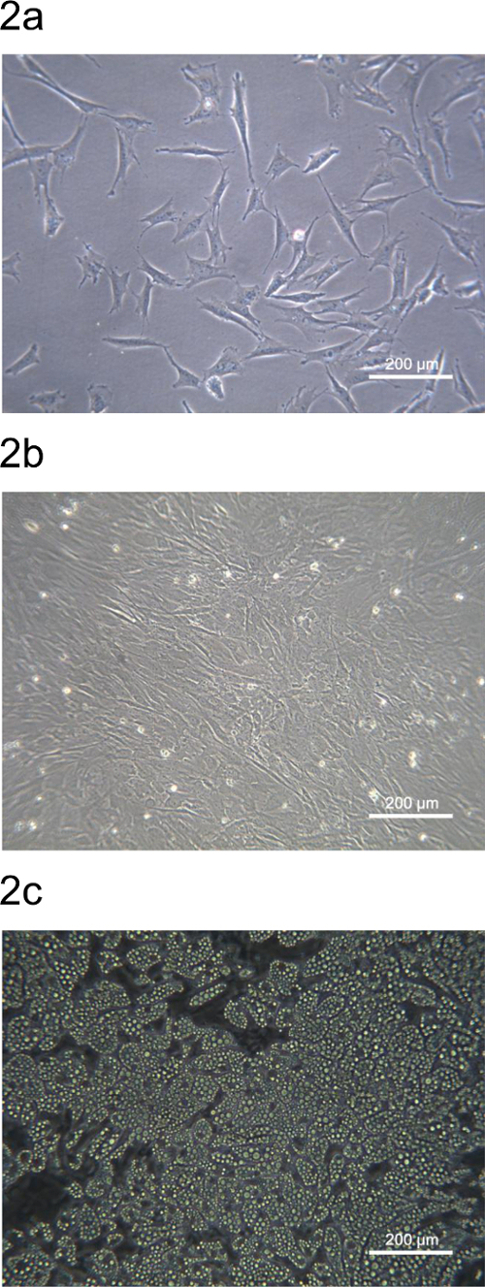
Figura 2. Morfología de pADSC de la especie porcina espalda región grasa. (A) Subconfluent pADSC adhiere y se expandió después de 24 h de siembra en una placa de cultivo de 6 pocillos. (B) pADSC se hizo confluente después de 72-h de la siembra en una placa de cultivo de 6 pocillos. Se observaron los adipocitos (C) maduros después de 9 días de diferenciación adipogénica de pADSC. Se tomaron imágenes a 100 aumentos utilizando un microscopio de contraste de fase. Por favor, haga clic aquí para ver una versión más grande de esta figura.
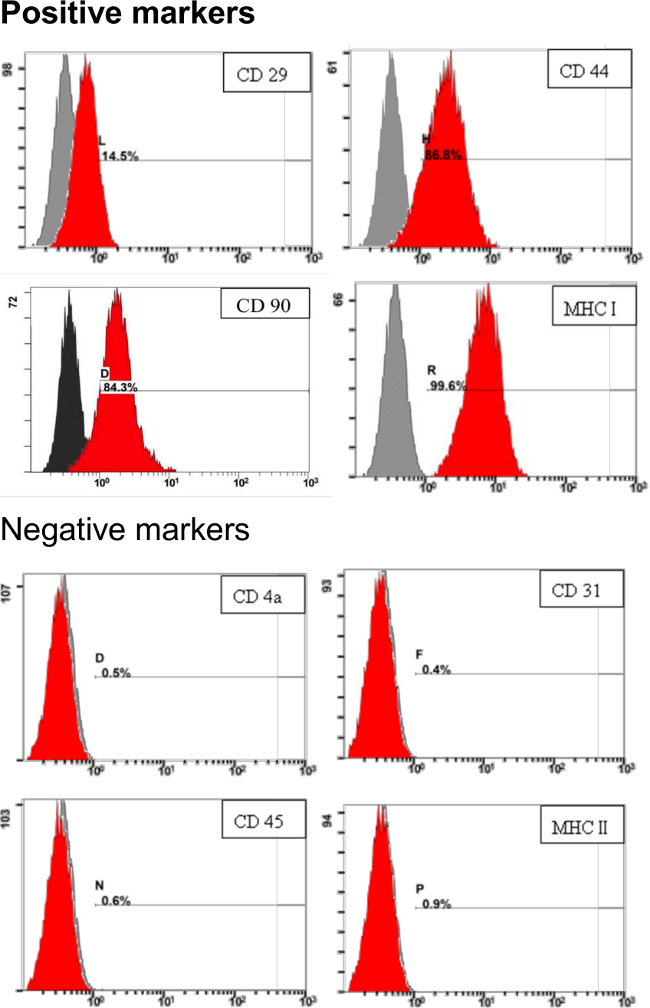
Figura 3. Identificación de células madremarcadores de superficie para pADSC. 1 x 10 5 de pADSC se hicieron reaccionar con anticuerpos específicos y se analizaron los marcadores de células madre por citometría de flujo. Los números indican el porcentaje de células teñidas en la población (rojo) en comparación con el control sin teñir. El eje x representa la intensidad de fluorescencia relativa. El eje y representa la población de células. Por favor, haga clic aquí para ver una versión más grande de esta figura.
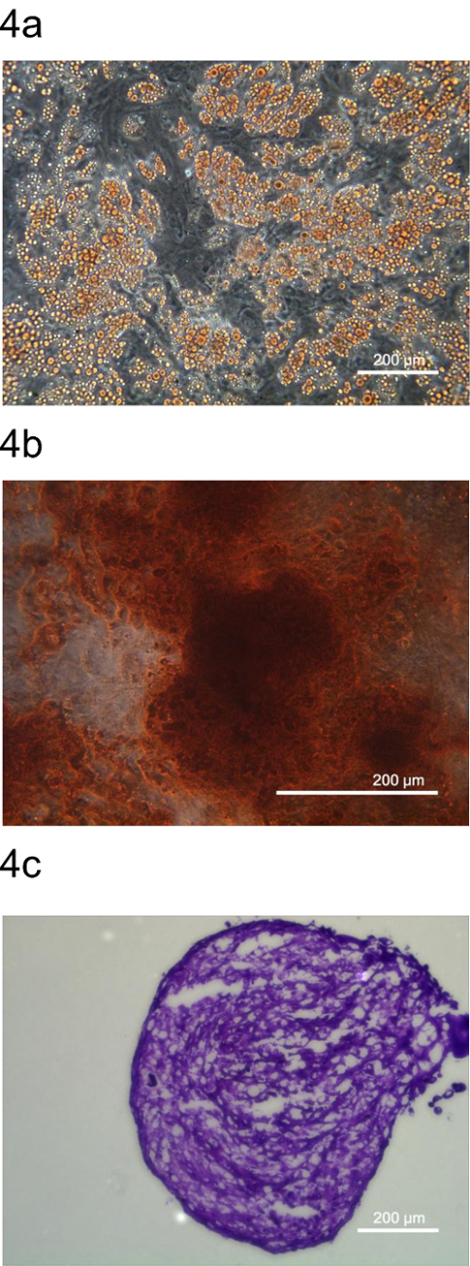
Figura 4. Multipotentes diferenciación de pADSC. Multipotencia de pADSC se determinó mediante la diferenciación de adipocitos pADSC en (A), osteocitos condrocitos (C) (B) y teñidas por colorantes representativos, Oil Red O, rojo de alizarina S y azul de toluidina O, respectivamente . ImaGES se tomaron en (A) x 100, (B) x 200, y (C) 100 aumentos utilizando un microscopio de contraste de fase, respectivamente. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí presentamos un sistema celular fiable para estudiar el desarrollo del tejido adiposo en cultivo de células primarias de pADSC. En comparación con otras líneas de células inmortalizadas, este método proporciona una forma conveniente para aislar grandes cantidades de células madre adultas mesenquimales de alta calidad que se pueden aplicar para estudiar los procesos de diferenciación de adipocitos u otros linajes mesenquimales relacionados con el desarrollo de los animales in vivo. El paso modificado crítico en este protocolo es que derivamos pADSC utilizando un cochinillo viejo de 7 a 9 días, ya que es fácil de manejar el pequeño cochinillo en comparación con animales de más edad y similar a otras especies de 19,20, el rendimiento múltiple y capacidad de pADSC disminuye a medida que las edades de 21 cerdos.
fuentes de células madre potenciales incluyen las células madre embrionarias (ESC), células madre pluripotentes inducidas (IPSC), y células madre adultas postnatales. La restricción de ADSC, clasificado como células madre adultas multipotentes, es que la multipotencia de células madre adultasen la diferenciación de los linajes divergentes es relativamente limitada en comparación con el ESC o IPSC. Sin embargo, cuestiones éticas relacionadas con la derivación de ESC y oncogénico propiedades de IPSC restringen la aplicación de la CES y de IPSC 22,23. Por lo tanto, numerosos investigadores se han centrado en las células madre adultas con los esfuerzos para mejorar la pluripotencia. La fuente más común de células madre mesenquimales adultas (MSC), que durante mucho tiempo se ha estudiado, es células madre mesenquimales derivadas de médula ósea 24. Sin embargo, la recolección de médula ósea se considera un procedimiento relativamente dolorosa. Otra preocupación es que el rendimiento de las células madre de la médula ósea es finito. Aspirados de médula ósea producen una media de 6 × 10 6 células nucleadas por ml, y el MSC sólo representan el 0,001 a 0,01% de todas las células nucleadas. Después de considerar estos inconvenientes, ADSC se sugiere como una fuente menos molesto para obtener células madre multipotentes 25,26.
Limitaciones en el uso de ADSC en Regenerativa medicina dependen, en gran medida en el rendimiento de células y la calidad. Por lo tanto, la importancia de emplear cerdos para aislar ADSC en este protocolo es para producir una gran cantidad de células madre adultas de alta calidad. El cerdo es un modelo animal útil en representación de los seres humanos, debido al tamaño comparable órgano y muchas similitudes fisiológicas y bioquímicas entre las especies 27-30. La adquisición de hADSC de empresas comerciales es caro y en muchos casos han sido manipuladas las células, passaged o crioconservado. La adquisición de muestras clínicas humanas es relativamente difícil debido a cuestiones éticas y la producción de ADSC es limitado. Derivamos aproximadamente 6 x 10 5 hADSC por g de grasa después de la digestión con colagenasa. Con 100 g de tejido adiposo de mama femenino (un promedio de muestreo), un total de 6 x 10 7 células pueden ser cosechadas. El uso de un ratón individual, el rendimiento es aún más limitada. Un total de 1 x 10 6 células se pueden cosechar a partir de 0,4 g de ratón i subcutáneanguinal tejido adiposo de las dos piernas de un ratón adulto FVB (6-8 semanas de edad). Sin embargo, en un cerdo individuo (de 7 a 9 días de edad), un total de 2 x 10 8 células se pueden cosechar fácilmente de 60 g de tejido adiposo subcutáneo obtenido del depósito de grasa dorsal. El pADSC derivada en este protocolo tiene plena potencia múltiple de tipo mesenquimal y marcadores de células madre mesenquimales apropiadas. Por lo tanto, pADSC son una fuente favorable para obtener grandes cantidades de células madre adultas sin comprometer la calidad de células madre.
La aplicación de pADSC no se limita a descifrar la diferenciación de adipocitos incluyendo la adipogénesis y la lipogénesis. Recientemente, ADSC han convertido en una fuente popular de las células madre en el campo de la regeneración 22,31,32 medicamento. En comparación con otras fuentes de células madre, ADSC retener una ventaja única de ser fácilmente accesible y abundante, y su multipotencia robusto ha demostrado ser una fuente prometedora para la terapia con células madre y tejido engineering 22,33,34. La fácil accesibilidad del tejido adiposo hace ADSC una de las formas menos intrusivas para obtener células progenitoras multipotentes. Recientemente, diferenciamos pADSC en grupos secretoras de insulina sensibles a glucosa, lo que indica que pADSC no se limitan a la diferenciación mesenquimal (datos no publicados). Otros también han demostrado que ADSC puede diferenciarse en muchos tipos de células derivadas de otras capas germinales, tales como hepatocitos endodérmico (de hADSC 35 o pADSC 36) o neuronas ectodérmicas (de hADSC 37 o pADSC 38). Por lo tanto, pADSC podría ser utilizado para drogas de alto rendimiento o de cribado biomaterial dirigiendo las células para los procesos de diferenciación divergentes para producir linajes deseados. Por lo tanto, pADSC derivada en este protocolo tiene aplicación potencial en la terapia de células madre y trasplante de tejidos para investigación medicina regenerativa.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Los autores desean expresar su gratitud a todos los miembros del laboratorio para la discusión extensa y la técnica apoya en este protocolo. La investigación realizada en el laboratorio fue apoyado por becas de Ministerio de Ciencia y Tecnología (MOST 103-2314-B-002-126 y el MOST 102 a 2313-B-002-026-MY3) y por las subvenciones del objetivo para el Plan Universitario Top (104R350144) de la Universidad Nacional de Taiwán.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Collagenase, Type II | Sigma-Aldrich | C6885 | |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-001-1 | |
| Penicillin-Streptomycin-Amphotericin B (P/S/A) solution | Biological Industries | 03-033-1 | For antibiotics and antimycotic usage |
| αMEM, no nucleosides | Life Technologies | 12561-049 | |
| ACK lysis buffer | Life Technologies | A10492-01 | |
| Trypsin-EDTA (0.25%), phenol red | Life Technologies | 25200072 | |
| CD4a-PE | Sigma-Aldrich | SAB4700063 | |
| CD29-PE | Sigma-Aldrich | SAB4700398 | |
| CD31-PE | Sigma-Aldrich | SAB4700467 | |
| CD44-PE | Sigma-Aldrich | SAB4700183 | |
| CD45-PE | Sigma-Aldrich | SAB4700483 | |
| CD90-PE | Sigma-Aldrich | SAB4700686 | |
| HLA Class I-PE (MHC I) | Sigma-Aldrich | SAB4700640 | |
| HLA-DR-PE (MHC II) | Sigma-Aldrich | SAB4700662 | |
| Insulin | Sigma-Aldrich | I9278 | |
| 3,3',5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| Transferrin | Sigma-Aldrich | T2036 | |
| 3-isobutyl-1-methylxanthine (IBMX) | Sigma-Aldrich | I7018 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Rosiglitazone | Cayman | 71740 | |
| β-Glycerophosphate | Sigma-Aldrich | G9422 | |
| 2-Phospho-L-ascorbic acid | Sigma-Aldrich | 49752 | |
| TGFB1 Recombinant Human Protein | R&D Systems | 240-B-002 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Carbon Steel Blades | Thomas Scientific | 6727C18 | |
| Falcon 100 µm cell strainer | Corning | 352360 | |
| Falcon 6-well plate | Corning | 353046 | |
| Falcon 100 mm dish | Corning | 353003 |
Referencias
- Farese, R. V., Zechner, R., Newgard, C. B., Walther, T. C. The Problem of Establishing Relationships between Hepatic Steatosis and Hepatic Insulin Resistance. Cell Metab. 15, 570-573 (2012).
- Taubes, G. Cancer research. Unraveling the obesity-cancer connection. Science. 335 (28), 30-32 (2012).
- Apovian, C. M., Gokce, N. Obesity and cardiovascular disease. Circulation. 125, 1178-1182 (2012).
- Glass, C. K., Olefsky, J. M. Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metab. 15, 635-645 (2012).
- Rosen, E. D., Spiegelman, B. M. Adipocytes as regulators of energy balance and glucose homeostasis. Nature. 444, 847-853 (2006).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metabolism. 4, 263-273 (2006).
- Aune, U. L., Ruiz, L., Kajimura, S. Isolation and Differentiation of Stromal Vascular Cells to Beige/Brite Cells. J Vis Exp. , (2013).
- Hsu, J. M., Ding, S. T. Effect of polyunsaturated fatty acids on the expression of transcription factor adipocyte determination and differentiation-dependent factor 1 and of lipogenic and fatty acid oxidation enzymes in porcine differentiating adipocytes. Brit J Nutr. 90, 507-513 (2003).
- Hsu, J. M., Wang, P. H., Liu, B. H., Ding, S. T. The effect of dietary docosahexaenoic acid on the expression of porcine lipid metabolism-related genes. J Anim Sci. 82, 683-689 (2004).
- Liu, B. H., Kuo, C. F., Wang, Y. C., Ding, S. T. Effect of docosahexaenoic acid and arachidonic acid on the expression of adipocyte determination and differentiation-dependent factor 1 in differentiating porcine adipocytes. J Anim Sci. 83, 1516-1525 (2005).
- Ou, J. F., et al. Unsaturated fatty acids inhibit transcription of the sterol regulatory element-binding protein-1c (SREBP-1c) gene by antagonizing ligand-dependent activation of the LXR. P Natl Acad Sci USA. 98, 6027-6032 (2001).
- Sekiya, M., et al. Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP-1 suppression. Hepatology. 38, 1529-1539 (2003).
- Xu, J., Nakamura, M. T., Cho, H. P., Clarke, S. D. Sterol regulatory element binding protein-1 expression is suppressed by dietary polyunsaturated fatty acids - A mechanism for the coordinate suppression of lipogenic genes by polyunsaturated fats. J Biol Chem. 274, 23577-23583 (1999).
- Ding, S. T., McNeel, R. L., Mersmann, H. J. Conjugated linoleic acid increases the differentiation of porcine adipocytes in vitro. Nutr Res. 20, 1569-1580 (2000).
- Ding, S., Mersmann, H. J. Fatty acids modulate porcine adipocyte differentiation and transcripts for transcription factors and adipocyte-characteristic proteins. J Nutr Biochem. 12, 101-108 (2001).
- Liu, L. R., et al. Serum amyloid A induces lipolysis by downregulating perilipin through ERK1/2 and PKA signaling pathways. Obesity (Silver Spring. 19, 2301-2309 (2011).
- Chen, Y. J., et al. Docosahexaenoic acid suppresses the expression of FoxO and its target genes. J Nutr Biochem. 23, 1609-1616 (2012).
- Lin, Y. Y., et al. Modulation of glucose and lipid metabolism by porcine adiponectin receptor 1-transgenic mesenchymal stromal cells in diet-induced obese mice. Cytotherapy. 15, 971-978 (2013).
- Schipper, B. M., Marra, K. G., Zhang, W., Donnenberg, A. D., Rubin, J. P. Regional anatomic and age effects on cell function of human adipose-derived stem cells. Ann Plast Surg. 60, 538-544 (2008).
- Efimenko, A., et al. Adipose-Derived Mesenchymal Stromal Cells From Aged Patients With Coronary Artery Disease Keep Mesenchymal Stromal Cell Properties but Exhibit Characteristics of Aging and Have Impaired Angiogenic Potential. Stem Cell Transl Med. 3, 32-41 (2014).
- Akanbi, K. A., Brodie, A. E., Suryawan, A., Hu, C. Y. Effect of age on the differentiation of porcine adipose stromal-vascular cells in culture. J Anim Sci. 72, 2828-2835 (1994).
- Mizuno, H., Tobita, M., Uysal, A. C. Concise Review: Adipose-Derived Stem Cells as a Novel Tool for Future Regenerative Medicine. Stem Cells. 30, 804-810 (2012).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Cir Res. 100, 1249-1260 (2007).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived Stem Cells: Current Findings and Future Perspectives. Discov Med. 57, 160-170 (2011).
- Baer, P. C. Adipose-Derived Stem Cells and Their Potential to Differentiate into the Epithelial Lineage. Stem Cell Dev. 20, 1805-1816 (2011).
- Kakudo, N., et al. Adipose-derived regenerative cell (ADRC)enriched fat grafting: optimal cell concentration and effects on grafted fat characteristics. J Transl Med. 11, (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. Int J Biol Sci. 3, 179-184 (2007).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically Engineered Pig Models for Human Diseases. Annu Rev Anim Biosci. 1, 203-219 (2013).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Ann Ny Acad Sci. 1049, 161-171 (2005).
- Wolf, E., et al. Transgenic pigs as models for translational biomedical research. Transgenic Res. 20, 1150-1150 (2011).
- Lindroos, B., Suuronen, R., Miettinen, S. The Potential of Adipose Stem Cells in Regenerative Medicine. Stem Cell Rev Rep. 7, 269-291 (2011).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Circ Res. 100, 1249-1260 (2007).
- Cignarelli, A., et al. Human adipose tissue stem cells: relevance in the pathophysiology of obesity and metabolic diseases and therapeutic applications. Expert Rev Mol Med. 14, (2012).
- Cawthorn, W. P., Scheller, E. L., MacDougald, O. A. Adipose tissue stem cells: the great WAT hope. Trends Endocrinol Metab. 23, 270-277 (2012).
- Banas, A., et al. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 46, 219-228 (2007).
- Bruckner, S., et al. A fat option for the pig: hepatocytic differentiated mesenchymal stem cells for translational research. Exp Cell Res. 321, 267-275 (2014).
- Anghileri, E., et al. Neuronal Differentiation Potential of Human Adipose-Derived Mesenchymal Stem Cells. Stem Cells Dev. 17, 909-916 (2008).
- Huang, T. T., He, D. S., Kleiner, G., Kuluz, J. Neuron-like differentiation of adipose-derived stem cells from infant piglets in vitro. J Spinal Cord Med. 30, S35-S40 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados