Method Article
Isolierung und Differenzierung von Fettgewebe gewonnenen Stammzellen aus Porcine Subkutan Fettgewebes
In diesem Artikel
Zusammenfassung
This protocol describes the isolation of pig adipose-derived stem cells (pADSC) from subcutaneous adipose tissues with examination of multipotency. The multipotent pADSC are used to delineate processes of adipocyte differentiation and study transdifferentiation into multiple cell lineages of mesodermal mesenchyme or further lineages of ectoderm and endoderm for regenerative studies.
Zusammenfassung
Obesity is an unconstrained worldwide epidemic. Unraveling molecular controls in adipose tissue development holds promise to treat obesity or diabetes. Although numerous immortalized adipogenic cell lines have been established, adipose-derived stem cells from the stromal vascular fraction of subcutaneous white adipose tissues provide a reliable cellular system ex vivo much closer to adipose development in vivo. Pig adipose-derived stem cells (pADSC) are isolated from 7- to 9-day old piglets. The dorsal white fat depot of porcine subcutaneous adipose tissues is sliced, minced and collagenase digested. These pADSC exhibit strong potential to differentiate into adipocytes. Moreover, the pADSC also possess multipotency, assessed by selective stem cell markers, to differentiate into various mesenchymal cell types including adipocytes, osteocytes, and chondrocytes. These pADSC can be used for clarification of molecular switches in regulating classical adipocyte differentiation or in direction to other mesenchymal cell types of mesodermal origin. Furthermore, extended lineages into cells of ectodermal and endodermal origin have recently been achieved. Therefore, pADSC derived in this protocol provide an abundant and assessable source of adult mesenchymal stem cells with full multipotency for studying adipose development and application to tissue engineering of regenerative medicine.
Einleitung
Übergewicht, die in etwa 30% der Bevölkerung in den USA, mit einem Body - Mass - Index über 30, hat als weltweit verbreitet Phänomen 1 entstanden. Fettleibigkeit neigt 2-4 zu Komplikationen im Zusammenhang mit Herz - Kreislauf - Erkrankungen, Typ-2 - Diabetes und Krebs führen. Daher kann mit Fettleibigkeit zu tun ist eine wichtige Priorität. Adipositas ist durch eine massive Expansion von Fettgewebe manifestiert, und wird zu einer übermäßigen Nahrungsaufnahme und einer sesshaften Lebensweise in der modernen Gesellschaft zurückzuführen. Somit könnte halten Sie die Transkriptionsregulation der Adipogenese und Lipogenese Entzifferung versprechen 5 Fettleibigkeit oder Diabetes zu behandeln.
Die 3T3-L1, 3T3-F442A und andere Maus adipogenetische Zelllinien wurden adipogenesis oder Lipogenese während Fettgewebe Entwicklung zu studieren angewendet. Es gibt jedoch einige Abweichungen in Regulationsmechanismen zwischen Zelllinien in vitro und in vivo Tier 6. Primäre Fettgewebe derived Stammzellen (ADSC) in der Stroma-Gefäßzellfraktion kann direkt aus weißem Fettgewebe isoliert werden und zur Differenzierung induziert. Die Differenzierung der ADSC in Adipozyten meisten rekapituliert wahrscheinlich den Prozess der Adipogenese und Lipogenese im Fettgewebe Entwicklung in vivo 7.
Schweine sind ein geeignetes Tiermodell für Adipogenese und Lipogenese im Fettgewebe Entwicklung zu studieren. Unsere vorherigen Studien porcine 8-10 zeigen , dass die Expression von Sterol - regulatorische Element bindenden Transkriptionsfaktor 1c (SREBP1c), ein wichtiger Faktor Transkription bekannt Transkription lipogenic Fettsäuresynthase zu modulieren, die von mehrfach ungesättigten Fettsäuren (PUFA) in der Schweineleber gehemmt wird und Fettgewebe. Die Expression von Schweine - SREBP1c verringerte sich um PUFA in vivo und in vitro ist ähnlich wie andere Arten wie Mensch und Maus 11-13. Diese Schweine Studien in vitro sind in erster Linie in differentiated Adipozyten aus Schweine ADSC (pADSC) abgeleitet. Daher kann diese primäre Zellkultur pADSC verwendet werden als zuverlässiges zellulare System zu dienen Fettgewebe Entwicklung oder andere Stammzellen Anwendungen zu untersuchen.
Protokoll
Hinweis: Diese Methode hergestellt wurde und verwendet in der Forschung bereits berichtet 14-17 aus diesem Labor; im Laufe der Zeit wurde die Methodik geändert. Das derzeitige Verfahren wurde von einem Ferkel (7 bis 9 Tage alt) mit seeding auf 6-Well-Gewebekulturplatten mit einem Durchschnitt von 60 g Schweine subkutane Fettgewebe erfolgen. Alle Verfahren wurden bei RT durchgeführt, wenn nicht anders bezeichnet. Alle Tierversuche wurden von der Institutional Animal Care und Use Committee (IACUC) an der National Taiwan University zugelassen.
1. Bereiten Sie Digestionsmedium
- Erhalten subkutane Fettgewebe aus dem Nacken und Rücken; 40 bis 80 g pro Ferkel (7 bis 9 Tage alt), abhängig von der Größe der Schweine. Hier verwenden 60 g subkutanen Fettgewebe von einem Schwein erhalten.
- Bereiten Sie Digestionsmedium: wiegen Kollagenase II Pulver mit insgesamt 54.000 Einheiten und löst ihn in 90 ml Dulbecco-modifiziertem Eagle-Medium (DMEM,60 g Fett) in einer 100 ml Flasche serologische (900 Einheiten Collagenase / 1,5 ml DMEM / g Fett).
- Vorsichtig geschwenkt, für die Sterilisation mindestens 15 Minuten zu lösen und dann die Digestionsmedium durch ein 0,22-um-Filter passieren die Digestionsmedium auf einem Rütteltisch (100 rpm). Lagerung bei 4 ° C vor dem Gebrauch.
2. Dissect Subkutan Fettgewebes von Schweinen
- Sterilisieren alle Instrumente, Glas und Plastikwaren und warm alle Medien bis 37 ° C vor dem Gebrauch.
- Sacrifice das Ferkel mit elektrischer Betäubung und Ausbluten oder durch ein Verfahren, in Übereinstimmung mit den örtlichen Vorschriften IACUC verwenden. Führen Präparation sorgfältig und unmittelbar nach dem Ferkel geopfert werden.
- Lay (nach hinten raus und Bauch nach unten), um die Ferkel auf eine saubere OP-Tisch. Abrasieren das Haar von der Ferkel wieder zu entfernen alle Haare vom Hals bis zum Schwanz und an beiden Seiten nach unten auf der Mittellinie.
- Scrub die Rückenhaut des Schweins mit 7,5% PolyvidonJod dreimal (mit drei neuen unabhängigen scheuert) und lassen dann das Jod für etwa 10 min auf der Oberfläche der Haut zu sitzen.
- Entfernen Sie die Povidon-Iod mit mehreren Sprays von 70% Ethanol. Verwenden Gazekompressen oder Tissuepapiere 70% Ethanol enthält, um die Haut in einer Richtung zu wischen, zu wiederholen, bis keine offensichtliche Farbe der Povidon-Iod beobachtet wird.
- Verwenden Sie ein Skalpell die Schweinerückenfettschicht von subkutanem Fettgewebe zu trennen zusammen mit der beigefügten Hautschicht aus den Muskeln, während das Fett hält und die Haut mit einer Pinzette.
- Unmittelbar tauchen mit angebrachtem Haut die Fettschicht von subkutanem Fettgewebe in einem sterilisierten Becher (200 ml) serumfreies DMEM enthält.
- Sprühen Sie die Außenseite des Bechers die Fettschicht mit 70% Ethanol und in einer Laminar-Flow-Zellkultur Haube enthält. Legen Sie eine große (40 cm x 30 cm) sterilisierte dreischichtigen Deckfolie in der Motorhaube. [Eine dreifache Schicht wird verwendet, kontinuierliche Integrität zu gewährleisten.]
- Setze dasGewebe mit der Haut auf der Deckfolie nach unten zeigt.
- Schneiden Sie die verbleibenden Muskelgewebe aus des Fettgewebes mit einer Pinzette und Schere Kontamination mit Muskelgewebe zu vermeiden.
- Schneiden Sie das Fett in quadratische Stücke (~ 7 cm x 7 cm) mit einem Skalpell oder einer Schere. Setzen Sie diese Stücke der Fettschicht in einen neuen sterilisierten Becher (200 ml), das Serum-freiem DMEM.
- Stellen Sie eine maßgeschneiderte Scheibe Halter auf der Deckfolie mit einem Kohlenstoffstahl Schneidklinge montiert (Abbildung 1). Nehmen Sie ein Stück Fett aus dem Becher und legen Sie es auf der Schneidemaschine (Hautschicht auf der Oberseite und Fettschicht unten).
- Schneiden Sie die Fettschicht von subkutanem Fettgewebe in etwa 1 mm dicke Stücke. Schneiden Sie die Fettschicht von der Haut so nah wie möglich, aber vermeiden Sie die Haut schneiden.
- Mince in Scheiben geschnitten Fettgewebe mit einer Schere so fein wie möglich.
- In gefiltert Digestionsmedium Kollagenase in einen 250 ml Erlenmeyerkolben oder einer serologischen Flasche enthält, mit gehacktemFettgewebe (54.000 Einheiten Kollagenase / 90 ml DMEM / 60 g Fett).
- Inkubieren und den Erlenmeyerkolben bei 45 rpm in einem Schüttler für 90 min bei 37 ° C verwirbelt die Kollagenase zu verdauen das Gewebe zu ermöglichen.
Hinweis: Überprüfen Sie alle 15 bis 30 Minuten über Verdauung zu vermeiden. Der Verdauungsvorgang abgeschlossen ist, wenn die Digestionsmedium ein Brei ohne signifikante Gewebeklumpen ist. - Ein gleiches Volumen (gleich dem Digestionsmedium) von Kulturmedium, das DMEM / F12 mit 10% fötalem Rinderserum (FBS) die Kollagenaseverdau zu stoppen.

Abbildung 1. Eine angepasste Schneidemaschine für die Isolierung von pADSC verwendet. Dissected Fettgewebe aus Schweinerücken subkutanen Fettgewebe aus der Fettschicht zusammengesetzt mit angebautem Hautschichten. Eine Schneidemaschine erforderlich, um die Fettschicht etwa 1 mm dick mit Vermeidung von Über- zu schneidenSchneiden in die Hautschichten. Von links nach rechts: Scheibe Halter, Slicer-Pad, Kohlenstoffstahl Schneidklinge und Schrauben. Slicer Messer zwischen Scheibe Halter und Slicer - Pad eingeführt wird , wenn montiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
3. Sammlung von pADSC aus dem Stroma-vaskuläre Fraktion
- Übergeben Sie das Digestionsmedium der verdauten Fettgewebe durch eine einzige Schicht aus Chiffon in eine saubere sterilisierte 250 ml Erlenmeyerkolben oder einem 250 ml serologische Flasche enthält. Verwenden Sie eine Zange in der Mitte des Chiffon zu drücken Passage des verdauen zu führen und zu unterstützen.
- Abtropfen lassen und den Chiffon mit einer Zange drehen, um Durchgang abzuschließen.
- Verteilen Sie das Digestionsmedium in vier 50 ml konischen Zentrifugenröhrchen (~ 40 ml Medium pro Röhrchen).
- Zentrifuge bei 700 × g für 10 min das Pellet von stromal-Gefäßzellen zu sammeln.
- Den Überstand dekantieren, ohne die Pellets zu stören die meisten der Top-Fettschicht reifen Adipozyten enthält, zu entfernen. Waschen Sie das Pellet durch Zugabe von 10 ml DMEM in jedes Röhrchen, das Pellet mit Pipettieren und vorsichtigem Schütteln des Röhrchens zu resuspendieren.
- Zentrifuge bei 700 × g für 6 min. Den Überstand umfüllen.
- 10 ml ACK-Lysepuffer und anschließend das Pellet durch Pipettieren. Lassen Sie es für 7 min (5 bis 10 min) bei RT stehen roten Blutkörperchen in dem Stroma-vaskulären Fraktion zu lysieren.
- Hinzufügen gleiche Mengen von DMEM (10 ml), die Reaktion unter leichtem Schütteln des Rohres zu stoppen und dann bei 700 xg für 10 min zentrifugiert.
- Den Überstand umfüllen, 10 ml DMEM in jedes Röhrchen, das Pellet mit wiederholten Pipettieren und Zentrifuge bei 700 × g für 6 min. Zweimal wiederholen.
- Sammeln und das DMEM (insgesamt 40 ml DMEM von 4 Röhrchen die 60 g Fett) mit suspendierten Zellen durch ein 100 & mgr; m Sieb in ein neues 50 ml konischen Röhrchen passieren.
- Gently Pipette medium mehrmals mit 180 ul von 0,4% Trypanblau-Lösung (1:10 Verdünnung) in ein neues 1,5 ml-Eppendorf-Röhrchen gut vermischt und aliquote 20 ul zellhaltigen Medium zu mischen.
- Zähle die Zellen mit einem Hämozytometer und dann Samen pADSC bei einer Dichte von 60.000 Zellen / cm 2 auf eine gewünschte Größe der Kulturschale oder eine Platte mit Kulturmedium , das DMEM / F12, das 10% fötales Rinderserum (FBS) und 1% Antibiotika Penicillin -streptomycin-Amphotericin B-Lösung (P / S / A). Im Allgemeinen Samen der pADSC auf den 6-Well-Gewebekulturplatten für Adipozyten oder osteocyte Differenzierung. Samen der pADSC auf 10-cm-Schalen für Oberflächenmarker Färbung von Stammzellen oder Chondrozyten-Differenzierung.
- Inkubieren der Platten oder Schalen in dem 37 ° C Inkubator in Luft mit 5% CO 2 Zellanheftung an den Platten zu ermöglichen.
4. Identifizierung Stem-Zelloberflächenmarker von pADSC durch Durchflusszytometrie
- Nach 24 Stunden das Medium vollständig zu entfernen, waschen the 10-cm-Schale zweimal mit phosphatgepufferter Kochsalzlösung (PBS) und des Ernte Zellen mit 1 ml von 0,25% Trypsin-EDTA für 5 min bei 37 ° C.
- Neutralisieren Trypsin-EDTA mit gleichen Mengen Kulturmedium (1 ml), sammeln Zellen in einem neuen 15-ml konischen Röhrchen und dann Zentrifuge bei 400 × g für 7 min.
- Den Überstand umfüllen. Waschen Sie das Pellet zweimal in 3 ml eiskaltem FCS-Waschpuffer unter Verwendung von Resuspension (PBS enthaltend 10% FBS) mit Zentrifugation für 7 min bei 400 xg gekoppelt Pipettieren.
- Resuspendieren, zählen und stellen pADSC bis 10 6 Zellen / ml in eiskaltem FCS-Waschpuffer. Ortszellen (100 ul / jedes Rohr) in mehrere neue 15 ml konische Röhrchen und Inkubation Röhrchen mit pADSC bei 4 ° C für 30 min mit Antikörpern gegen entweder Phycoerythrin-konjugiertem CD4a (CD4a-PE), CD29-PE, CD31-PE , CD44-PE, CD45-PE, CD90-PE, MHC I-PE oder MHC-II-PE für die direkte Färbung. Die Reaktion durch Waschen der Zellen zweimal in 10 ml FCS-Waschpuffer mit 400 × g centrifugat gekoppeltIon für 7 min.
- Fix und resuspendieren Zellen in Fixierungspuffer (PBS mit 0,01% FBS und 1% Formaldehyd) für die Durchflusszytometrie entsprechend den Anweisungen des Herstellers und unserer früheren Veröffentlichung 18.
5. Differenzierung von pADSC in Adipozyten, Osteozyten und Chondrozyten
- Differenzierung von pADSC in Adipozyten
- Bereiten Sie Adipozyten Induktionsmedium und Adipozyten-Erhaltungsmedium
- Für Adipozyten Induktionsmedium vorbereiten 1 l Serum-freies DMEM / F12 (mit Antibiotika von 1% P / S / A) mit folgendem Inhalt: 1 ml Insulin Lager (10 mg / ml HEPES-Puffer, pH 8), Endkonzentration = 10 & mgr; g / ml; 1 & mgr; l T3 Lager (3,3 ', 5-Triiod-L-thyronine, 1 mM in DMSO), Endkonzentration = 1 nM; 200 & mgr; l Transferrin Lager (50 mg / ml doppelt destilliertem H 2 O), Endkonzentration = 10 & mgr; g / ml; 100 & mgr; l Dexamethason Lager (10 mM in Ethanol), Endkonzentration = 1 & mgr; M; 100 ul Rosiglitazon Lager (10 mM in DMSO), Endkonzentration= 1 uM.
- Bereiten Sie Adipozyten Erhaltungsmedium mit den gleichen Zusätzen wie das Induktionsmedium, aber unter Weglassung von Dexamethason.
- Differenzierungsprozess für Adipozyten
Hinweis: Nach der Aussaat pADSC auf 6-Well-Platten, werden pADSC innerhalb von 72 h konfluent werden.- Nach 3 Tagen, entfernen Sie das Medium vollständig und fügen Sie dann 3 ml Adipozyten Induktionsmedium in jede Vertiefung. Bringen Sie die Platten in den Inkubator. Dies ist Tag Null der Differenzierung.
- Nach 3 Tagen entfernen mit 3 ml Adipozyten Erhaltungsmedium alle drei Tage die Adipozyten-Induktionsmedium vollständig und zu ersetzen. Ältere Adipozyten terminal um etwa 9 Tage differenziert werden. Über 90% der Adipozyten sind gut differenziert dieses Protokoll verwenden. Diese Adipozyten sind bereit für Oil Red O Färbung.
- Bereiten Sie Adipozyten Induktionsmedium und Adipozyten-Erhaltungsmedium
- Differenzierung von pADSC in Osteozyten
- Bereiten Sie osteocyte Induktionsmedium: alle Kultur medium (DMEM / F12 mit 10% FBS und 1% P / S / A), enthaltend 1 & mgr; M Dexamethason, 10 mM β-Glycerophosphat und 50 & mgr; g / ml Ascorbat-2-phosphat.
- Differenzierungsprozess für osteocytes
Hinweis: Nach der Aussaat pADSC auf 6-Well-Platten, werden pADSC innerhalb von 72 h konfluent werden.- Nach 3 Tagen, entfernen Sie das Medium vollständig und 3 ml osteocyte Induktionsmedium in jede Vertiefung. Bringen Sie die Platten auf dem 37 ° C Inkubator. Dies ist Tag Null der Differenzierung.
- Ersetzen mit osteocyte Induktionsmedium alle drei Tage. Ältere osteocytes wird durch einen 14-tägigen Differenzierung bilden. Diese Osteozyten sind bereit für Alizarin Red S-Färbung.
- Differenzierung von pADSC in Chondrozyten
- Bereiten Chondrozyten Induktionsmedium: & agr; MEM, das 1% FBS, 6,25 & mgr; g / ml Insulin, 50 ug / ml Ascorbat-2-phosphat und 10 ng / ml transformierender Wachstumsfaktor-β1.
- Differenzierungsprozess für Chondrozyten
- Nach der Aussaat pADSC auf 10-cm-Kulturschalen für 24 h, Kulturmedium vollständig zu entfernen und Geschirr spülen zweimal mit PBS.
- Trypsinize pADSC mit 1 ml 0,25% Trypsin-EDTA für 5 min und dann mit 1 ml Kulturmedium neutralisieren. Sammeln, zählen und justieren pADSC in 15 ml konischen Röhrchen mit einer Dichte von 2,5 × 10 5 Zellen pro Röhrchen. Verwenden Sie ein Hämozytometer die Zellen zu zählen.
- Nach Zentrifugation bei 400 × g für 7 min, den Überstand verwerfen, ohne das Pellet zu stören und 1 ml Chondrozyten-Induktionsmedium in einem 15-ml-Röhrchen hinzufügen. Das Rohr wird in den Inkubator 37 ° C zurückgeführt. Dies ist Tag Null der Differenzierung.
- Tauschen Sie die Chondrozyten-Induktionsmedium alle drei Tage ohne Zellen auf dem Boden zu entfernen. Ältere Chondrozyten werden in etwa 14 Tage bilden. Diese Chondrozyten sind bereit für Toluidinblau-O-Färbung.
6. Färbung von Differentiated Adipozyten, Osteocytes und Chondrozyten
- Oil Red O Färbung für differenzierte Adipozyten
- Am Tag 9, Adipozyten Erhaltungsmedium in 6-Well-Kulturplatten mit differenzierten Adipozyten entfernen und dann die Platte zweimal mit PBS waschen. [In den folgenden Schritten fügen genug bezeichneten Reagenzien jede Vertiefung der 6-Well-Platte zu bedecken.]
- Fix Adipozyten mit 10% Formalin-Lösung für mindestens 10 min.
- Entfernen Sie die 10% Formalin-Lösung und waschen Sie die Platte zweimal mit doppelt destilliertem Wasser.
- Nach zwei Wäschen 100% Propylenglykol zu der Kulturplatte hinzufügen und lassen Sie 1 min lang stehen.
- Entfernen Sie die 100% Propylenglykol und dann Oil Red O-Lösung (0,5% in Propylenglykol) mit der Kulturplatte hinzuzufügen. mindestens 10 min auf einer Wippe Schüttler stehen unter leichtem Schütteln (100 Umdrehungen pro Minute) Es sei.
- Entfernen Sie die Oil Red O-Lösung und dann mit 60% Propylenglykol ersetzen. Lassen Sie für 1 min stehen.
- Entfernen Sie die 60% Propylenglykol und dann waschen Sie die Platte zweimal mit double-destilliertes Wasser.
- Ersetzen Sie mit 10% Formalin-Lösung. Die gefärbten Lipidtröpfchen innerhalb von Adipozyten sind bereit für die Beobachtung durch Lichtmikroskopie.
- Die Quantifizierung der intrazellulären Oil Red O (optionale Schritte unten): Nach der mikroskopischen Beobachtung, entfernen Sie 10% Formalin-Lösung und waschen Sie die Platte zweimal mit doppelt destilliertem Wasser.
- Lassen Sie die Platte vollständig und fügen 500 ul Isopropanol zu der 6-Well-Platte.
- Lassen Isopropanol stehen in 6-Well-Platte auf einem sanften rocker Schüttler (100 rpm) für mindestens 10 min, den Farbstoff von Oil Red O. aufzulösen
- Saugen Sie das Isopropanol Oil Red O enthält, und verteilen auf einer 96-Well-Platte. Quantifizieren der extrahierten Oil Red O, um eine photometrische Messung bei 510 nm verwendet wird.
- Alizarin Red S-Färbung für eine differenzierte osteocytes
- Am Tag 14, osteocyte Induktionsmedium aus 6-Well-Platten mit differenzierten Osteozyten und waschen Sie die Platten zweimal mit PBS zu entfernen. [In den following Schritte, genug bezeichnet Reagenzien hinzufügen jede Vertiefung der 6-Well-Platte zu bedecken.]
- Fix Osteozyten in 10% Formalin-Lösung für mindestens 10 min.
- Entfernen Sie die 10% Formalin-Lösung aus jeder Vertiefung und waschen Sie die Platte zweimal mit doppelt destilliertem Wasser.
- Nach zwei Wäschen, fügen Sie 2% Alizarin Red S-Lösung (pH = 4,1-4,3) mit dem 6-Well-Platte und lassen Sie sich für mindestens 15 Minuten lang auf einem sanften Rocker Schüttler (100 rpm) stehen.
- Entfernen Sie die Alizarin Red S-Lösung und dann waschen Sie die Platte zweimal mit doppelt destilliertem Wasser.
- Ersetzen Sie mit 10% Formalin-Lösung. Osteozyten sind für die Beobachtung durch Lichtmikroskopie bereit.
- Toluidinblau-O-Färbung für differenzierte Chondrozyten
- Am Tag 14, absaugen Chondrozyten Induktionsmedium aus dem 15 ml konischen Röhrchen ohne Sedimente von differenzierten Chondrozyten in dem Boden des Röhrchens und wasche das Röhrchen zweimal mit PBS entfernt. [In den folgenden Schritten fügen genug bezeichneten Reagenzien Buchtr Chondrozyten in dem Boden des Röhrchens oder auf dem Abschnitt Folie.]
- Fix Chondrozyten in 10% Formalin-Lösung für mindestens 10 min.
- Entfernen Sie die 10% Formalin-Lösung aus jedem Röhrchen und waschen Sie die Röhrchen zweimal mit doppelt destilliertem Wasser.
- Nach zwei Wäschen einzubetten Pellets in OCT-Verbindung und Abschnitt mit einem Kryostaten bei einer Dicke von 5 um.
- Beflecken der Schieber des Kryostatschnitten mit Toluidinblau O-Lösung (0,1% bei pH 4,1).
- Entfernen Sie Toluidinblau O-Lösung und dann waschen Sie den Abschnitt zweimal mit doppelt destilliertem Wasser.
Hinweis: Chondrozyten auf Folien zur Beobachtung bereit sind, durch Lichtmikroskopie.
Ergebnisse
Die pADSC abgeleitet aus Schweine dorsalen subkutanen Fettgewebes wurden auf den Kulturplatten oder Schalen ausgesät und in 2. Die Morphologie der pADSC vom Stroma vaskulären Fraktion ähnelt Maus oder Mensch abgeleitet ADSC gezeigt. Vierundzwanzig Stunden nach dem Aussäen subkonfluenten pADSC eingehalten und haben eine erweiterte fibroblastenartige Morphologie (2A). Die pADSC wird konfluieren innerhalb von 72 h und sind bereit für Adipozyten oder andere mesenchymale-Typ Differenzierung (2B). pADSC zeigen starke adipogenetische Potential nach der chemischen Induktion und reifen Adipozyten kann nach 9 Tagen der Differenzierung mit mehr als 90% der pADSCs zeigt adipogenetische Differenzierung (Abbildung 2C) beobachtet werden.
Um die Eigenschaften von pADSC in diesem Protokoll ergeben adressieren, Oberflächenmarker von pADSC wurden mittels Durchflusszytometrie bewertet anallyse. Wie in 3 gezeigt ist , Oberflächenmarker für mesenchymale Stammzellen, einschließlich CD29, CD44, CD90 und MHC I (oder HLA I) wurden stark exprimiert. Negative Oberflächenmarker, wie CD4a, CD31, CD45 und MHC II (oder HLA II) waren kaum in pADSC detektierbaren abgeleitet in dem Protokoll (Abbildung 3). Diese Ergebnisse zeigen, dass diese pADSC zeigen mesenchymalen-Typ Stammzelleigenschaften ohne signifikante endothelialen oder hämatopoetischer Stammzellen Kontamination, einschließlich myeloischer oder lymphatischen Vorläufern.
Um sicherzustellen, dass pADSC mesenchymalen Stammzellen darstellen, wurde die Multipotenz von pADSC durch Differenzierung zu Adipozyten, Osteozyten und Chondrozyten untersucht. Diese Adipozyten, Osteozyten und Chondrozyten wurden gefärbt durch spezifische Farbstoffe, Oil Red O, Alizarin Red S, und Toluidinblau O, bzw. (Abbildung 4). Diese Daten zeigen, dass dieses Protokoll pADSC erzeugt, die mu beibehaltenltipotency mit voller Eigenschaften mesenchymalen-Typ Vorläufern ähnelt.
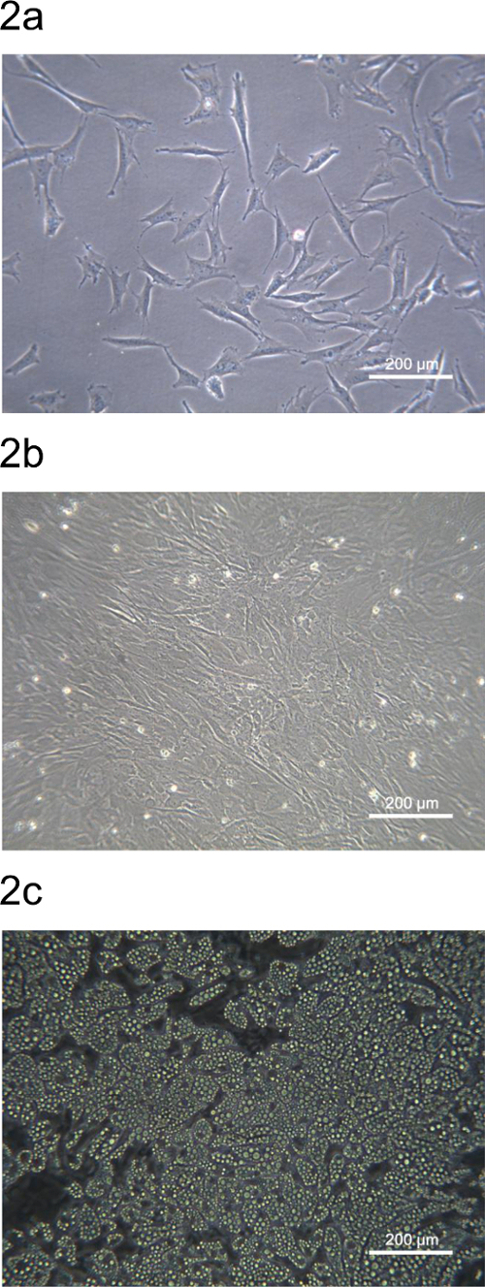
Abbildung 2. Morphologie der pADSC aus Schweinerückenfett Region. (A) Subkonfluierende pADSC geklebt und breiteten sich nach 24-h - Aussaat auf einer 6-Well - Kulturplatte. (B) pADSC wurde nach 72-h Seeding konfluent auf einer 6-Well - Kulturplatte. (C) Mature Adipozyten wurden nach 9 Tagen adipogenetische Differenzierung von pADSC beobachtet. Bilder bei 100 - facher Vergrößerung aufgenommen wurden Phasenkontrast - Mikroskopie. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
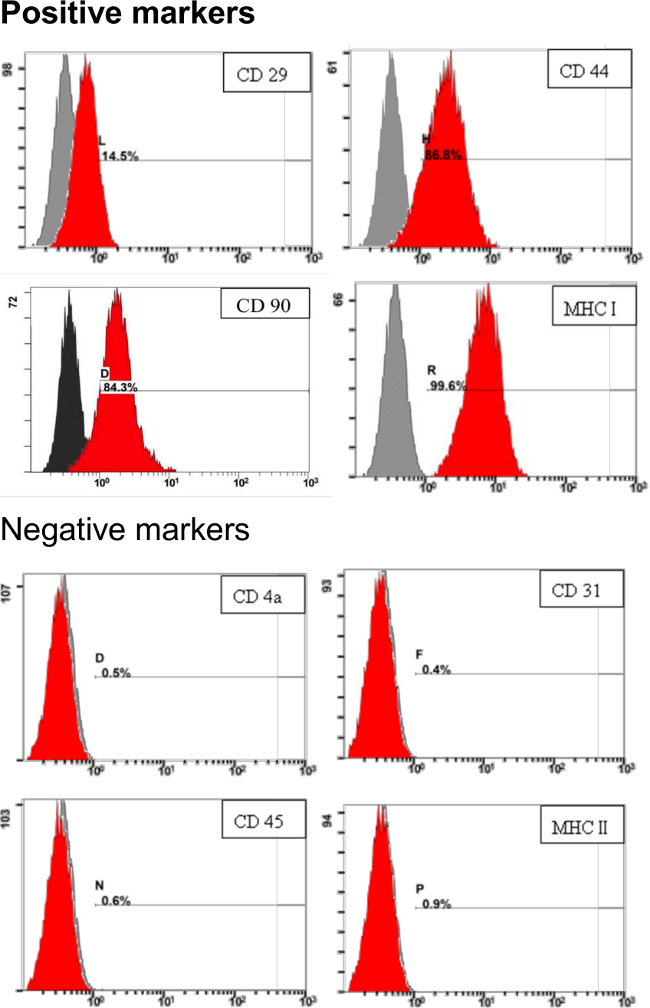
Abbildung 3. Identifizierung von StammzellOberflächenmarker für pADSC. 1 x 10 5 von pADSC wurden mit spezifischen Antikörpern und analysiert für die Stammzellmarker durch Durchflusszytometrie - Analyse umgesetzt. Die Zahlen geben den Prozentsatz der gefärbten Zellen in der Population (rot) im Vergleich mit der ungefärbten Kontrolle. Die x-Achse stellt die relative Fluoreszenzintensität. Die y-Achse stellt die Population von Zellen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
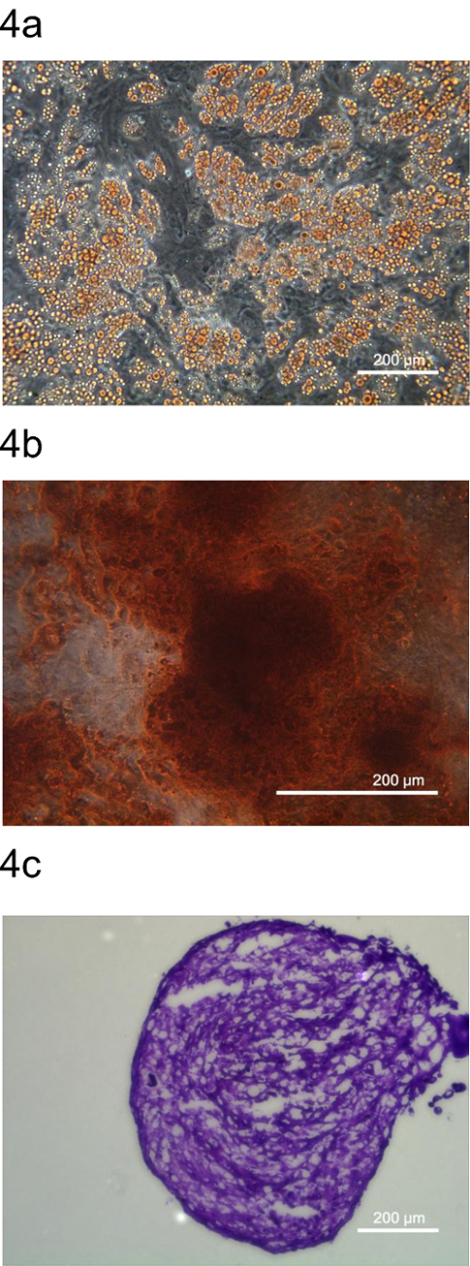
Abbildung 4. Differenzierung von multipotenten pADSC. Multipotenz von pADSC wurde durch Differenzierung pADSC in (A) Adipozyten bestimmt, (B) Osteozyten (C) Chondrozyten und gefärbt durch repräsentative Farbstoffe, Oil Red O, Alizarin Red S, und Toluidinblau O, jeweils . Images wurden bei (A) genommen 100 x (B) 200 x, und (C) 100 - facher Vergrößerung unter Verwendung von Phasenkontrastmikroskopie dar. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Hier präsentieren wir eine zuverlässige Zellensystem zu studieren Entwicklung Fettgewebe in der primären Zellkultur von pADSC. Im Vergleich zu anderen immortalisierten Zelllinien, stellt dieses Verfahren eine bequeme Weise große Mengen qualitativ hochwertige adulten mesenchymalen Stammzellen zu isolieren , die angewendet werden können Differenzierungsprozesse von Adipozyten oder anderen mesenchymalen Abstammungslinien im Zusammenhang mit Tier Entwicklung in vivo zu studieren. Der kritische Schritt in diesem modifizierten Protokoll ist , dass wir pADSC mit einem 7- bis 9-Tage alte Ferkel herzuleiten , weil es leicht ist, die kleinen Ferkel zu handhaben im Vergleich zu älteren Schweinen und ähnlich wie bei anderen Arten 19,20, die Ausbeute und der Multipotenz pADSC abnimmt , wenn die Schweine im Alter von 21.
Potenzielle Stammzellquellen umfassen embryonale Stammzellen (ESC), induzierte pluripotente Stammzellen (iPS) und postnatale adulten Stammzellen. Die Einschränkung von ADSC, als erwachsene multipotenter Stammzellen eingestuft, ist, dass Multipotenz von adulten Stammzellenin divergenten Linien Differenzierung relativ ist mit ESC oder iPSC begrenzt verglichen. Allerdings ethische Fragen Ableitung von ESC in Bezug auf und onkogenen Eigenschaften von iPS begrenze die Anwendung von ESC und iPSC 22,23. Aus diesem Grund haben zahlreiche Forscher an adulten Stammzellen mit Bemühungen konzentriert Pluripotenz zu verbessern. Die häufigste Ursache von adulten mesenchymalen Stammzellen (MSC), die lange Zeit untersucht wurde, ist Knochenmark stammenden mesenchymalen Stammzellen 24. Allerdings ist die Ernte des Knochenmarks eine relativ schmerzhafte Prozedur betrachtet. Ein weiteres Problem ist, dass die Ausbeute von Stammzellen aus dem Knochenmark endlich ist. Knochenmarkaspirate ergeben einen Durchschnitt von 6 × 10 6 nukleierten Zellen pro ml, und die MSC nur repräsentieren 0,001 bis 0,01% aller kernhaltigen Zellen. Nachdem diese Nachteile bedenkt, ist ADSC als weniger aufdringliche Quelle vorgeschlagen 25,26 multipotenten Stammzellen zu erhalten.
Beschränkungen für die Benutzung von ADSC in regenerative Medizin sind zu einem großen Teil auf die Zellausbeute und -qualität abhängig. Daher ist die Bedeutung Schweine der Verwendung ADSC in diesem Protokoll zu isolieren, die eine große Menge an hochwertigen adulten Stammzellen zu erhalten. Das Schwein ist ein nützliches Tiermodell Menschen wegen der vergleichbaren Organgröße und viele physiologische und biochemische Ähnlichkeiten zwischen den Arten repräsentieren 27-30. Der Erwerb hADSC von Unternehmen der gewerblichen Wirtschaft ist teuer und in vielen Fällen wurden die Zellen manipuliert worden, agierten oder kryokonserviert. humanen klinischen Proben zu erwerben ist relativ schwierig, weil ethische Fragen und die Produktion von ADSC ist begrenzt. Wir leiten ungefähr 6 x 10 5 hADSC pro g Fett nach Collagenaseverdau. Mit 100 g der weiblichen Brust Fettgewebe (durchschnittlich sampling), insgesamt 6 x 10 7 Zellen können geerntet werden. Unter Verwendung einer einzelnen Maus ist die Ausbeute noch geringer. Eine Gesamtzahl von 1 x 10 6 Zellen aus 0,4 g des subkutanen Maus i geerntetnguinal Fettgewebe aus beiden Beinen eines Erwachsenen FVB-Maus (6-8 Wochen alt). Jedoch in einem einzelnen Schweins (7 bis 9 Tage alt), insgesamt 2 x 10 8 Zellen leicht von 60 g des subkutanen Fettgewebes von der dorsalen Fettdepot erhalten geerntet werden. Die pADSC in diesem Protokoll ergeben, haben die volle mesenchymalen-Typ Multipotenz und entsprechenden mesenchymalen Stammzellmarker. Daher sind pADSC eine günstige Quelle großer Mengen von adulten Stammzellen zu erhalten, ohne Stammzellqualität zu beeinträchtigen.
Die Anwendung von pADSC ist nicht auf Entzifferung Adipocytendifferenzierung einschließlich adipogenesis und Lipogenese beschränkt. Vor kurzem haben ADSC eine beliebte Quelle von Stammzellen auf dem Gebiet der regenerativen Medizin 22,31,32 werden. Im Vergleich zu anderen Stammzellquellen behalten ADSC einen einzigartigen Vorteil, leicht zugänglich und reichlich zu sein, und ihre robuste Multipotenz hat sich gezeigt, eine vielversprechende Quelle für die Stammzelltherapie und Gewebe e zu seinngineering 22,33,34. Die leichte Erreichbarkeit des Fettgewebes macht ADSC eines der am wenigsten aufdringliche Art und Weise multi Vorläufern zu bekommen. Vor kurzem unterschieden wir pADSC in Glukose-responsive insulinsezernierenden Clustern angibt, dass pADSC sind nicht auf mesenchymale Differenzierung begrenzt (nicht veröffentlichte Daten). Andere haben auch gezeigt, dass ADSC von anderen Keimschichten, wie endodermaler Hepatozyten (von hADSC 35 oder pADSC 36) oder ektodermalen Neuronen (von hADSC 37 oder pADSC 38) abgeleitet in vielen Zelltypen unterschieden werden. Somit werden pADSC könnte für die Hochdurchsatz-Wirkstoff oder Biomaterial-Screening durch Richten Zellen zu unterschiedlichen Differenzierungsprozessen verwendet, um die gewünschten Linien ergeben. Daher wird in diesem Protokoll abgeleitet pADSC haben potentielle Anwendung in der Stammzelltherapie und Gewebetransplantation für die regenerative Medizin Forschung.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Autoren danken Dank für die ausführliche Diskussion zu allen Labor-Mitglieder zum Ausdruck bringen und Technik unterstützt in diesem Protokoll. Die Forschung im Labor durchgeführt wurde unterstützt durch Zuschüsse aus Ministerium für Wissenschaft und Technologie (MOST 103-2314-B-002-126 und MOST 102-2313-B-002-026-MY3) und durch Zuschüsse aus Ziel für den Top-Universität-Plan unterstützt (104R350144) der National University, Taiwan.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Collagenase, Type II | Sigma-Aldrich | C6885 | |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-001-1 | |
| Penicillin-Streptomycin-Amphotericin B (P/S/A) solution | Biological Industries | 03-033-1 | For antibiotics and antimycotic usage |
| αMEM, no nucleosides | Life Technologies | 12561-049 | |
| ACK lysis buffer | Life Technologies | A10492-01 | |
| Trypsin-EDTA (0.25%), phenol red | Life Technologies | 25200072 | |
| CD4a-PE | Sigma-Aldrich | SAB4700063 | |
| CD29-PE | Sigma-Aldrich | SAB4700398 | |
| CD31-PE | Sigma-Aldrich | SAB4700467 | |
| CD44-PE | Sigma-Aldrich | SAB4700183 | |
| CD45-PE | Sigma-Aldrich | SAB4700483 | |
| CD90-PE | Sigma-Aldrich | SAB4700686 | |
| HLA Class I-PE (MHC I) | Sigma-Aldrich | SAB4700640 | |
| HLA-DR-PE (MHC II) | Sigma-Aldrich | SAB4700662 | |
| Insulin | Sigma-Aldrich | I9278 | |
| 3,3',5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| Transferrin | Sigma-Aldrich | T2036 | |
| 3-isobutyl-1-methylxanthine (IBMX) | Sigma-Aldrich | I7018 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Rosiglitazone | Cayman | 71740 | |
| β-Glycerophosphate | Sigma-Aldrich | G9422 | |
| 2-Phospho-L-ascorbic acid | Sigma-Aldrich | 49752 | |
| TGFB1 Recombinant Human Protein | R&D Systems | 240-B-002 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Carbon Steel Blades | Thomas Scientific | 6727C18 | |
| Falcon 100 µm cell strainer | Corning | 352360 | |
| Falcon 6-well plate | Corning | 353046 | |
| Falcon 100 mm dish | Corning | 353003 |
Referenzen
- Farese, R. V., Zechner, R., Newgard, C. B., Walther, T. C. The Problem of Establishing Relationships between Hepatic Steatosis and Hepatic Insulin Resistance. Cell Metab. 15, 570-573 (2012).
- Taubes, G. Cancer research. Unraveling the obesity-cancer connection. Science. 335 (28), 30-32 (2012).
- Apovian, C. M., Gokce, N. Obesity and cardiovascular disease. Circulation. 125, 1178-1182 (2012).
- Glass, C. K., Olefsky, J. M. Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metab. 15, 635-645 (2012).
- Rosen, E. D., Spiegelman, B. M. Adipocytes as regulators of energy balance and glucose homeostasis. Nature. 444, 847-853 (2006).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metabolism. 4, 263-273 (2006).
- Aune, U. L., Ruiz, L., Kajimura, S. Isolation and Differentiation of Stromal Vascular Cells to Beige/Brite Cells. J Vis Exp. , (2013).
- Hsu, J. M., Ding, S. T. Effect of polyunsaturated fatty acids on the expression of transcription factor adipocyte determination and differentiation-dependent factor 1 and of lipogenic and fatty acid oxidation enzymes in porcine differentiating adipocytes. Brit J Nutr. 90, 507-513 (2003).
- Hsu, J. M., Wang, P. H., Liu, B. H., Ding, S. T. The effect of dietary docosahexaenoic acid on the expression of porcine lipid metabolism-related genes. J Anim Sci. 82, 683-689 (2004).
- Liu, B. H., Kuo, C. F., Wang, Y. C., Ding, S. T. Effect of docosahexaenoic acid and arachidonic acid on the expression of adipocyte determination and differentiation-dependent factor 1 in differentiating porcine adipocytes. J Anim Sci. 83, 1516-1525 (2005).
- Ou, J. F., et al. Unsaturated fatty acids inhibit transcription of the sterol regulatory element-binding protein-1c (SREBP-1c) gene by antagonizing ligand-dependent activation of the LXR. P Natl Acad Sci USA. 98, 6027-6032 (2001).
- Sekiya, M., et al. Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP-1 suppression. Hepatology. 38, 1529-1539 (2003).
- Xu, J., Nakamura, M. T., Cho, H. P., Clarke, S. D. Sterol regulatory element binding protein-1 expression is suppressed by dietary polyunsaturated fatty acids - A mechanism for the coordinate suppression of lipogenic genes by polyunsaturated fats. J Biol Chem. 274, 23577-23583 (1999).
- Ding, S. T., McNeel, R. L., Mersmann, H. J. Conjugated linoleic acid increases the differentiation of porcine adipocytes in vitro. Nutr Res. 20, 1569-1580 (2000).
- Ding, S., Mersmann, H. J. Fatty acids modulate porcine adipocyte differentiation and transcripts for transcription factors and adipocyte-characteristic proteins. J Nutr Biochem. 12, 101-108 (2001).
- Liu, L. R., et al. Serum amyloid A induces lipolysis by downregulating perilipin through ERK1/2 and PKA signaling pathways. Obesity (Silver Spring. 19, 2301-2309 (2011).
- Chen, Y. J., et al. Docosahexaenoic acid suppresses the expression of FoxO and its target genes. J Nutr Biochem. 23, 1609-1616 (2012).
- Lin, Y. Y., et al. Modulation of glucose and lipid metabolism by porcine adiponectin receptor 1-transgenic mesenchymal stromal cells in diet-induced obese mice. Cytotherapy. 15, 971-978 (2013).
- Schipper, B. M., Marra, K. G., Zhang, W., Donnenberg, A. D., Rubin, J. P. Regional anatomic and age effects on cell function of human adipose-derived stem cells. Ann Plast Surg. 60, 538-544 (2008).
- Efimenko, A., et al. Adipose-Derived Mesenchymal Stromal Cells From Aged Patients With Coronary Artery Disease Keep Mesenchymal Stromal Cell Properties but Exhibit Characteristics of Aging and Have Impaired Angiogenic Potential. Stem Cell Transl Med. 3, 32-41 (2014).
- Akanbi, K. A., Brodie, A. E., Suryawan, A., Hu, C. Y. Effect of age on the differentiation of porcine adipose stromal-vascular cells in culture. J Anim Sci. 72, 2828-2835 (1994).
- Mizuno, H., Tobita, M., Uysal, A. C. Concise Review: Adipose-Derived Stem Cells as a Novel Tool for Future Regenerative Medicine. Stem Cells. 30, 804-810 (2012).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Cir Res. 100, 1249-1260 (2007).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived Stem Cells: Current Findings and Future Perspectives. Discov Med. 57, 160-170 (2011).
- Baer, P. C. Adipose-Derived Stem Cells and Their Potential to Differentiate into the Epithelial Lineage. Stem Cell Dev. 20, 1805-1816 (2011).
- Kakudo, N., et al. Adipose-derived regenerative cell (ADRC)enriched fat grafting: optimal cell concentration and effects on grafted fat characteristics. J Transl Med. 11, (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. Int J Biol Sci. 3, 179-184 (2007).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically Engineered Pig Models for Human Diseases. Annu Rev Anim Biosci. 1, 203-219 (2013).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Ann Ny Acad Sci. 1049, 161-171 (2005).
- Wolf, E., et al. Transgenic pigs as models for translational biomedical research. Transgenic Res. 20, 1150-1150 (2011).
- Lindroos, B., Suuronen, R., Miettinen, S. The Potential of Adipose Stem Cells in Regenerative Medicine. Stem Cell Rev Rep. 7, 269-291 (2011).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Circ Res. 100, 1249-1260 (2007).
- Cignarelli, A., et al. Human adipose tissue stem cells: relevance in the pathophysiology of obesity and metabolic diseases and therapeutic applications. Expert Rev Mol Med. 14, (2012).
- Cawthorn, W. P., Scheller, E. L., MacDougald, O. A. Adipose tissue stem cells: the great WAT hope. Trends Endocrinol Metab. 23, 270-277 (2012).
- Banas, A., et al. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 46, 219-228 (2007).
- Bruckner, S., et al. A fat option for the pig: hepatocytic differentiated mesenchymal stem cells for translational research. Exp Cell Res. 321, 267-275 (2014).
- Anghileri, E., et al. Neuronal Differentiation Potential of Human Adipose-Derived Mesenchymal Stem Cells. Stem Cells Dev. 17, 909-916 (2008).
- Huang, T. T., He, D. S., Kleiner, G., Kuluz, J. Neuron-like differentiation of adipose-derived stem cells from infant piglets in vitro. J Spinal Cord Med. 30, S35-S40 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten