Method Article
Isolamento e differenziazione delle cellule staminali derivate da tessuto adiposo sottocutaneo da Suini tessuti adiposi
In questo articolo
Riepilogo
This protocol describes the isolation of pig adipose-derived stem cells (pADSC) from subcutaneous adipose tissues with examination of multipotency. The multipotent pADSC are used to delineate processes of adipocyte differentiation and study transdifferentiation into multiple cell lineages of mesodermal mesenchyme or further lineages of ectoderm and endoderm for regenerative studies.
Abstract
Obesity is an unconstrained worldwide epidemic. Unraveling molecular controls in adipose tissue development holds promise to treat obesity or diabetes. Although numerous immortalized adipogenic cell lines have been established, adipose-derived stem cells from the stromal vascular fraction of subcutaneous white adipose tissues provide a reliable cellular system ex vivo much closer to adipose development in vivo. Pig adipose-derived stem cells (pADSC) are isolated from 7- to 9-day old piglets. The dorsal white fat depot of porcine subcutaneous adipose tissues is sliced, minced and collagenase digested. These pADSC exhibit strong potential to differentiate into adipocytes. Moreover, the pADSC also possess multipotency, assessed by selective stem cell markers, to differentiate into various mesenchymal cell types including adipocytes, osteocytes, and chondrocytes. These pADSC can be used for clarification of molecular switches in regulating classical adipocyte differentiation or in direction to other mesenchymal cell types of mesodermal origin. Furthermore, extended lineages into cells of ectodermal and endodermal origin have recently been achieved. Therefore, pADSC derived in this protocol provide an abundant and assessable source of adult mesenchymal stem cells with full multipotency for studying adipose development and application to tissue engineering of regenerative medicine.
Introduzione
L'obesità, presente in circa il 30% della popolazione degli Stati Uniti, con un indice di massa corporea superiore a 30, è emerso come un fenomeno mondiale diffusa 1. L'obesità tende a portare a complicazioni legate tra cui le malattie cardiovascolari, il diabete di tipo 2 e cancro 2-4. Pertanto, si occupano di obesità è una priorità importante. L'obesità si manifesta con massiccia espansione del tessuto adiposo, ed è attribuita ad un eccessivo consumo di cibo e di uno stile di vita sedentario nella società moderna. Quindi, decifrare la regolazione trascrizionale di adipogenesis e lipogenesi potrebbe promettenti per trattare l'obesità o il diabete 5.
Il 3T3-L1, 3T3-F442A e altri mouse adipogenico linee cellulari sono state applicate per studiare adipogenesi o lipogenesi durante lo sviluppo del tessuto adiposo. Tuttavia, ci sono alcune discrepanze nei meccanismi di regolazione tra le linee di cellule in vitro e negli animali in vivo 6. Primaria adiposo-deriLe cellule staminali ved (ADSC) nella frazione di cellule stromali-vascolari possono essere isolati direttamente da tessuti adiposi bianchi e indotte a differenziarsi. Differenziazione delle ADSC in adipociti molto probabilmente racchiude in sintesi il processo di adipogenesis e lipogenesi nello sviluppo di tessuto adiposo in vivo 7.
I maiali sono un modello animale adatto per lo studio adipogenesis e la lipogenesi nello sviluppo di tessuto adiposo. I nostri studi precedenti suina 8-10 dimostrano che l'espressione di steroli normativo elemento vincolante fattore di trascrizione 1c (SREBP1c), un importante fattore di trascrizione noto per modulare la trascrizione di lipogenic acido grasso sintasi, è inibita da acidi grassi polinsaturi (PUFA) nel fegato di maiale e tessuti adiposi. L'espressione di SREBP1c porcine diminuito di PUFA in vivo ed in vitro è simile ad altre specie, come gli esseri umani e topi 11-13. Questi studi maiale in vitro sono principalmente in diffadipociti erentiated derivati da ADSC suina (pADSC). Pertanto, questa coltura cellulare primaria di pADSC può essere usato per servire come un sistema cellulare affidabile per studiare lo sviluppo del tessuto adiposo o altre applicazioni cellule staminali.
Protocollo
Nota: Questo metodo è stato stabilito e utilizzato nella ricerca riportata in precedenza 14-17 da questo laboratorio; nel corso del tempo è stata modificata la metodologia. L'attuale procedura è stata eseguita utilizzando una media di 60 g di tessuto adiposo sottocutaneo suina da un suinetto (7 a 9 giorni) con semina il 6-pozzetti di coltura tissutale. Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato. Tutti gli esperimenti sugli animali sono stati approvati dalla cura e l'uso degli animali Comitato Istituzionale (IACUC) al National Taiwan University.
1. Preparare digestione Media
- Ottenere tessuto adiposo sottocutaneo del collo e della schiena; 40 a 80 g per suinetto (7 a 9 giorni di età), a seconda delle dimensioni dei suini. Qui, utilizzare 60 g di tessuto adiposo sottocutaneo ottenuti da un suino.
- Preparare medio digestione: pesare collagenasi II in polvere con un totale di 54.000 unità e scioglierlo in 90 ml di Modified Eagle Medium di Dulbecco (DMEM,per 60 g di grasso) in un flacone da 100 ml sierologico (900 unità di collagenasi / 1,5 ml DMEM / g di grasso).
- Agitare delicatamente il mezzo di digestione su un tavolo shaker (100 rpm) per almeno 15 minuti per sciogliere e quindi passare il mezzo di digestione attraverso un filtro di 0,22 micron per la sterilizzazione. Conservare a 4 ° C prima dell'uso.
2. Dissect sottocutaneo adiposo tessuti dai suini
- Sterilizzare tutti gli strumenti, vetro e oggetti in plastica e caldo tutti i media a 37 ° C prima dell'uso.
- Sacrificare il maialino con elettrica dissanguamento mozzafiato e oppure utilizzando un metodo in conformità con le normative locali IACUC. Eseguire con attenzione e subito dopo la dissezione maialini vengono sacrificati.
- Posare il maialino su un tavolo operatorio pulito (posteriore rivolto verso l'alto e verso il basso ventre). Radersi i capelli dal porcellino indietro rimuovendo tutti i capelli dal collo alla coda e su entrambi i lati fino alla linea mediana.
- Scrub pelle dorsale del maiale con il 7,5% povidoneiodio tre volte (con tre nuovi indipendenti-scrub) e quindi consentire lo iodio per sedersi sulla superficie della pelle per circa 10 min.
- Rimuovere il iodopovidone con più spruzzi di etanolo al 70%. Utilizzare garze o veline che contengono il 70% di etanolo per pulire la pelle in una direzione, ripetendo fino a quando non si osservano colore evidente di iodopovidone.
- Utilizzare un bisturi per separare lo strato di grasso dorsale suino da tessuti adiposi sottocutanei insieme con lo strato di pelle attaccata dai muscoli mentre si tiene il grasso e la pelle con pinze.
- immergere immediatamente lo strato di grasso da tessuti adiposi sottocutanei con pelle attaccato in un becher sterilizzato (200 ml) contenente DMEM senza siero.
- Spruzzare la parte esterna del bicchiere contenente lo strato di grasso con il 70% di etanolo e posto in una cappa di coltura cellulare a flusso laminare. Mettere un grande (40 cm x 30 cm) sterilizzato triplo strato di foglio di copertura nella cappa. [Un triplo strato è usato per assicurare l'integrità continua.]
- Posiziona ilil tessuto con la pelle rivolta verso il basso sul foglio di copertina.
- Tagliare il tessuto muscolare residua fuori del tessuto adiposo con pinze e forbici per evitare la contaminazione con il tessuto muscolare.
- Tagliare il grasso in pezzi quadrati (~ 7 cm x 7 cm) con un bisturi o forbici. Mettere questi pezzi di strato di grasso in un nuovo bicchiere sterilizzato (200 ml) contenente DMEM senza siero.
- Impostare un supporto fetta personalizzato sulla pellicola coperchio montato con una lama affettatrice in acciaio al carbonio (Figura 1). Prendere un pezzo di grasso fuori del bicchiere e posizionarlo sul affettatrice (strato di pelle sulla parte superiore e grassi strato sottostante).
- Tagliare lo strato di grasso da tessuti adiposi sottocutanei in circa 1 millimetro di spessore pezzi. Tagliare lo strato di grasso dalla pelle più vicino possibile, ma evitare affettare la pelle.
- Mince affettato tessuti adiposi con le forbici più fine possibile.
- Aggiungere mezzo digestione filtrato contenente collagenasi a una beuta da 250 ml o una bottiglia sierologico con tritatotessuti adiposi (54.000 unità di collagenasi / 90 ml DMEM / 60 g di grasso).
- Incubare e agitare beuta a 45 rpm in un agitatore orbitale per 90 min a 37 ° C per permettere la collagenasi di digerire i tessuti.
Nota: Controllare ogni 15 a 30 minuti per evitare un eccesso di digestione. Il processo di digestione si completa se il mezzo di digestione è un impasto senza grumi di tessuto significativi. - Aggiungere un volume uguale (uguale al mezzo digestione) di terreno di coltura contenente DMEM / F12 con il 10% di siero fetale bovino (FBS) per arrestare la digestione collagenasi.

Figura 1. Una affettatrice personalizzato utilizzato per l'isolamento di pADSC. Dissected tessuti adiposi da suino dorsali tessuti adiposi sottocutanei sono composti dello strato di grasso con strati di pelle attaccati. Una affettatrice è necessaria per tagliare lo strato di grasso di circa 1 millimetro di spessore con evitamento di sovra-affettare negli strati della pelle. Da sinistra a destra: titolare fetta, pad affettatrice, lama in acciaio al carbonio affettatrice, e le viti. Lama affettatrice è inserito tra il titolare fetta e pad affettatrice quando assemblato. Clicca qui per vedere una versione più grande di questa figura.
3. Raccolta di pADSC dalla frazione stromale-vascolare
- Passare il mezzo di digestione contenente tessuti adiposi digeriti attraverso un singolo strato di chiffon in un matraccio da 250 ml Erlenmeyer pulito sterilizzato o una bottiglia sierologico 250 ml. Utilizzare una pinza a deprimere la metà del chiffon per guidare e assistere il passaggio del digest.
- Scolare e torcere la chiffon con una pinza per completare il passaggio.
- Distribuire il mezzo di digestione in quattro provette da 50 ml per centrifuga coniche (~ media 40 ml per provetta).
- Centrifugare a 700 xg per 10 minuti per raccogliere il pellet di cellule stromali-vascolare.
- Decantare il surnatante senza disturbare il pellet per rimuovere la maggior parte dello strato di grasso superiore contenente adipociti maturi. Lavare il pellet aggiungendo 10 ml DMEM in ciascuna provetta per risospendere il pellet con pipettaggio e leggero scuotimento del tubo.
- Centrifugare a 700 g per 6 min. Decantare il surnatante.
- Aggiungere 10 ml di tampone di lisi ACK e poi risospendere il pellet pipettando. Lasciare riposare per 7 minuti (da 5 a 10 min) a temperatura ambiente per lisare i globuli rossi nella frazione stromale-vascolare.
- Aggiungere stessa quantità di DMEM (10 ml) per arrestare la reazione agitando delicatamente del tubo e centrifugare a 700 xg per 10 min.
- Decantare il surnatante, aggiungere 10 ml di DMEM in ogni provetta, risospendere il pellet con ripetuti pipettaggio, e centrifugare a 700 g per 6 min. Ripetere due volte.
- Raccogliere e passare il DMEM (totale di 40 ml DMEM da 4 tubi in rappresentanza di 60 g di grasso) con le cellule in sospensione attraverso un colino 100 micron in un nuovo tubo da 50 ml.
- Delicatamente pipetta medium più volte per mescolare bene e un'aliquota di 20 ml di mezzo di cellule contenenti mescolato con 180 ml di soluzione di blu trypan 0,4% (diluizione 1:10) in un nuovo 1,5 ml provetta Eppendorf.
- Contare le cellule con un emocitometro e poi seme pADSC ad una densità di 60.000 cellule / cm 2 su un formato desiderata del piatto cultura o piastra con terreno di coltura contenente DMEM / F12, 10% di siero fetale bovino (FBS) e 1% di antibiotici di penicillina soluzione B -streptomycin-amfotericina (P / S / A). In generale, seminare il pADSC sui 6 pozzetti piastre di coltura dei tessuti per adipociti o differenziazione osteociti. Seed il pADSC su piatti di 10 cm per marcatore di superficie colorazione delle cellule staminali o di differenziazione dei condrociti.
- Incubare le piastre o piatti nel 37 ° C incubatore in aria con 5% di CO 2 per consentire l'adesione delle cellule alle piastre.
4. Identificazione di superficie sulle cellule staminali Marcatori di pADSC mediante citometria di flusso
- Dopo 24 ore, rimuovere completamente il medium, lavare °e 10-cm pietanza due volte con soluzione salina tamponata con fosfato (PBS), e le cellule raccolto con 1 ml di 0,25% tripsina-EDTA per 5 min a 37 ° C.
- Neutralizzare tripsina-EDTA con pari quantità di terreno di coltura (1 ml), raccogliere le cellule in una nuova provetta conica da 15 ml e centrifugare a 400 g per 7 min.
- Decantare il surnatante. Lavare il pellet due volte in 3 ml di tampone FCS-wash ghiacciata (PBS contenente 10% FBS) utilizza risospensione pipettando accoppiata con centrifugazione a 400 xg per 7 minuti.
- Risospendere, contare, e regolare pADSC a 10 6 cellule / ml in tampone FCS-lavaggio ghiacciata. Cellule posto (100 microlitri / ogni provetta) in più nuove provette coniche da 15 ml e incubare provette contenenti pADSC a 4 ° C per 30 min con anticorpi contro sia CD4a ficoeritrina coniugata (CD4a-PE), CD29-PE, CD31-PE , CD44-PE, CD45-PE, CD90-PE, MHC I-PE o MHC II-PE per la colorazione diretta. Arrestare la reazione lavando le cellule due volte in 10 ml di tampone FCS-lavaggio accoppiato con 400 × g centrifugationico per 7 min.
- Fissare e risospendere le cellule in tampone di fissaggio (PBS con 0,01% FBS e 1% di formaldeide) per citometria a flusso in base alle istruzioni del produttore e la nostra precedente pubblicazione 18.
5. La differenziazione di pADSC in adipociti, Osteociti e condrociti
- Differenziazione delle pADSC in adipociti
- Preparare induzione a media degli adipociti e terreno di mantenimento degli adipociti
- Per induzione a media degli adipociti, preparare 1 L di DMEM / F12 senza siero (con antibiotici di 1% P / S / A) contenente le seguenti: 1 ml di insulina magazzino (10 mg / ml di tampone HEPES, pH 8), conc finale = 10 mg / ml; 1 ml T3 magazzino (3,3 ', 5-triiodo-L-thyronine, 1 mM in DMSO), conc def = 1 nM; 200 ml transferrina magazzino (50 mg / ml di H 2 O distillata), def conc = 10 mg / ml; 100 ml desametasone magazzino (10 mm di etanolo), conc def = 1 micron; 100 ml rosiglitazone magazzino (10 mM in DMSO), conc finale= 1 pM.
- Preparare adipociti terreno di mantenimento con le stesse aggiunte come mezzo di induzione, ma con omissione di desametasone.
- processo di differenziazione per adipociti
Nota: dopo la semina pADSC su 6 pozzetti, pADSC sarà confluenti entro 72 ore.- Dopo 3 giorni, rimuovere il supporto completamente e poi aggiungere 3 ml di terreno adipociti induzione in tutti i pozzetti. Riportare le piastre per l'incubatore. Questo è il giorno zero della differenziazione.
- Dopo 3 giorni, rimuovere il supporto di adipociti di induzione completamente e sostituirlo con 3 ml di terreno adipociti manutenzione ogni tre giorni. adipociti maturi saranno differenziate da circa 9 giorni. Oltre il 90% degli adipociti sono ben differenziati utilizzando questo protocollo. Questi adipociti sono pronti per Oil Red O colorazione.
- Preparare induzione a media degli adipociti e terreno di mantenimento degli adipociti
- Differenziazione delle pADSC in osteociti
- Preparare medio osteociti induzione: completa mediu culturam (DMEM / F12 con 10% FBS e 1% P / S / A) contenente 1 mM dexametasone, 10 mM β-glicerofosfato e 50 ug / ml ascorbato-2-fosfato.
- processo di differenziazione per osteociti
Nota: dopo la semina pADSC su 6 pozzetti, pADSC sarà confluenti entro 72 ore.- Dopo 3 giorni, rimuovere il supporto completamente e aggiungere 3 ml di terreno osteociti induzione in tutti i pozzetti. Riportare le piastre per la 37 ° C incubatore. Questo è il giorno zero della differenziazione.
- Sostituire con media osteociti induzione ogni tre giorni. osteociti maturi formeranno da 14 giorni di differenziazione. Questi osteociti sono pronti per Alizarina Rossa S colorazione.
- La differenziazione di pADSC in condrociti
- Preparare medio di induzione di condrociti: αMEM contenente 1% FBS, 6,25 mg / ml di insulina, 50 mg / ml ascorbato-2-fosfato, e 10 ng / ml fattore di crescita trasformante-β1.
- processo di differenziazione per i condrociti
- Dopo la semina pADSC su piastre di coltura di 10 cm per 24 ore, togliere terreno di coltura completamente e lavare i piatti due volte con PBS.
- Trypsinize pADSC di 1 ml di 0,25% tripsina-EDTA per 5 min e quindi neutralizzare con terreno di coltura 1 ml. Raccogliere, contare e registrare pADSC in 15 ml provette coniche con una densità di 2,5 x 10 5 cellule per provetta. Utilizzare un emocitometro per contare le cellule.
- Dopo centrifugazione a 400 g per 7 minuti, scartare il surnatante senza disturbare il pellet e aggiungere 1 ml di terreno condrociti induzione in un tubo da 15 ml. Il tubo viene restituito al incubatore a 37 °. Questo è il giorno zero della differenziazione.
- Sostituire il mezzo condrociti induzione ogni tre giorni senza rimuovere cellule sul fondo. condrociti maturi formeranno in circa 14 giorni. Questi condrociti sono pronti per blu di toluidina O colorazione.
6. colorazione di differenziata adipociti OsteocyTES e condrociti
- Oil Red O colorazione per adipociti differenziati
- Al giorno 9, rimuovere adipociti terreno di mantenimento in piastre di coltura 6 pozzetti con adipociti differenziati e poi lavare la piastra due volte con PBS. [Nei seguenti passaggi, aggiungere abbastanza reattivi designati per coprire ciascun pozzetto della piastra da 6 pozzetti.]
- Fissare adipociti con formalina al 10% per almeno 10 min.
- Rimuovere la soluzione di formalina al 10% e lavare la piastra due volte con acqua bidistillata.
- Dopo due lavaggi, aggiungere 100% glicole propilenico alla piastra di coltura e lasciare riposare per 1 min.
- Rimuovere il glicole propilenico 100% e quindi aggiungere la soluzione Oil Red O (0,5% in glicole propilenico) alla piastra di coltura. Lasciare riposare per almeno 10 minuti su un agitatore rocker con agitazione (100 rpm).
- Rimuovere la soluzione Oil Red O e quindi sostituire con il 60% di glicole propilenico. Lasciate riposare per 1 min.
- Rimuovere il glicole propilenico 60% e poi lavare la piastra due volte con dacqua ouble-distillata.
- Sostituire con formalina al 10%. Le goccioline lipidiche macchiate all'interno degli adipociti sono pronti per l'osservazione al microscopio ottico.
- Quantificazione dei intracellulare Oil Red O (passaggi facoltativi sotto): dopo l'osservazione microscopica, rimuovere il 10% soluzione di formalina e lavare la piastra due volte con acqua bidistillata.
- Scolate la piastra completamente e aggiungere 500 ml di isopropanolo al 6 pozzetti.
- Lasciare riposare isopropanolo nella piastra da 6 pozzetti in un agitatore rocker leggera (100 rpm) per almeno 10 minuti per sciogliere il colorante di Oil Red O.
- Aspirare il isopropanolo contenente Oil Red O e distribuire su una piastra a 96 pozzetti. Quantificare l'estratto Oil Red O utilizzando una lettura spettrofotometrica a 510 nm.
- Alizarina Rossa S colorazione per osteociti differenziata
- Al giorno 14, rimuovere medio osteociti induzione da 6 pozzetti con osteociti differenziati e lavare due volte le piastre con PBS. [Negli following passi, aggiungere abbastanza reattivi designati per coprire ciascun pozzetto della piastra da 6 pozzetti.]
- Fissare osteociti in formalina al 10% per almeno 10 min.
- Rimuovere la soluzione di formalina al 10% da ogni pozzetto e lavare la piastra due volte con acqua bidistillata.
- Dopo due lavaggi, aggiungere 2% Soluzione di rosso alizarina S (pH = 4,1-4,3) al 6 pozzetti e lasciate riposare per almeno 15 minuti su un agitatore rocker dolce (100 rpm).
- Rimuovere la soluzione Alizarina Rossa S e poi lavare la piastra due volte con acqua bidistillata.
- Sostituire con formalina al 10%. Osteociti sono pronti per l'osservazione al microscopio ottico.
- Blu di toluidina O colorazione per condrociti differenziate
- Al giorno 14, medie aspirare condrociti induzione dal tubo da 15 ml senza rimuovere sedimenti di condrociti differenziate nel fondo della provetta e lavare il tubo due volte con PBS. [Nei seguenti passaggi, aggiungere abbastanza reattivi designati Cover condrociti nella parte inferiore del tubo o sul vetrino sezione.]
- Fissare condrociti in formalina al 10% per almeno 10 min.
- Rimuovere la soluzione di formalina al 10% da ciascuna provetta e lavare il tubo due volte con acqua bidistillata.
- Dopo due lavaggi, incorporare pellets in OCT Compound e sezione con un criostato ad uno spessore di 5 micron.
- Macchia scorrimento delle sezioni al criostato con soluzione blu di toluidina O (0,1% a pH 4.1).
- Rimuovere la soluzione blu di toluidina O e poi lavare la sezione due volte con acqua bidistillata.
Nota: I condrociti su diapositive sono pronti per l'osservazione al microscopio ottico.
Risultati
Il pADSC derivato dal maiale dorsale grasso sottocutaneo sono state seminate su piastre di coltura o piatti e mostrato in Figura 2. La morfologia del pADSC derivata dalla frazione stromale-vascolare è simile al mouse o ADSC umana. Ventiquattro ore dopo la semina, subconfluenti pADSC vengano rispettati e hanno un esteso fibroblasti simile morfologia (Figura 2A). Il pADSC diventerà confluenti entro 72 ore e sono pronti per adipociti o altro mesenchimali-tipo di differenziazione (Figura 2B). pADSC esibire forte potenziale adipogenico dopo induzione chimica e adipociti maturi possono essere osservati dopo 9 giorni di differenziamento con oltre il 90% dei pADSCs mostrano differenziazione adipogenico (Figura 2C).
Per affrontare le caratteristiche di pADSC derivato in questo protocollo, marcatori di superficie di pADSC sono stati valutati mediante citometria di flusso analeYsis. Come mostrato in figura 3, marcatori di superficie di cellule staminali mesenchimali, tra CD29, CD44, CD90 e MHC I (HLA o I), erano altamente espressi. Marcatori di superficie negativi, come CD4a, CD31, CD45 e MHC II (o HLA II) erano appena rilevabile nel pADSC derivata nel protocollo (Figura 3). Questi risultati dimostrano che questi pADSC mostra mesenchimali tipo caratteristiche di cellule staminali endoteliali senza significative o la contaminazione di cellule staminali ematopoietiche, tra cui mieloidi o linfoidi progenitori.
Ad ulteriore conferma che pADSC rappresentano le cellule staminali mesenchimali, la multipotenza di pADSC è stata esaminata dalla differenziazione in adipociti, osteociti e condrociti. Questi adipociti, osteociti e condrociti sono state colorate coloranti specifici, Oil Red O, Alizarina Rossa S, e blu di toluidina O, rispettivamente (Figura 4). Questi dati indicano che questo protocollo ha generato pADSC che ha mantenuto multipotency con caratteristiche simili a pieno mesenchimali tipo progenitori.
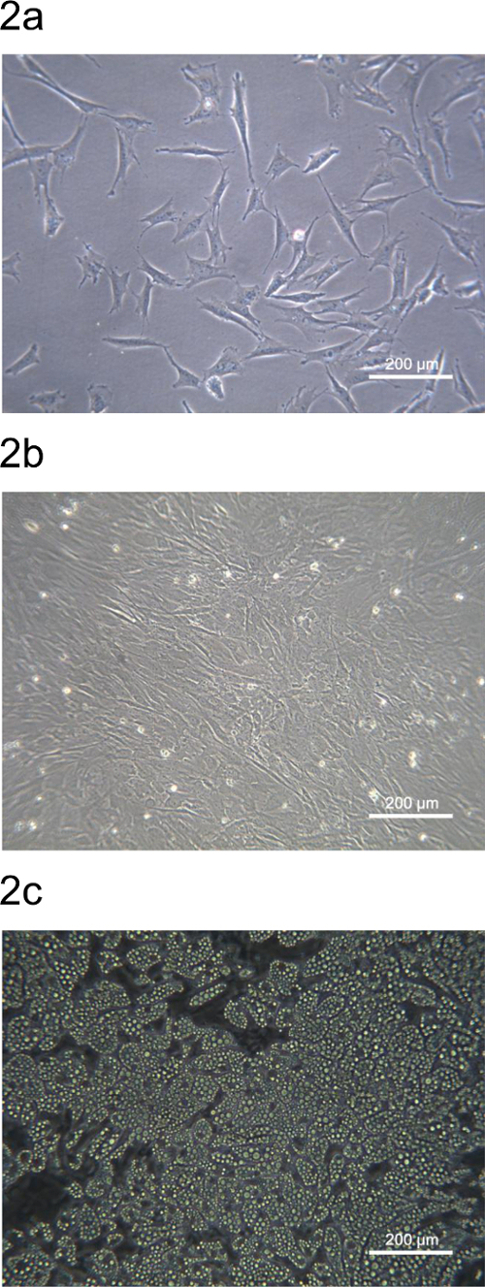
Figura 2. Morfologia pADSC da suini indietro regione di grasso. (A) subconfluenti pADSC aderito ed estesi dopo 24 ore semina su una piastra di coltura 6-bene. (B) pADSC divenne confluente dopo 72 ore semina su una piastra di coltura 6-bene. Adipociti (C) mature sono stati osservati dopo 9 giorni di differenziazione adipogenico da pADSC. Le immagini sono state prese a 100 ingrandimenti al microscopio a contrasto di fase. Cliccate qui per vedere una versione più grande di questa figura.
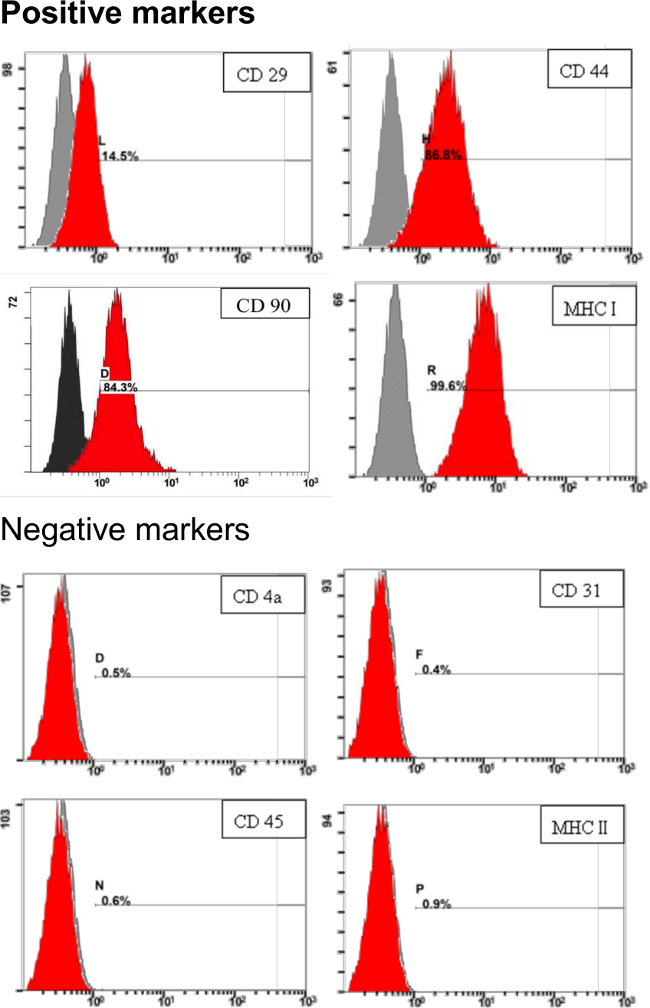
Figura 3. Identificazione delle cellule staminalimarcatori di superficie per pADSC. 1 x 10 5 di pADSC sono stati reagito con anticorpi specifici e analizzati per i marcatori di cellule staminali di citometria a flusso. I numeri indicano la percentuale di cellule colorate nella popolazione (rosso) rispetto al controllo non colorato. L'asse x rappresenta l'intensità di fluorescenza relativa. L'asse y rappresenta la popolazione di cellule. Clicca qui per vedere una versione più grande di questa figura.
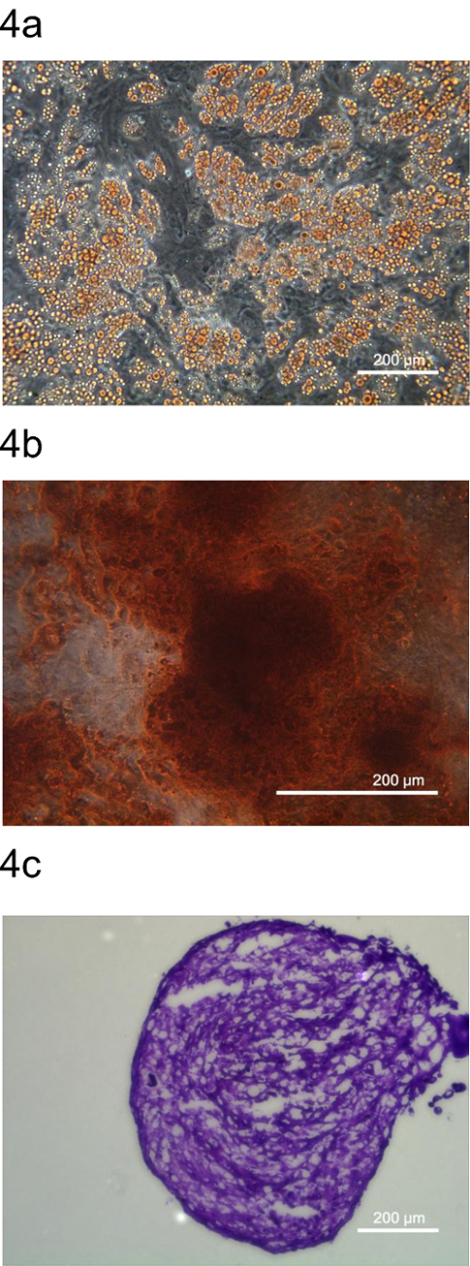
Figura 4. Multipotent differenziazione dei pADSC. Multipotenza di pADSC è stata determinata da differenziare in adipociti pADSC (A), (B) osteociti (C) condrociti e colorate con tinture rappresentative, Oil Red O, Alizarina Rossa S, e blu di toluidina O, rispettivamente, . Io sono unGES sono state prese in (A) 100 x, (B) 200 x, e (C) 100 ingrandimenti al microscopio a contrasto di fase, rispettivamente. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Qui vi presentiamo un sistema cellulare affidabile per studiare lo sviluppo del tessuto adiposo in coltura cellulare primaria di pADSC. Rispetto ad altre linee cellulari immortali, questo metodo fornisce un modo conveniente per isolare grandi quantità di cellule staminali adulte mesenchimali di alta qualità che possono essere applicati per studiare processi di differenziazione degli adipociti o di altri lignaggi mesenchimali relative allo sviluppo degli animali in vivo. La fase critica modificato in questo protocollo è che deriviamo pADSC con un 7 a 9 giorni vecchio porcellino perché è facile da maneggiare il piccolo porcellino rispetto ai suini anziani e simile ad altre specie 19,20, la resa e la multipotenza di pADSC diminuisce con l'invecchiamento della maiale 21.
fonti di cellule staminali potenziali includono cellule staminali embrionali (ESC), cellule staminali pluripotenti indotte (IPSC), e le cellule staminali adulte postnatale. Il vincolo di ADSC, classificati come cellule staminali multipotenti adulte, è che multipotenza delle cellule staminali adultenel differenziare linee divergenti è relativamente limitato rispetto al ESC o IPSC. Tuttavia, questioni di carattere etico derivazione del CES e oncogeni proprietà del iPSC frenare l'applicazione di ESC e IPSC 22,23. Pertanto, numerosi ricercatori si sono concentrati sulle cellule staminali adulte con gli sforzi per migliorare la pluripotenza. La fonte più comune di cellule adulte mesenchimali staminali (MSC), che è stato a lungo studiato, è cellule staminali mesenchimali derivate dal midollo osseo 24. Tuttavia, la raccolta del midollo osseo è considerata una procedura relativamente dolorosa. Un'altra preoccupazione è che il rendimento delle cellule staminali dal midollo osseo è finito. Aspirati midollari producono una media di 6 × 10 6 cellule nucleate per ml, e MSC rappresentano solo 0,001-,01% di tutte le cellule nucleate. Dopo aver considerato questi inconvenienti, ADSC è suggerita come una fonte meno invadente per ottenere cellule staminali multipotenti 25,26.
Limitazioni all'uso di ADSC in rigenerazionetive farmaco dipendono, in larga misura dalla quantità di cellule e qualità. Pertanto, il significato di impiegare suini isolare ADSC in questo protocollo è quello di produrre una grande quantità di cellule staminali adulte di garanzia. Il maiale è un modello animale utile rappresentano esseri umani a causa delle dimensioni dell'organo comparabili e molte somiglianze fisiologiche e biochimiche tra la specie 27-30. L'acquisizione di hADSC da società commerciali è costoso e in molti casi sono stati manipolati le cellule, diversi passaggi o crioconservati. L'acquisizione di campioni clinici umani è relativamente difficile a causa di problemi etici e produzione di ADSC è limitato. Deriviamo circa 6 x 10 5 hADSC per g grasso dopo collagenasi digestione. Con 100 g di femmina tessuto adiposo mammario (un campionamento medio), per un totale di 6 x 10 7 cellule può essere raccolto. Utilizzando un mouse individuo, la resa è ancora più limitato. Un totale di 1 x 10 6 cellule può essere raccolto da 0,4 g di i sottocutanea topoil tessuto adiposo nguinal da entrambe le gambe di un topo adulto FVB (6-8 settimane). Tuttavia in un suino individuale (7 a 9 giorni), per un totale di 2 x 10 8 cellule può essere facilmente raccolto da 60 g di tessuto adiposo sottocutaneo ottenuta dal deposito grasso dorsale. Il pADSC derivato in questo protocollo hanno pieno mesenchimali-tipo multipotenza e marcatori di cellule staminali mesenchimali del caso. Pertanto, pADSC sono una fonte favorevoli per ottenere grandi quantità di cellule staminali adulte senza compromettere la qualità delle cellule staminali.
L'applicazione di pADSC non si limita a decifrare differenziazione degli adipociti compresi adipogenesis e lipogenesi. Recentemente, ADSC sono diventati una fonte popolare di cellule staminali nel campo della medicina rigenerativa 22,31,32. Rispetto ad altre fonti di cellule staminali, ADSC mantenere un vantaggio unico di essere facilmente accessibile e abbondante, e la loro multipotenza robusta ha dimostrato di essere una fonte promettente per la terapia delle cellule staminali e dei tessuti eNGINEERING 22,33,34. La facile accessibilità del tessuto adiposo rende ADSC uno dei modi meno intrusivi per ottenere progenitori multipotenti. Recentemente, abbiamo di smaltirlo differenziando pADSC in cluster che secernono insulina glucosio-reattiva, indicando che pADSC non sono limitati a mesenchimali differenziazione (dati non pubblicati). Altri sono stati anche dimostrato che ADSC può essere differenziato in molti tipi di cellule derivate da altri strati germinali, come epatociti endodermico (da hADSC 35 o pADSC 36) o neuroni ectodermiche (da hADSC 37 o pADSC 38). Così, pADSC potrebbe essere utilizzato per farmaci ad alto rendimento o di screening biomateriale indirizzando le cellule a processi di differenziazione divergenti per produrre linee desiderati. Pertanto, pADSC derivato in questo protocollo hanno potenziali applicazioni per la terapia con cellule staminali e trapianto di tessuti per la ricerca della medicina rigenerativa.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Gli autori desiderano esprimere gratitudine a tutti i membri del laboratorio per l'ampia discussione e la tecnica sostiene in questo protocollo. La ricerca eseguita in laboratorio è stato sostenuto da sovvenzioni dal Ministero della Scienza e della Tecnologia (MOST 103-2314-B-002-126 e 102-2313 MOST-B-002-026-MY3) e da sovvenzioni dal Aim per il Piano Top Università (104R350144) della National University, Taiwan.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Collagenase, Type II | Sigma-Aldrich | C6885 | |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-001-1 | |
| Penicillin-Streptomycin-Amphotericin B (P/S/A) solution | Biological Industries | 03-033-1 | For antibiotics and antimycotic usage |
| αMEM, no nucleosides | Life Technologies | 12561-049 | |
| ACK lysis buffer | Life Technologies | A10492-01 | |
| Trypsin-EDTA (0.25%), phenol red | Life Technologies | 25200072 | |
| CD4a-PE | Sigma-Aldrich | SAB4700063 | |
| CD29-PE | Sigma-Aldrich | SAB4700398 | |
| CD31-PE | Sigma-Aldrich | SAB4700467 | |
| CD44-PE | Sigma-Aldrich | SAB4700183 | |
| CD45-PE | Sigma-Aldrich | SAB4700483 | |
| CD90-PE | Sigma-Aldrich | SAB4700686 | |
| HLA Class I-PE (MHC I) | Sigma-Aldrich | SAB4700640 | |
| HLA-DR-PE (MHC II) | Sigma-Aldrich | SAB4700662 | |
| Insulin | Sigma-Aldrich | I9278 | |
| 3,3',5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| Transferrin | Sigma-Aldrich | T2036 | |
| 3-isobutyl-1-methylxanthine (IBMX) | Sigma-Aldrich | I7018 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Rosiglitazone | Cayman | 71740 | |
| β-Glycerophosphate | Sigma-Aldrich | G9422 | |
| 2-Phospho-L-ascorbic acid | Sigma-Aldrich | 49752 | |
| TGFB1 Recombinant Human Protein | R&D Systems | 240-B-002 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Carbon Steel Blades | Thomas Scientific | 6727C18 | |
| Falcon 100 µm cell strainer | Corning | 352360 | |
| Falcon 6-well plate | Corning | 353046 | |
| Falcon 100 mm dish | Corning | 353003 |
Riferimenti
- Farese, R. V., Zechner, R., Newgard, C. B., Walther, T. C. The Problem of Establishing Relationships between Hepatic Steatosis and Hepatic Insulin Resistance. Cell Metab. 15, 570-573 (2012).
- Taubes, G. Cancer research. Unraveling the obesity-cancer connection. Science. 335 (28), 30-32 (2012).
- Apovian, C. M., Gokce, N. Obesity and cardiovascular disease. Circulation. 125, 1178-1182 (2012).
- Glass, C. K., Olefsky, J. M. Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metab. 15, 635-645 (2012).
- Rosen, E. D., Spiegelman, B. M. Adipocytes as regulators of energy balance and glucose homeostasis. Nature. 444, 847-853 (2006).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metabolism. 4, 263-273 (2006).
- Aune, U. L., Ruiz, L., Kajimura, S. Isolation and Differentiation of Stromal Vascular Cells to Beige/Brite Cells. J Vis Exp. , (2013).
- Hsu, J. M., Ding, S. T. Effect of polyunsaturated fatty acids on the expression of transcription factor adipocyte determination and differentiation-dependent factor 1 and of lipogenic and fatty acid oxidation enzymes in porcine differentiating adipocytes. Brit J Nutr. 90, 507-513 (2003).
- Hsu, J. M., Wang, P. H., Liu, B. H., Ding, S. T. The effect of dietary docosahexaenoic acid on the expression of porcine lipid metabolism-related genes. J Anim Sci. 82, 683-689 (2004).
- Liu, B. H., Kuo, C. F., Wang, Y. C., Ding, S. T. Effect of docosahexaenoic acid and arachidonic acid on the expression of adipocyte determination and differentiation-dependent factor 1 in differentiating porcine adipocytes. J Anim Sci. 83, 1516-1525 (2005).
- Ou, J. F., et al. Unsaturated fatty acids inhibit transcription of the sterol regulatory element-binding protein-1c (SREBP-1c) gene by antagonizing ligand-dependent activation of the LXR. P Natl Acad Sci USA. 98, 6027-6032 (2001).
- Sekiya, M., et al. Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP-1 suppression. Hepatology. 38, 1529-1539 (2003).
- Xu, J., Nakamura, M. T., Cho, H. P., Clarke, S. D. Sterol regulatory element binding protein-1 expression is suppressed by dietary polyunsaturated fatty acids - A mechanism for the coordinate suppression of lipogenic genes by polyunsaturated fats. J Biol Chem. 274, 23577-23583 (1999).
- Ding, S. T., McNeel, R. L., Mersmann, H. J. Conjugated linoleic acid increases the differentiation of porcine adipocytes in vitro. Nutr Res. 20, 1569-1580 (2000).
- Ding, S., Mersmann, H. J. Fatty acids modulate porcine adipocyte differentiation and transcripts for transcription factors and adipocyte-characteristic proteins. J Nutr Biochem. 12, 101-108 (2001).
- Liu, L. R., et al. Serum amyloid A induces lipolysis by downregulating perilipin through ERK1/2 and PKA signaling pathways. Obesity (Silver Spring. 19, 2301-2309 (2011).
- Chen, Y. J., et al. Docosahexaenoic acid suppresses the expression of FoxO and its target genes. J Nutr Biochem. 23, 1609-1616 (2012).
- Lin, Y. Y., et al. Modulation of glucose and lipid metabolism by porcine adiponectin receptor 1-transgenic mesenchymal stromal cells in diet-induced obese mice. Cytotherapy. 15, 971-978 (2013).
- Schipper, B. M., Marra, K. G., Zhang, W., Donnenberg, A. D., Rubin, J. P. Regional anatomic and age effects on cell function of human adipose-derived stem cells. Ann Plast Surg. 60, 538-544 (2008).
- Efimenko, A., et al. Adipose-Derived Mesenchymal Stromal Cells From Aged Patients With Coronary Artery Disease Keep Mesenchymal Stromal Cell Properties but Exhibit Characteristics of Aging and Have Impaired Angiogenic Potential. Stem Cell Transl Med. 3, 32-41 (2014).
- Akanbi, K. A., Brodie, A. E., Suryawan, A., Hu, C. Y. Effect of age on the differentiation of porcine adipose stromal-vascular cells in culture. J Anim Sci. 72, 2828-2835 (1994).
- Mizuno, H., Tobita, M., Uysal, A. C. Concise Review: Adipose-Derived Stem Cells as a Novel Tool for Future Regenerative Medicine. Stem Cells. 30, 804-810 (2012).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Cir Res. 100, 1249-1260 (2007).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived Stem Cells: Current Findings and Future Perspectives. Discov Med. 57, 160-170 (2011).
- Baer, P. C. Adipose-Derived Stem Cells and Their Potential to Differentiate into the Epithelial Lineage. Stem Cell Dev. 20, 1805-1816 (2011).
- Kakudo, N., et al. Adipose-derived regenerative cell (ADRC)enriched fat grafting: optimal cell concentration and effects on grafted fat characteristics. J Transl Med. 11, (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. Int J Biol Sci. 3, 179-184 (2007).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically Engineered Pig Models for Human Diseases. Annu Rev Anim Biosci. 1, 203-219 (2013).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Ann Ny Acad Sci. 1049, 161-171 (2005).
- Wolf, E., et al. Transgenic pigs as models for translational biomedical research. Transgenic Res. 20, 1150-1150 (2011).
- Lindroos, B., Suuronen, R., Miettinen, S. The Potential of Adipose Stem Cells in Regenerative Medicine. Stem Cell Rev Rep. 7, 269-291 (2011).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Circ Res. 100, 1249-1260 (2007).
- Cignarelli, A., et al. Human adipose tissue stem cells: relevance in the pathophysiology of obesity and metabolic diseases and therapeutic applications. Expert Rev Mol Med. 14, (2012).
- Cawthorn, W. P., Scheller, E. L., MacDougald, O. A. Adipose tissue stem cells: the great WAT hope. Trends Endocrinol Metab. 23, 270-277 (2012).
- Banas, A., et al. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 46, 219-228 (2007).
- Bruckner, S., et al. A fat option for the pig: hepatocytic differentiated mesenchymal stem cells for translational research. Exp Cell Res. 321, 267-275 (2014).
- Anghileri, E., et al. Neuronal Differentiation Potential of Human Adipose-Derived Mesenchymal Stem Cells. Stem Cells Dev. 17, 909-916 (2008).
- Huang, T. T., He, D. S., Kleiner, G., Kuluz, J. Neuron-like differentiation of adipose-derived stem cells from infant piglets in vitro. J Spinal Cord Med. 30, S35-S40 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon