Method Article
ブタ皮下脂肪組織から分離し、脂肪由来幹細胞の分化
要約
This protocol describes the isolation of pig adipose-derived stem cells (pADSC) from subcutaneous adipose tissues with examination of multipotency. The multipotent pADSC are used to delineate processes of adipocyte differentiation and study transdifferentiation into multiple cell lineages of mesodermal mesenchyme or further lineages of ectoderm and endoderm for regenerative studies.
要約
Obesity is an unconstrained worldwide epidemic. Unraveling molecular controls in adipose tissue development holds promise to treat obesity or diabetes. Although numerous immortalized adipogenic cell lines have been established, adipose-derived stem cells from the stromal vascular fraction of subcutaneous white adipose tissues provide a reliable cellular system ex vivo much closer to adipose development in vivo. Pig adipose-derived stem cells (pADSC) are isolated from 7- to 9-day old piglets. The dorsal white fat depot of porcine subcutaneous adipose tissues is sliced, minced and collagenase digested. These pADSC exhibit strong potential to differentiate into adipocytes. Moreover, the pADSC also possess multipotency, assessed by selective stem cell markers, to differentiate into various mesenchymal cell types including adipocytes, osteocytes, and chondrocytes. These pADSC can be used for clarification of molecular switches in regulating classical adipocyte differentiation or in direction to other mesenchymal cell types of mesodermal origin. Furthermore, extended lineages into cells of ectodermal and endodermal origin have recently been achieved. Therefore, pADSC derived in this protocol provide an abundant and assessable source of adult mesenchymal stem cells with full multipotency for studying adipose development and application to tissue engineering of regenerative medicine.
概要
米国の人口の約30%に存在する肥満は、30以上のボディ・マス・インデックスで、世界的に流行している現象1として浮上しています。肥満は心血管疾患、2型糖尿病、および癌2-4を含む関連合併症を引き起こす傾向があります。そのため、肥満に対処することは重要な課題です。肥満は、脂肪組織の大規模な拡張によって明らかにされており、現代社会における過剰な食物消費と座りがちな生活習慣に起因します。したがって、脂肪生成及び脂質生成の転写調節を解読することは、肥満や糖尿病の5を治療するための約束を保持することができます。
3T3-L1、3T3-F442Aおよび他のマウス脂肪生成細胞株は、脂肪組織の開発中に脂肪生成または脂質生成を研究するために適用されています。しかし、 インビボ 6 インビトロおよび動物の細胞株との間の調節機構に何らかの不一致があります。プライマリ脂肪-DERI間質血管細胞画分におけるVED幹細胞(ADSC)は、白色脂肪組織から直接単離され、分化するように誘導することができます。脂肪細胞へのADSCの分化は、最も可能性の高い生体内 7 における脂肪組織開発における脂肪生成及び脂質生成の過程を再現します。
ブタは、脂肪組織の発達に脂肪生成及び脂質生成を研究するための適切な動物モデルです。我々の以前のブタ研究8-10ステロール調節エレメント結合転写因子1C(SREBP1c)、脂質合成脂肪酸シンターゼの転写を調節することが知られている重要な転写因子の発現は、ブタ肝臓における多価不飽和脂肪酸(PUFA)によって阻害されることを実証しますそして、脂肪組織。 インビボおよびインビトロでの PUFAの減少ブタSREBP1cの発現は、ヒトおよびマウス11〜13のような他の種と同様です。 in vitroでのこれらのブタの研究は、差分に主にブタADSC(pADSC)由来の脂肪細胞をerentiated。したがって、pADSCこの初代細胞培養物は、脂肪組織の発達または他の幹細胞の用途を研究するための信頼性のあるセルラーシステムとして機能するように使用することができます。
プロトコル
注:この方法は確立され、研究に使用される以前にこの研究室14から17 を報告されています。時間をかけて方法論を修正しました。現在の手順は、6ウェル組織培養プレートに播種すると、ワン子ブタ(7~9日齢)からブタ皮下脂肪組織60gの平均を使用して行きました。特に指定しない限り、全ての手順を室温で実施しました。全ての動物実験は、国立台湾大学の施設内動物管理使用委員会(IACUC)によって承認されました。
1.消化培地を調製
- 首の後ろからの皮下脂肪組織を得ます。ブタの大きさに応じて(7~9日齢)子豚あたり40〜80グラム、。ここでは、1匹のブタから得られた皮下脂肪組織の60グラムを使用します。
- 消化培地を準備:54,000単位の合計でコラゲナーゼII粉末を計量し、90でそれを溶解mlのダルベッコ改変イーグル培地(DMEM、100ミリリットル血清学的ボトルコラゲナーゼ/ 1.5ミリリットルDMEM /グラムの脂肪の(900単位)で60グラムの脂肪)のために。
- 静かに溶解した後、滅菌のために0.22μmのフィルターを通して消化培地を渡すために、少なくとも15分間振盪台(100回転)上の消化培地を攪拌。使用前に4℃で保管してください。
ブタから2.解剖皮下脂肪組織
- 使用前に37℃にすべての機器、ガラスやプラスチックの構造と暖かいすべてのメディアを滅菌します。
- 電気素晴らしいと失血またはローカルIACUCの規則に従った方法を使用して子豚を生け贄に捧げます。子豚を屠殺した後、慎重に、すぐに解剖を行います。
- きれいな手術台上の子豚を置き(背中や腹を上下に向いています)。正中線まで首から尾までと両側のすべての毛を取り除く子豚から髪をバック剃り落とします。
- 7.5%と豚の背側の皮膚をスクラブpovidone-ヨウ素3回(3新しい独立-スクラブ付き)、次いでヨウ素は約10分間、皮膚の表面の上に座ることができます。
- 70%エタノールの複数のスプレーとポビドンヨードを削除します。ポビドンヨードの明らかな色が観察されなくなるまで繰り返し、1方向に皮膚を拭くために70%エタノールを含むガーゼパッドまたはティッシュペーパーを使用してください。
- 鉗子を使用して脂肪と皮膚を保持しながら、筋肉の付着したスキン層と一緒に皮下脂肪組織のブタの背脂肪層を分離するためにメスを使用してください。
- すぐに無血清DMEMを含有する滅菌ビーカー(200ml)中に付着した皮膚と皮下脂肪組織の脂肪層を浸します。
- 層流細胞培養フード中で70%エタノールと場所で脂肪層を含むビーカーの外側をスプレー。フードの大きい(40センチメートル×30 cm)の滅菌三重層のカバー箔を置きます。 【三重層は、継続的な整合性を確保するために使用されています。]
- 置きカバー箔上に下向きに皮膚と組織。
- 筋肉組織による汚染を避けるために、鉗子およびハサミを使用して脂肪組織から残りの筋肉組織をトリミング。
- メスやはさみで正方形のピース(〜7センチメートルX 7センチ)の中に脂肪をカット。無血清DMEMを含む新しい滅菌ビーカー(200ミリリットル)に脂肪層のこれらの部分を入れてください。
- 炭素鋼スライサーの刃( 図1)を用いて組み立てカバー箔上にカスタマイズされたスライスホルダーを設定します。ビーカーのうち、脂肪の1枚を取り、スライサー(トップと脂肪層の下の皮膚層)の上に置きます。
- 厚さ約1mmの小片に皮下脂肪組織の脂肪層をスライス。できるだけ近い皮膚から脂肪層をスライスが、皮膚をスライス避けます。
- ミンスはできるだけ細かいハサミで脂肪組織をスライスしました。
- みじん切りに250ミリリットルの三角フラスコや血清学的ボトルにコラゲナーゼを含むフィルタリング消化培地を追加します。脂肪組織(コラゲナーゼの54,000単位/ 90ミリリットルDMEM / 60グラムの脂肪)。
- インキュベートし、コラゲナーゼは、組織を消化できるようにするために37℃で90分間、オービタルシェーカーで45 rpmで三角フラスコを旋回させます。
注:オーバー消化避けるために、すべての15〜30分を確認してください。消化培地は、有意な組織塊なしのスラリーである場合、消化プロセスを終了します。 - コラゲナーゼ消化を停止し、10%ウシ胎児血清(FBS)を含むDMEM / F12を含む培地の(消化培地に等しい)等量加えます。

ブタの背部皮下脂肪組織から図1 pADSCの単離のために使用されるカスタマイズされたスライサー。解剖脂肪組織は、添付のスキン層と脂肪層で構成されています。スライサーは、オーバーの回避で約1ミリメートルの厚さの脂肪層をスライスすることが要求されます皮膚層にスライスします。スライスホルダー、スライサパッド、炭素鋼スライサーブレード、ネジ:左から右へ。スライサーの刃がスライスホルダーと組み立てスライサーパッドとの間に挿入されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
間質血管画分からpADSCの3コレクション
- きれいな滅菌250ミリリットルの三角フラスコまたは250ミリリットル血清学的ボトルにシフォンの単層を介して消化脂肪組織を含む消化培地を渡します。案内し、ダイジェストの通過を助けるためのシフォンの中央を押下する鉗子を使用してください。
- ドレン通路を完了するために鉗子でシフォンをねじります。
- 4 50mlコニカル遠心管(チューブあたり〜40ミリリットル培地)に消化培地を配布します。
- 間質血管細胞のペレットを収集するために10分間、700×gで遠心分離します。
- 成熟脂肪細胞を含むトップ脂肪層の大部分を除去し、ペレットを乱すことなく上清を除去。ピペッティングとチューブを穏やかに振とうしながら、ペレットを再懸濁し、各チューブに10ミリリットルのDMEMを添加することにより、ペレットを洗浄。
- 6分間700×gで遠心分離します。上清を除去。
- 10ミリリットルACK溶解緩衝液を追加し、ピペッティングによりペレットを再懸濁。それは間質 - 血管画分中の赤血球を溶解し、室温で7分(5〜10分)放置してみましょう。
- チューブを穏やかに振とうしながら反応を停止した後、10分間700×gで遠心分離するDMEM(10ミリリットル)の等量を追加します。
- 上清を除去、各チューブに10ミリリットルのDMEMを追加し、6分間700×gで繰り返しピペッティングし、遠心分離でペレットを再懸濁。二回繰り返します。
- 収集し、新しい50mlコニカルチューブに100μmのストレーナを介して懸濁した細胞を含むDMEM(60グラムの脂肪を表す4管からの40ミリリットルのDMEMの合計)を渡します。
- 静かにピペットメディええと、いくつかの回を新しい1.5mlエッペンドルフチューブによく、アリコート0.4%トリパンブルー溶液(1:10希釈)180μlのと混合し、細胞含有培地を20μlを混合します。
- DMEM / F12、10%ウシ胎児血清(FBS)及びペニシリン、1%抗生物質を含む培地で培養皿またはプレートの所望の大きさに60,000細胞/ cm 2の密度で、次いで血球計数器とシードpADSCで細胞を数えます-streptomycin-アムホテリシンB溶液(P / S / A)。一般に、脂肪細胞または骨細胞分化のために6ウェル組織培養プレートにpADSCをシード。幹細胞又は軟骨細胞分化の表面マーカーの染色のための10cm皿上に播種pADSC。
- プレートへの細胞接着を可能にするために、5%CO 2で、空気中で37℃のインキュベーターでプレートや皿をインキュベートします。
フローサイトメトリーによるpADSC 4.同定幹細胞表面マーカー
- 24時間後、培地を完全に削除し、目の洗浄37℃で5分間、0.25%トリプシン-EDTA 1 mlのリン酸緩衝生理食塩水(PBS)、および収穫細胞と二回E 10 cmのディッシュ。
- 、培地(1ミリリットル)の等量でトリプシン-EDTAを中和する新しい15 mlのコニカルチューブに細胞を回収し、その後7分間400×gで遠心します。
- 上清を除去。 7分間400×gの遠心分離に結合されたピペッティングにより再懸濁を使用して(PBS、10%FBSを含む)3ミリリットルの氷冷FCS-洗浄緩衝液中で2回ペレットを洗浄。
- 再懸 濁は、カウントし、氷冷FCS洗浄緩衝液中に10 6細胞/ mlにpADSCを調整します。場所細胞(100μL/各チューブ)は、複数の新しい15 mlのコニカルチューブにし、フィコエリトリン結合CD4a(CD4a-PE)のいずれかに対する抗体で4℃で30分間pADSCを含むチューブをインキュベート、CD29-PE、CD31-PE 、CD44-PE、CD45-PE、CD90-PE、MHC I-PEまたは直接染色のためにMHC II-PE。 FCS-洗浄バッファーは、400×gでのcentrifugatに結合された10ミリリットルで細胞を2回洗浄することにより反応を停止させます7分間のイオン。
- メーカーの指示と私たちの以前の出版物18に従ってフローサイトメトリー用の固定バッファ(0.01%FBSおよび1%のホルムアルデヒドを含むPBS)で細胞を固定し、再懸濁します。
脂肪細胞、骨細胞および軟骨細胞へのpADSCの5分化
- 脂肪細胞への分化pADSC
- 脂肪細胞誘導培地と脂肪細胞維持培地を準備
- 脂肪細胞誘導培地については、以下を含む(1%P / S / Aの抗生物質での)無血清DMEM / F12の1 Lの準備:1ミリリットルのインスリンストック(10 mg / mlでHEPES緩衝液、pH 8)、最終濃度を= 10 / mlの。 1μlのT3株(3,3 '、5トリヨードL-チロニン、DMSO中の1mM)、最終濃度= 1 nMの。 200μlのトランスフェリンストック最終濃度= 10 / mlの(50 mg / mlで再蒸留H 2 O); 100μlのデキサメタゾンストック(エタノール中10mM)、最終濃度= 1μM; 100μlのロシグリタゾンストック(DMSO中10mM)、最終濃度= 1μM。
- 誘導培地と同じ添加物と脂肪細胞維持培地を準備したが、デキサメタゾンを省略しています。
- 脂肪細胞のための分化過程
注:6ウェルプレート上pADSCを播種した後、pADSCは72時間以内にコンフルエントされます。- 3日後、培地を完全に除去し、各ウェルに脂肪細胞誘導培地の3ミリリットルを追加します。インキュベーターにプレートを返します。 これは、分化の日はゼロです。
- 3日後、完全に脂肪細胞誘導培地を除去し、脂肪細胞維持培地の3ミリリットル、3日毎に交換してください。成熟脂肪細胞は、末端約9日によって区別されます。脂肪細胞の90%以上がよく、このプロトコルを使用して区別されます。これらの脂肪細胞は、オイルレッドO染色のための準備が整いました。
- 脂肪細胞誘導培地と脂肪細胞維持培地を準備
- 骨細胞への分化pADSC
- 骨細胞誘導培地を準備します。完全培養mediu1μMのデキサメタゾン、10mMのβグリセロリン酸および50μg/ mlのアスコルビン酸-2-リン酸を含有するM(10%FBSおよび1%P / S / Aを含むDMEM / F12)。
- 骨細胞のための分化過程
注:6ウェルプレート上pADSCを播種した後、pADSCは72時間以内にコンフルエントされます。- 3日後、完全培地を除去し、各ウェルに骨細胞誘導培地の3ミリリットルを追加します。 37℃のインキュベーターにプレートを返します。これは、分化の日はゼロです。
- 3日ごとに骨細胞誘導培地と交換してください。成熟した骨細胞は、分化の14日までに形成することになります。これらの骨は、アリザリンレッドS染色のための準備が整いました。
- 軟骨細胞への分化pADSC
- 軟骨細胞誘導培地を調製する:αMEM1%FBS、6.25 / mlのインスリン、50μg/ mlのアスコルビン酸-2-リン酸を含有し、10成長因子β1を形質転換をng / ml。
- 軟骨細胞のための分化過程
- 24時間、10 cmの培養皿上pADSCを播種した後、完全培地を除去し、PBSで2回皿を洗います。
- その後トリプシン処理0.25%トリプシン-EDTAで5分間、1 mlのpADSC、1mlの培養培地で中和します。収集、カウントとチューブあたり2.5×10 5細胞の密度で15ミリリットルコニカルチューブにpADSCを調整します。細胞をカウントし、血球計数器を使用してください。
- 7分間400×gで遠心分離した後、ペレットを乱すことなく、上清を廃棄し、15mlチューブに軟骨細胞誘導培地の1ミリリットルを追加します。チューブを37℃のインキュベーターに戻されます。これは、分化の日はゼロです。
- 底に細胞を除去することなく、3日ごとに軟骨細胞誘導培地を交換してください。成熟した軟骨細胞は、約14日間で形成することになります。これらの軟骨細胞はトルイジンブルーO染色のための準備が整いました。
差別脂肪細胞、Osteocy 6.染色TESおよび軟骨細胞
- 分化した脂肪細胞のためのオイルレッドO染色
- 9日目に、分化した脂肪細胞で6ウェル培養プレート中で脂肪細胞維持培地を除去し、その後、PBSで2回プレートを洗浄します。 【以下の手順で、6ウェルプレートの各ウェルをカバーするために十分な指定された試薬を加えます。]
- 少なくとも10分間、10%ホルマリン溶液で脂肪細胞を修正しました。
- 10%ホルマリン溶液を除去し、二重蒸留水で2回プレートを洗浄します。
- 2回洗浄した後、培養プレートに100%のプロピレングリコールを添加し、1分間放置しました。
- 100%のプロピレングリコールを外し、培養プレートにオイルレッドO溶液(プロピレングリコール中0.5%)を追加します。穏やかに撹拌(100 rpm)してロッカーシェーカー上で、少なくとも10分間放置してみましょう。
- オイルレッドO溶液を除去した後、60%のプロピレングリコールと交換してください。 1分間放置してみましょう。
- 60%のプロピレングリコールを外し、dでプレートを2回洗浄ouble蒸留水。
- 10%ホルマリン溶液に交換してください。脂肪細胞の内部染色脂肪滴は、光学顕微鏡による観察の準備ができています。
- 細胞内のオイルレッドO(下記オプションの手順)の定量:顕微鏡で観察した後、10%ホルマリン溶液を除去し、二重蒸留水で2回プレートを洗浄します。
- 完全版を排出し、6ウェルプレートにイソプロパノール500μlのを追加します。
- イソプロパノールは、オイルレッドOの染料を溶解させるために、少なくとも10分間、穏やかなロッカーシェーカー(100 rpm)での6ウェルプレートに立ってみましょう
- オイルレッドOを含むイソプロパノールを吸引し、96ウェルプレートに分配します。 510 nmで分光光度読み取りを使用して抽出オイルレッドOを定量化します。
- 分化した骨細胞のためのアリザリンレッドS染色
- 14日目に、分化した骨細胞で6ウェルプレートから骨細胞誘導培地を除去し、PBSで2回プレートを洗浄します。 [followiでステップngを、6ウェルプレートの各ウェルをカバーするのに十分な指定された試薬を加えます。]
- 少なくとも10分間、10%ホルマリン溶液中で骨細胞を修正しました。
- 各ウェルから10%ホルマリン溶液を除去し、二重蒸留水で2回プレートを洗浄します。
- 2回洗浄した後、6ウェルプレートに2%アリザリンレッドS液(pH = 4.1〜4.3)を追加し、穏やかなロッカーシェーカー(100 rpm)での少なくとも15分間放置しました。
- アリザリンレッドS溶液を除去した後、二重蒸留水で2回プレートを洗浄します。
- 10%ホルマリン溶液に交換してください。骨細胞は、光学顕微鏡による観察の準備ができています。
- 分化した軟骨細胞のためのトルイジンブルーO染色
- 14日目、2回PBSでチューブをチューブの底に分化した軟骨細胞の堆積物を除去し、洗浄せずに15ミリリットルコニカルチューブから吸引軟骨細胞誘導培地。 [次の手順では、入り江に十分な指定された試薬を追加チューブの底にまたはセクションのスライド上の軟骨細胞rを。]
- 少なくとも10分間、10%ホルマリン溶液中の軟骨細胞を修正しました。
- 各チューブから10%ホルマリン溶液を除去し、二重蒸留水で2回チューブを洗浄します。
- 2回洗浄した後、5ミクロンの厚さでクライオスタットと10月の化合物とセクションのペレットを埋め込みます。
- トルイジンブルーO溶液(pHは4.1と0.1%)で凍結切片のスライドを染色します。
- トルイジンブルーO溶液を除去した後、二重蒸留水で2回セクションを洗います。
注意:スライド上の軟骨細胞は、光学顕微鏡による観察の準備ができています。
結果
豚の背側皮下脂肪由来pADSCは、培養プレートまたはディッシュに播種し、 図2に示した。間質-血管画分由来pADSCの形態は、マウスまたはヒトADSCに似ています。播種後二十四時間、サブコンpADSCが付着し、拡張線維芽細胞様の形態( 図2A)を有しています。 pADSCは、72時間以内にコンフルエントになると脂肪細胞または他の間葉型分化( 図2B)の準備ができているでしょう。化学誘導および成熟脂肪細胞が脂肪細胞への分化( 図2C)を示すpADSCsの90%以上と分化の9日後に観察することができた後に強力な脂肪生成潜在能力を発揮pADSC。
このプロトコルで導出pADSCの特性に対処するために、pADSCの表面マーカーは、肛門、フローサイトメトリーによって評価しました。ysis。 図3に示すように、CD29、CD44、CD90、およびMHC I(またはHLA I)を含む間葉系幹細胞のための表面マーカーは、高度に発現されました。このようなCD4a、CD31、CD45およびMHC II(またはHLA II)のような負の表面マーカーは、プロトコル( 図3)で求めたpADSCでかろうじて検出可能でした。これらの結果は、骨髄やリンパ系前駆細胞を含む、重要な内皮細胞または造血幹細胞の混入のないこれらのpADSC展示間葉系幹細胞の特性ことを示しています。
さらにそのpADSCを確認するために、間葉系幹細胞を表し、pADSCの多能は、脂肪細胞、骨細胞および軟骨細胞への分化によって調べました。これらの脂肪細胞、骨細胞および軟骨細胞は、特定の染料、オイルレッドO、アリザリンレッドS、およびトルイジンブルーO、それぞれ( 図4)によって染色しました。これらのデータは、このプロトコルがムーを保持pADSCを生成することを示します間葉系前駆細胞に似た完全な特性を持つltipotency。
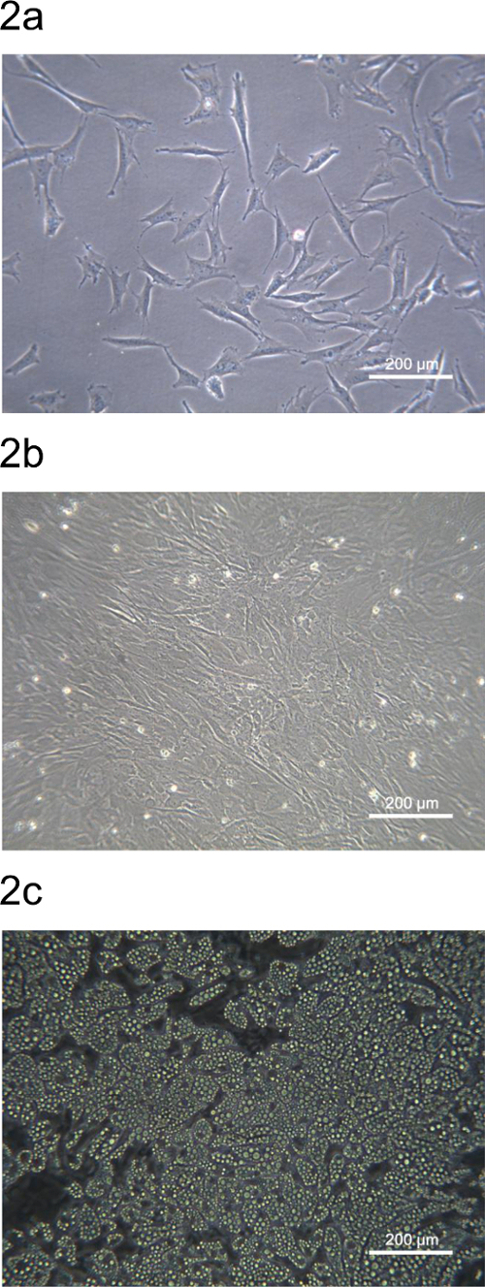
ブタの背脂肪地域からpADSCの図2形態。(A)サブコンフルエントpADSCが付着し、6ウェル培養プレートに24時間播種した後に拡大しました。 (B)pADSCは6ウェル培養プレートに72時間播種後コンフルエントになりました。 (C)成熟脂肪細胞をpADSCから脂肪細胞への分化の9日後に観察しました。画像は位相差顕微鏡を用いて100倍の倍率で撮影した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
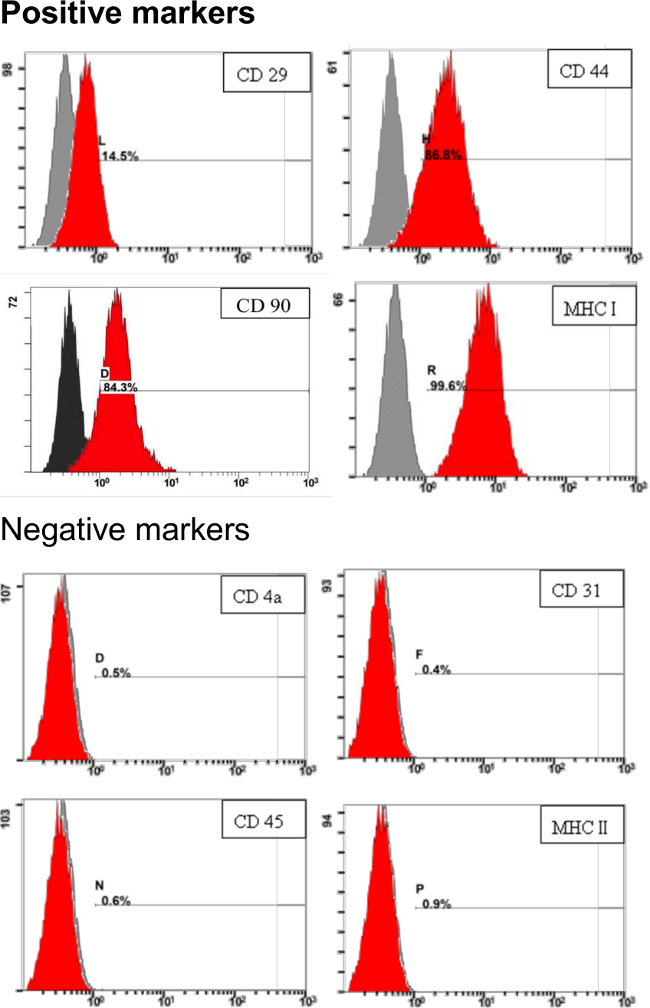
幹細胞の図3.同定pADSCための表面マーカー1×10 5 pADSCの特異的抗体と反応させ、フローサイトメトリー分析により、幹細胞マーカーについて分析しました。数値は、染色していない対照と比較して人口(赤)で染色された細胞の割合を示しています。 x軸は相対蛍光強度を表します。 y軸は細胞の集団を表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
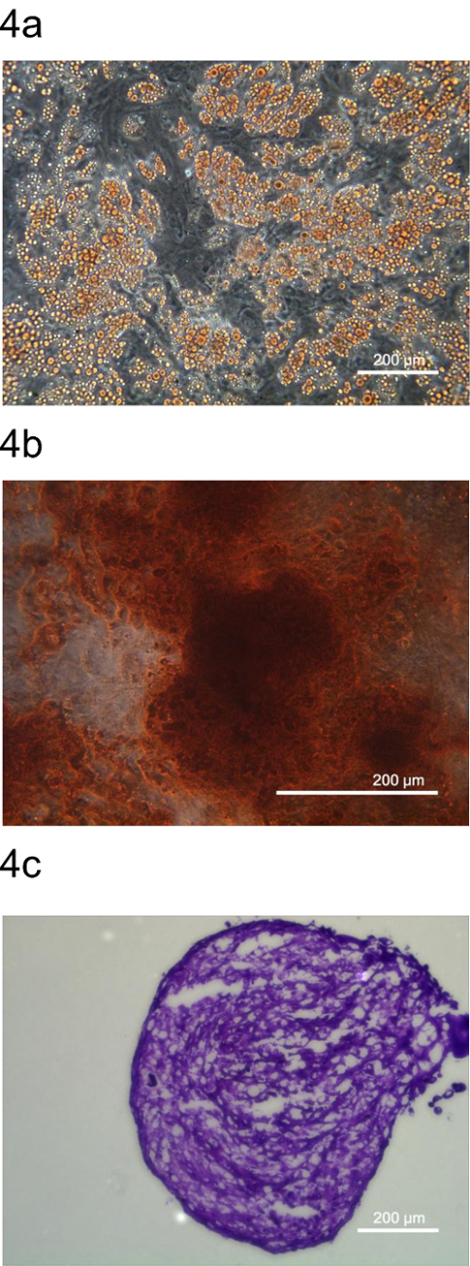
pADSCのpADSC。多能の図4.多能分化は、(A)脂肪細胞、(B)骨(C)軟骨細胞にpADSCを微分することによって決定され、それぞれの代表的な染料、オイルレッドO、アリザリンレッドS、およびトルイジンブルーOで染色しました。いまGESはそれぞれ、位相差顕微鏡を用いて、(A)100×(B)200×、および(C)100倍の倍率で撮影したこの図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここでは、pADSCの初代細胞培養における脂肪組織の発達を研究するための信頼性の高いセルラーシステムを提案します。他の不死化細胞株と比較して、この方法は、脂肪細胞の分化プロセスまたはインビボで動物の開発に関連する他の間葉系統を研究するために適用することができ、高品質の成人間葉系幹細胞を大量に単離するための便利な方法を提供します。このプロトコルで重要な変更されたステップは、古い豚と19,20他の種に類似に比べて小さい子豚を処理するために容易であるため、我々は、7〜9日齢の子豚を使用してpADSCの収率および多分化をpADSCを導き出すことです豚の年齢21に減少します。
潜在的な幹細胞の供給源は、胚性幹細胞(ESC)、人工多能性幹細胞(IPSC)、および出生後の成体幹細胞を含みます。成体多能性幹細胞として分類ADSCの制約は、成体幹細胞の多分あります発散系統を分化にESCまたはIPSCと比較して相対的に限定されています。しかし、IPSCのESCと発癌特性の導出に関する倫理的な問題は、ESCとIPSC 22,23の適用を抑えます。したがって、多数の研究者らは、多能性を高めるために努力して成体幹細胞に焦点を当てています。長い間研究されてきた成体間葉系幹細胞(MSC)の最も一般的な供給源は、骨髄由来間葉系幹細胞24です。しかし、収穫骨髄は比較的痛みを伴う手順であると考えられます。別の問題は、骨髄からの幹細胞の収量が有限であることです。骨髄吸引物は、1mlあたり6×10 6有核細胞の平均を得て、MSCは、すべての有核細胞の0.001〜0.01%を表します。これらの欠点を検討した後、ADSCは、多能性幹細胞25,26を得るために、目立たない源として提案されています。
regeneraでADSCの使用に関する制限事項的な医学細胞収量と品質に大きく依存しています。したがって、このプロトコルでADSCを分離するために、ブタを用いる意義は、高品質の成体幹細胞を大量に生成するためです。豚が原因種27-30の間に匹敵する器官の大きさと多くの生理学的および生化学的類似性の人間を表す有用な動物モデルです。営利企業からhADSCを獲得することは高価であり、多くの場合、細胞は、操作継代または凍結保存されてきました。ヒト臨床サンプルを取得することがあるため倫理的な問題では比較的困難であるとADSCの生産が制限されています。私たちは、コラゲナーゼ消化後グラムの脂肪あたり約6×10 5 hADSCを導き出します。女性の乳房の脂肪組織(平均サンプリング)100gを、6×10 7個の細胞の合計を回収することができます。個々のマウスを使用して、収率はさらに制限されます。 1×10 6個の細胞の合計は、皮下マウスiの0.4グラムから収穫することができます大人のFVBマウスの両足からnguinal脂肪組織(6〜8週齢)。しかし、一人の個人豚(7〜9日齢)に、2×10 8個の細胞の合計を簡単に背脂肪デポから得られた皮下脂肪組織の60グラムから収穫することができます。このプロトコルで派生pADSCはフル間葉系多能し、適切な間葉系幹細胞マーカーを持っています。したがって、pADSCは、幹細胞の品質を損なうことなく、成体幹細胞を大量に得るための良好な供給源です。
pADSCの適用は、脂肪生成及び脂質生成などの脂肪細胞分化を解読に限定されるものではありません。最近では、ADSCは、再生医療22,31,32の分野では、幹細胞の人気の源となっています。他の幹細胞源に比べて、ADSCは、容易にアクセス可能と豊富であるというユニークな利点を保持し、その堅牢な多分化は、幹細胞治療および組織電子のための有望な源であることが実証されていますngineering 22,33,34。脂肪組織の容易なアクセス性がADSC多能性前駆細胞を得るために少なくとも侵入的な方法の一つになります。最近、我々はpADSCは間葉分化(未発表データ)に限定されないことを示す、グルコース応答性インスリン分泌クラスタにpADSCを分化しました。その他にも、ADSCは、このような(hADSC 37またはpADSC 38から)(hADSC 35またはpADSC 36)から内胚葉肝細胞または外胚葉の神経細胞などの他の胚葉由来の多くの細胞型に分化させることができることが実証されてきました。したがって、pADSCは、所望の系統を得るために発散分化過程に細胞を誘導することによって、ハイスループット薬物または生体物質のスクリーニングに使用することができます。したがって、このプロトコルで派生pADSCは、再生医療研究のための幹細胞治療および組織移植における潜在的なアプリケーションを持っています。
開示事項
The authors have nothing to disclose.
謝辞
著者らは、広範な議論のために、すべてのラボのメンバーに感謝の意を表したいとテクニックは、このプロトコルに対応しています。実験室で行われた研究は、科学技術省からの助成金によってサポートされていました(MOST 103から2314-B-002から126とMOST 102から2313-B-002から026-MY3)とトップ大学の計画のねらいからの助成金によって、国立大学、台湾の(104R350144)。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Collagenase, Type II | Sigma-Aldrich | C6885 | |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | |
| DMEM/F-12, HEPES | Life Technologies | 11330-032 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-001-1 | |
| Penicillin-Streptomycin-Amphotericin B (P/S/A) solution | Biological Industries | 03-033-1 | For antibiotics and antimycotic usage |
| αMEM, no nucleosides | Life Technologies | 12561-049 | |
| ACK lysis buffer | Life Technologies | A10492-01 | |
| Trypsin-EDTA (0.25%), phenol red | Life Technologies | 25200072 | |
| CD4a-PE | Sigma-Aldrich | SAB4700063 | |
| CD29-PE | Sigma-Aldrich | SAB4700398 | |
| CD31-PE | Sigma-Aldrich | SAB4700467 | |
| CD44-PE | Sigma-Aldrich | SAB4700183 | |
| CD45-PE | Sigma-Aldrich | SAB4700483 | |
| CD90-PE | Sigma-Aldrich | SAB4700686 | |
| HLA Class I-PE (MHC I) | Sigma-Aldrich | SAB4700640 | |
| HLA-DR-PE (MHC II) | Sigma-Aldrich | SAB4700662 | |
| Insulin | Sigma-Aldrich | I9278 | |
| 3,3',5-Triiodo-L-thyronine (T3) | Sigma-Aldrich | T6397 | |
| Transferrin | Sigma-Aldrich | T2036 | |
| 3-isobutyl-1-methylxanthine (IBMX) | Sigma-Aldrich | I7018 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Rosiglitazone | Cayman | 71740 | |
| β-Glycerophosphate | Sigma-Aldrich | G9422 | |
| 2-Phospho-L-ascorbic acid | Sigma-Aldrich | 49752 | |
| TGFB1 Recombinant Human Protein | R&D Systems | 240-B-002 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| Toluidine Blue O | Sigma-Aldrich | 198161 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Carbon Steel Blades | Thomas Scientific | 6727C18 | |
| Falcon 100 µm cell strainer | Corning | 352360 | |
| Falcon 6-well plate | Corning | 353046 | |
| Falcon 100 mm dish | Corning | 353003 |
参考文献
- Farese, R. V., Zechner, R., Newgard, C. B., Walther, T. C. The Problem of Establishing Relationships between Hepatic Steatosis and Hepatic Insulin Resistance. Cell Metab. 15, 570-573 (2012).
- Taubes, G. Cancer research. Unraveling the obesity-cancer connection. Science. 335 (28), 30-32 (2012).
- Apovian, C. M., Gokce, N. Obesity and cardiovascular disease. Circulation. 125, 1178-1182 (2012).
- Glass, C. K., Olefsky, J. M. Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metab. 15, 635-645 (2012).
- Rosen, E. D., Spiegelman, B. M. Adipocytes as regulators of energy balance and glucose homeostasis. Nature. 444, 847-853 (2006).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metabolism. 4, 263-273 (2006).
- Aune, U. L., Ruiz, L., Kajimura, S. Isolation and Differentiation of Stromal Vascular Cells to Beige/Brite Cells. J Vis Exp. , (2013).
- Hsu, J. M., Ding, S. T. Effect of polyunsaturated fatty acids on the expression of transcription factor adipocyte determination and differentiation-dependent factor 1 and of lipogenic and fatty acid oxidation enzymes in porcine differentiating adipocytes. Brit J Nutr. 90, 507-513 (2003).
- Hsu, J. M., Wang, P. H., Liu, B. H., Ding, S. T. The effect of dietary docosahexaenoic acid on the expression of porcine lipid metabolism-related genes. J Anim Sci. 82, 683-689 (2004).
- Liu, B. H., Kuo, C. F., Wang, Y. C., Ding, S. T. Effect of docosahexaenoic acid and arachidonic acid on the expression of adipocyte determination and differentiation-dependent factor 1 in differentiating porcine adipocytes. J Anim Sci. 83, 1516-1525 (2005).
- Ou, J. F., et al. Unsaturated fatty acids inhibit transcription of the sterol regulatory element-binding protein-1c (SREBP-1c) gene by antagonizing ligand-dependent activation of the LXR. P Natl Acad Sci USA. 98, 6027-6032 (2001).
- Sekiya, M., et al. Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP-1 suppression. Hepatology. 38, 1529-1539 (2003).
- Xu, J., Nakamura, M. T., Cho, H. P., Clarke, S. D. Sterol regulatory element binding protein-1 expression is suppressed by dietary polyunsaturated fatty acids - A mechanism for the coordinate suppression of lipogenic genes by polyunsaturated fats. J Biol Chem. 274, 23577-23583 (1999).
- Ding, S. T., McNeel, R. L., Mersmann, H. J. Conjugated linoleic acid increases the differentiation of porcine adipocytes in vitro. Nutr Res. 20, 1569-1580 (2000).
- Ding, S., Mersmann, H. J. Fatty acids modulate porcine adipocyte differentiation and transcripts for transcription factors and adipocyte-characteristic proteins. J Nutr Biochem. 12, 101-108 (2001).
- Liu, L. R., et al. Serum amyloid A induces lipolysis by downregulating perilipin through ERK1/2 and PKA signaling pathways. Obesity (Silver Spring. 19, 2301-2309 (2011).
- Chen, Y. J., et al. Docosahexaenoic acid suppresses the expression of FoxO and its target genes. J Nutr Biochem. 23, 1609-1616 (2012).
- Lin, Y. Y., et al. Modulation of glucose and lipid metabolism by porcine adiponectin receptor 1-transgenic mesenchymal stromal cells in diet-induced obese mice. Cytotherapy. 15, 971-978 (2013).
- Schipper, B. M., Marra, K. G., Zhang, W., Donnenberg, A. D., Rubin, J. P. Regional anatomic and age effects on cell function of human adipose-derived stem cells. Ann Plast Surg. 60, 538-544 (2008).
- Efimenko, A., et al. Adipose-Derived Mesenchymal Stromal Cells From Aged Patients With Coronary Artery Disease Keep Mesenchymal Stromal Cell Properties but Exhibit Characteristics of Aging and Have Impaired Angiogenic Potential. Stem Cell Transl Med. 3, 32-41 (2014).
- Akanbi, K. A., Brodie, A. E., Suryawan, A., Hu, C. Y. Effect of age on the differentiation of porcine adipose stromal-vascular cells in culture. J Anim Sci. 72, 2828-2835 (1994).
- Mizuno, H., Tobita, M., Uysal, A. C. Concise Review: Adipose-Derived Stem Cells as a Novel Tool for Future Regenerative Medicine. Stem Cells. 30, 804-810 (2012).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Cir Res. 100, 1249-1260 (2007).
- Tobita, M., Orbay, H., Mizuno, H. Adipose-derived Stem Cells: Current Findings and Future Perspectives. Discov Med. 57, 160-170 (2011).
- Baer, P. C. Adipose-Derived Stem Cells and Their Potential to Differentiate into the Epithelial Lineage. Stem Cell Dev. 20, 1805-1816 (2011).
- Kakudo, N., et al. Adipose-derived regenerative cell (ADRC)enriched fat grafting: optimal cell concentration and effects on grafted fat characteristics. J Transl Med. 11, (2013).
- Lunney, J. K. Advances in swine biomedical model genomics. Int J Biol Sci. 3, 179-184 (2007).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically Engineered Pig Models for Human Diseases. Annu Rev Anim Biosci. 1, 203-219 (2013).
- Vodicka, P., et al. The miniature pig as an animal model in biomedical research. Ann Ny Acad Sci. 1049, 161-171 (2005).
- Wolf, E., et al. Transgenic pigs as models for translational biomedical research. Transgenic Res. 20, 1150-1150 (2011).
- Lindroos, B., Suuronen, R., Miettinen, S. The Potential of Adipose Stem Cells in Regenerative Medicine. Stem Cell Rev Rep. 7, 269-291 (2011).
- Gimble, J. M., Katz, A. J., Bunnell, B. A. Adipose-derived stem cells for regenerative medicine. Circ Res. 100, 1249-1260 (2007).
- Cignarelli, A., et al. Human adipose tissue stem cells: relevance in the pathophysiology of obesity and metabolic diseases and therapeutic applications. Expert Rev Mol Med. 14, (2012).
- Cawthorn, W. P., Scheller, E. L., MacDougald, O. A. Adipose tissue stem cells: the great WAT hope. Trends Endocrinol Metab. 23, 270-277 (2012).
- Banas, A., et al. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 46, 219-228 (2007).
- Bruckner, S., et al. A fat option for the pig: hepatocytic differentiated mesenchymal stem cells for translational research. Exp Cell Res. 321, 267-275 (2014).
- Anghileri, E., et al. Neuronal Differentiation Potential of Human Adipose-Derived Mesenchymal Stem Cells. Stem Cells Dev. 17, 909-916 (2008).
- Huang, T. T., He, D. S., Kleiner, G., Kuluz, J. Neuron-like differentiation of adipose-derived stem cells from infant piglets in vitro. J Spinal Cord Med. 30, S35-S40 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved