Method Article
确定免疫系统抑制中枢神经系统对保护药物干预自身免疫性脱髓鞘
摘要
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
摘要
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
引言
多发性硬化(MS)主要在大脑中疾病早期的白质的区域的特征在于炎症性病变。长期进展后,灰质萎缩通过MRI成像检测并标记该疾病的神经变性阶段。反应性神经胶质增生,脱髓鞘,并在白质轴索损害归因于中枢神经系统浸润免疫细胞。目前使用中的MS逆转或直接防止神经变性CNS中处理无 - 代替,它们通过减弱T细胞活化和/或渗透进入CNS减少炎症。由于没有特效药MS和利用现有治疗的患者继续经历疾病进展的防止脱髓鞘和神经元丢失的药物发现是非常重要的。然而,对免疫细胞的作用以及对中枢神经系统区分可能是困难的实验,作为结果- 即 ,降低至CNS损伤-看起来在SAME无论通过其发生的机制。因此,保护中枢神经系统的评估必须以中枢神经系统浸润的免疫细胞和免疫细胞的增殖在外围,以确定如何剂药物影响疾病的机制来评估合作。
实验性自身免疫性脑脊髓炎(EAE)是自身免疫性炎症性疾病,这是用于药物目前用于治疗的MS 1-4的发现直接负责的一个公认的动物模型。小鼠通常用于EAE,与C57BL / 6小鼠是基于遗传变异体的可用性的流行株。患有EAE诱导C57BL / 6小鼠表现出与围绕第10天诱导后发病的慢性疾病的进展。脊髓实质和小脑的浸润是这些动物的组织病理学的特性,与在皮层薄壁5缺席浸润。此外,皮质损伤和脱髓鞘在B雨是疾病6-9的标志,这是在C57BL / 6小鼠相对缺席。因此,它可能是优选的,当可能使用SJL小鼠,其具有复发-缓解疾病和出现类似于在MS 10中的脑和脊髓都发现病变。
治疗不能被归类为神经保护,如果免疫细胞不会到达中枢神经系统。因此,此协议利用大脑,脊髓,并从EAE小鼠的脾的流式细胞术分析,以确定治疗对免疫细胞浸润到CNS和外周免疫细胞增殖的作用,如先前证实11。中枢神经系统组织的免疫组化分析,以确定程度和神经保护性质也被描述。结合这些方法允许对免疫细胞是否被激活,并在外围增殖,免疫细胞是否进入中枢神经系统的确定,以及中枢神经系统是否公关炎症或损害otected。如果神经保护作用被怀疑尽管对免疫系统的影响,实验者可以改变处理后的免疫细胞浸润的开始时间到发生在CNS。
这里,我们提出使用主动EAE,MS的T细胞介导的动物模型两种不同型号的协议,并且该疾病期间流式细胞仪分析在不同时间点免疫结合,以确定在不同方面的实验性疗法的功效MS的发病机制。这种方法将帮助研究人员在免疫细胞增殖和浸润对中枢神经系统的保护作用之间进行区分,从而更容易来缩小药物对疾病发病机理如何行动。
研究方案
涉及小鼠实验步骤必须遵守相关制度和政府规章。对于目前的研究,小鼠被安置,并按照卫生和阿拉巴马大学的国家机构在伯明翰机构动物护理和使用委员会的指导方针进行处理。
1. EAE诱导和评分
- 诱导EAE在C57BL / 6小鼠11-13或SJL小鼠10,11先前所描述的13。
注:实验者应该选择适合自己研究问题(见进一步详细讨论)模型的理想选择。 - 记录分数每日如前所述11每只小鼠开始后第7天诱导。比较日均分数在治疗组之间的时间。
2.治疗
- 发病前治疗EAE小鼠,以确定是否治疗影响免疫细胞浸润或增殖。
- 选择的治疗,我交付的ThOD,并同时考虑药物的血脑屏障通透性,半衰期,以及剂量治疗的频率。
注:EAE增加血脑屏障通透性,并可能允许药物到达中枢神经系统,不会以其他方式能在健康的动物。在进行用于看着EAE临床得分的剂量 - 响应曲线的实验可能有助于在选择药物的适当剂量。车辆控制应在平行于药物治疗进行。可替代地,条件性敲除小鼠可以与同窝作为对照使用。 - 使用SJL或C57BL / 6小鼠此实验。治疗EAE小鼠诱导(7天)后早期使用交货的选择的方法发病前。
- 牺牲并且在(约15天)的疾病的峰解剖小鼠,如在步骤3.1和其子步骤,基于最高临床分数平均值的时间。
- 行为对小鼠脊髓流式细胞术(如在步骤3.2),以确定免疫细胞入渗对CNS的,并在脾脏(如在步骤3.3),以确定在外围免疫细胞增殖。在不同的老鼠,免疫组化行为(如步骤4)量化星形胶质细胞和小胶质细胞,髓鞘的保存。
- 选择的治疗,我交付的ThOD,并同时考虑药物的血脑屏障通透性,半衰期,以及剂量治疗的频率。
- 治疗EAE小鼠发病后,以确定是否处理保护中枢神经系统发生免疫细胞浸润后。
- 重复步骤2.1.1。
- 使用SJL小鼠实验中,因为这些老鼠有可测量病灶缓解。在疾病的第一个高峰期间治疗小鼠(或,如果需要的话,在随后的复发的峰),通过平均临床得分测量。
- 牺牲在所需的时间后EAE小鼠诱导。因为渗透已经发生,它可能不是有用通过FACS分析来测量渗透。然而,采取脊髓量化反应性神经胶质增生和髓鞘,以确定是否有中枢神经系统的保护,尽管免疫细胞浸润。
3.流式细胞仪分析
- 解剖
- 标签三的15毫升锥形管中(一个用于脑,一个用于脊髓,和一个用于脾脏)每只动物与动物的ID和组织的类型包含。请分开管所有组织在冰上的整个过程。
- 3分钟 - 对脾的FACS分析,在用二氧化碳以每分钟约15%的容器体积为2的流速疾病(〜15天后的EAE诱导)的峰牺牲小鼠。确认缺乏呼吸安乐死。以下各小鼠的牺牲,取出脾脏14和地点到个体,标记含有冰冷的RPMI补充有2%FCS,100 IU青霉素,和100μg/ ml链霉素的15毫升锥形管中(从步骤3.1.1)(被称为"媒体"整个协议)。
- 对脑和脊髓的FACS分析,通过切割鼠标的右心房手术剪释放circulatin执行心脏灌注克血和穿孔与连接到填充用10ml冰冷的PBS中的注射器的针的左心室。缓缓注入10毫升的PBS。
- 切断小鼠的头部,并进行切开手术剪头皮的中线。剥离背部的皮肤用手或钳,并进行切开手术剪颅骨中线,使用脊髓为出发点的切入点。
- 剥离与微型镊子头骨和用勺子来释放大脑。将大脑成标记的15毫升锥形管(从步骤3.1.1),含介质。
- 卸下鼠标的使用镊子和手术剪皮肤,并用手术剪剔骨鼠标。切断肢体,尾巴,肋骨,并用手术剪任何周围的肌肉来释放脊柱。
- 切脊柱成约5大致相等的部分手术剪挤一块的一端用止血钳,然后用另一种止血ŤØ继续挤压,沿着一块移动,直到脊髓挤出顶部。重复此每段脊柱和帘线放置成单个,标记的15毫升锥形管中(从步骤3.1.1)含有介质。
- 在脑和脊髓的免疫细胞浸润的评估
- 切脑和脊髓成使用无菌剪刀小块。从3毫升注射器超过70微米的细胞过滤柱塞挤压到一个新的50ml管中,而漂洗介质过滤器。带来每个管至50ml体积的介质。离心机在453×g离心5分钟以沉淀细胞。
- 吸上清并在4毫升40%浓度梯度介质重新悬浮颗粒。小心覆盖载2毫升70%的密度梯度的顶端细胞在新的15毫升锥形管移液器非常慢到锥形管的壁的40%的密度梯度,以确保该梯度的适当分层。在旋转796 XG在室温下20分钟,出的制动器。
- 小心地从梯度1毫升移液管除去上层髓鞘层,然后用1毫升移液管并转移除去活细胞在界面到一个新的15毫升锥形管中。使管到15ml与媒体和离心机在448×g离心10分钟。
- 在200μl培养基重悬沉淀,并放置到96孔圆底板的一个孔(每只动物每个样品将进入其自身的孔)。离心板在410×g离心5分钟。
- 轻弹关闭在200μl再刺激介质的上清,重悬沉淀(RPMI补加了10%FCS,100IU / ml青霉素,100微克/ ml链霉素,2mM的L-谷氨酰胺,1×非必需氨基酸,1mM丙酮酸钠和55μMβ巯基乙醇,加50纳克/毫升佛波醇肉豆蔻乙酸酯(PMA),750纳克/毫升的离子霉素,蛋白转运抑制剂布雷菲德菌素A)。放置在培养箱的板在37℃下4小时。
注:PMA和ionom霉素再刺激的结果在所有的T淋巴细胞,而不论其抗原特异性的活化,以评估在给定的组织的每个的T细胞子集的总数量。然而,抗原特异性效应T细胞应答可以以各种方式,包括再刺激用MOG肽的细胞在布雷菲德菌素一15,16的存在进行评估。 - CNS CD4 + T细胞表型的评估
- 培养后,离心分离机的96孔圆底板(从步骤3.2.5)中,在410×g离心5分钟并轻弹关闭上清液。以下所有染色步骤是在该板中进行。
- 洗涤细胞在200μlPBS中有2%FCS和离心机在410×g离心5分钟。轻弹关闭上清液孵育用含2%FCS的与Fc的块(克隆2.4G2)10 200微升PBS中的细胞 - 在冰上15分钟。
- 要开始外染色,离心细胞在410 XG 5分钟,甩尾关闭上清,重新悬浮颗粒在50℃#956;含有荧光标记的抗体对CD4(1:200,1微克/毫升)的表面染色鸡尾酒的升,TCRβ(1:200,1微克/毫升),和生存力染料(1:500)在PBS中稀释为15分钟在冰上。离心细胞以410×g离心5分钟并轻弹关闭上清液。洗涤细胞2×于200μlPBS中,然后在410 xg离心离心5分钟。
- 除去细胞外液染色后,通过启动固定/通透其次是细胞内染色的细胞内染色过程。
- 首先,甩尾关闭上清和固定/通透细胞Foxp3的转录因子染色试剂17(根据制造商的说明;见材料列表)30分钟,在4℃过夜
- 在410 xg离心洗150微升透化缓冲液细胞来自试剂盒和离心机板5分钟。轻弹了与抗IL-17A荧光标记的抗体50微升通透缓冲区上清和染色细胞(1:200,1微克/毫升),IFN-γ(1:200,1微克/毫升),和Foxp3(1:200,在PBS中稀释,在冰上30分钟2.5微克/毫升)。
- 离心细胞以410×g离心5分钟并轻弹关闭上清液。以除去多余的抗体在200μl透化缓冲液洗3次,然后在410 xg离心离心5分钟。弗里克关闭上清,重悬在200微升PBS。
- 通过分析流动池术,门控+TCRβ+细胞如前所述11来评估表达每个分子细胞百分比活CD4。算使用血球18或其它有效的方法来确定每只小鼠的细胞与每个CD4 + T细胞的表型的数量的细胞。
- 使用所获得的数据,计算百分比和渗透每只小鼠的大脑和脊髓的CD4 + T细胞数量,尤其侧重于这些人群这在EAE的发病机制和保护中发挥关键作用19:IL-17A + IFN-γ - ,IL-17A + IFN-γ+ IL-17A - IFN-γ+的Foxp3 +。
- 外周T细胞增殖和活化的评估
- 粉碎脾脏在一个60×15毫米的培养皿磨砂玻璃幻灯片。利用媒体暂停细胞放置的细胞悬浮液在15ml锥形管中。在448 XG填充管到15ml与媒体和离心机细胞5分钟。
- 在2ml抽吸媒体和重悬沉淀在RT ACK裂解缓冲液以裂解红血细胞约3分钟。
- 带来管至15ml体积与媒体和应变超过70微米的细胞过滤到一个新的试管中。离心细胞以448×g离心5分钟,吸出上清液,并重新悬浮在2ml的介质。
- 通过Ki-67的染色外周血CD4 + T细胞增殖的评估
- 放置当量的一小等分试样(通常为200微升)脾细胞uivalent号码从3.3.3成在96孔圆底板各个孔(每采样1)。
- 离心机在410×g离心5分钟并轻弹关闭上清液。重悬在200μlPBS中含2%FCS和重复离心。轻弹关闭上清,重悬细胞用含2%FCS的与Fc的块(克隆2.4G2)的PBS孵育10 - 在冰上15分钟。对于外染色重复步骤3.2.6.3。
- 除去细胞外液染色后,通过启动固定/通透其次是细胞内染色的细胞内染色过程。
- 重复步骤3.2.6.4.1。
- 离心细胞以410×g离心5分钟并轻弹关闭上清液。洗涤细胞1倍,从该试剂盒和离心机在410×g离心5分钟,将200μl透化缓冲液。轻弹关于50μl透化缓冲液上清和染色细胞用抗Ki-67的抗体(1:200,1微克/毫升)30分钟。
- 离心机的细胞在410 XG FOR 5分钟并轻弹关闭上清液。洗涤细胞2倍,从该试剂盒和离心机在410×g离心5分钟,将200μl透化缓冲液。
- 轻弹关闭上清,洗涤细胞1倍于200μlPBS中并在410×g离心5分钟离心。通过分析流动池术,门控+TCRβ+细胞如前所述11直播CD4,然后评估%的Ki-67的+细胞。
- 外周血CD4 + T细胞表型的评估
- 放置200微升细胞(来自步骤3.3.3)的在96孔圆底平板(每采样1孔)和离心机在410×g离心5分钟,重新刺激如在3.2.5。
- 将板的孵化器,在37℃下4小时。执行相同的染色按步骤3.2.6及其子步骤。分析通过流式细胞术的细胞作为在3.2.6.4.4-3.2.6.5.5。
4.免疫组化的ð量化
- 组织准备
- 牺牲EAE小鼠在一个单独的实验中,从那些在EAE诱导(通常约30天后的任何点,在步骤3和其子步骤中使用,在疾病的对C57BL / 6小鼠或在平均临床得分的高峰期间,慢性期SJL小鼠)按照下面的步骤来确定反应性胶质和脱髓鞘的程度。
- 麻醉用2.5%异氟醚和97.5%的氧气小鼠和确认的麻醉深度适当用温和的捏脚趾使用镊子,寻找一个毫无反应。如步骤3.1.3描述执行transcardiac灌注。 PBS注射进入左心室后,用新型注射器注资100毫升PBS 小心 4%多聚甲醛:多聚甲醛是一种皮肤和肺有刺激性,可能对眼睛造成严重伤害,并怀疑会致癌。避免吸入,食入,与皮肤和眼睛接触。灌注应在通风橱中进行。
- 3.1.6 - 按照步骤3.1.4说明卸下大脑和脊椎列。领带椎列枝用绳子,以保证脊髓直线排列。
- 放在标有动物的ID与在PBS中约20ml的4%多聚甲醛的闪烁瓶中,并脊髓大脑在50毫升PBS中标记与动物的ID与约50ml的4%多聚甲醛的锥形管到后固定过夜。
- 要cryoprotect绞尽脑汁,在在1X PBS 30%蔗糖4℃下冲洗在1X PBS 3倍和存储。让大脑下降到它们的容器(约3天)的底部。
- 通过漂洗3次在1×PBS中并将其放置在一个大的体积(约50毫升的小鼠脊髓)在1×PBS中的0.5M的EDTA(起始pH值将是移除脊柱钙〜10; pH至〜7.8用6N HCl中)为2 - 3周直到骨不再是刚性的。通过下面的步骤4.1.5 Cryoprotect脊柱。
- 嵌入大脑和在OCT中脊椎柱按照以下只要它们落至它们的容器的底部的子步骤。
- 使在1×PBS中的1部分的30%的蔗糖和2份OCT的混合物(例如,在1×PBS中加入15mL 30%蔗糖至30ml OCT)。
- 十月/蔗糖混合物添加到嵌入模具(22×22×20毫米的大脑与22×30×20毫米,脊髓),直到约半满。
- 切割椎体列到6用剃刀刀片同样大小的块,并放入朝前为冠状脊髓切片一个22×30×20mm的嵌入模具。将整个大脑到22朝前×22×20mm的模具。
- 添加OCT /蔗糖混合物覆盖组织,让它坐1小时。所以气泡能逃脱。在这一小时,加入2甲基丁烷到可容纳闪光冻结嵌入模具一道菜。放在干冰的菜,涵盖预冷。
- 在-80℃下闪光冻结AC内的干冰和存储2-甲基丁烷模具ontainer,以防止脱水。
- 准备就绪后,在16微米与冰冻切片组织,并安装在带静电的幻灯片。把每10 个部分上分别用于脑和脊髓的滑动(例如,滑动1将具有第1,第11和21,以及滑动2将具有第2,第12和22,等等)。幻灯片储存在-80℃或马上使用的染色。
- 染色反应性胶质和髓鞘
- 当准备进行染色,每选择一个幻灯片每污点大脑和脊髓在同一个(或尽可能相似)地区每一种动物。对于大脑,选择的幻灯片显示胼胝体和扣带束。
- 与地方组织切片在70℃加热块7分钟上。 7分钟后关火块,让幻灯片冷却另外10散热块 - 15分钟。这将防止组织切片从染色过程中脱落的幻灯片。
- 洗涤滑动用0.1%的非离子型洗涤剂(细胞内抗原)或1x PBS各3次在1X PBS(对于抗体靶向表面抗原)5分钟。
注意:由于在该协议中使用的抗体是细胞内的,非离子洗涤剂将在后续步骤中使用。不要让幻灯片到这一步完全干燥后进行。 - 放置载玻片在一个容器中并用柠檬酸缓冲液3.0覆盖。使柠檬酸盐缓冲液,加0.192克无水柠檬酸至100ml在水中的最终体积。如果pH值高于3.0或NaOH如果低于pH调节用乙酸。
- 在37℃下30分钟孵育载玻片并在1×PBS中与0.1%的非离子型洗涤剂洗3次,每次5分钟。
- 圈周围具有疏水屏障笔所述组织的区域,并放置在加湿室中的载玻片(例如含有湿纸巾的滑动框)。添加封闭缓冲液至组织。在室温下孵育30分钟。
注意:阻止缓冲区包括1X的PBS加0.3%的非离子洗涤剂和基于第二抗体, 即 ,马血清髓鞘碱性蛋白(MBP),胶质纤维酸性蛋白(GFAP)和山羊血清Iba1的主机上的相应的血清(5%)。 - 轻拂阻断缓冲关闭的幻灯片,并添加一级抗体(1:1000,或为少突0.2微克/毫升的山羊抗髓鞘碱性蛋白,1:1000,或1微克/毫升至3微克/毫升小鼠抗GFAP针对星形胶质细胞,或1 :750或在适当的封闭缓冲液稀释0.67微克/毫升的兔抗Iba1为小胶质细胞)(参见步骤4.2.6)的圆形区域。留在加湿室4 摄氏度过夜。
- 在阻断缓冲关闭载玻片并用0.1%的非离子洗涤剂洗涤载玻片3次,在1×PBS中5分钟轻拂抗体。
- 添加第二抗体(1:200,或7.5微克/毫升生物素化的马抗小鼠为MBP和GFAP,或生物素化的山羊抗兔为Iba1)在适当的封闭缓冲液稀释(参见STEp 4.2.6),以带圆圈的区域并留下载玻片在加湿室中在室温下孵育1小时。
- 在阻断缓冲关闭载玻片并用0.1%的非离子洗涤剂洗涤载玻片3次,在1×PBS中5分钟轻拂抗体。
- 在准备免疫过氧化物酶抗生物素蛋白 - 生物素 - 过氧化物酶复合物(ABC)(请参阅材料明细表)30分钟前使用,直到需要4.2.12振荡器上搅动。在甲醇中添加0.3%的H 2 O 2的圆形区域10分钟以淬灭内源过氧化物酶活性。
- 轻弹溶液落载玻片并在1×PBS或1×PBS中2倍与0.1%的非离子型清洁剂清洗5分钟,然后在1时间在1×PBS中。 ABC试剂添加到圆形区域30分钟。
- 轻弹溶液断幻灯片和在1×PBS洗涤3次,每次5分钟,然后用2在水中次5分钟。使3,3'-二氨基联苯胺(DAB)解决方案(见材料清单),并把它添加到覆盖部分。
注:此步骤需要显微镜观察发现最佳要比较的染色的离子时,必须为幻灯片相同的时间内完成的。 - 洗涤滑入水洗3次,每次5分钟。在水中70%的乙醇,在水中95%的乙醇,在水中的100%乙醇,50%二甲苯和50%乙醇,100%二甲苯:通过在以下溶液放置每个2分钟脱水组织。在密封用树脂封固剂幻灯片盖玻片。
- 可替代地,如先前所述11,以评估使用抗伊巴-1和GFAP反应性胶质执行免疫荧光染色。
- 拍摄带有4X,0.13 NA客观每个脊髓节(使用DAB相应抗体染色)的图像和图像保存为.TIFF。另外,您使用的是20X,0.50 NA目标胼胝体和扣带回在左侧或右侧大脑半球的图像和图像保存为.TIFF。为更全面的测定在大脑损伤负荷的,有益的是包括hemispherES在分析。
- 测量平均分数面积反应性胶质(Iba1和GFAP染色)
- 下载ImageJ的美国国立卫生研究院(http://imagej.nih.gov/ij/)和一台电脑上打开。在ImageJ的软件,使用菜单字符串文件>打开,然后从步骤4.2.16选择图像。绘制使用菜单栏上的"多边形选择"工具的区域。对于脊髓,追踪整个部分;对于大脑,胼胝体和扣带束。通过去图像>类型并单击将图像转换为16位"16位"。
- 去噪前往流程>扣除背景,并设置了" 风水球半径"到不在后台(见HTTP的ImageJ的用户指南的一部分,最大的对象,至少大小的图像://rsbweb.nih 。州长/ IJ /文档/引导/ 146-29.html)。
注:IBA-1染色的4X形象,我们使用4.0和GFAP我们使用50.0,但这些数字可以根据图像的放大倍率和染色INT变化密度。 - 检查"滑动抛物面",然后单击"确定"。去图像>调整>阈值...并设置使用滑动杆低阈值电平(顶栏)。仅包含染色是细胞和横跨的图片一致。对于深色背景(仅适用于荧光染色)的图像,确保"黑后台"复选框被选中。
- 去分析>集测量...并选择"面积分数"(给出的感兴趣的区域内阈值面积的百分比)。确保"限制门槛",并选中"显示标签"被选中。点击"确定"完成时。
- 为了获得测量,去分析>测量。 A"结果"弹出框会出现,或者这个数据可以保存原样复制到另一个程序。有关人士分析,比较两组间"面积率"的价值观。
- 通过选择MBP染色的量化iCal中密度
- 如步骤4.3.1所述,打开图像,绘制感兴趣的区域。进入分析>设置测量...并选择"平均灰度值"(灰度值的像素数除以选定区域内的总和)。确保"限制门槛",并选中"显示标签"被选中。点击"确定"完成时。
- 为了获得测量,去分析>测量。观察一个"结果"弹出框出现。复制此数据并保存为是或复制到另一个程序。
- 为了便于分析,复制和粘贴值到另一个程序。平均转换灰度值将用公式光密度(OD):OD = 10日志(255 /平均灰度值)。
结果
在这里,我们使用的EAE两个模型来理解,如果药剂通过提供CNS保护要么减弱CNS浸润T细胞或预防炎症性免疫细胞浸润袭港期间髓鞘和轴索损伤。以确定是否治疗剂阻止免疫细胞浸润到脊髓,用于慢性EAE的C57BL / 6小鼠模型,其中免疫细胞浸润和疾病病理学主要位于在脊髓( 图1A)。以确定是否治疗药物的免疫细胞的侵入中枢神经系统,复发-缓解EAE的SJL动物模型被使用,这表明疾病病理中的脑和脊髓( 图1B)二者中提供的CNS的保护。
临床评估
相关的临床评估是根据下面的栏目典型( 图1制成C)或非典型的( 图1D)的EAE。对于典型的临床疾病,0分是无异常行为。当由尾基部拾起,尾部可以快速旋转(很像直升机转子)和后腿将分开。的1的临床评分是部分柔弱的尾部,其可通过由尾根部抬起鼠标来确定。正常的直升机般旋转可减弱或消失,而尾部的一部分可能是完全瘫软。一个有用的方法来确定尾部麻痹程度是运行一个人的手指尾的长度,作为unparalyzed尾巴通常会围绕手指卷曲而部分瘫痪的尾巴将无法这样做。 2临床分代表完全瘫痪的尾巴。尾部没有移动采摘在尾巴的基部鼠标向上时,会发生在所有。 3临床分数代表局部后肢麻痹。这个分数的确定需要鼠标可以自由地在移动FLAŤ面。如果一个后肢拖随着鼠标向前移动,或者如果一个或两个后肢似乎是部分瘫痪,可给予3分。 4临床分表示完全后肢瘫痪。有了这个分数,鼠标将无法移动它的后肢,并会拖累本身向前使用它的前肢。 5临床评分代表一个垂死的老鼠,或困难一只老鼠从笼子里,或呼吸运动本身。如果鼠标不能沿笼底或者如果呼吸吃力拖累本身,鼠标应该安乐死。 6临床分数代表在笼子里发现死老鼠。 6分是不寻常的,比其他EAE死亡原因应进行调查。
非典型临床疾病可能会或可能不会瘫痪陪同。如果鼠标非典型疾病加上典型症状呈现,可能有必要对包括两个单独的评分系统。 0分无异常行为,一s的典型的评分系统。 1临床分代表轻微的头部转动或倾斜而鼠标走。这可通过允许鼠标向前走,并观察一个恒定左或右方向性其运动来确定。 2临床分代表更明显的头部转动和扶正能力差。作为具有1非典型得分,鼠标具有方向性的移动,并且可以具有与平衡轻微困难。 3临床分数代表没有能力走在一条直线上。鼠标将难以平衡,并可以使用笼子的一边,帮助权利本身,因为它散步。 4临床分代表鼠标铺设在其一侧,无法行走,由于平衡的问题。鼠标可能能够拖动本身沿笼的底部,但可以具有方向性其运动。 5临床分数代表,除非支持连续轧制。到达这个分数鼠标应安乐死。一所诊所人得分6代表在笼子里发现死老鼠。 6分是不寻常的,比其他EAE死亡原因应进行调查。
可能有必要以允许分数, 如 "在中间"的,添加0.5〜分数如果鼠标的病情变化略,或者如果两个分数之间进行选择是困难的。例如,开始一个鼠标更缓慢移动比其正常的对应,但显示不麻痹,或当由所述尾拾取可给予一个分数的0.5该搂抱其后腿其前代替张开腿出来的小鼠。鼠标只能拖本身沿着笼子的底部,并且只能抽搐其后肢定期或在触摸时可能给予评分3.5。
评估免疫细胞浸润减少
EAE在C57BL / 6小鼠模型( 图1A,第0天),抗原presentati诱导后对T细胞在脾和增殖发生在天1 - 5随后的免疫细胞浸润到CNS中围绕第7天,大约存在与临床评分的初始免疫细胞浸润小鼠后3至5天。为了评估如果治疗剂是阻断免疫细胞浸润到脊髓,药物或媒介物被引入在脾抗原呈递和增殖后7一天,但之前的免疫细胞开始渗透到脊髓。如果免疫细胞浸润已衰减,所述临床疾病过程中应反映在疾病的从天上升阶段为10〜15( 图2)改善的临床得分。
在免疫细胞浸润的减少也将导致削弱神经炎症。活性星形细胞增生和小神经胶质细胞被认为是神经发炎的主要特点。染色用GFAP和小胶质细胞与伊巴-1-星形细胞然后可用于评估昌在平均面积率染色ES量化神经炎症( 图3)。
以确定是否免疫细胞浸润减少,脊髓被除去并在疾病的峰( 图1A,约18天)流式细胞分析处理。这确保了免疫细胞的数量最多的已进入到脊髓。 T细胞进入CNS的入口被认为是引发炎症事件和Th1和Th17细胞中EAE的动物模型,以及MS患者中找到。两者合计,流式细胞仪分析应该包括这两种类型的病原性T细胞的评估。此外,调节性T细胞是抑制疾病充分表征抑制性T细胞。因此,调节性T细胞的从总的CD4 +群体的百分比必须相比效应T细胞群体的百分比进行评估。这将或透露是否出现在T细胞浸润总体上减少如存在e是在中枢神经系统的T细胞表型的倾斜。代表点图( 图4A)展示的 CD4 +的总数量的减少与载体处理的小鼠(在右上象限数字)脊髓相比浸润T细胞在脊髓从药物处理的小鼠。分别IFN-γ+ IL-17 +,和Foxp3 +和应减少( 图4A):评价Th1时,Th17细胞和Treg细胞以下签名蛋白进行评价。统计分析应该对CD4 + IFN-γ+ IL-17 +,和Foxp3 +细胞数目进行展示一个显著减少( 图4B)。为了排除T细胞亚群的偏斜,IFN-γ+ IL-17 + IFN-γ+ IL-17的比例的统计评估- ,IL-17 + IFN-γ - ,并且执行的Foxp3 +细胞( 网络连接古尔4C)。
以消除在中枢神经系统浸润的T细胞的减少是在外围抑制增殖,活化和分化的结果的可能性,需要进行评估的活跃增殖的T细胞除了T细胞亚型的比例数。如果活化和分化不受影响( 图 5A)中的 CD4 + IFN-γ+的百分比没有变化,IL-17 +,或FOXP3 +应当找到。此外,如果扩散不受影响( 图 5B)中的Ki67 + CD4 +细胞没有变化应被发现。药物治疗被引入第7天或更高,以避免改变初始抗原呈递和T细胞活化中的周边。然而,在遗传模型蛋白质通常组成胚胎发育过程中删除或使脾ASSE EAE诱导前诱导的高度重视ssment。
评估CNS保护
为了证明如果一个特定的治疗剂调节免疫后细胞浸润中枢神经系统疾病的病理,药物干预应在临床疾病得分的第一个高峰期间进行管理。因为这些小鼠表现出复发 - 缓解型EAE的SJL模型是用于这些实验是有利的。如果药物治疗预防髓鞘轴突变性,在临床评分的改善将观察( 图6)。髓鞘的病理评估必须确证髓鞘损伤与改善临床分数一致的减少。定量评价髓鞘完整性,髓鞘碱性蛋白的DAB染色(MBP)进行,接着对这种染色的光密度的统计分析( 图7)。为了进一步证实该神经炎症是持续或therape降低UTIC干预,反应性神经胶质增生,可以通过测量平均分数面积为上述( 图3)所描述的反应性胶质进行评估。为了证实该治疗干预是直接保护CNS无免疫调节作用,免疫细胞浸润到中枢神经系统和增殖脾脏衰减必须打折扣。 (5图4和 ),以解决这个问题,对脑和免疫细胞浸润和外周T细胞增殖和活化的评估脊髓评估方法应该如上所述来进行。两者合计,阻断在中枢神经系统中的细胞损伤,没有在中枢神经系统浸润T细胞或T细胞中的周边的增殖减少的证据的治疗剂是中枢神经系统的保护处理。
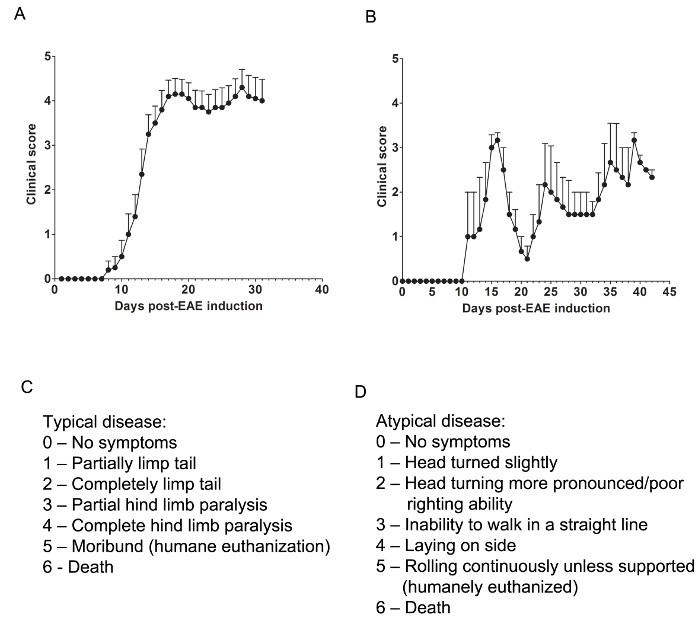
图1. 代表性的地区环境部门一道从EAE在C57BL / 6小鼠SJL临床评分的LTS( 一 )临床得分(平均值±SEM)C57BL / 6小鼠(n = 10)与MOG 35-55诱导产生EAE的慢性疾病。 ( 二 )临床得分(平均值±SEM)与PLP 139-151诱导产生EAE与复发缓解型疾病SJL小鼠(n = 3)。 (C)的用于追踪在EAE小鼠典型疾病进展的临床得分栏目。 (D)用于追踪EAE小鼠非典型疾病进展的临床评分栏目。 请点击此处查看该图的放大版本。
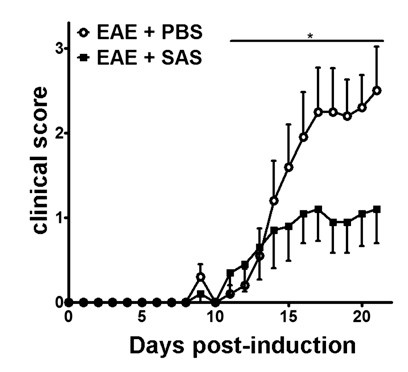
图2. 药理治疗免疫前细胞浸润与EAE C57BL / 6小鼠。 临床分数(平均值±SEM)与PBS从第7天接种后处理C57BL / 6小鼠(n = 20)或SAS(N = 19)与MOG 35-55。数据是来自三个池独立的实验。使用非参数双尾曼 - 惠特尼U检验确定统计学差异,* P <0.05。与许可(11)重新打印。
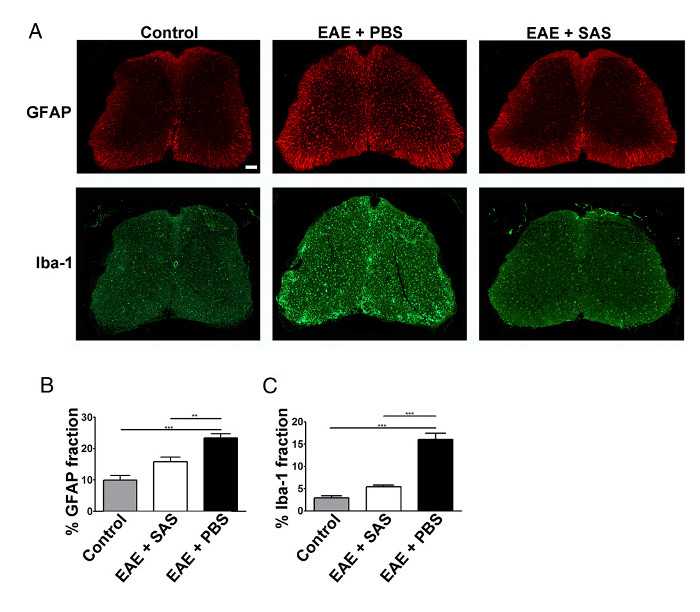
图3. 免疫荧光染色和反应性胶质的控制,EAE的脊髓的定量和处理C57BL / 6小鼠。( 一 )控制的脊髓荧光标记为GFAP(星形胶质细胞)和IBA-1(小胶质细胞)(未免疫)小鼠(左小图)和EAE小鼠用PBS(中图)或SAS(右图)处理。比例尺= 100微米。使用面积分数技术测量百分之immunop测定染色的量化对于GFAP(B)和IBA-1(C)的ositive区域。平均值±SEM,n = 3的对照组,n = 3 SAS处理,或n = 4 PBS处理的小鼠,每只小鼠6部分。使用单向ANOVA确定统计学差异,* P <0.05,** P <0.01,*** P <0.001。重新打印与(11)权限。 请点击此处查看该图的放大版本。
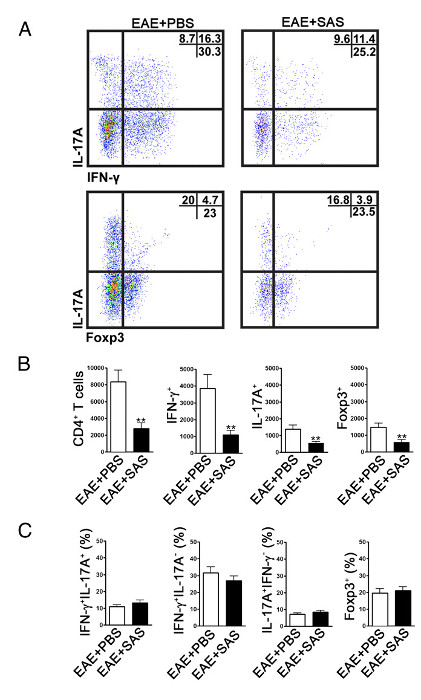
图4. FACS EAE C57BL / 6小鼠脊髓的研究表明减少T细胞浸润在处理的小鼠中,C57BL / 6小鼠SAS或PBS处理,开始7天EAE的postinduction。在第15天(A)代表散点图获得脊髓表明Th1细胞(IFN-γ+ / IL-17 - )和Th17(IFN-γ- / IL-17 +)细胞中的CD4 +栅极(上图)和T调节细胞(FOXP3 +)(下图)。点图显示在右上象限的百分比。 (B)中的CD4 +细胞的绝对数量,以及IFN-γ+ IL-17A +和Foxp3的+细胞进行统计学分析。 (C)的SAS-和PBS处理的EAE小鼠之间的T细胞群的百分比的变化也受到审查。平均值±SEM,每组10对PBS处理,和n = 9用于从两个独立的实验治疗的SAS。双尾t检验用于所有条形图。 ** P <0.01。重新打印与(11)权限。 请点击此处查看该图的放大版本。
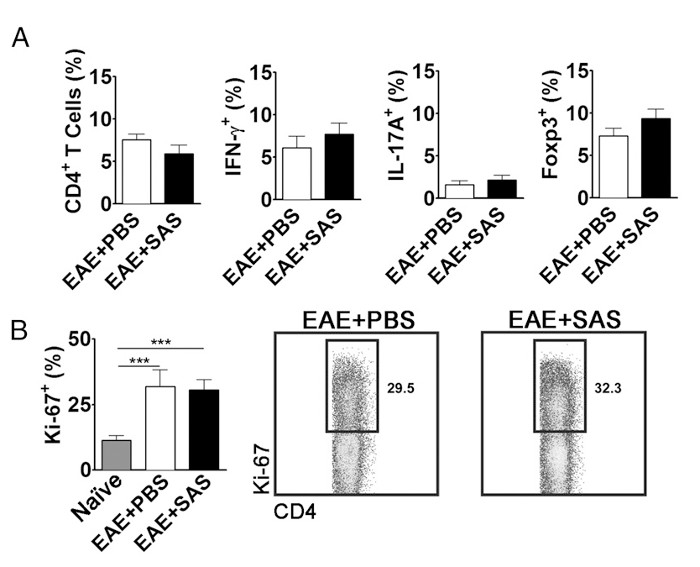
图5. FAC演示EAE C57BL / 6小鼠脾脏S分析等效性T细胞的表达谱和增殖处理和未处理小鼠。脾脏从PBS-和SAS治疗的小鼠进行了分析EAE的15天postinduction。 (A)的CD4 + T细胞的百分比,Th1型(IFN-γ+ / IL-17 - ),Th17细胞(IFN-γ - / IL-17 +)在从PBS-脾脏,和调节性T细胞(的Foxp3 +)组(n = 10),并从两个独立实验的SAS-组(n = 9)的小鼠。 (B,左图)中Ki-67 +细胞在从幼稚脾脏的CD4 +群体的百分比(n = 4时),以及从PBS-(N = 5)和SAS处理的小鼠(n = 5)诱导与EAE。单向ANOVA检验证明中Ki-67 +幼稚从脾脏细胞或者PBS-或SAS处理的EAE脾相比的比例之间的统计学意义。 PBS-和SAS处理的EAE脾间无显着性。 (B,右图)代表点图;数字表明增殖比例。散点图显示百分比。柱状图代表双尾t检验,*** P <0.001。重新打印与(11)权限。 请点击此处查看该图的放大版本。
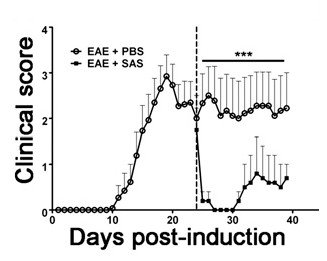
图6. 药物治疗后,免疫细胞浸润SJL小鼠EAE临床得分(平均值±SEM)用PBS处理SJL小鼠(N = 8)或SAS(N = 8)从24日接种后(虚线)与PLP 139-151。数据是平均临床得分±SEM。使用非参数双尾曼 - 惠特尼U检验确定统计学差异,*** P <0.001。上面一行表示用于统计值分析。与许可(11)重新打印。
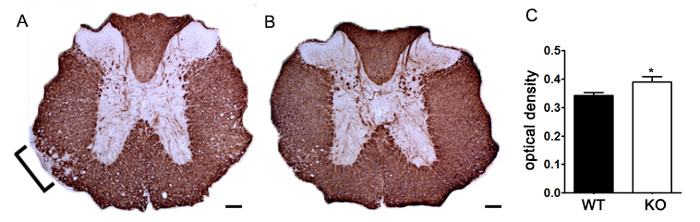
图7. MBP染色的定量使用光密度。(A)在胸段脊髓MBP的代表从染色相比于同窝出生的控制C57BL / 6小鼠EAE诱导不明基因敲除小鼠。方括号表示减少MBP染色表明脱髓鞘的代表区域。从一个未指定的遗传敲除的C57BL / 6小鼠胸脊髓(B)中的MBP染色。 (C)用的EAE诱导的未指定的遗传基因敲除小鼠(KO; N = 6只小鼠,2 - 4腰椎和每只动物胸椎部分)显示在脊髓比野生型(WT MBP染色的较高的光密度(OD); N = 3只,2 - 4腰椎和每个动物的胸段)与EAE诱发小鼠。统计学分析USI纳克双尾t检验,* P <0.05。误差棒表示SEM。比例尺为100μm。
讨论
MS患者继续经历疾病复发而采取任何减弱T细胞活化和/或渗透进入CNS药物,warranting的直接保护中枢神经系统的治疗方案的开发。 EAE已经典被用于MS的症状进行建模和研究在体内的免疫系统和中枢神经系统之间相互作用的性质时可以是一个功能强大的工具。使用对EAE的治疗方面的考虑, 例如 ,定时之前或疾病开始后,在与检查在CNS的免疫细胞浸润和增殖和活化在周边相结合,有可能描绘免疫系统和两个上的治疗效果中枢神经系统。
而EAE在C57BL / 6小鼠被更广泛地利用,EAE在SJL小鼠可能是更具有代表性的大多数的MS的情况下,因为这些小鼠具有在实质一个复发 - 缓解型和免疫细胞的浸润脑10。 SJL小鼠缓解期有明显的复苏,以及,使病情已经呈现后,可以开始治疗,但在减少炎症倍。考虑到SJL小鼠并不总是复发和汇中同步,从而导致潜在的大量变异时的结果汇集是很重要的。因此,一些研究人员可能会选择从一个动物显示临床评分代表性的结果,而在疾病进展为服用FACS分析和组织学小鼠个体化分。
当操作被到EAE小鼠制成可以协助的治疗如何影响免疫系统或中枢神经系统的确定考虑。有用于治疗开始时许多选项,每个都有其自己的内涵免疫细胞是否已进入CNS和它们如何与中枢神经系统进行交互。发病前处理意味着免疫细胞尚未进入或造成中枢神经系统的损害。出现症状后治疗意味着免疫细胞已进入中枢神经系统,并已造成了一定的损害。使用SJL小鼠中,治疗还可以复发,其中免疫细胞正在积极浸润和引起炎症,或缓解,其中免疫细胞可以是在CNS中不太普遍用更少的炎症过程中开始。考虑,其中免疫细胞在治疗期间是在病理过程时可以进行关于治疗如何影响中枢神经系统和免疫系统的初始假设。
有许多,其中处理可能会影响免疫细胞和中枢神经系统,每减少EAE症状的严重程度的最终结果的方法。因此,有必要使用流式细胞术分析和免疫组织化学来看看如何免疫细胞中的外周和中枢神经系统受到影响,免疫细胞是否已进入中枢神经系统,以及中枢神经系统如何响应治疗。而脊髓的流式细胞术分析可确定有多少细胞哈已经输入的中枢神经系统在给定的时间,不能确定,这种效果是由于减少的免疫细胞的运输除非免疫细胞的增殖是在脾不受影响。因此,有必要分析外周和中枢神经组织,并确定什么样的结果意味着机械地当两个组织进行了比较。另外,也可以对免疫细胞的活性曲线以通过处理而改变,例如具有在致病辅助性T细胞重分布的开关来调节T细胞重分布。看为不同的细胞类型的标记和处理的和未处理的动物之间进行比较百分比表达因此也是一个重要的考虑因素。在MS研究中的一个新兴的概念表明,B细胞发挥在自身免疫性脱髓鞘了重要作用。这是基于研究表明,B细胞所必需的T细胞20的激活。这个概念是通过处理如利妥昔单抗,针对CD20前的抗体的成功支持压B细胞21,22的表面上。这表现在单克隆抗体的ocrelizumab的在临床试验的成功,药物靶向CD20的不同表位可以提高B细胞靶向疗法23的功效。
这里提出的技术的一个限制是,它有可能为免疫细胞进入CNS,但无法在实质的旅行。免疫组织化学可用于检测免疫细胞的血管周围袖套和评价处理和未处理的动物之间的实质行进距离。另一个潜在的限制涉及对EAE发病中的微生物的效果。共生的肠道菌群可严重影响疾病的发病机制24;因此,小鼠放置在不同的殖民地,甚至在不同的笼子可以在疾病严重程度的巨大差异。因此,它总是优选尽可能使用在同一笼饲养同窝对照实验涉及EAE。最后需要说明的是,如果它是实验需要消除的在外围免疫细胞增殖的改变的影响,有可能这样做使用被动转移感应,而不是在此协议中描述的活性诱导。
用于神经保护进一步的确认可以使用共培养系统11来测试细胞死亡或通过使用条件性敲除小鼠的其允许蛋白的缺失选择性上的细胞类型特异性的机制来实现。此外,为了扩大是神经保护药剂的探索,轴突横断和神经元死亡的标志物应该包括在内。重要性的另一领域是髓鞘再生。受伤的轴突无法remyelinate进一步支持了神经保护疗法应该是髓鞘再生疗法的重要组成部分。此外,无髓鞘的轴突更容易受到伤害比myelina特德轴突。这表明,当一个轴突成为促进髓鞘及时将防止性轴索损伤脱髓鞘治疗干预。探索这些途径中,可以使用其他的体内模型用于脱髓鞘和髓鞘再生( 即 cuprizone和溶血卵磷脂)。本文的方法描述侧重于量化髓鞘损失评估保护作用。为髓鞘再生的评价祖细胞的数目以及它们的增殖和成熟的也将是非常重要的研究的能力。有了这些替代车型的提,还必须考虑脑炎的不同型号被病毒介导的。有两个产生髓磷脂损失充分表征RNA病毒的模型:一个是Theiler鼠脑脊髓炎,无包膜小核糖核酸病毒,而另一个是鼠肝炎病毒,该冠状病毒家族25,26中的一员。
EAE是ST的有价值的工具的操纵或治疗如何影响免疫系统和中枢神经系统体内 udies。这里描述可以有助于确定治疗方法影响疾病过程中,无论是在外围,在血脑屏障,或在CNS的协议。为MS无电流疗法治愈疾病和患者经常遇到下降一段时间。同样,涉及免疫细胞浸润到中枢神经系统髓鞘的退化,包括急性播散性脑脊髓炎,横断性脊髓炎和视神经脊髓炎,保护中枢神经系统,因为它直接受到攻击由浸润的免疫细胞缺乏治疗其他疾病。考虑到治疗的时间和使用脾脏的流式细胞术分析和脊髓结合CNS的免疫组织化学以评估炎症和损害将使机械测定关于治疗,以制成。
披露声明
作者什么都没有透露。
致谢
一般捐赠基金,国家 - 这项工作是由NINDS P30-NS069324,国家多发性硬化症SocietyRG 4587-A-1,Civitan国际研究基金会,麦克L. Jezdimir横贯性脊髓炎基金会,阿拉巴马州卫生服务基金会资助的大学科学基金会1355183,和T32 AI007051从国家过敏和传染病研究所,美国国立卫生研究院。
材料
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
参考文献
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。