Method Article
La determinazione di soppressione del sistema immunitario contro il sistema nervoso centrale di protezione per farmacologici Interventi a demielinizzazione autoimmune
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Abstract
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Introduzione
La sclerosi multipla (SM) è caratterizzata da lesioni infiammatorie prevalentemente nelle regioni sostanza bianca del cervello nelle prime fasi della malattia. Dopo progressione a lungo termine, sostanza grigia atrofia viene rilevata mediante imaging MRI e segna la fase neurodegenerativa della malattia. gliosi reattiva, demielinizzazione, e danno assonale nella sostanza bianca sono attribuiti a CNS-infiltranti cellule immunitarie. Nessuno dei trattamenti attualmente utilizzati in MS inversa o direttamente prevenire la neurodegenerazione nel SNC - invece, ridurre l'infiammazione attenuando l'attivazione delle cellule T e / o infiltrazione nel SNC. Poiché non esiste una cura per la SM e pazienti che utilizzano trattamenti attuali continuano a sperimentare la progressione della malattia, le scoperte di farmaci che impediscono la demielinizzazione e perdita neuronale sono di fondamentale importanza. Tuttavia, distinguendo tra effetti sulle cellule immunitarie e quelli sul sistema nervoso centrale, può essere difficile sperimentalmente, come risultato - cioè, ridotta danni al SNC - guarda le same indipendentemente dei meccanismi attraverso i quali si verifica. Pertanto, la valutazione di protezione del sistema nervoso centrale deve essere una partnership con le valutazioni di SNC-infiltrazione di cellule immunitarie e la proliferazione delle cellule immunitarie nella periferia di determinare come agenti farmacologici influisce meccanismi di malattia.
Encefalomielite autoimmune sperimentale (EAE) è un modello animale consolidata di malattie infiammatorie autoimmuni che era direttamente responsabile per la scoperta di farmaci attualmente utilizzati per il trattamento di MS 1-4. I topi sono spesso utilizzati per EAE, con C57BL / 6 topi essere un ceppo popolare basata sulla disponibilità di varianti genetiche. C57BL / 6 topi indotti con EAE mostrano progressione della malattia cronica, con insorgenza intorno al giorno 10 post-induzione. L'infiltrazione del parenchima del midollo spinale e del cervelletto sono caratteristici della istopatologia di questi animali, con l'assenza di infiltrazione nel parenchima corticale 5. lesioni Inoltre, corticali e demielinizzazione nel bpioggia sono caratteristiche della malattia 6-9, che sono relativamente assenti in C57BL / 6 topi. Pertanto, può essere preferibile quando possibile utilizzare topi SJL, che hanno la malattia recidivante-remittente e lesioni riscontrate sia nel cervello e il midollo spinale che sembrano simili a quelle di MS 10.
Il trattamento non può essere classificato come neuroprotettivo se le cellule immunitarie non raggiungono mai il sistema nervoso centrale. Pertanto, questo protocollo fa uso di flusso citometria di cervello, midollo spinale, e milza di topi EAE determinare effetti del trattamento sulla infiltrazione di cellule immunitarie nel sistema nervoso centrale e la proliferazione delle cellule immunitarie nella periferia, come precedentemente dimostrato 11. analisi immunoistochimica del tessuto del sistema nervoso centrale per determinare entità e la natura di neuroprotezione è anche descritto. La combinazione di questi metodi consente di determinare se le cellule immunitarie sono stati attivati e proliferano in periferia, se le cellule immunitarie entrati nel CNS, e se il CNS era protected da infiammazione o danni. Se gli effetti neuroprotettivi sono sospettate nonostante effetti sul sistema immunitario, sperimentatori possono alterare trattamento orari di inizio dopo l'infiltrazione di cellule immunitarie nel è verificato il CNS.
Qui, vi presentiamo un protocollo utilizzando due diversi modelli di EAE attivo, un modello animale cellulo-mediata T della sclerosi multipla, e citometria a flusso analisi combinata con immunoistochimica in diversi punti temporali durante la malattia per determinare l'efficacia delle terapie sperimentali su diversi aspetti della patogenesi della SM. Questo metodo aiuterà i ricercatori a distinguere tra effetti sulla proliferazione delle cellule immunitarie e l'infiltrazione contro la protezione del sistema nervoso centrale, rendendo più facile per restringere come farmaci agiscono sulla patogenesi della malattia.
Protocollo
procedure sperimentali che coinvolgono i topi devono essere conformi alle relative norme istituzionali e governative. Per questo studio, i topi sono stati alloggiati e trattati in conformità con National Institutes of Health e la University of Alabama a Birmingham linee guida Istituzionale cura degli animali e del Comitato Usa.
1. EAE Induzione e punteggio
- Indurre EAE in topi C57BL / 6 11-13 o topi SJL 10,11 come descritto in precedenza 13.
NOTA: Gli sperimentatori dovrebbero scegliere un modello ideale per la loro domanda di ricerca (vedi la discussione per ulteriori dettagli). - Punteggi Daily Record come precedentemente descritto 11 per ogni mouse a partire dal giorno 7 post-induzione. Confronto media punteggi quotidiane nel tempo tra i gruppi di trattamento.
2. Trattamento
- Trattare topi EAE prima insorgenza della malattia per determinare se il trattamento riguarda l'infiltrazione delle cellule immunitarie o di proliferazione.
- Scegliere un trattamento, miThOD di consegna, e la frequenza del trattamento tenendo conto del farmaco emato-encefalica barriera di permeabilità, emivita, e il dosaggio.
NOTA: EAE aumenta ematoencefalica permeabilità della barriera e può consentire farmaci per raggiungere il SNC che non sarebbero altrimenti in grado in animali sani. Conducendo esperimenti per le curve dose-risposta in cerca di punteggi clinici EAE può aiutare nella scelta di una dose adeguata di farmaco. comandi del veicolo devono essere eseguiti in parallelo al trattamento farmacologico. In alternativa, i topi knockout condizionali possono essere utilizzati con cucciolata come controlli. - Utilizzare SJL o C57BL / 6 topi per questo esperimento. Trattare i topi subito dopo l'induzione EAE (giorno 7), prima della comparsa dei sintomi con il metodo scelto per la consegna.
- Sacrificio e sezionare topi al picco della malattia (circa il giorno 15), come al punto 3.1 e le sue sotto-fasi, sulla base del più alto punteggio medio clinica nel corso del tempo.
- Comportamento citometria a flusso sul topo midollo spinale (come al punto 3.2) per determinare infiltrati di cellule immunitariesul SNC, e milza (come al punto 3.3) per determinare la proliferazione delle cellule immunitarie nella periferia. Su topi separati, condotta immunoistochimica (come al punto 4) per quantificare astrociti e microglia, e la conservazione della mielina.
- Scegliere un trattamento, miThOD di consegna, e la frequenza del trattamento tenendo conto del farmaco emato-encefalica barriera di permeabilità, emivita, e il dosaggio.
- Trattare i topi EAE dopo l'insorgenza della malattia per determinare se il trattamento protegge il sistema nervoso centrale dopo che si è verificato l'infiltrazione delle cellule immunitarie.
- Ripetere il punto 2.1.1.
- Utilizzare topi SJL per questo esperimento, come questi topi hanno remissioni malattia misurabile. Trattare topi durante il primo picco nella malattia (o, se desiderato, al culmine del seguente recidiva) come misurato dai punteggi clinici medi.
- Sacrifica i topi in una induzione tempo di post-EAE desiderato. Poiché infiltrazione è già verificato, non può essere utile per misurare l'infiltrazione mediante analisi FACS. Tuttavia, prendere il midollo spinale per quantificare gliosi reattiva e mielina per determinare se esiste una protezione del sistema nervoso centrale, nonostante l'infiltrazione delle cellule immunitarie.
3. Analisi flusso Citometria
- Dissezione
- Label tre 15 ml provette coniche (uno per il cervello, uno per il midollo spinale, e uno per la milza) per animali con ID dell'animale e il tipo di tessuto contenute. Tenere tutti i tessuti in tubi separati per l'intera procedura sul ghiaccio.
- Per l'analisi FACS di milze, sacrificare topi al picco della malattia (~ giorno 15 post-EAE induzione) utilizzando anidride carbonica con una portata di circa il 15% del volume del contenitore al minuto per 2 - 3 min. Confermare l'eutanasia dalla mancanza di respiro. Dopo il sacrificio di ogni mouse, rimuovere la milza 14 e posto in un individuo, con etichetta tubo da 15 ml (dal punto 3.1.1) contenente ghiacciata RPMI integrato con il 2% di FCS, 100 UI di penicillina, e 100 mg / ml di streptomicina ( denominato "media" in tutto il protocollo).
- Per l'analisi FACS di cervello e del midollo spinale, eseguire la perfusione cardiaca tagliando atrio destro del mouse con le forbici chirurgiche per rilasciare circulating sangue e penetrante il ventricolo sinistro con un ago collegato ad una siringa riempita con 10 ml di PBS ghiacciato. Iniettare lentamente i 10 ml di PBS.
- Tagliare la testa del mouse e fare un taglio fino alla linea mediana del cuoio capelluto con le forbici chirurgiche. Sbucciate la pelle torna a mano o con una pinza e fare un taglio fino alla linea mediana del cranio con le forbici chirurgiche, utilizzando il punto di ingresso del midollo spinale come un posto da titolare.
- Sbucciare via il cranio con micro pinza e utilizzare una paletta per liberare il cervello. Mettere il cervello in etichetta 15 ml provette coniche (dal punto 3.1.1) supporti contenenti.
- Togliere la pelle del mouse con pinze e forbici chirurgiche, e sviscerare il mouse utilizzando forbici chirurgiche. Tagliare le arti, la coda, le costole, e ogni muscolo che circonda con le forbici chirurgiche per liberare la colonna vertebrale.
- Tagliare la colonna vertebrale in circa 5 pezzi quasi uguali con le forbici chirurgiche e spremere una estremità di un pezzo con un emostatico, e quindi utilizzare un altro emostatico to continuare spremitura, muovendosi lungo il pezzo fino midollo spinale spreme dalla parte superiore. Ripetere questo per ogni pezzo della colonna vertebrale e posizionare i cavi in singolo, con etichetta 15 ml provette coniche (dal punto 3.1.1) contenenti i media.
- La valutazione di infiltrazione delle cellule immunitarie nel cervello e nel midollo spinale
- Tagliare il cervello e il midollo spinale in parti più piccole con le forbici sterili. Crush con lo stantuffo di una siringa da 3 ml su un filtro cella 70 micron in un nuovo tubo 50 ml durante il risciacquo del filtro con i media. Portare ogni tubo ad un volume di 50 ml con supporti. Centrifugare a 453 xg per 5 min per le cellule pellet.
- Aspirare il surnatante e risospendere pellet in 4 ml di 40% dei media gradiente di densità. sovrapporre cautela il gradiente di densità 40% contenente cellule sulla parte superiore di 2 ml di gradiente di densità 70% in un nuovo 15 ml conica tubo pipetta molto lentamente sulla parete del tubo conico per garantire la corretta stratificazione del gradiente. Spin a 796 xg per 20 minuti a temperatura ambiente conun freno.
- Rimuovere accuratamente lo strato di mielina superiore dal gradiente con un trasferimento pipetta 1 ml, quindi rimuovere cellule vitali a livello di interfaccia con una pipetta 1 ml di trasferimento e trasferimento in un nuovo tubo da 15 ml. Portare il tubo a 15 ml con media e centrifugare a 448 xg per 10 min.
- Risospendere il pellet in 200 microlitri mezzi e mettere in un pozzetto di una piastra a 96 pozzetti a fondo tondo (ogni campione da ogni animale andrà in proprio bene). Centrifugare la piastra a 410 xg per 5 min.
- Flick il sopranatante e risospendere pellet in 200 ml di mezzi restimolazione (RPMI supplementato con 10% FCS, 100 IU / ml penicillina, 100 ug / ml di streptomicina, 2 mM L-glutammina, 1x aminoacidi non essenziali, 1 mM piruvato di sodio , e 55 mM β-mercaptoetanolo, più 50 ng / ml forbolo miristato acetato (PMA), 750 ng / ml ionomicina, e l'inibitore del trasporto proteico brefeldina a). Porre la piastra in un incubatore a 37 ° C per 4 ore.
NOTA: PMA e ionomrisultati restimolazione ycin di attivazione di tutti i linfociti T-indipendentemente dalla loro specificità antigenica al fine di valutare il numero totale di ogni sottogruppo di cellule T nel tessuto dato. Tuttavia, le risposte delle cellule T effettrici antigene-specifiche possono essere valutati in vari modi, tra cui restimolare cellule con MOG peptide in presenza di brefeldina a 15,16. - La valutazione dei fenotipi delle cellule T CD4 CNS
- Dopo l'incubazione, centrifugare la piastra a fondo rotondo a 96 pozzetti (dal punto 3.2.5), a 410 xg per 5 min e flick fuori il surnatante. Tutti i seguenti passaggi di colorazione sono svolte in questa piastra.
- Lavare le cellule in 200 microlitri di PBS con 2% FCS e centrifugare a 410 xg per 5 min. Flick il surnatante e incubare cellule con 200 ml di PBS contenente 2% FCS con Fc Block (clone 2.4G2) per 10 - 15 minuti in ghiaccio.
- Per iniziare la macchia extracellulare, le cellule centrifugare a 410 xg per 5 minuti, flick off surnatante, e risospendere pellet in 50 &# 956; l di cocktail superficie macchia contenente fluoroforo etichettati anticorpi anti-CD4 (1: 200, 1 mg / ml), TCRβ (1: 200, 1 mg / ml), e la vitalità tintura (1: 500) diluito in PBS per 15 min in ghiaccio. cellule centrifugare a 410 xg per 5 min e flick il surnatante. Lavare le cellule 2x in 200 l di PBS poi centrifugare a 410 xg per 5 min.
- Dopo aver rimosso la macchia extracellulare, avviare la procedura di colorazione intracellulare per la fissazione / permeabilizzazione seguita dalla colorazione intracellulare.
- Per cominciare, flick il surnatante e fissare / cellule permeabilize con Foxp3 fattore di trascrizione di colorazione reagenti 17 (secondo le istruzioni del fabbricante; vedi lista dei materiali) per 30 minuti per una notte a 4 ° C.
- Lavare le cellule in tampone permeabilizzazione 150 microlitri dalla piastra kit e centrifugare a 410 xg per 5 min. Flick le cellule surnatante e macchia nel buffer di permeabilizzazione 50 ml con fluoroforo marcati-anticorpi contro IL-17A (1: 200, 1 mg / ml), IFN-γ (1: 200, 1 mg / ml), e Foxp3 (1: 200, 2,5 mg / ml) diluito in PBS per 30 min in ghiaccio.
- cellule centrifugare a 410 xg per 5 min e flick il surnatante. Per rimuovere gli anticorpi in eccesso Lavare 3x in un tampone permeabilizzazione 200 microlitri poi centrifugare a 410 xg per 5 min. Flick il surnatante e risospendere in 200 microlitri di PBS.
- Analizzare le cellule di citometria a flusso, gating su CD4 in diretta cellule + TCRβ + come descritto in precedenza 11 per valutare la percentuale di cellule che esprimono ogni molecola. Contare le cellule utilizzando un emocitometro 18 o un altro metodo convalidato per determinare il numero di cellule per topo con ciascuno dei fenotipi delle cellule T CD4.
- Utilizzando i dati ottenuti, calcolare la percentuale e il numero di cellule T CD4 + infiltrante il cervello e il midollo spinale da ogni mouse, con una particolare attenzione per queste popolazioni, che svolgono un ruolo critico nella patogenesi EAE e protezione19: IL-17A + IFN-γ -, IL-17A + IFN-γ +, IL-17A - IFN-γ +, Foxp3 +.
- Valutazione della proliferazione delle cellule T periferiche e attivazione
- Crush milza con scivoli in vetro smerigliato in un piatto di coltura di 60 x 15 mm. Posizionare sospensione cellulare in un tubo da 15 ml usando un supporto per sospendere le cellule. Riempire il tubo a 15 ml con celle di media e centrifugare a 448 xg per 5 min.
- Aspirare media e risospendere pellet in 2 ml di ACK lisi tampone a temperatura ambiente per lisare i globuli rossi per circa 3 minuti.
- Portare tubo per volume di 15 ml con i media e la tensione su un colino cella di 70 micron in un nuovo tubo. cellule centrifugare a 448 xg per 5 minuti, aspirare il surnatante, e risospendere in 2 ml di media.
- Valutazione della periferica proliferazione delle cellule T CD4 + da Ki-67 colorazione
- Mettere una piccola aliquota (in genere 200 ml) di eqnumeri uivalent di splenociti da 3.3.3 in singoli pozzi (uno per ogni campione) in un piatto fondo rotondo a 96 pozzetti.
- Centrifugare a 410 xg per 5 min e flick il surnatante. Risospendere in 200 ml di PBS contenente 2% FCS e ripetere la centrifugazione. Flick le cellule surnatante e risospendere con PBS contenente 2% FCS con Fc Block (clone 2.4G2) e incubare per 10 - 15 minuti in ghiaccio. Per extracellulare macchia ripetere il punto 3.2.6.3.
- Dopo aver rimosso la macchia extracellulare, avviare la procedura di colorazione intracellulare per la fissazione / permeabilizzazione seguita dalla colorazione intracellulare.
- Ripetere il punto 3.2.6.4.1.
- cellule centrifugare a 410 xg per 5 min e flick il surnatante. Lavare le cellule 1x in 200 microlitri di buffer permeabilizzazione dal kit e centrifugare a 410 xg per 5 min. Flick off cellule surnatante e macchie in tampone permeabilizzazione 50 microlitri con anti-Ki-67 anticorpi (1: 200, 1 mg / ml) per 30 min.
- cellule centrifugare a 410 xg FOR 5 min e flick il surnatante. Lavare le cellule 2x in 200 microlitri di buffer permeabilizzazione dal kit e centrifugare a 410 xg per 5 min.
- Flick off surnatante e lavare le cellule 1x in 200 ml di PBS e centrifugare a 410 xg per 5 min. Analizzare le cellule di citometria a flusso, gating su CD4 in diretta cellule + TCRβ + come descritto in precedenza 11, poi valutare Ki-67 + cellule per cento.
- Valutazione della periferici fenotipi di cellule T CD4 +
- Mettere 200 ml di cellule (dal punto 3.3.3) in una piastra a 96 pozzetti a fondo tondo (un pozzo per campione) e centrifugare a 410 xg per 5 minuti e ri-stimolare come in 3.2.5.
- Inserire piatto in un incubatore a 37 ° C per 4 ore. Eseguire la stessa procedura di colorazione, come nel passo 3.2.6 e dei suoi sotto-fasi. Analizzare le cellule mediante citometria di flusso come in 3.2.6.4.4-3.2.6.5.5.
4. un immunoistochimicad Quantificazione
- preparazione dei tessuti
- Sacrifica topi EAE in un esperimento separato da quelli utilizzati nel passaggio 3 e le sue sottofasi in qualsiasi momento dopo l'induzione EAE (spesso ~ giorno 30, durante la fase cronica della malattia di topi C57BL / 6 o durante un picco nei punteggi clinici medi SJL topi) seguendo le istruzioni riportate di seguito per determinare misura di gliosi reattiva e demielinizzazione.
- Anestetizzare topi con 2,5% isoflurano e 97,5% di ossigeno e confermare adeguata profondità dell'anestesia con un dito del piede delicato pizzico usando pinze, alla ricerca di una mancanza di risposta. Eseguire perfusione transcardiac come descritto al punto 3.1.3. Dopo l'iniezione di PBS nel ventricolo sinistro, utilizzare una nuova siringa per iniettare 10 ml di paraformaldeide al 4% in PBS. ATTENZIONE: Paraformaldeide è una pelle e polmone irritante, può causare gravi danni agli occhi, ed è sospettato di provocare il cancro. Evitare l'inalazione, l'ingestione, e il contatto con la pelle e gli occhi. Perfusione deve essere eseguita in una cappa aspirante.
- Rimuovere i cervelli e le colonne vertebrali come descritto ai punti 3.1.4 - 3.1.6. Legare le colonne vertebrali di bastoni con lo spago per garantire l'allineamento rettilineo del midollo spinale.
- Mettere cervelli in fiale di scintillazione etichettati con ID dell'animale con circa 20 ml di paraformaldeide al 4% in PBS, e midollo spinale in 50 ml provette coniche etichettati con ID dell'animale con circa 50 ml di paraformaldeide al 4% in PBS al post-correzione durante la notte.
- Per cryoprotect cervello, lavare 3 volte in 1x PBS e conservare a 4 ° C in 30% di saccarosio in PBS 1x. Lasciare il cervello a cadere sul fondo del loro contenitori (circa 3 giorni).
- Rimuovere il calcio dalla colonna vertebrale risciacquandola 3 volte in PBS 1x e ponendolo in un grande volume (circa 50 ml per un mouse midollo spinale) di 0,5 M EDTA in PBS 1x (iniziando pH sarà ~ 10; pH a ~ 7,8 con 6 N HCl) per 2 - 3 settimane fino all'osso non è più rigida. Cryoprotect la colonna vertebrale seguendo passo 4.1.5.
- cervelli sovrastante ecolonne vertebrali in OCT seguenti sotto-fasi di seguito non appena cadono sul fondo dei loro contenitori.
- Fare una miscela di 1 parte di 30% di saccarosio in PBS 1x e 2 parti OCT (ad esempio, aggiungere 15 ml 30% di saccarosio in PBS 1x 30 ml OCT).
- Aggiungete il composto Ott / saccarosio allo stampo embedding (22 x 22 x 20 mm per il cervello e 22 x 30 x 20 mm per il midollo spinale) fino a quando si tratta di ½ pieno.
- Tagliare le colonne vertebrali in 6 pezzi di pari dimensioni con una lama di rasoio e posto in un mm stampo 22 x 30 x 20 embedding rivolto in avanti per le sezioni coronali del midollo spinale. Mettere cervelli interi in 22 stampi x 22 x 20 mm rivolti in avanti.
- Aggiungere ottobre miscela / di saccarosio per coprire il tessuto e lasciare riposare per 1 ora. in modo da bolle possono sfuggire. Durante questa ora, aggiungere 2-metilbutano ad un piatto che può contenere stampi incorporamento per il flash-congelamento. Porre la capsula in ghiaccio secco e coprire pre-cool.
- Flash-congelare lo stampo in 2-metilbutano in ghiaccio secco e conservare a -80 ° C all'interno di acontainer per prevenire la disidratazione.
- Quando si è pronti, sezione di tessuto a 16 micron con un criostato e montare su vetrini caricate elettrostaticamente. Mettere ogni sezione 10 ° su un vetrino per ciascun cervello e nel midollo spinale (per esempio, far scorrere 1 avrà sezioni 1, 11, e 21, e far scorrere 2 avrà sezioni 2, 12, e 22, e così via). Conservare scivola a -80 ° C o utilizzare per la colorazione subito.
- Colorazione per gliosi reattiva e mielina
- Quando si è pronti per la colorazione, scegliere uno scivolo per ciascun cervello e il midollo spinale per macchia per ogni animale nello stesso (o il più possibile simili) regione. Per il cervello, selezionare le diapositive che mostrano il corpo calloso e fagotto cingolo.
- Collocare i vetrini con il tessuto su un blocco di calore a 70 ° C per 7 min. Dopo 7 minuti spegnere il blocco di calore e lasciare raffreddare le diapositive sul blocco di calore per altri 10 - 15 min. Questo consentirà di evitare sezioni di tessuto di cadere le diapositive durante la procedura di colorazione.
- Lavare i vetrini 3 volte ciascuna in 1x PBS con 0,1% di detergente non ionico (per gli antigeni intracellulari) o 1x PBS (per gli anticorpi rivolti antigeni di superficie) per 5 min.
NOTA: Dal momento che gli anticorpi utilizzati in questo protocollo sono intracellulare, detergenti non ionici saranno utilizzati nei passaggi successivi. Non permettere mai che i vetrini si asciughino completamente dopo questo passaggio. - Collocare i vetrini in un contenitore e coprire con citrato tampone a pH 3.0. Per rendere tampone citrato, aggiungere 0,192 g di acido citrico anidro fino ad un volume finale di 100 ml di acqua. Aggiustare il pH con acido acetico se sopra pH 3.0 o NaOH se al di sotto.
- Incubare i vetrini a 37 ° C per 30 minuti e lavare 3 volte in PBS 1x con 0,1% di detergente non ionico per 5 min.
- Cerchio un'area attorno al tessuto con una penna barriera idrofobica e posizionare i vetrini in una camera umidificata (ad esempio, una scatola contenente tovaglioli di carta umidi). Aggiungere tampone di bloccaggio al tessuto. Incubare per 30 minuti a RT.
NOTA: Il blocco di buffer è costituito da 1x PBSpiù lo 0,3% di detergente non ionico e il siero appropriato (5%) in base l'ospite della anticorpo secondario, vale a dire, siero di cavallo per proteina basica della mielina (MBP) e acida fibrillare gliale proteina (GFAP), e siero di capra per Iba1. - Flick tampone di bloccaggio al largo delle diapositive e aggiungere anticorpo primario (1: 1.000 o 0.2 mg / capra ml anti-proteina basica della mielina per gli oligodendrociti, 1: 1000 o 1 mg / ml a 3 mg / topo ml anti-GFAP per gli astrociti, o 1 : 750 o 0,67 mg / ml di coniglio anti-Iba1 per microglia) diluito in tampone di bloccaggio appropriata (vedi punto 4.2.6) per l'area cerchiata. Lasciare a 4 ° C durante la notte nella camera umidificata.
- anticorpo Flick in tampone di bloccaggio fuori i vetrini e lavare i vetrini 3 volte in PBS 1x con 0,1% di detergente non ionico per 5 min.
- Aggiungere anticorpo secondario (1: 200 o 7,5 mg / ml cavallo biotinilato anti-topo per MBP e GFAP, o di capra biotinilato anti-coniglio per Iba1) diluito in tampone di bloccaggio appropriata (vedere step 4.2.6) nell'area cerchiata e lasciare diapositive incubare nella camera umidificata per 1 ora a RT.
- anticorpo Flick in tampone di bloccaggio fuori i vetrini e lavare i vetrini 3 volte in PBS 1x con 0,1% di detergente non ionico per 5 min.
- Preparare avidina-biotina-perossidasi complesso (ABC) in dell'immunoperossidasi (vedi elenco dei materiali) 30 minuti prima dell'uso e porre in un agitatore fino al momento in 4.2.12. Aggiungere 0,3% H 2 O 2 in metanolo al area cerchiata per 10 minuti per spegnere attività perossidasica endogena.
- soluzione Flick al largo delle diapositive e lavare in 2 volte in PBS 1x o 1x PBS con 0,1% di detergente non ionico per 5 minuti, poi 1 volta in 1x PBS. Aggiungere ABC reagente al area cerchiata per 30 min.
- soluzione Flick al largo delle diapositive e lavare 3 volte in 1x PBS per 5 minuti, poi 2 volte in acqua per 5 min. Fare soluzione 3,3'-diaminobenzidina (DAB) (vedi Lista dei materiali) e aggiungerlo per coprire le sezioni.
NOTA: Questo passaggio richiede un microscopio per osservare ottimale rilevaretempo ione di colorazione e deve essere fatto per la stessa quantità di tempo per vetrini da confrontare. - Lavare i vetrini 3 volte in acqua per 5 minuti ciascuna. Disidratare il tessuto posizionando Le soluzioni per 2 minuti ogni: 70% di etanolo in acqua, etanolo al 95% in acqua, 100% di etanolo in acqua, 50% xileni e il 50% di etanolo, 100% xileni. Sigillare un vetrino sul vetrino con un mezzo di montaggio resinoso.
- In alternativa, eseguire immunofluorescenza colorazione come descritto in precedenza 11 per valutare gliosi reattiva utilizzando anticorpi contro Iba-1 e GFAP.
- Prendere le immagini di ciascuna sezione del midollo spinale (macchiato con i relativi anticorpi utilizzando DAB) con un 4X, 0,13 oggettiva NA e salvare le immagini come .tiff. In alternativa, prendere le immagini del corpo calloso e fagotto cingulum nell'emisfero cerebrale sinistro o destro con un 20X, 0.50 obiettivo NA e salvare le immagini come .tiff. Per una determinazione più completa di carico lesionale nel cervello, è utile includere sia hemispheres nelle analisi.
- Misurare area media frazione di gliosi reattiva (Iba1 e GFAP colorazione)
- Scarica NIH ImageJ (http://imagej.nih.gov/ij/) e aperto su un computer. Sul software ImageJ, utilizzare il menu di stringa File> Apri e selezionare un'immagine dal punto 4.2.16. Disegnare una superficie tramite funzione "selezioni poligono" sulla barra dei menu. Per midollo spinale, tracciare l'intera sezione; per il cervello, il corpo calloso e fascio cingolo. Convertire l'immagine a 16 bit andando su Immagine> Tipo e cliccando su "16 bit".
- De-rumore l'immagine andando a processo> Sottrai sfondo e impostare il "raggio di rotolamento palla" per almeno la dimensione dell'oggetto più grande che non fa parte dello sfondo (vedere il manuale d'uso ImageJ all'indirizzo http: //rsbweb.nih .gov / IJ / docs / guide / 146-29.html).
NOTA: Per un'immagine 4X di Iba-1 colorazione usiamo 4.0 e per GFAP usiamo 50.0, ma questi numeri possono variare a seconda ingrandimento dell'immagine e colorazione intensità. - Controllare "paraboloide scorrevole" e fare clic su "OK". Vai a Immagine> Regola> Soglia ... e impostare il livello di soglia inferiore (barra in alto) utilizzando le barre di scorrimento. Includere solo colorazione che è cellulare e essere coerenti tra le immagini. Per le immagini con sfondi scuri (si applica solo a colorazione fluorescente), assicurarsi che la casella "sfondo scuro" sia selezionata.
- Vai Analizza> Set Misure ... e selezionare "frazione Area" (dà la percentuale di zona thresholded all'interno della regione di interesse). Assicurarsi che "Limitato a soglia" è selezionata e "l'etichetta Display" sia selezionata. Fai clic su "OK" quando completa.
- Per ottenere misurazioni, va ad analizzare> Misura. Una finestra di popup "Risultati" apparirà e questi dati possono essere salvati come è o copiati in un altro programma. Per l'analisi, confrontare i valori "frazione Area" tra i gruppi di trattamento.
- Quantificazione del MBP colorazione da optdensità iCal
- Aprire immagine e disegnare un'area di interesse come descritto al punto 4.3.1. Vai Analizzare> Set Misure ... e selezionare (la somma dei valori di grigio all'interno della selezione diviso per il numero di pixel) "valore di grigio medio". Assicurarsi che "Limitato a soglia" è selezionata e "l'etichetta Display" sia selezionata. Fai clic su "OK" quando completa.
- Per ottenere misurazioni, va ad analizzare> Misura. Osservare apparire una finestra di pop-up "Risultati". Copiare questi dati e salvare come è o copiare in un altro programma.
- Per l'analisi, copiare e incollare valori in un altro programma. Convertire valore di grigio medio in densità ottica (OD) con la formula: OD = log 10 (255 / valore medio grigio).
Risultati
Qui, abbiamo utilizzato due modelli di EAE per capire se un agente farmacologico fornisce una protezione del sistema nervoso centrale da una attenuando cellule T SNC-infiltranti o prevenire mielina e danno assonale durante l'assalto di infiammatorio infiltrazione di cellule immunitarie. Per determinare se un agente terapeutico impedisce l'infiltrazione di cellule immunitarie nel midollo spinale, il modello di topo C57BL / 6 di EAE cronica è usato dove infiltrazione di cellule immunitarie e patologia malattia è prevalentemente trova nel midollo spinale (Figura 1A). Per determinare se un farmaco terapeutico fornisce una protezione del sistema nervoso centrale durante l'intrusione di cellule immunitarie nel sistema nervoso centrale, il modello animale SJL di recidivante-remittente EAE viene utilizzato, il che dimostra la malattia patologia sia nel cervello e il midollo spinale (Figura 1B).
valutazioni cliniche
Valutazioni cliniche rilevanti sono realizzati secondo il seguente rubrica per tipica (Figura 1C) o atipici (Figura 1D) EAE. Per la malattia clinica tipica, un punteggio di 0 non è un comportamento anomalo. Quando prelevati dalla base della coda, la coda può ruotare rapidamente (molto simile a un rotore di elicottero) e le zampe posteriori si divaricate. Un punteggio clinico di 1 è una coda parzialmente limp, che possono essere determinate sollevando il mouse dalla base della coda. Il normale rotazione elicottero-come può essere indebolito o assente, e parte della coda può essere completamente inerte. Un modo utile per determinare entità della coda paralisi è quello di eseguire un dito la lunghezza della coda, come coda unparalyzed solito arricciare intorno al dito, mentre una coda parzialmente paralizzato non sarà in grado di farlo. Un punteggio clinico di 2 rappresenta una coda completamente paralizzato. Nessun movimento della coda si verifica affatto quando raccogliendo il mouse fino alla base della coda. Un punteggio clinico di 3 rappresenta parziale paralisi degli arti posteriori. Determinazione di questo punteggio richiede che il mouse sia libero di muoversi su un fladi superficie t. Se uno degli arti posteriori sta trascinando il mouse si sposta in avanti, o se uno o entrambi gli arti posteriori sembrano essere parzialmente paralizzato, può essere dato un punteggio di 3. Un punteggio clinico di 4 rappresenta paralisi completa degli arti posteriori. Con questo punteggio, un mouse non sarà in grado di spostare gli arti posteriori e si trascinerà per sé in avanti con le sue arti anteriori. Un punteggio clinico di 5 rappresenta un topo moribondo, o un mouse con difficoltà spostandosi in tutta la sua gabbia o la respirazione. Se un mouse non si può trascinare lungo il fondo della gabbia o se il suo respiro è affannoso, il mouse deve essere umanamente eutanasia. Un punteggio clinico di 6 rappresenta un topo trovato morto nella sua gabbia. Un punteggio di 6 è insolito e cause di morte diversa da EAE dovrebbe essere studiata.
malattia clinica atipica può o non può essere accompagnata da paralisi. Può essere necessario includere due sistemi di punteggio separati se un topo presenta con malattia atipica più sintomi tipici. Un punteggio di 0 non è un comportamento anomalo, uns con il tipico sistema di punteggio. Un punteggio clinico di 1 rappresenta una leggera curva testa o inclinazione mentre il mouse sta camminando. Questo può essere determinato autorizzando il mouse per camminare avanti e osservando una direzionalità costante sinistra oa destra per il suo movimento. Un punteggio clinico di 2 rappresenta una svolta testa più pronunciato e scarsa capacità di raddrizzamento. Come con un punteggio di 1 atipico, il mouse ha direzionalità al suo movimento e può avere leggera difficoltà di equilibrio. Un punteggio clinico di 3 rappresenta una incapacità di camminare in linea retta. Il mouse avrà difficoltà a bilanciare e può usare il lato della gabbia per aiutare diritto stesso quando cammina. Un punteggio clinico di 4 rappresenta un mouse che sul suo lato, in grado di camminare a causa di problemi di bilanciamento. Il mouse può essere in grado di trascinarsi lungo il fondo della gabbia, ma possono avere direzionalità al suo movimento. Un punteggio clinico di 5 rappresenta rotolamento continuo a meno sostenuto. Un mouse che raggiunge questo punteggio deve essere umanamente eutanasia. Una clinicaAl punteggio di 6 rappresenta un topo trovato morto nella sua gabbia. Un punteggio di 6 è insolito e cause di morte diversa da EAE dovrebbe essere studiata.
Può essere necessario per consentire "in-between" colonne sonore, ad esempio, l'aggiunta di 0,5 a un punteggio se la condizione modifiche di un topo leggermente o se scegliere tra due punteggi è difficile. Ad esempio, un mouse che comincia a muoversi più lentamente rispetto ai suoi omologhi normali, ma non visualizza paralisi o un mouse che stringe zampe posteriori con il suo fronte invece di dispiegamento sue gambe alla raccolta per la coda può essere dato un punteggio di 0.5 . Un topo che si possono trascinare solo lungo il fondo della gabbia ed è solo in grado di contrarsi i suoi arti posteriori periodicamente o quando viene toccato può essere dato un punteggio di 3.5.
Valutare una riduzione immunitario delle cellule Infiltration
Dopo l'induzione di EAE nel / 6 modello di topo C57BL (Figura 1A, giorno 0), Presentati antigenesu e la proliferazione delle cellule T nella milza si verificano nei giorni 1-5 seguito da infiltrazione di cellule immunitarie nel sistema nervoso centrale intorno al giorno 7. Circa 3 a 5 giorni dopo che i topi immuni infiltrazione di cellule iniziali presenti con punteggi clinici. Per valutare se un agente terapeutico sta bloccando l'infiltrazione di cellule immunitarie nel midollo spinale, droghe o veicolo vengono introdotti il giorno 7 dopo la presentazione dell'antigene e la proliferazione nei milza, ma prima di cellule del sistema immunitario iniziano a infiltrarsi nel midollo spinale. Se infiltrazione di cellule immunitarie è stato attenuato, il decorso clinico dovrebbe riflettere miglioramento dei punteggi clinici durante la fase di salita della malattia da 10 giorni a 15 (Figura 2).
Una riduzione dell'infiltrazione delle cellule immunitarie potrebbe anche tradursi in neuroinfiammazione diminuita. astrocitosi reattiva e microgliosis sono considerati importanti caratteristiche per neuroinfiammazione. Colorazione per astrociti con GFAP e microglia con Iba-1 può quindi essere utilizzato per valutare changes in media colorazione frazione area da quantificare neuroinfiammazione (Figura 3).
Per determinare se l'infiltrazione delle cellule immunitarie è ridotta, i midolli spinali vengono rimossi e trattati per citometria a flusso al picco della malattia (Figura 1A, circa il giorno 18). Questo assicura che il maggior numero di cellule immunitarie sono entrati nel midollo spinale. L'ingresso di cellule T nel sistema nervoso centrale è considerato l'inizio evento infiammatorio ed entrambe le cellule Th1 e Th17 si trovano in modelli animali di EAE e pazienti affetti da SM. Nel loro insieme, analisi di citometria di flusso dovrebbe includere la valutazione di entrambi i tipi di cellule T patogene. Inoltre, Tregs sono cellule ben caratterizzati soppressore T che smorzano la malattia. Pertanto, la percentuale di Tregs da una popolazione totale CD4 + deve essere valutata rispetto alla percentuale di popolazioni di cellule T effettrici. Questo rivelerà se si è verificata una riduzione complessiva infiltrazione di cellule T o se there è un disallineamento di fenotipi di cellule T nel sistema nervoso centrale. Dot plots rappresentativi (figura 4a) dimostrano una riduzione del numero complessivo di CD4 + infiltranti cellule T nel midollo spinale di topi trattati con farmaci rispetto al midollo spinale di topi trattati con veicolo (numeri in quadranti alto a destra). Per valutare Th1, Th17 e Treg le seguenti proteine di firma sono valutati: IFN-γ +, IL-17 +, e Foxp3 +, rispettivamente, e deve essere ridotta (Figura 4A). L'analisi statistica dovrebbe essere eseguita su CD4 +, IFN-γ +, IL-17 +, e il numero di cellule Foxp3 + a dimostrare una significativa riduzione (Figura 4B). Per escludere un inclinazione di sottoinsiemi di cellule T, valutazione statistica della percentuale di IFN-γ + IL-17 +, IFN-γ + IL-17 -, IL-17 + IFN-γ -, e viene eseguita cellule Foxp3 + ( Fifigura 4C).
Per eliminare la possibilità che una riduzione CNS infiltranti cellule T è una conseguenza della proliferazione, attivazione e differenziazione in periferia, il numero di attivamente proliferanti cellule T in aggiunta alla percentuale di sottotipi di cellule T deve essere valutata. Nessun cambiamento nella percentuale di CD4 +, IFN-γ +, IL-17 +, o Foxp3 + dovrebbero essere trovati se l'attivazione e la differenziazione non sono influenzati (Figura 5A). Inoltre, nessun cambiamento nelle cellule Ki67 + CD4 + dovrebbe essere trovata se la proliferazione non è influenzato (Figura 5B). trattamenti farmacologici vengono introdotti il giorno 7 o successivo per non alterare presentazione dell'antigene iniziale e l'attivazione delle cellule T nella periferia. Tuttavia, in modelli genetici delle proteine sono spesso cancellati costitutivamente durante l'embriogenesi o indotto prima dell'induzione di EAE fare splenocyte assessment di grande importanza.
Valutare CNS Protezione
Per dimostrare se un particolare agente terapeutico modula la patologia della malattia del sistema nervoso centrale dopo l'infiltrazione di cellule immunitarie, interventi di droga devono essere somministrati durante il primo picco nella malattia punteggio clinico. Il modello SJL di EAE è vantaggioso per questi esperimenti dal momento che questi topi mostrano un fenotipo recidivante-remittente. Se un trattamento farmaco impedisce mielina-assone degenerazione, un miglioramento nei punteggi clinici sarà osservato (Figura 6). la valutazione patologica della mielina deve corroborare una riduzione del danno mielina coerente con migliori punteggi clinici. Per valutare quantitativamente integrità mielina, DAB colorazione della proteina basica della mielina (MBP) è effettuata, seguito da analisi statistica della densità ottica di questa colorazione (Figura 7). Per confermare ulteriormente che neuroinfiammazione è sostenuta o diminuito therapeinterventi UTIC, gliosi reattiva può essere valutata misurando area media frazione di gliosi reattiva come sopra descritto (Figura 3). Per corroborare che un intervento terapeutico è direttamente protegge il sistema nervoso centrale, senza effetti immunomodulatori, attenuazione di infiltrazione di cellule immunitarie nel sistema nervoso centrale e la proliferazione nelle milza deve essere scontato. Per risolvere questo problema, metodi per la valutazione del cervello e del midollo spinale di infiltrazione di cellule immunitarie e valutazione della proliferazione delle cellule T periferiche e di attivazione deve essere eseguita come sopra descritto (figure 4 e 5). Presi insieme, agenti terapeutici che bloccano danno cellulare nel SNC senza evidenza di una riduzione nel CNS infiltranti cellule T o proliferazione di cellule T nella periferia sono trattamenti CNS-protettivi.
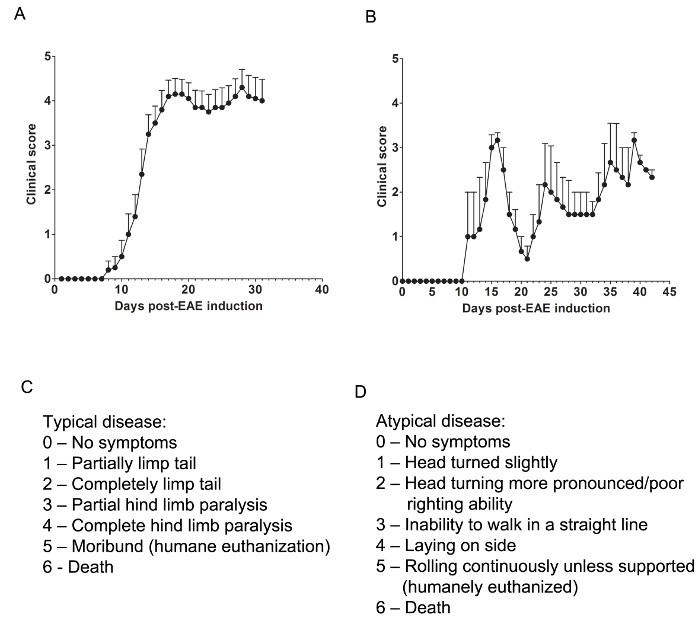
Figura 1. Rappresentante Result di punteggi clinici da EAE in topi SJL C57BL / 6 e. (A) punteggi clinici (media ± SEM) di C57BL / 6 topi (n = 10), indotta con MOG 35-55 per la produzione di EAE con malattie croniche. (B) realizza cliniche (media ± SEM) di topi SJL (n = 3) indotte con PLP 139-151 per produrre EAE con malattia recidivante-remittente. (C) Il punteggio rubrica clinica usata per monitorare la progressione tipica malattia nei topi EAE. (D) Il punteggio rubrica clinica usata per monitorare la progressione della malattia atipica nei topi EAE. Cliccate qui per vedere una versione più grande di questa figura.
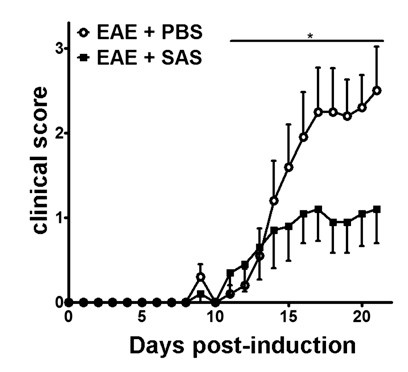
Figura 2. trattamento farmacologico prima immunitaria cellulo infiltrazione in C57BL / 6 topi con EAE. punteggi clinici (media ± SEM) di C57BL / 6 topi trattati con PBS (n = 20) o SAS (n = 19) dal giorno 7 post-immunizzazione con MOG 35-55. I dati sono da tre esperimenti indipendenti pool. differenza statistica è stata determinata utilizzando un parametrico a due code test di Mann-Whitney U, * p <0,05. Ristampa con il permesso (11).
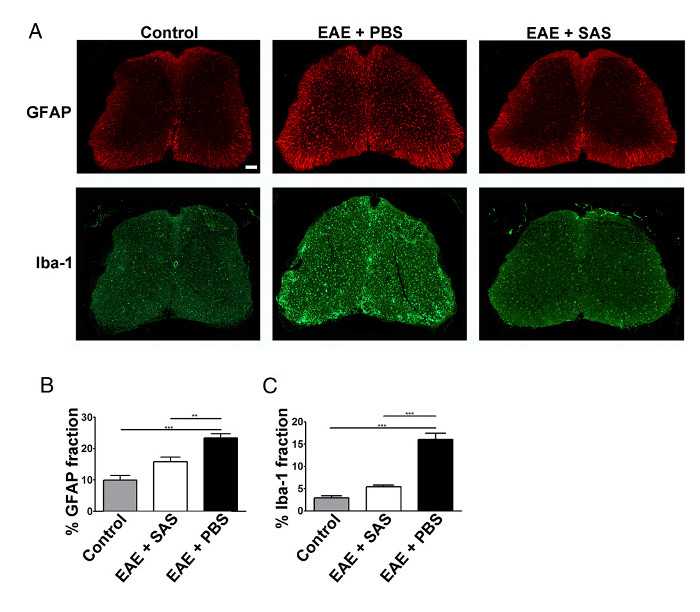
Figura 3. colorazione di immunofluorescenza e quantificazione dei reattiva Gliosi in Spinal cavi di controllo, EAE, e trattati C57BL / 6 topi. (A) l'etichettatura fluorescente per GFAP (astrociti) e Iba-1 (microglia) nel midollo spinale del controllo (non immunizzata ) mouse (sinistra pannelli) e topi EAE trattati con PBS (pannelli centrali) o SAS (pannelli a destra). Barra di scala = 100 micron. La quantificazione di colorazione è stato determinato utilizzando la tecnica frazione zona di misurare cento immunopzona ositive per GFAP (B) e Iba-1 (C). Media ± SEM, n = 3 di controllo, n = 3 SAS-trattata, o n = 4 topi PBS-trattati, 6 sezioni per il mouse. Le differenze statistiche sono stati determinati usando un one-way ANOVA, * p <0.05, ** p <0.01, *** p <0.001. Re-stampa con il permesso (11). Si prega di cliccare qui per vedere una versione più grande di questa figura.
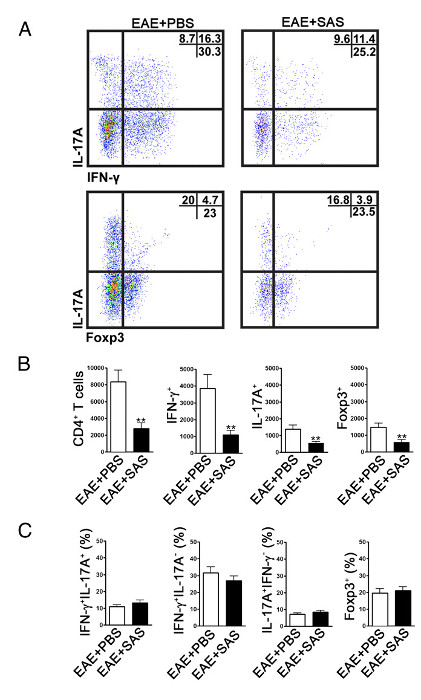
Figura 4. FACS analisi della EAE C57BL / 6 del mouse Spinal Cords dimostrando la riduzione dell'infiltrazione delle cellule T nei topi trattati. C57BL / 6 topi sono stati trattati con SAS o PBS, a cominciare 7 d postinduction della EAE. Midollo spinale sono stati ottenuti il giorno 15. (A) Rappresentante trame dot mostrare Th1 (IFN-γ + / IL-17 -) e Th17 (IFN-γ- / IL-17 +), le cellule CD4 + in porta (pannelli superiori) e le cellule T regolatorie (Foxp3 +) (pannelli inferiori). trame Dot mostrano percentuali nel quadrante in alto a destra. (B) numero assoluto di cellule CD4 + e IFN-γ +, IL-17A + e cellule Foxp3 + sono stati analizzati statisticamente. (C) La variazione percentuale di popolazioni di cellule T tra sas- e topi EAE PBS-trattati è stata anche esaminata. Media ± SEM, n = 10 per PBS trattati, e n = 9 per SAS trattata da due esperimenti indipendenti. t test a due code è stato utilizzato per tutti i grafici a barre. ** P <0.01. Re-stampa con il permesso (11). Si prega di cliccare qui per vedere una versione più grande di questa figura.
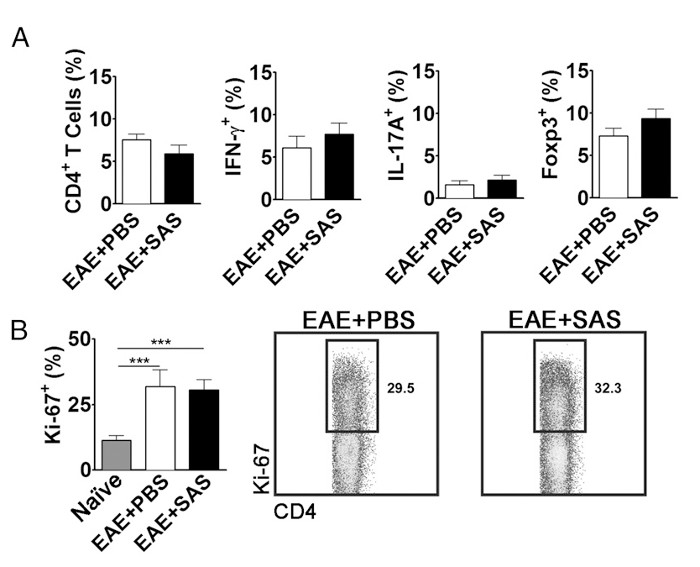
Figura 5. FACAnalisi S di EAE C57BL / 6 del mouse milze Dimostrando equivalenti profili di espressione delle cellule T e la proliferazione di topi trattati e non trattati. Milza di topi PBS- e SAS-trattati sono stati analizzati 15 d postinduction di EAE. (A) La percentuale di cellule T CD4 +, Th1 (IFN-γ + / IL-17 -), Th17 (IFN-g - / IL-17 +), e T cellule regolamentazione (Foxp3 +) nella milza di PBS- trattati (n = 10) e SAS trattati (n = 9) topi da due esperimenti indipendenti. (B, pannello di sinistra) La percentuale di cellule Ki-67 + nella popolazione CD4 + da milze naive (n = 4), nonché da PBS- (n = 5) e topi SAS-trattati (n = 5) indotta con EAE. Un test ANOVA a senso unico ha dimostrato significatività statistica tra la percentuale di Ki-67 + cellule provenienti da milza naive rispetto sia con PBS- o milza EAE SAS-trattati. Non è stata osservata significatività tra PBS- e milze EAE SAS-trattati. (B, pannello di destra) dot plots rappresentativi; numeri indicano percentuale di proliferazione. trame Dot mostrano percentuali. I grafici a barre rappresentano t test a due code, *** p <0.001. Re-stampa con il permesso (11). Si prega di cliccare qui per vedere una versione più grande di questa figura.
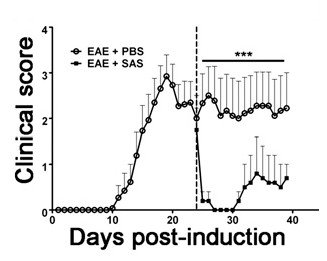
Figura 6. trattamento farmacologico dopo immunitaria cellulo infiltrazione in SJL topi con EAE. Punteggi clinici (media ± SEM) di topi SJL trattati con PBS (n = 8) o SAS (n = 8) dal giorno 24 post-immunizzazione (linea tratteggiata) con PLP 139-151. I dati sono media ± SEM dei punteggi clinici. differenza statistica è stata determinata utilizzando un parametrico a due code test di Mann-Whitney U, *** p <0.001. La linea superiore rappresenta i valori utilizzati per la statisticaanalisi. Ristampa con il permesso (11).
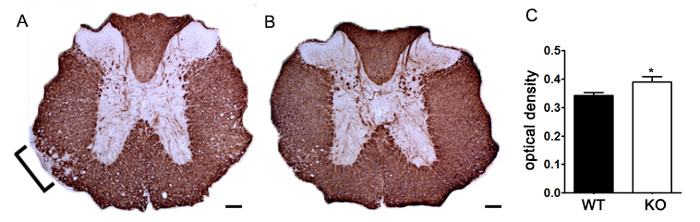
Figura 7. Quantificazione di MBP colorazione con densità ottica. (A) colorazione Rappresentante del MBP in toracico del midollo spinale da un topo knockout genetica non specificato rispetto al controllo littermate C57BL / 6 del mouse indotta con EAE. Staffa indica un'area rappresentativa di riduzione MBP colorazione indica demielinizzazione. (B) MBP colorazione del midollo spinale toracico da un knockout genetica non specificato C57BL / 6 del mouse. (C) topi knockout genetiche non specificati indotte con EAE (KO; n = 6 topi, 2 - 4 lombari e sezioni toracica per animale) presentano una densità ottica superiore (OD) di MBP colorazione nel midollo spinale di tipo selvatico (WT; n = 3 topi, 2-4 lombari e sezioni toraciche per animale) topi indotti con EAE. USI analizzati statisticamenteng un test t a due code, * p <0,05. Le barre di errore rappresentano SEM. barra della scala di 100 micron.
Discussione
I pazienti con SM continuano a sperimentare le recidive di malattia durante l'assunzione di farmaci che attenuano l'attivazione delle cellule T e / o infiltrazione nel sistema nervoso centrale, garantendo lo sviluppo di opzioni di trattamento che proteggono direttamente il sistema nervoso centrale. EAE è stato classicamente utilizzato per modellare i sintomi della sclerosi multipla e può essere un potente strumento quando si studia la natura delle interazioni tra il sistema immunitario e del sistema nervoso centrale in vivo. Utilizzando tempi di considerazioni di trattamento in EAE, ad esempio, prima o dopo l'inizio della malattia, in combinazione con l'esame infiltrazione delle cellule immunitarie nel SNC e la proliferazione e l'attivazione in periferia, è possibile delineare gli effetti dei trattamenti sia sul sistema immunitario e il CNS.
Mentre EAE nel topo C57BL / 6 è più ampiamente utilizzato, EAE nel SJL mouse potrebbe essere più rappresentativi della maggior parte dei casi di SM, come questi topi hanno un fenotipo dirimessa e infiltrazione di cellule immunitarie nel parenchimadel cervello 10. topi SJL hanno recupero chiara durante la remissione pure, rendendo possibile iniziare il trattamento dopo che la malattia ha presentato, ma durante i periodi di riduzione dell'infiammazione. E 'importante considerare che i topi SJL non sempre ricaduta e rimettono in sincronia, con conseguente potenzialmente grande variabilità quando i risultati vengono raggruppati. Di conseguenza, alcuni ricercatori possono scegliere di mostrare i risultati rappresentativi per i punteggi clinici da un animale durante l'assunzione di topi per l'analisi FACS ed istologia a punti individualizzati nella progressione della malattia.
Considerando quando manipolazioni sono fatti per topi EAE può aiutare nella determinazione di come un trattamento agisce sul sistema immunitario o CNS. Ci sono molte opzioni per quando inizia il trattamento, ciascuno con la propria connotazione di se le cellule immunitarie sono entrati nel sistema nervoso centrale e come essi possono essere che interagiscono con il sistema nervoso centrale. Trattamento prima comparsa dei sintomi implica che le cellule immunitarie non sono ancora entrate o causato danni al sistema nervoso centrale.Trattamento dalla comparsa dei sintomi suggerisce che le cellule immunitarie sono entrati nel sistema nervoso centrale e hanno causato qualche danno. Utilizzando topi SJL, il trattamento può anche iniziare durante una ricaduta, in cui le cellule immunitarie sono attivamente infiltrando e causando infiammazione, o durante la remissione, in cui le cellule immunitarie possono essere meno diffuso nel SNC con meno infiammazione. ipotesi iniziali per quanto riguarda come trattamenti colpiscono il sistema nervoso centrale e il sistema immunitario può essere fatto se si considera dove le cellule immunitarie sono nel processo patologico durante il trattamento.
Ci sono un certo numero di modi in cui i trattamenti possono influire cellule immunitarie e del SNC, ciascuno con il risultato finale di ridurre la gravità dei sintomi EAE. Pertanto, è necessario utilizzare l'analisi citofluorimetrica e immunoistochimica guardare a come le cellule immunitarie sono influenzate in periferia e CNS, se le cellule immunitarie sono entrati nel CNS, e come il CNS reagisce al trattamento. Mentre l'analisi di citometria di flusso del midollo spinale in grado di determinare quante cellule ettarive entrato nel CNS in un determinato momento, non si può determinare che questo effetto è dovuto al ridotto il traffico delle cellule immunitarie meno proliferazione delle cellule immunitarie è influenzato nella milza. È pertanto necessario analizzare sia tessuti periferici e CNS e determinare quali risultati medi meccanicamente quando entrambi i tessuti vengono confrontati. E 'anche possibile per profili di attività delle cellule immunitarie che deve essere modificato mediante trattamento, per esempio avendo un interruttore in un profilo patogeno cellule helper T pesanti ad un profilo cella pesante T normativo. Guardando i marcatori per i diversi tipi di cellule e confrontando espressione per cento tra gli animali trattati e non trattati è quindi anche una considerazione importante. Un concetto emergente nella ricerca MS suggerisce che le cellule B svolgono un ruolo importante nella demielinizzazione autoimmune. Questo si basa su studi che dimostrano che le cellule B sono necessarie per la riattivazione di cellule T 20. Questo concetto è supportato dal successo di trattamenti come rituximab, un anticorpo contro CD20 expremuto sulla superficie delle cellule B 21,22. Come dimostrato dal successo del ocrelizumab anticorpo monoclonale in studi clinici, farmaci destinati differenti epitopi di CD20 può migliorare l'efficacia delle cellule B mirati terapeutica 23.
Una limitazione delle tecniche presentate qui è che è possibile per le cellule immunitarie di entrare nel CNS ma essere in grado di viaggiare nel parenchima. Immunoistochimica può essere utilizzato per rilevare manicotti perivascolari di cellule immunitarie e valutare distanza percorsa nel parenchima tra gli animali trattati e non trattati. Un altro potenziale limitazione riguarda gli effetti della microbiome sulla EAE patogenesi. Commensale flora intestinale può influenzare pesantemente patogenesi della malattia 24; di conseguenza, i topi alloggiati in diverse colonie e anche in diverse gabbie possono avere grandi differenze nella gravità della malattia. Di conseguenza, è sempre preferibile ove possibile utilizzare i controlli littermate sollevati nella stessa gabbia peresperimenti EAE. Una nota finale è che se è sperimentalmente desiderabile eliminare gli effetti delle cellule immunitarie cambiamenti proliferative della periferia, può essere possibile farlo utilizzando induzione trasferimento passivo piuttosto che l'induzione attivo descritto in questo protocollo.
Un'ulteriore conferma per la neuroprotezione può essere realizzato utilizzando un sistema di co-coltura 11 per testare specifici meccanismi di morte cellulare o tramite l'utilizzo di topi knockout condizionali che consente l'eliminazione di proteine selettivamente su un tipo di cellula. Inoltre, per estendere l'esplorazione di agenti farmacologici che sono neuroprotettivo, marcatori di transezione assonale e morte neuronale dovrebbero essere inclusi. Un altro settore di importanza è rimielinizzazione. assoni feriti sono in grado di remyelinate prestare ulteriore sostegno che le terapie neuroprotettive dovrebbe essere una parte importante di terapie rimielinizzazione. Inoltre, gli assoni amieliniche sono più vulnerabili al danno di myelinaassoni TED. Questo suggerisce che quando un assone diventa interventi terapeutici demielinizzati che promuovono la rimielinizzazione tempestivo impedirà danno assonale. Per esplorare queste vie, altri modelli in vivo per la demielinizzazione e rimielinizzazione possono essere utilizzati (ad esempio, cuprizone e lisolecitina). Il metodo descritto nel presente documento si è concentrato sulla valutazione neuroprotezione quantificando la perdita di mielina. Per la valutazione della remyelination il numero di cellule progenitrici nonché la loro capacità di proliferare e maturare sarebbe anche importante indagare. Con la menzione di questi modelli alternativi, si deve anche considerare diversi modelli di encefalite virale che sono mediate. Ci sono due modelli ben caratterizzati virale di RNA che producono la perdita di mielina: uno è encefalomielite murina di Theiler, un virus senza involucro Picornaviridae, e l'altro è il mouse virus dell'epatite, un membro della famiglia di virus Coronaviridae 25,26.
EAE è uno strumento prezioso per studies di come manipolazioni o trattamenti influenzano il sistema immunitario e del sistema nervoso centrale in vivo. Il protocollo qui descritto può aiutare a determinare se i trattamenti colpiscono il processo della malattia, sia in periferia, alla barriera emato-encefalica, o nel SNC. Nessun attuali trattamenti per la SM curare la malattia e spesso i pazienti esperienza declino nel corso del tempo. Allo stesso modo, altre malattie che coinvolgono l'infiltrazione di cellule immunitarie nel sistema nervoso centrale e la degradazione della mielina, compresa l'encefalomielite acuta disseminata, mielite trasversa, e neuromielite ottica, trattamenti mancanza che proteggono il sistema nervoso centrale in quanto è direttamente sotto attacco da infiltrazione di cellule immunitarie. Prendendo in considerazione i tempi di trattamento e mediante analisi citofluorimetrica della milza e del midollo spinale in combinazione con immunoistochimica del SNC per valutare l'infiammazione e danni consentirà determinazioni meccanicistici essere fatte riguardo trattamenti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dal NINDS P30-NS069324, la National Multiple Sclerosis SocietyRG 4587-A-1, la Fondazione Civitan International Research, The Mike L. Jezdimir trasversa Mielite Foundation, The University of Alabama Servizi sanitari Fondazione - Generale Endowment Fund, The National Science Foundation 1355183, e T32 AI007051 dal National Institute of Allergy e Malattie infettive, National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
Riferimenti
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon