Method Article
Détermination Suppression du système immunitaire contre la protection du système nerveux central pour les interventions pharmacologiques dans démyélinisation autoimmune
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Résumé
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Introduction
La sclérose en plaques (SEP) est caractérisée par des lésions inflammatoires principalement dans les régions de la substance blanche du cerveau au début de la maladie. Après la progression à long terme, la matière grise atrophie est détectée par imagerie IRM et marque la phase neurodégénératif de la maladie. gliose réactive, démyélinisation et des lésions axonales dans la substance blanche sont attribuées aux cellules immunitaires CNS-infiltrant. Aucun des traitements actuellement utilisés dans la SEP inverse ou directement empêcher la neurodégénérescence dans le système nerveux central - au contraire, ils réduisent l'inflammation en atténuant l'activation et / ou l'infiltration des lymphocytes T dans le SNC. Parce qu'il n'y a pas de remède pour la SP et les patients utilisant les traitements actuels continuent de connaître la progression de la maladie, les découvertes de médicaments qui préviennent la démyélinisation et neuronale perte sont d'une importance cruciale. Cependant, la différence entre les effets sur les cellules immunitaires et celles sur le SNC peut être difficile expérimentalement, comme le résultat - à savoir, la réduction des dommages au système nerveux central - regarde les same quels que soient les mécanismes par lesquels elle se produit. Par conséquent, l'évaluation de la protection CNS doit être associé à des évaluations de CNS infiltrant les cellules immunitaires et la prolifération des cellules immunitaires dans la périphérie afin de déterminer comment les agents pharmacologiques affecte les mécanismes de la maladie.
Experimental encéphalomyélite auto - immune (EAE) est un modèle animal bien établi de troubles inflammatoires auto - immunes qui était directement responsable de la découverte de médicaments actuellement utilisés pour traiter MS 1-4. Les souris sont souvent utilisées pour l'EAE avec C57BL / 6 souris étant une souche populaire basée sur la disponibilité de variantes génétiques. C57BL / 6 souris induites avec EAE présentent la progression de la maladie chronique avec apparition d'environ 10 jours après l'induction. Infiltration du parenchyme de la moelle épinière et du cervelet sont caractéristiques de l'histopathologie de ces animaux, en l' absence d'infiltrations dans le parenchyme cortical 5. lésions plus, corticales et démyélinisation dans le bla pluie sont les caractéristiques de la maladie 6-9, qui sont relativement absentes dans C57BL / 6. Par conséquent, il peut être préférable si possible d'utiliser des souris SJL, qui ont une maladie récurrente-rémittente et des lésions trouvées dans le cerveau et la moelle épinière qui semblent similaires à ceux de la MS 10.
Le traitement ne peut pas être classé comme neuroprotecteur si les cellules immunitaires ne jamais atteindre le système nerveux central. Par conséquent, ce protocole permet l' utilisation d'écoulement analyse cytométrique de cerveau, la moelle épinière et les rates des souris atteintes d' EAE afin de déterminer les effets du traitement sur l' infiltration des cellules immunitaires dans le SNC et la prolifération des cellules immunitaires dans la périphérie, comme démontré précédemment 11. analyses immunohistochimiques de tissu du SNC pour déterminer l'étendue et la nature de la neuroprotection est également décrite. La combinaison de ces méthodes permet de déterminer si les cellules immunitaires ont été activés et prolifèrent à la périphérie, que les cellules immunitaires sont entrés dans le système nerveux central, et si le système nerveux central est protected de l'inflammation ou de dommage. Si l'on soupçonne des effets neuroprotecteurs malgré des effets sur le système immunitaire, les expérimentateurs peuvent altérer le traitement des heures de démarrage après l'infiltration des cellules immunitaires dans le SNC est produite.
Ici, nous présentons un protocole utilisant deux modèles différents de EAE actif, un modèle animal à médiation cellulaire T de MS, et cytométrie de flux combiné avec immunohistochimie à divers points de temps au cours de la maladie afin de déterminer l'efficacité des thérapies expérimentales sur différents aspects de MS pathogenèse. Cette méthode va aider les chercheurs à différencier les effets sur la prolifération des cellules immunitaires et de l'infiltration par rapport à la protection du système nerveux central, ce qui rend plus facile à affiner la façon dont les médicaments agissent sur la pathogenèse de la maladie.
Protocole
Les procédures expérimentales portant sur les souris doivent se conformer aux réglementations institutionnelles et gouvernementales pertinentes. Pour la présente étude, les souris ont été logés et traités conformément aux National Institutes of Health et de l'Université d'Alabama à Birmingham directives Institutional Animal Care et l'utilisation du Comité.
1. EAE Induction et notation
- Induire l' EAE chez les souris C57BL / 6 ou des souris SJL 11-13 10,11 13 comme décrit précédemment.
NOTE: Les expérimentateurs doivent choisir un modèle idéal pour leur question de recherche (voir la discussion pour plus de détails). - Scores record par jour comme décrit précédemment 11 pour chaque souris à partir du jour 7 post-induction. Comparez vos scores quotidiens moyens au fil du temps entre les groupes de traitement.
2. Traitement
- Traiter les souris EAE avant l'apparition de la maladie afin de déterminer si le traitement affecte l'infiltration de cellules immunitaires ou la prolifération.
- Choisissez un traitement, methode de livraison, et la fréquence du traitement tout en tenant compte barrière hémato-encéphalique perméabilité, la demi-vie, et le dosage du médicament.
NOTE: EAE augmente barrière hémato-encéphalique perméabilité et peut permettre à des médicaments pour atteindre le système nerveux central qui ne serait pas autrement pouvoir chez les animaux sains. Réalisation d'expériences pour les courbes dose-réponse en regardant les scores cliniques EAE peut aider à choisir une dose appropriée de médicament. les commandes du véhicule doivent être exécutées en parallèle au traitement de la toxicomanie. Alternativement, les souris knock-out conditionnel peuvent être utilisés avec la même portée que les contrôles. - Utiliser SJL ou C57BL / 6 pour cette expérience. Traiter les souris tôt après induction de l'EAE (jour 7), avant l'apparition des symptômes en utilisant la méthode de livraison choisie.
- Sacrifice et de disséquer les souris au pic de la maladie (environ 15 jours), comme dans l'étape 3.1 et de ses sous-étapes, en fonction de la moyenne la plus élevée clinique du score au fil du temps.
- Conduite cytométrie en flux sur la moelle épinière de souris (comme dans l'étape 3.2) pour déterminer infiltrati de cellules immunitairessur le système nerveux central, ainsi que sur la rate (comme dans l'étape 3.3) pour déterminer la prolifération des cellules immunitaires à la périphérie. Sur des souris distinctes, la conduite immunohistochimie (comme dans l'étape 4) pour quantifier les astrocytes et la microglie, et la préservation de la myéline.
- Choisissez un traitement, methode de livraison, et la fréquence du traitement tout en tenant compte barrière hémato-encéphalique perméabilité, la demi-vie, et le dosage du médicament.
- Traiter les souris EAE après l'apparition de la maladie afin de déterminer si le traitement protège le système nerveux central après l'infiltration de cellules immunitaires est produite.
- Répétez l'étape 2.1.1.
- Utiliser des souris SJL pour cette expérience, ces souris ont rémissions de la maladie mesurable. Traiter les souris au cours du premier pic de la maladie (ou, si on le souhaite, au sommet d'une rechute après) tel que mesuré par les scores cliniques moyens.
- Sacrifiez les souris à une induction de temps post-EAE souhaitée. Parce que l'infiltration a déjà eu lieu, il peut ne pas être utile pour mesurer l'infiltration par analyse FACS. Cependant, prenez la moelle épinière pour quantifier gliose réactive et la myéline afin de déterminer s'il existe une protection CNS malgré l'infiltration des cellules immunitaires.
3. Analyse de cytométrie en flux
- Dissection
- Étiquette trois tubes de 15 ml coniques (un pour le cerveau, l'un pour la moelle épinière, et une pour la rate) par animal avec l'ID de l'animal et le type de tissu contenaient. Gardez tous les tissus dans des tubes séparés pour l'ensemble de la procédure sur la glace.
- Pour l'analyse FACS de la rate, sacrifier les souris au pic de la maladie (~ 15 jours post-induction de l'EAE) en utilisant du dioxyde de carbone avec un taux de volume du récipient d'environ 15% par minute pour 2 flux - 3 min. Confirmer l'euthanasie par le manque de respiration. Après le sacrifice de chaque souris, retirer la rate 14 et la place dans un individu, marqué 15 ml tube conique (de l' étape 3.1.1) contenant RPMI glacé supplémenté avec 2% de FCS, 100 UI de pénicilline et 100 pg / ml de streptomycine ( dénommé «médias» tout au long du protocole).
- Pour l'analyse FACS du cerveau et de la moelle épinière, effectuer la perfusion cardiaque en coupant l'oreillette droite de la souris avec des ciseaux chirurgicaux pour libérer circulating de sang et perçant le ventricule gauche avec une aiguille reliée à une seringue remplie avec 10 ml de PBS glacé. Lentement injecter 10 ml de PBS.
- Coupez la tête de la souris et faire une coupe jusqu'à la ligne médiane du cuir chevelu avec des ciseaux chirurgicaux. Peler la peau du dos à la main ou avec une pince et faire une coupe jusqu'à la ligne médiane du crâne avec des ciseaux chirurgicaux, en utilisant le point de la moelle épinière comme une tache de départ d'entrée.
- Décollez le crâne avec pince micro et utiliser une pelle pour libérer le cerveau. Placez les cerveaux dans étiquetés 15 ml tubes coniques (de l'étape 3.1.1) des milieux contenant.
- Retirez la peau de la souris avec des pinces et des ciseaux chirurgicaux, et éviscérer la souris à l'aide des ciseaux chirurgicaux. Coupez les branches, la queue, les côtes, et tout muscle entourant avec des ciseaux chirurgicaux pour libérer la colonne vertébrale.
- Couper la colonne vertébrale dans environ 5 morceaux à peu près égales avec des ciseaux chirurgicaux et presser une extrémité d'une pièce avec un hémostatique, puis utiliser un autre hémostatique to continuer la compression, se déplaçant le long de la pièce jusqu'à ce que la moelle épinière serre de la partie supérieure. Répétez cette opération pour chaque pièce de la colonne vertébrale et de placer les cordons en individuel, marqué 15 ml tubes coniques (de l'étape 3.1.1) contenant les médias.
- L'évaluation de l'infiltration des cellules immunitaires dans le cerveau et la moelle épinière
- Couper le cerveau et la moelle épinière en petits morceaux à l'aide de ciseaux stériles. Écraser avec le piston d'une seringue de 3 ml sur une cellule tamis 70 pm dans un nouveau tube de 50 ml pendant le rinçage du filtre avec des milieux. Amener chaque tube à un volume de 50 ml avec des milieux. Centrifuger à 453 g pendant 5 min à un culot de cellules.
- Aspirer le surnageant et remettre le culot dans 4 ml de 40% milieu à gradient de densité. superposer soigneusement le gradient de densité 40% contenant les cellules sur le dessus de 2 ml de 70% en gradient de densité dans un nouveau tube de 15 ml conique pipette très lentement sur la paroi du tube conique pour assurer une bonne stratification du gradient. Spin à 796 xg pendant 20 min à température ambiante avecun frein.
- Retirez délicatement la couche de myéline supérieure du gradient avec une pipette de transfert 1 ml, puis éliminer les cellules viables à l'interface avec un 1 ml pipette de transfert et le transfert à un nouveau tube de 15 ml conique. Amener le tube à 15 ml avec les médias et centrifuger à 448 g pendant 10 min.
- Resuspendre le culot dans 200 médias ul et placer dans un puits d'une plaque à 96 puits à fond rond (chaque échantillon de chaque animal ira dans son propre puits). Centrifuger la plaque à 410 g pendant 5 min.
- Flick le surnageant et remettre en suspension le culot dans 200 pl de milieu de re-stimulation (RPMI supplémenté avec 10% de FCS, 100 UI / ml de pénicilline, 100 pg / ml streptomycine, 2 mM de L-glutamine, 1 x acides aminés non essentiels, pyruvate de sodium 1 mM et 55 pM de β-mercaptoéthanol, plus 50 ng / ml d'acétate myristate de phorbol (PMA), 750 ng / ml d'ionomycine, et l'inhibiteur de transport des protéines Brefeldine A). Placer la plaque dans un incubateur à 37 ° C pendant 4 heures.
NOTE: PMA et ionomRésultats de la restimulation ycin dans l'activation de tous les lymphocytes T-indépendamment de leur spécificité antigénique afin d'évaluer le nombre total de chaque sous-ensemble de cellules T dans le tissu donné. Cependant, les réponses des lymphocytes T effecteurs spécifiques d' un antigène peuvent être évaluées de diverses manières, y compris restimulating cellules avec le peptide MOG , en présence de Brefeldine A 15,16. - Évaluation des phénotypes de cellules T CD4 + du système nerveux central
- Après incubation, centrifuger la plaque à fond rond de 96 puits (de l'étape 3.2.5), à 410 xg pendant 5 min et secouez le surnageant. Toutes les étapes de coloration suivantes sont effectuées dans cette plaque.
- Laver les cellules dans 200 ul de PBS avec 2% de FCS et centrifuger à 410 g pendant 5 min. Flick le surnageant et incuber les cellules avec 200 ul de PBS contenant 2% de FCS avec Fc Block (clone 2.4G2) pendant 10 - 15 min sur la glace.
- Pour commencer la tache extracellulaire, centrifuger les cellules à 410 g pendant 5 min, feuilletez le surnageant et remettre le culot dans 50 &# 956; l de la tache de la surface cocktail contenant des anticorps fluorophores marqué contre les cellules CD4 (1: 200, 1 pg / ml), TCRβ (1: 200, 1 pg / ml) et de la viabilité de colorant (1: 500) dilué dans du PBS pendant 15 min sur la glace. Centrifuger les cellules à 410 xg pendant 5 min et flick le surnageant. Laver les cellules 2x dans 200 ul de PBS puis centrifuger à 410 g pendant 5 min.
- Après avoir enlevé la tache extracellulaire, engager la procédure de coloration intracellulaire par fixation / perméabilisation suivie d'une coloration intracellulaire.
- Pour commencer, faites glisser le surnageant et fixer / cellules perméabiliser avec Foxp3 facteur de transcription coloration des réactifs 17 (selon les instructions du fabricant; voir la liste des matériaux) pendant 30 minutes pour une nuit à 4 o C.
- Laver les cellules dans un tampon de perméabilisation 150 pi du kit et centrifuger plaque à 410 g pendant 5 min. Flick off cellules surnageant et tache dans 50 pi de tampon de perméabilisation avec fluorophores marqués-anticorps contre IL-17A (1200, 1 pg / ml) IFN-γ (1: 200, 1 pg / ml) et Foxp3 (1: 200, 2,5 pg / ml) dilué dans du PBS pendant 30 minutes sur de la glace.
- Centrifuger les cellules à 410 xg pendant 5 min et flick le surnageant. Pour éliminer les anticorps en excès de lavage 3x dans un tampon de perméabilisation 200 pi puis centrifuger à 410 g pendant 5 min. Flick le surnageant et remettre en suspension dans 200 ul de PBS.
- Analyser les cellules par cytométrie de flux en temps réel fenêtrage CD4 + + TCRβ des cellules comme décrit précédemment 11 pour évaluer le pourcentage de cellules exprimant chaque molécule. Compter les cellules en utilisant un hémocytomètre 18 ou une autre méthode validée pour déterminer le nombre de cellules par souris avec chacun des phénotypes de lymphocytes T CD4 +.
- En utilisant les données obtenues, calculer le pourcentage et le nombre de cellules T CD4 + infiltrant le cerveau et la moelle épinière de chaque souris, avec un accent particulier sur ces populations qui jouent un rôle essentiel dans la pathogenèse et la protection EAE19: IL-17A + IFN-γ -, IL-17A + IFN-γ +, IL-17A - IFN-γ +, Foxp3 +.
- Évaluation de périphérique prolifération des lymphocytes T et l'activation
- Ecrasez la rate avec des lames de verre dépoli dans une boîte de culture de 60 x 15 mm. Placez suspension cellulaire dans un tube conique de 15 ml en utilisant les médias de suspendre les cellules. Remplir le tube à 15 ml avec des cellules de médias et de centrifugation à 448 g pendant 5 min.
- Aspirer les médias et les remettre en suspension le culot dans 2 ml de tampon de lyse ACK à la température ambiante pour lyser les globules rouges pendant environ 3 min.
- Amener le tube à 15 ml de volume avec les médias et la souche sur une cellule crépine 70 pm dans un nouveau tube. Centrifuger les cellules à 448 xg pendant 5 min, Aspirer le surnageant et remettre en suspension dans 2 ml de milieu.
- L' évaluation des lymphocytes T CD4 + périphériques prolifération cellulaire par coloration au Ki-67
- Placer une petite aliquote (typiquement 200 pi) de l'équationnuméros uivalent de splénocytes de 3.3.3 dans des puits individuels (un par échantillon) dans une plaque à fond rond de 96 puits.
- Centrifuger à 410 xg pendant 5 min et flick le surnageant. Remettre en suspension dans 200 ul de PBS contenant 2% de FCS et répéter la centrifugation. Flick off cellules surnageant et resuspendre avec du PBS contenant 2% de FCS avec Fc Block (clone 2.4G2) et incuber pendant 10 à 15 min sur la glace. Pour tache extracellulaire répétez l'étape 3.2.6.3.
- Après avoir enlevé la tache extracellulaire, engager la procédure de coloration intracellulaire par fixation / perméabilisation suivie d'une coloration intracellulaire.
- Répétez l'étape 3.2.6.4.1.
- Centrifuger les cellules à 410 xg pendant 5 min et flick le surnageant. Laver les cellules 1x dans 200 pi de tampon de perméabilisation du kit et centrifuger à 410 g pendant 5 min. Flick hors des cellules du surnageant et la tache dans un tampon de perméabilisation de 50 ul avec des anticorps anti-Ki-67 anticorps (1: 200, 1 pg / ml) pendant 30 min.
- Centrifuger les cellules à 410 xg for 5 min et flick le surnageant. Laver les cellules 2x dans 200 pi de tampon de perméabilisation du kit et centrifuger à 410 g pendant 5 min.
- Flick le surnageant et laver les cellules 1x dans 200 ul de PBS et centrifuger à 410 g pendant 5 min. Analyser les cellules par cytométrie en flux, gating sur CD4 + en direct TCRβ + cellules comme décrit précédemment 11, puis d' évaluer pour cent Ki-67 + cellules.
- Évaluation des phénotypes périphériques de lymphocytes T CD4 +
- Placez 200 pi de cellules (de l'étape 3.3.3) dans une plaque de 96 puits à fond rond (un puits par échantillon) et centrifuger à 410 g pendant 5 min et re-stimuler comme dans 3.2.5.
- Placer la plaque dans un incubateur à 37 ° C pendant 4 heures. Effectuez la même procédure de coloration comme à l'étape 3.2.6 et ses sous-étapes. Analyser les cellules par cytométrie de flux comme dans 3.2.6.4.4-3.2.6.5.5.
4. immunohistochimie und Quantification
- Préparation des tissus
- Sacrifiez les souris EAE dans une expérience séparée de celles utilisées à l'étape 3 et ses sous-étapes à tout moment après induction de l'EAE (souvent ~ 30 jours, au cours de la phase chronique de la maladie pour les C57BL / 6 souris ou lors d'un pic dans les scores cliniques moyens pour SJL souris) suivant les étapes ci-dessous pour déterminer l'étendue de la gliose réactive et démyélinisation.
- Anesthetize souris avec 2,5% d'isoflurane et 97,5% d'oxygène et de confirmer la profondeur appropriée de l'anesthésie avec un orteil douce pincer en utilisant une pince, à la recherche d'une absence de réponse. Effectuer perfusion transcardiaque comme décrit à l'étape 3.1.3. Après l' injection de PBS dans le ventricule gauche, utilisez une nouvelle seringue pour injecter 10 ml de 4% de paraformaldehyde dans PBS ATTENTION:. Paraformaldéhyde est un irritant pour la peau et des poumons, peut causer des dommages graves aux yeux, et est soupçonné de provoquer le cancer. Éviter l'inhalation, l'ingestion et contact avec la peau et les yeux. Perfusion doit être effectuée sous une hotte aspirante.
- Retirer les cerveaux et les colonnes vertébrales comme décrit dans les étapes 3.1.4 - 3.1.6. Attachez les colonnes vertébrales de bâtons avec une ficelle pour assurer un alignement rectiligne de la moelle épinière.
- Mettre le cerveau dans des flacons à scintillation marqués avec l'ID de l'animal avec environ 20 ml de paraformaldehyde à 4% dans du PBS, et la moelle épinière dans 50 ml tubes coniques marqués avec l'ID de l'animal avec environ 50 ml de paraformaldehyde à 4% dans du PBS à la post-fixent pendant une nuit.
- Pour cryoprotect cerveaux, rincer 3 fois dans PBS 1x et conserver à 4 ° C dans 30% de saccharose dans PBS 1x. Laisser les cerveaux de tomber au fond de leurs réceptacles (environ 3 jours).
- Enlever le calcium de la colonne vertébrale par rinçage 3 fois dans du PBS 1X et en le plaçant dans un grand volume (environ 50 ml pour une moelle épinière de souris) de 0,5 M d'EDTA dans 1 x PBS (pH de départ sera ~ 10; pH ~ 7,8 avec 6 N HCl) pour 2 - 3 semaines jusqu'à ce que l'os est plus rigide. Cryoprotect la colonne vertébrale en suivant l'étape 4.1.5.
- cerveaux Intégrer etcolonnes vertébrales en octobre suivant les sous-étapes ci-dessous dès qu'ils tombent dans le fond de leurs conteneurs.
- Faire un mélange de 1 partie de 30% de saccharose dans PBS 1x et 2 parties OCT (par exemple, ajouter 15 ml 30% de saccharose dans PBS 1x à 30 ml OCT).
- Ajouter le mélange OCT / saccharose dans le moule enrobage (22 x 22 x 20 mm pour les cerveaux et 22 x 30 x 20 mm pour la moelle épinière) jusqu'à ce qu'il soit environ ½ plein.
- Couper les colonnes vertébrales en 6 morceaux de taille égale à l'aide d'une lame de rasoir et la placer dans un moule mm 22 x 30 x 20 intégration vers l'avant pour les sections de la moelle épinière coronales. Placez cerveaux entiers en 22 x 22 x 20 mm moules tournées vers l'avant.
- Ajouter OCT / mélange de saccharose pour couvrir le tissu et laisser reposer pendant 1 heure. donc des bulles peuvent échapper. Pendant cette heure, ajouter 2-méthylbutane à un plat qui peut contenir des moules d'enrobage pour le flash-gel. Placez le plat sur la glace sèche et couvrir une pré-cool.
- Flash geler le moule dans 2-méthylbutane sur glace sèche et conserver à -80 o C à l' intérieur des acontainer pour prévenir la déshydratation.
- Une fois prêt, section de tissu à 16 um avec un cryostat et monter sur des lames chargées électrostatiquement. Mettez chaque section 10 e sur une lame pour chaque cerveau et la moelle épinière (par exemple, glisser 1 aura des articles 1, 11 et 21, et faites glisser 2 aura des articles 2, 12 et 22, et ainsi de suite). Magasin glisse à -80 o C ou utiliser tout de suite pour la coloration.
- La coloration pour la gliose réactive et myéline
- Lorsque vous êtes prêt pour la coloration, choisissez une diapositive pour chaque cerveau et la moelle épinière par tache pour chaque animal dans le même (ou aussi proche que possible) région. Pour le cerveau, choisissez diapositives montrant le corps calleux et cingulum bundle.
- Placer les lames avec le tissu sur un bloc thermique à 70 ° C pendant 7 min. Après 7 min éteignez le bloc de chaleur et de laisser les diapositives refroidir sur le bloc thermique pendant 10 - 15 min. Cela permettra d'éviter des coupes de tissu de tomber les diapositives pendant la procédure de coloration.
- Laver les lames 3 fois dans 1 x PBS avec 0,1% de détergent non ionique (pour des antigènes intracellulaires) ou 1 x PBS (pour des anticorps ciblant des antigènes de surface) pendant 5 min.
REMARQUE: Étant donné que les anticorps utilisés dans ce protocole sont intracellulaires, des détergents non ioniques seront utilisés dans les étapes suivantes. Ne jamais laisser les lames sécher complètement après cette étape. - Placez les lames dans un récipient et couvrir avec un tampon citrate pH 3,0. Pour rendre le tampon citrate, ajouter 0,192 g d'acide citrique anhydre à un volume final de 100 ml d'eau. Ajuster le pH avec de l'acide acétique si un pH supérieur à 3,0 ou NaOH si elle est inférieure.
- Incuber les lames à 37 ° C pendant 30 minutes et laver 3 fois en PBS 1x avec 0,1% de détergent non - ionique pendant 5 min.
- Cercle une zone autour du tissu avec un stylo barrière hydrophobe et placer les lames dans une chambre humidifiée (par exemple, une boîte de diapositives contenant des serviettes en papier humide). Ajouter un tampon de blocage au tissu. Incuber pendant 30 min à température ambiante.
REMARQUE: Le tampon de blocage est constitué de 1 x PBSplus 0,3% de détergent non ionique et le sérum approprié (5%) sur la base de l'hôte de l'anticorps secondaire, soit du sérum de cheval pour la protéine basique de la myéline (MBP) et la protéine acide fibrillaire gliale (GFAP) et de sérum de chèvre Iba1. - Flick tampon de blocage hors des glissières et ajouter un anticorps primaire (1: 1000 ou de la protéine basique de 0,2 pg / chèvre ml d'anti-myéline pour les oligodendrocytes, 1: 1000 ou 1 pg / ml à 3 pg / souris ml d'anticorps anti-GFAP pour les astrocytes ou 1 : 750 ou 0,67 pg / ml de lapin anti-Iba1 pour microglie) dilué dans le tampon de blocage approprié (voir étape 4.2.6) à la zone encerclée. Laissez à 4 ° C pendant la nuit dans la chambre humidifiée.
- Flick anticorps dans un tampon de blocage hors des glissières et laver les lames 3 fois dans 1 x PBS avec 0,1% de détergent non ionique pendant 5 min.
- Ajouter un anticorps secondaire (1: 200 ou 7,5 pg / ml de cheval anti-souris biotinylé pour MBP et GFAP, ou de chèvre biotinylé anti-lapin pour Iba1) dilué dans le tampon de blocage approprié (voir step 4.2.6) à la zone encerclée et laisser les diapositives à incuber dans la chambre humidifiée pendant 1 heure à température ambiante.
- Flick anticorps dans un tampon de blocage hors des glissières et laver les lames 3 fois dans 1 x PBS avec 0,1% de détergent non ionique pendant 5 min.
- Préparer complexe avidine-biotine-peroxydase (ABC) en immunoperoxydase (voir la liste des matériaux) 30 min avant utilisation et agiter sur un agitateur jusqu'à ce que nécessaire en 4.2.12. Ajouter 0,3% de H 2 O 2 dans du méthanol à la zone encerclée pendant 10 minutes pour désactiver l' activité de peroxydase endogène.
- solution Flick au large des diapositives et laver en 2 fois en PBS 1x ou 1x PBS avec 0,1% de détergent non-ionique pendant 5 min, puis 1 fois dans PBS 1x. Ajouter le réactif ABC à la zone encerclée pendant 30 min.
- solution Flick au large des diapositives et laver 3 fois dans 1x PBS pendant 5 min, puis 2 fois dans l'eau pendant 5 min. Faire 3,3'-diaminobenzidine (DAB) solution (voir la liste des matériaux) et l'ajouter à couvrir les sections.
REMARQUE: Cette étape nécessite un microscope pour observer la détection optimaletemps ion de la coloration et doit être fait pour la même quantité de temps pour les diapositives à comparer. - Laver les lames 3 fois dans l'eau pendant 5 minutes chacun. Déshydrater le tissu en plaçant dans les solutions suivantes pendant 2 mn chacun: éthanol à 70% dans l'eau, de l'éthanol à 95% dans l'eau, de l'éthanol à 100% dans l'eau, 50% de xylènes et de 50% d'éthanol, à 100% de xylènes. Sceller une lamelle sur la lame avec un milieu de montage résineux.
- Vous pouvez également effectuer des immunofluorescence comme décrit précédemment 11 pour évaluer la gliose réactive en utilisant des anticorps contre Iba-1 et GFAP.
- Prenez des photos de chaque section de la moelle épinière (colorées avec des anticorps respectifs en utilisant DAB) avec un 4X, 0,13 objectif NA et enregistrer les images comme .tiff. Sinon, prendre des images du corps calleux et cingulum faisceau dans l'hémisphère cérébral gauche ou à droite en utilisant un 20X, 0,50 objectif NA et enregistrer les images comme .tiff. Pour une détermination plus complète de la charge de la lésion dans le cerveau, il est avantageux d'inclure à la fois hémisphèrees dans les analyses.
- La mesure de la zone de la fraction moyenne pour gliose réactive (Iba1 et coloration GFAP)
- Télécharger NIH ImageJ (http://imagej.nih.gov/ij/) et ouvert sur un ordinateur. Le logiciel ImageJ, utilisez la chaîne de menu Fichier> Ouvrir et sélectionnez une image à l'étape 4.2.16. Dessinez une zone en utilisant la "sélections polygonales" outil sur la barre de menu. Pour la moelle épinière, tracer l'ensemble de la section; pour les cerveaux, le corps calleux et cingulum bundle. Convertir l'image en 16 bits en allant à l'image> Type et en cliquant sur «16 bits».
- De bruit de l'image en allant à Process> Soustraire Contexte et définir le "rayon de boule roulante" au moins la taille du plus grand objet qui ne fait pas partie de l'arrière - plan (voir le mode d' emploi ImageJ à l' adresse http: //rsbweb.nih .gov / ij / docs / Guide / 146-29.html).
NOTE: Pour une image 4X de Iba-1 coloration nous utilisons 4.0 et pour GFAP nous utilisons 50,0, mais ces chiffres peuvent varier en fonction de grossissement de l'image et la coloration intensité. - Vérifiez "paraboloïde coulissante" et cliquez sur "OK". Allez à Image> Réglages> Seuil ... et régler le niveau inférieur de seuil (la barre du haut) en utilisant les barres coulissantes. Inclure uniquement la coloration qui est cellulaire et être cohérent à travers les images. Pour les images avec un fond sombre (applique à coloration fluorescente seulement), vérifiez que la case "de fond Dark" est cochée.
- Aller à analyser> Mesures Set ... et sélectionnez "fraction de zone» (donne le pour cent de la superficie seuillée au sein de la région d'intérêt). Assurez-vous que «Limiter à seuil» est cochée et «étiquette d'affichage" est cochée. Cliquez sur "OK" lorsque vous avez terminé.
- Pour obtenir des mesures, allez à Analyse> Mesure. A "Résultats" fenêtre contextuelle apparaît et ces données peuvent être sauvegardées comme est ou copié dans un autre programme. Pour l'analyse, comparer les valeurs de «fraction Zone» entre les groupes de traitement.
- Quantification de MBP coloration par optdensité ical
- Ouvrir l'image et d'en tirer un domaine d'intérêt, comme décrit à l'étape 4.3.1. Aller à analyser> Mesures Set ... et sélectionnez (la somme des valeurs de gris dans la sélection divisé par le nombre de pixels) "valeur de gris moyenne". Assurez-vous que «Limiter à seuil» est cochée et «étiquette d'affichage" est cochée. Cliquez sur "OK" lorsque vous avez terminé.
- Pour obtenir des mesures, allez à Analyse> Mesure. Observer un "Résultats" fenêtre contextuelle apparaît. Copiez ces données et enregistrer tel quel ou copier dans un autre programme.
- Pour l'analyse, copier et coller des valeurs dans un autre programme. Convertir la valeur de gris moyen dans la densité optique (DO) en utilisant la formule: OD = log 10 (255 / valeur moyenne gris).
Résultats
Ici, nous avons utilisé deux modèles de EAE à comprendre si un agent pharmacologique fournit une protection CNS soit par atténuation des cellules T CNS-infiltrant ou la prévention de la myéline et des lésions axonales lors de l'assaut de l'infiltration inflammatoire des cellules immunitaires. Pour déterminer si un agent thérapeutique empêche l' infiltration de cellules immunitaires dans la moelle épinière, le modèle de souris C57BL / 6 de l' EAE chronique est utilisée lorsque l' infiltration des cellules immunitaires et de la pathologie de la maladie sont principalement situées dans la moelle épinière (figure 1A). Pour déterminer si un médicament thérapeutique offre une protection CNS pendant l'intrusion de cellules immunitaires dans le système nerveux central, le modèle animal SJL de forme rémittente EAE est utilisé, ce qui démontre la pathologie de la maladie dans le cerveau et la moelle épinière (figure 1B).
Les évaluations cliniques
Évaluations cliniques pertinentes sont faites selon la rubrique suivante pour typique (Figure 1C) ou atypique (figure 1D) EAE. Pour la maladie clinique typique, un score de 0 est pas un comportement anormal. Lorsque ramassé par la base de la queue, la queue peut tourner rapidement (un peu comme un rotor d'hélicoptère) et les pattes arrière sera écartées. Un score clinique de 1 est une queue partiellement mou, qui peut être déterminée en soulevant la souris par la base de la queue. La rotation de l'hélicoptère de type normal peut être affaibli ou absent, et une partie de la queue peut être complètement mou. Un moyen utile pour déterminer l'étendue de paralysie de la queue est d'exécuter son doigt vers le haut de la longueur de la queue, comme une queue non paralysés habituellement pelotonner autour du doigt tandis qu'une queue partiellement paralysé sera incapable de le faire. Un score clinique de 2 représente une queue complètement paralysé. Aucun mouvement de la queue se produit du tout lors de la prise de la souris vers le haut à la base de la queue. Un score clinique de 3 représente une paralysie partielle des membres postérieurs. Détermination de ce score exige que la souris soit libre de se déplacer sur un flat surface. Si un membre postérieur se traîne que la souris se déplace vers l'avant, ou si un ou les deux membres postérieurs semblent être partiellement paralysé, un score de 3 peut être donné. Un score clinique de 4 représente une paralysie complète des membres postérieurs. Avec ce score, une souris sera incapable de bouger ses membres postérieurs et se glisser vers l'avant à l'aide de ses membres antérieurs. Un score clinique de 5 représente une souris moribondes ou une souris avec difficulté se déplaçant à travers sa cage ou de la respiration. Si une souris ne peut pas se déplacer le long du fond de la cage ou si sa respiration est difficile, la souris doit être euthanasiés sans cruauté. Un score clinique de 6 représente une souris retrouvé mort dans sa cage. Un score de 6 est inhabituel et causes de décès autres que EAE devrait être étudiée.
maladie clinique Atypique peut ou non être accompagnée d'une paralysie. Il peut être nécessaire d'inclure deux systèmes de notation distincts si une souris présente une maladie atypique, plus les symptômes typiques. Un score de 0 est pas un comportement anormal, uns avec le système de notation classique. Un score clinique de 1 représente une légère rotation de la tête ou de l'inclinaison alors que la souris est la marche. Ceci peut être déterminé en permettant à la souris pour marcher vers l'avant et l'observation d'une directivité constante gauche ou à droite pour son mouvement. Un score clinique de 2 représente un tour de tête plus prononcée et une mauvaise capacité de redressement. Comme avec un score atypique de 1, la souris a directionnalité à son mouvement et peut avoir de légères difficultés avec l'équilibre. Un score clinique de 3 représente une incapacité à marcher en ligne droite. La souris aura des difficultés d'équilibrage et peut utiliser le côté de la cage pour aider le droit lui-même comme il marche. Un score clinique de 4 représente une souris portant sur son côté, incapable de marcher en raison de problèmes d'équilibrage. La souris peut être en mesure de se glisser le long du fond de la cage, mais peut avoir directionnalité à son mouvement. Un score clinique de 5 représente laminage continu à moins soutenu. Une souris qui atteint ce score devrait être euthanasiés sans cruauté. Une cliniqueLe score al 6 représente une souris retrouvé mort dans sa cage. Un score de 6 est inhabituel et causes de décès autres que EAE devrait être étudiée.
Il peut être nécessaire pour permettre «entre-deux" scores, par exemple, en ajoutant 0,5 à un score si l' état change légèrement ou si une souris en choisissant entre deux scores est difficile. Par exemple, une souris qui commence à se déplacer plus lentement que ses homologues normaux, mais ne présente aucune paralysie, ou une souris qui enserre ses pattes de derrière avec sa façade au lieu de évasement ses jambes quand ramassé par la queue peut être donné un score de 0,5 . Une souris qui ne peut se glisser le long du fond de la cage et est seulement capable de contracter ses membres postérieurs périodiquement ou au toucher peut être donné une note de 3,5.
Évaluation de réduction de la cellule immunitaire Infiltration
Après l' induction de l' EAE chez le modèle de souris C57BL / 6 (figure 1A, jour 0), l'antigène PRESENTATIet sur la prolifération des lymphocytes T dans la rate se produire sur les jours 1-5, suivie par une infiltration de cellules immunitaires dans le système nerveux central autour du jour 7. Environ 3 à 5 jours après les premières souris d'infiltration des cellules immunitaires présentent des scores cliniques. Pour évaluer si un agent thérapeutique bloque l'infiltration des cellules immunitaires dans la moelle épinière, les médicaments ou le véhicule sont introduits au jour 7 après la présentation de l'antigène et la prolifération dans la rate, mais avant que les cellules immunitaires commencent à pénétrer dans la moelle épinière. Si l' infiltration de cellules immunitaires a été atténuée, le cours de la maladie clinique devrait refléter les scores cliniques améliorés au cours de la phase ascendante de la maladie de 10 à 15 jours (figure 2).
Une réduction de l'infiltration des cellules immunitaires se traduirait aussi par une diminution de la réponse inflammatoire. astrocytosis Réactif et microgliose sont considérés comme les principales caractéristiques de la neuroinflammation. Coloration pour astrocytes avec GFAP et microglie avec Iba-1 peut alors être utilisé pour évaluer changes en moyenne coloration de fraction de surface pour quantifier neuroinflammation (Figure 3).
Pour déterminer si l' infiltration des cellules immunitaires est réduite, la moelle épinière sont retirées et traitées pour l' analyse par cytométrie en flux au pic de la maladie (figure 1A, environ 18 jours). Cela garantit que le plus grand nombre de cellules immunitaires sont entrés dans la moelle épinière. Entrée des cellules dans le système nerveux central T est considéré comme l'événement inflammatoire initiation et les deux cellules Th1 et Th17 se trouvent dans des modèles animaux de l'EAE ainsi que des patients atteints de SEP. Pris dans leur ensemble, l'analyse par cytométrie de flux, il faut évaluer les deux types de cellules T pathogènes. En outre, les Tregs sont des cellules T suppresseurs bien caractérisées qui amortissent la maladie. Par conséquent, le pourcentage de lymphocytes T régulateurs à partir d' une population totale de cellules CD4 + doivent être évaluées par rapport au pourcentage de populations de cellules T effectrices. Cela révélera si une réduction globale de l'infiltration de cellules T est produite ou si there est un désalignement des phénotypes des lymphocytes T dans le SNC. Tracés de points représentatifs (figure 4A) montrent une réduction du nombre total de cellules CD4 + infiltrant les cellules T dans la moelle épinière provenant de souris traitées par le médicament par rapport à la moelle épinière provenant de souris traitées avec le véhicule ( les chiffres dans les quadrants supérieur droit). Pour évaluer Th1, Th17 et Treg les protéines de signature suivants sont évalués: l' IFN-γ + IL-17 + et Foxp3 +, respectivement , et doit être réduit (figure 4A). L' analyse statistique doit être effectuée sur CD4 +, IFN-γ +, IL-17 +, et le nombre de cellules Foxp3 + pour démontrer une réduction significative (figure 4B). Pour écarter une obliquité de sous - ensembles de cellules T, une évaluation statistique de la proportion de l' IFN-γ + IL-17 + IFN-γ + IL-17 - IL-17 + IFN-γ - et Foxp3 + cellules est effectuée ( Figurer 4C).
Pour éliminer la possibilité que la réduction du système nerveux central infiltrant les cellules T est une conséquence de l'inhibition de la prolifération, l'activation et la différenciation dans la périphérie, le nombre de prolifération active des cellules T en plus de la proportion des sous-types de cellules T doit être évaluée. Aucun changement dans le pourcentage de CD4 +, IFN-γ +, IL-17 + ou Foxp3 + doivent être trouvées si l' activation et la différenciation ne sont pas affectés (figure 5A). De plus, aucun changement dans les cellules Ki67 + CD4 + devrait être trouvée si la prolifération est non affectée (figure 5B). Les traitements médicamenteux sont introduits le jour 7 ou plus tard pour éviter de modifier la présentation de l'antigène initial et l'activation des lymphocytes T dans la périphérie. Cependant, dans les modèles génétiques des protéines sont souvent supprimés constitutivement pendant l'embryogenèse ou induite avant l'induction de l'EAE faisant splénocytes assessment d'une grande importance.
Évaluation de la protection du système nerveux central
Pour démontrer si un agent thérapeutique particulier modulant pathologie de la maladie dans le SNC après l'infiltration de cellules immunitaires, les interventions de médicaments doivent être administrés pendant le premier pic dans la notation de la maladie clinique. Le modèle SJL de l'EAE est avantageux pour ces expériences, car ces souris présentent un phénotype rémittente. Si un traitement médicamenteux empêche la dégénérescence de la myéline-axone, une amélioration des scores cliniques sera observé (figure 6). l'évaluation pathologique de la myéline doit confirmer une réduction des lésions de la myéline cohérente avec l'amélioration des scores cliniques. Afin d' évaluer quantitativement l' intégrité de la myéline, la DAB coloration de la protéine basique de la myéline (MBP) est réalisée, suivie d' une analyse statistique de la densité optique de cette coloration (figure 7). Pour étayer davantage que neuroinflammation est soutenue ou diminué de therapeles interventions UTIC, gliose réactive peut être évaluée en mesurant la surface de la fraction moyenne pour gliose réactive telle que décrite ci - dessus (figure 3). Pour corroborer qu'une intervention thérapeutique protège directement le système nerveux central, sans effets immunomodulateurs, l'atténuation de l'infiltration de cellules immunitaires dans le SNC et la prolifération dans la rate doit être actualisée. Pour y remédier, des procédés pour l' évaluation du cerveau et de la moelle épinière de l' infiltration des cellules immunitaires et de l' évaluation de périphérique prolifération des lymphocytes T et l' activation doit être effectuée comme décrit ci - dessus (figures 4 et 5). Pris dans leur ensemble, des agents thérapeutiques qui bloquent la lésion cellulaire dans le système nerveux central sans aucune preuve d'une réduction du système nerveux central infiltrant les cellules T ou la prolifération des lymphocytes T dans la périphérie du système nerveux central sont des traitements protecteurs.
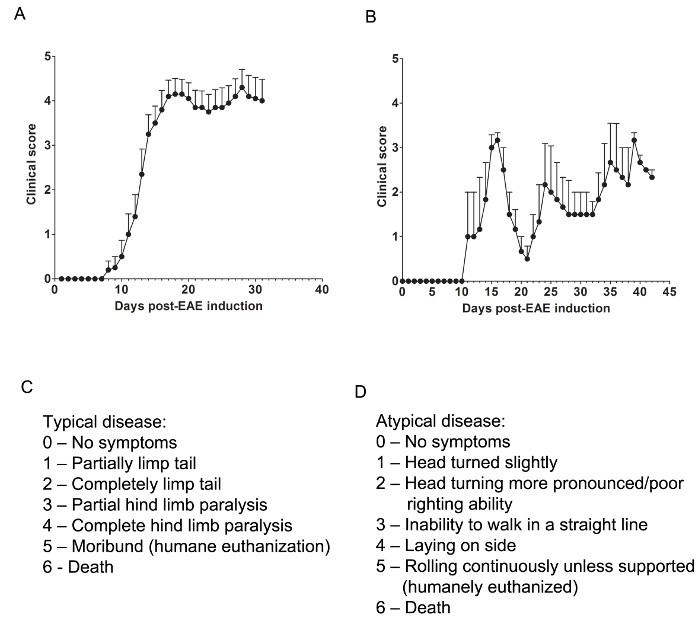
Figure 1. Représentant Results des scores cliniques de l' EAE dans C57BL / 6 et souris SJL. (A) Les scores cliniques (moyenne ± SEM) de souris C57BL / 6 (n = 10) induite par MOG 35-55 pour produire EAE avec une maladie chronique. (B) Les scores cliniques (moyenne ± SEM) de souris (n = 3) induites avec PLP 139-151 pour produire EAE avec une maladie récurrente-rémittente SJL. (C) La grille de notation clinique utilisé pour suivre la progression de la maladie typique chez les souris EAE. (D) La grille de notation clinique utilisé pour suivre la progression de la maladie atypique chez les souris EAE. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
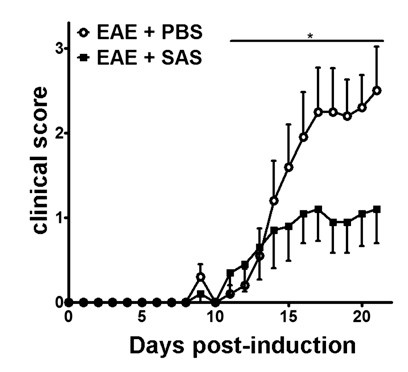
Figure 2. Le traitement pharmacologique avant l'infiltration des cellules immunitaires dans les souris C57BL / 6 avec l' EAE. Les scores cliniques (moyenne ± SEM) de C57BL / 6 souris traitées avec du PBS (n = 20) ou SAS (n = 19) du jour 7 avec MOG 35-55 après immunisation. Les données proviennent de trois expériences indépendantes mises en commun. Différence statistique a été déterminée en utilisant un test de Mann-Whitney U nonparametric à deux queues, * p <0,05. Re-imprimer avec la permission de (11).
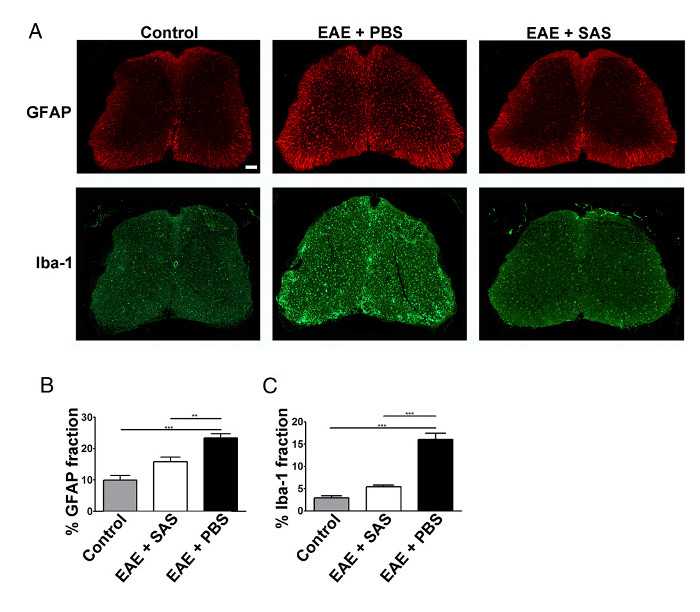
Figure 3. immunofluorescence et la quantification des Reactive Gliose dans la colonne vertébrale Cordons de contrôle, EAE, et traités C57BL / 6. (A) Le marquage fluorescent pour GFAP (astrocytes) et Iba-1 (microglie) dans la moelle épinière de contrôle (non immunisées ) souris (gauche panneaux) et des souris EAE traitées avec du PBS (panneaux intermédiaires) ou SAS (panneaux de droite). Barre d'échelle = 100 um. La quantification de la coloration a été déterminé en utilisant la technique de la fraction de surface à mesurer pour cent immunopzone ositive pour GFAP (B) et Iba-1 (C). Moyenne ± SEM, n = 3 témoin, n = 3 SAS-traitée, ou n = 4 souris traitées avec du STP, 6 sections par souris. Les différences statistiques ont été déterminées à l'aide d'une ANOVA à une voie, * p <0,05, ** p <0,01, *** p <0,001. Re-print avec la permission de (11). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
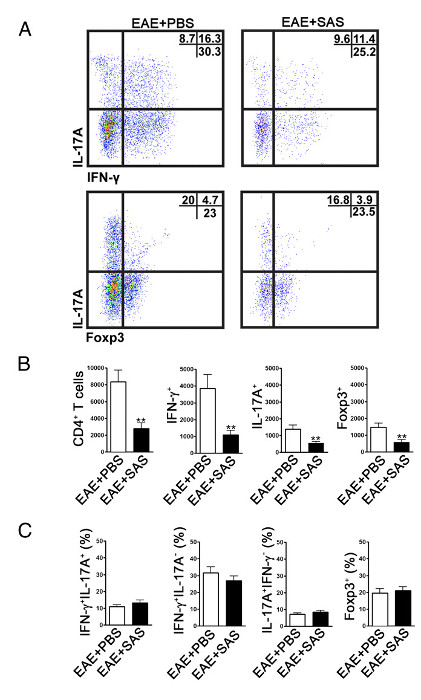
Figure 4. Analyse FACS des EAE souris C57BL / 6 Spinal Cordons démontrons réduit T Infiltration cellulaire chez les souris traitées. C57BL / 6 ont été traités avec SAS ou PBS, en commençant 7 d après l'induction de l' EAE. Moelles épinières ont été obtenus sur jour 15. (A) tracés de points représentatifs montrent Th1 (IFN-γ + / IL-17 -) et Th17 (IFN-γ- / IL-17 +) cellules CD4 + porte (panneaux supérieurs) et les cellules T régulatrices (Foxp3 +) (panneaux inférieurs). Dot parcelles affichent des pourcentages dans le quadrant supérieur droit. (B) Les nombres absolus de cellules CD4 +, ainsi que l' IFN-γ +, IL-17A +, et Foxp3 + cellules ont été analysées statistiquement. (C) La variation en pourcentage de la population de lymphocytes T entre SAS- et des souris EAE traitées avec du STP a également été examinée. Moyenne ± SEM, n = 10 pour le traitement du PBS, et n = 9 pour SAS traitée à partir de deux expériences indépendantes. test t bilatéral a été utilisé pour tous les graphiques à barres. ** P <0,01. Re-print avec la permission de (11). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
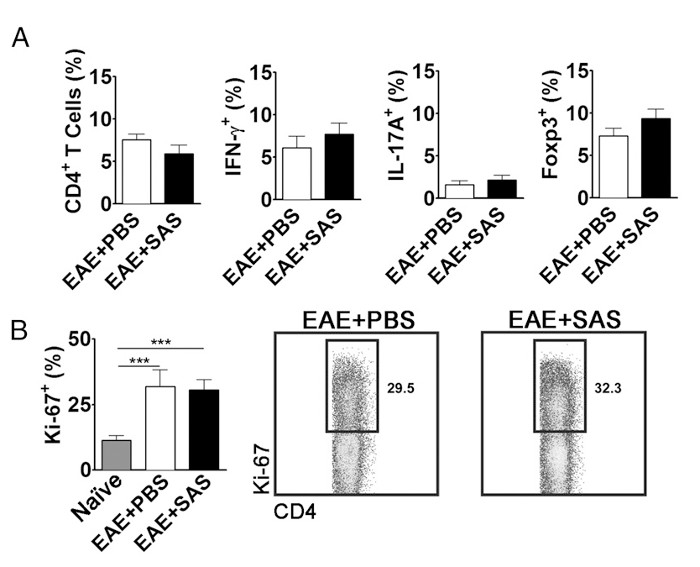
Figure 5. FACS Analyse des EAE C57BL / 6 Souris Spleens Démontrant T Profils d'expression de cellules équivalentes et prolifération chez les souris traitées et non traitées. Les rates de PBS- et souris SAS-traitées ont été analysées 15 d après l'induction de l' EAE. (A) Le pourcentage de cellules T CD4 +, Th1 (IFN-γ + / IL-17 -), Th17 (IFN-y - / IL-17 +) cellules régulatrices, et T (Foxp3 +) dans rates de PBS- traités (n = 10) et SAS-traités (n = 9) chez la souris à partir de deux expériences indépendantes. (B, panneau de gauche) Le pourcentage de Ki-67 + cellules dans la population de CD4 + à partir de rates naïfs (n = 4), ainsi que de PBS (n = 5) et des souris SAS-traitées (n = 5) induite par EAE. Un test ANOVA à sens unique a démontré la signification statistique entre la proportion de Ki-67 + cellules de rate naïfs par rapport à soit PBS- ou EAE rates SAS-traités. Aucune importance n'a été observée entre PBS- et les rates EAE SAS-traités. (B, panneau de droite) des tracés de points représentatifs; nombres indiquent la proportion de la prolifération. Dot parcelles affichent des pourcentages. Les graphiques à barres représentent test t à deux queues, *** p <0,001. Re-print avec la permission de (11). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
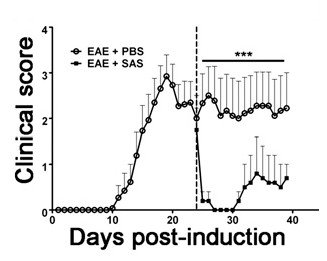
Figure 6. Traitement pharmacologique après des cellules immunitaires Infiltration dans SJL souris avec EAE. Scores cliniques (moyenne ± SEM) de souris SJL traitées avec du PBS (n = 8) ou SAS (n = 8) du jour 24 après immunisation (ligne pointillée) avec PLP 139-151. Les données sont la moyenne ± SEM des scores cliniques. Différence statistique a été déterminée en utilisant un test de Mann-Whitney U nonparametric à deux queues, *** p <0,001. Top ligne représente les valeurs utilisées pour les statistiquesune analyse. Re-imprimer avec la permission de (11).
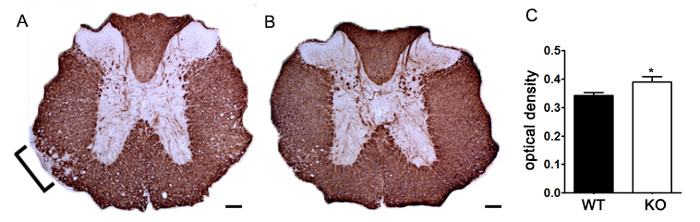
Figure 7. Quantification de PBM Coloration en utilisant la densité optique. (A) coloration représentant de MBP dans la moelle épinière thoracique d'une souris knock - out génétique non spécifiée par rapport au contrôle de littermate souris C57BL / 6 induite par l' EAE. Bracket indique zone représentative de la réduction de la coloration de MBP démyélinisation indiquant. (B) MBP coloration de la moelle épinière thoracique d'un KO génétique non précisée C57BL / 6 de la souris. (C) des souris génétiques non spécifiées knock - out induite par l' EAE (KO; n = 6 souris, 2 - 4 lombaire et les sections thoraciques par animal) présentent une plus grande densité optique (DO) de la MBP coloration dans la moelle épinière de type sauvage (WT; n = 3 souris, 2-4 lombaires et thoraciques sections par animal) souris induites avec EAE. usi Statistiquement analyséng un test t à deux queues, * p <0,05. Les barres d'erreur représentent SEM. Barre d'échelle de 100 um.
Discussion
Les patients atteints de SEP continuent de subir des rechutes de la maladie tout en prenant des médicaments qui atténuent l'activation et / ou infiltration cellules T dans le SNC, ce qui justifie le développement d'options de traitement qui protègent directement le SNC. EAE a été classiquement utilisé pour modéliser les symptômes de la sclérose en plaques et peut être un outil puissant pour l'étude de la nature des interactions entre le système immunitaire et du système nerveux central in vivo. En utilisant le calendrier des considérations de traitement dans l' EAE, par exemple, avant ou après le début de la maladie, en liaison avec l' examen de l' infiltration des cellules immunitaires dans le système nerveux central et de la prolifération et de l' activation de la périphérie, il est possible de délimiter les effets des traitements à la fois sur le système immunitaire et le SNC.
Alors que l'EAE chez la souris C57BL / 6 est plus largement utilisé, EAE dans la SJL souris peut être plus représentatif de la majorité des cas de sclérose en plaques, ces souris ont un phénotype et l'infiltration de cellules immunitaires récurrente-rémittente dans le parenchyme10 du cerveau. souris SJL ont nette reprise au cours de la remise ainsi, ce qui permet de commencer le traitement après que la maladie a présenté, mais pendant les périodes de l'inflammation réduite. Il est important de considérer que les souris SJL ne sont pas toujours rechutent pas et remettre en synchronie, entraînant potentiellement une grande variabilité lorsque les résultats sont mis en commun. Par conséquent, certains chercheurs peuvent choisir d'afficher des résultats représentatifs pour les scores cliniques d'un animal tout en prenant des souris pour l'analyse FACS et histologie à des points individualisés dans la progression de la maladie.
Considérant lorsque les manipulations sont faites à des souris EAE peut aider à la détermination de la façon dont un traitement affecte le système immunitaire ou du système nerveux central. Il existe de nombreuses options pour quand le traitement commence, chacun avec sa propre connotation pour savoir si les cellules immunitaires sont entrés dans le système nerveux central et la façon dont ils peuvent interagir avec le système nerveux central. Traitement avant l'apparition des symptômes implique que les cellules immunitaires sont pas encore entrés ou causé des dommages au système nerveux central.Traitement après l'apparition des symptômes implique que les cellules immunitaires sont entrés dans le système nerveux central et ont causé quelques dégâts. En utilisant des souris SJL, le traitement peut également commencer au cours d'une rechute, où les cellules immunitaires sont activement infiltraient et provoquant une inflammation, ou pendant la rémission, où les cellules immunitaires peuvent être moins fréquentes dans le SNC avec moins d'inflammation. hypothèses initiales concernant la façon dont les traitements affectent le système nerveux central et du système immunitaire peuvent être faites lors de l'examen, où les cellules immunitaires sont dans le processus pathologique au cours du traitement.
Il y a un certain nombre de façons dont les traitements peuvent affecter les cellules immunitaires et le système nerveux central, chacun avec le résultat de la réduction de la sévérité des symptômes EAE de fin. Par conséquent, il est nécessaire d'utiliser l'analyse cytométrique et immunohistochimie flux pour voir comment les cellules immunitaires sont affectées à la périphérie et du système nerveux central, que les cellules immunitaires sont entrées dans le système nerveux central, le système nerveux central et comment réagit au traitement. Bien que l'analyse cytométrique d'écoulement de la moelle épinière peut déterminer combien de cellules haavez entré dans le système nerveux central à un moment donné, on ne peut pas déterminer que cet effet est dû à la traite des cellules immunitaires réduites à moins prolifération des cellules immunitaires est affectée dans la rate. Il est donc nécessaire d'analyser à la fois les tissus périphériques et du système nerveux central et de déterminer ce que signifient les résultats mécaniste lorsque les deux tissus sont comparés. Il est également possible pour les profils d'activité des cellules immunitaires à être modifiées par le traitement, par exemple d'un commutateur dans un profil de cellule T auxiliaire lourd pathogène à un profil de cellules T régulatrices lourds. En regardant des marqueurs pour différents types de cellules et de comparaison pour cent expression entre les animaux traités et non traités est donc également une considération importante. Un nouveau concept dans la recherche MS suggère que les cellules B jouent un rôle important dans la démyélinisation auto-immune. Ceci est basé sur des études montrant que les cellules B sont nécessaires pour la réactivation des cellules T 20. Ce concept est soutenu par le succès des traitements tels que le rituximab, un anticorps anti-CD20 expressé sur la surface des cellules B 21,22. Comme l'a démontré le succès de l'ocrelizumab d'anticorps monoclonal dans les essais cliniques, des médicaments ciblant différents épitopes de CD20 peuvent améliorer l'efficacité de la thérapeutique ciblée B cellules 23.
Une limitation des techniques présentées ici est qu'il est possible pour les cellules du système immunitaire d'entrer dans le système nerveux central, mais être incapable de se déplacer dans le parenchyme. L'immunohistochimie peut être utilisée pour détecter manchon périvasculaire des cellules immunitaires et d'évaluer la distance parcourue dans le parenchyme entre les animaux traités et non traités. Une autre limite potentielle implique les effets de la microbiome sur EAE pathogenèse. Commensal microbiote intestinal peut fortement influencer la maladie pathogenèse 24; par conséquent, les souris logées dans différentes colonies et même dans différentes cages peuvent avoir de grandes différences dans la gravité de la maladie. Par conséquent, il est toujours préférable d'utiliser autant que possible les contrôles de la même portée soulevées dans la même cagedes expériences impliquant l'EAE. Une note finale est que si elle est expérimentalement souhaitable d'éliminer les effets de la cellule immunitaire modifications prolifératives dans la périphérie, il peut être possible de le faire en utilisant passive transfert induction plutôt que l'induction active décrite dans ce protocole.
Une confirmation supplémentaire pour la neuroprotection peut être accomplie en utilisant un système de co-culture 11 pour tester des mécanismes spécifiques de la mort cellulaire ou à travers l'utilisation des souris knock - out conditionnel qui permet de supprimer de manière sélective des protéines sur un type de cellule. En outre, pour étendre l'exploration des agents pharmacologiques qui sont neuroprotecteur, des marqueurs de transection axonale et la mort neuronale devraient être inclus. Un autre domaine d'importance est la remyélinisation. axones blessés sont incapables de remyéliniser prêter un soutien supplémentaire que les thérapies neuroprotectrices devraient être une partie importante des thérapies de remyélinisation. En outre, les axones amyéliniques sont plus vulnérables aux blessures que myelinaaxones ted. Cela donne à penser que quand un axone devient des interventions thérapeutiques démyélinisation qui favorisent la remyélinisation en temps opportun permettra d'éviter des lésions axonales. Pour explorer ces avenues, d' autres modèles in vivo pour la démyélinisation et la remyélinisation peuvent être utilisés ( par exemple, cuprizone et lysolécithine). Le procédé décrit ici centré sur l'évaluation de la neuroprotection par quantification de la perte de myéline. Pour l'évaluation de la remyélinisation le nombre de cellules progénitrices, ainsi que leur capacité à proliférer et à maturité serait également important d'étudier. Avec la mention de ces modèles alternatifs, il faut aussi tenir compte de différents modèles d'encéphalite qui sont viralement médiées. Il existe deux modèles ARN viraux bien caractérisées qui produisent une perte de myéline: l' un est l' encéphalomyélite murine de Theiler, d' un virus non enveloppé Picornaviridae, et l'autre est le virus de l' hépatite de la souris, un membre de la famille des virus Coronaviridae 25,26.
EAE est un outil précieux pour studies de la façon dont les traitements ou manipulations affectent le système immunitaire et du système nerveux central in vivo. Le protocole décrit ici peut aider à déterminer où les traitements ont une incidence sur le processus de la maladie, que ce soit dans la périphérie, à la barrière hémato-encéphalique, ou dans le SNC. Aucun traitements actuels pour MS guérir la maladie et les patients souvent déclin de l'expérience au fil du temps. De même, d'autres maladies impliquant une infiltration de cellules immunitaires dans le SNC et la dégradation de la myéline, y compris l'encéphalomyélite aiguë disséminée, la myélite transverse, et la neuromyélite optique, les traitements qui protègent le manque du système nerveux central comme il est directement attaqué par l'infiltration de cellules immunitaires. Prenant en considération le moment du traitement et l'utilisation de l'analyse de cytométrie de flux de la rate et de la moelle épinière en conjonction avec l'immunohistochimie du SNC pour évaluer l'inflammation et des dommages permettra déterminations mécanistes être prises concernant les traitements.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été financé par NINDS P30-NS069324, La National Multiple Sclerosis SocietyRG 4587-A-1, La Fondation Civitan international de recherche, la Fondation Mike L. Jezdimir Transverse myélite, L'Université de la Fondation des services de santé Alabama - Fonds général de dotation, The National science Foundation 1355183 et T32 AI007051 de l'Institut national des allergies et des maladies infectieuses, national Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
Références
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon