Method Article
Determinar a supressão imune Sistema contra CNS Proteção para farmacológicos intervenções na desmielinização auto-imune
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Resumo
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Introdução
A esclerose múltipla (MS) é caracterizada por lesões inflamatórias predominantemente em regiões de matéria branca do cérebro cedo na doença. Depois de progressão a longo prazo, atrofia matéria cinzenta é detectado por imagem de ressonância magnética e assinala a fase neurodegenerativa da doença. gliose reactiva, desmielinização e lesão axonal na substância branca são atribuídos a células imunes do SNC-infiltrantes. Nenhum dos tratamentos actualmente utilizados em MS reverter ou prevenir a neurodegeneração directamente no sistema nervoso central - em vez disso, eles reduzem a inflamação por meio da atenuação de activação e / ou a infiltração de células T no SNC. Porque não há nenhuma cura para a MS e pacientes em uso de tratamentos atuais continuam a experimentar a progressão da doença, as descobertas de medicamentos que impedem a desmielinização e neuronal perda são extremamente importantes. No entanto, diferenciando entre efeitos nas células do sistema imunológico e aqueles no sistema nervoso central pode ser difícil experimentalmente, como o resultado - isto é, reduziu os danos no SNC - parece o same independentemente dos mecanismos através dos quais ele ocorre. Assim, a avaliação da protecção do SNC deve ser uma parceria com avaliações de CNS-infiltrado de células imunitárias e a proliferação de células imunitárias na periferia para determinar como agentes farmacológicos afectar mecanismos da doença.
Encefalomielite auto-imune experimental (EAE) é um modelo animal bem estabelecido de desordens inflamatórias auto-imunes que foi directamente responsável pela descoberta de drogas actualmente usadas para tratar a MS 1-4. Os ratinhos são muitas vezes utilizados para a EAE, com ratinhos C57BL / 6 ser uma estirpe popular, com base na disponibilidade de variantes genéticas. Camundongos C57BL / 6 induzidos com EAE apresentam progressão da doença crônica, com início por volta do dia 10 pós-indução. A infiltração do parênquima da medula espinhal e cerebelo são característicos da histopatologia destes animais, com ausência de infiltração no parênquima cortical 5. lesões Além disso, corticais e desmielinização no bchuva são características da doença 6-9, que são relativamente ausente em ratinhos C57BL / 6. Portanto, pode ser preferível quando possível utilizar murganhos da estirpe SJL, que têm a doença recorrente-remitente e lesões encontradas tanto no cérebro e espinal medula que aparecem semelhantes aos do MS 10.
O tratamento não pode ser classificado como neuroprotetor se células do sistema imunológico nunca chegar ao CNS. Portanto, este protocolo faz uso de análise de citometria de fluxo de cérebro, a espinal medula, e baços de ratinhos EAE para determinar os efeitos do tratamento sobre a infiltração de células imunitárias para o SNC e proliferação de células imunitárias na periferia, tal como anteriormente demonstrado 11. análises de imuno-histoquímica de tecido do SNC para determinar extensão e natureza da neuroproteção é também descrito. A combinação destes métodos permite a determinação de se as células imunitárias foram activadas proliferaram e na periferia, se as células imunitárias entrou no SNC, e se o SNC foi protected de inflamação ou dano. Se os efeitos neuroprotectores são suspeitos apesar dos efeitos sobre o sistema imunitário, os experimentadores pode alterar o tratamento começar vezes após a infiltração de células imunitárias em que se registou o SNC.
Aqui, nós apresentamos um protocolo usando dois diferentes modelos de EAE activa, um modelo animal mediada por células T de MS, e citometria de fluxo combinada com imuno-histoquímica em vários pontos temporais durante a doença para determinar a eficácia de terapias experimentais em diferentes aspectos de patogênese MS. Este método irá auxiliar pesquisadores em diferenciar entre os efeitos sobre a proliferação de células imunes e infiltração e protecção das CNS, tornando mais fácil para limitar como as drogas agem sobre patogênese da doença.
Protocolo
procedimentos experimentais envolvendo ratos devem cumprir as normas institucionais e governamentais relevantes. Para o presente estudo, os ratos foram alojados e tratados de acordo com os Institutos Nacionais de Saúde e da Universidade de Alabama em Birmingham diretrizes Institucionais Animal Care e do Comitê Use.
1. EAE Indução e Scoring
- Induzir a EAE em ratinhos C57BL / 6 ou ratinhos SJL 11-13 10,11 13, como descrito anteriormente.
NOTA: Os experimentadores deve escolher um modelo ideal para a sua questão de pesquisa (veja a discussão para mais detalhes). - Pontuações recordes diariamente, como descrito anteriormente 11 para cada rato começando no dia 7 pós-indução. Comparar as pontuações médias diárias ao longo do tempo entre os grupos de tratamento.
2. Tratamento
- Tratar ratos EAE antes do início da doença para determinar se o tratamento afeta a infiltração de células imunes ou proliferação.
- Escolha um tratamento, meTHOD de entrega e frequência do tratamento, considerando simultaneamente sangue-cérebro barreira de permeabilidade, meia-vida, e dosagem do medicamento.
NOTA: EAE aumenta sangue-cérebro barreira de permeabilidade e pode permitir que drogas para atingir o SNC que não seriam capazes de animais saudáveis. Realizando experiências de curvas de dose-resposta que olham pontuações clínicas de EAE pode ajudar na escolha de uma dose apropriada da droga. veículos de controlo devem ser executadas em paralelo ao tratamento medicamentoso. Alternativamente, os ratinhos knockout condicionais pode ser usado com crias da mesma ninhada como controlos. - Use SJL ou camundongos C57BL / 6 para esta experiência. Tratar os ratos cedo após a indução da EAE (dia 7), antes do aparecimento dos sintomas, utilizando o método de entrega escolhido.
- Sacrifício e dissecar ratos no pico da doença (cerca dia 15), como no passo 3.1 e suas sub-etapas, com base na média mais alta pontuação clínica ao longo do tempo.
- Conduta de citometria de fluxo em medulas espinais de rato (como na etapa 3.2) para determinar infiltrati células imunitáriasno do SNC, e no baço (como no passo 3.3) para determinar a proliferação de células imunitárias na periferia. Em ratos separados, conduta imuno-histoquímica (como no passo 4) para quantificar astrócitos e microglia e preservação da mielina.
- Escolha um tratamento, meTHOD de entrega e frequência do tratamento, considerando simultaneamente sangue-cérebro barreira de permeabilidade, meia-vida, e dosagem do medicamento.
- Tratar os ratos EAE após o início da doença para determinar se o tratamento protege o sistema nervoso central depois da infiltração de células imunitárias ocorreu.
- Repita o passo 2.1.1.
- Use SJL para este experimento, já que estes ratos têm remissões doença mensurável. Tratar os ratos durante o primeiro pico na doença (ou, se desejado, no pico de uma recaída seguinte) como medida por contagens clínicos médios.
- Sacrifício camundongos em uma indução tempo pós-EAE desejado. Devido a infiltração já ocorreu, pode não ser útil para medir a infiltração por análise FACS. No entanto, tome medulas espinhais de quantificar gliose reativa e mielina para determinar se existe uma protecção CNS apesar infiltração de células imunes.
3. Fluxo de Análise de Citometria
- dissecação
- Etiqueta três 15 ml tubos cônicos (uma para o cérebro, uma para medula espinhal, e um para o baço) por animal com identificação do animal e do tipo de tecido contido. Manter todos os tecidos em tubos separados para todo o processo no gelo.
- Para análise FACS de baços, sacrificar os ratinhos no pico da doença (~ dia 15 pós-indução de EAE) utilizando dióxido de carbono com uma taxa de fluxo de volume do recipiente de cerca de 15% por minuto, durante 2-3 min. Confirmar eutanásia por falta de respiração. Após o sacrifício de cada ratinho, remover o baço e 14 lugar em um indivíduo, marcado tubo de 15 ml (a partir do passo 3.1.1) contendo gelada RPMI suplementado com FCS a 2%, 100 UI de penicilina, e 100 ug / ml de estreptomicina ( referido como "meios" ao longo do protocolo).
- Para a análise FACS do cérebro e da medula espinhal, execute perfusão cardíaca cortando átrio direito do rato com uma tesoura cirúrgica para liberar circulating sangue e perfuração do ventrículo esquerdo com uma agulha conectada a uma seringa cheia com 10 ml de PBS gelado. Lentamente injetar a 10 ml PBS.
- Cortar a cabeça do rato e fazer um corte acima da linha média do couro cabeludo com uma tesoura cirúrgica. Descasque a pele para trás com a mão ou com uma pinça e fazer um corte acima da linha média do crânio com uma tesoura cirúrgica, usando o ponto de entrada da medula espinhal como um ponto de partida.
- Descascar o crânio com micro pinça e usar uma colher para libertar o cérebro. Coloque os cérebros em rotulados 15 ml tubos cônicos (do passo 3.1.1) contendo.
- Retire a pele do rato com uma pinça e tesouras cirúrgicas, e estripar o rato usando uma tesoura cirúrgica. Cortar os membros, cauda, costelas, e qualquer músculo circundante, com uma tesoura cirúrgica para libertar a coluna vertebral.
- Cortar a coluna vertebral em cerca de 5 partes aproximadamente iguais com uma tesoura cirúrgica e espremer uma extremidade de um pedaço com uma pinça hemostática, e depois usar outra pinça hemostática to continuar apertando, movendo-se ao longo da peça até a medula espinhal espreme para fora do topo. Repita esse procedimento para cada peça da coluna vertebral e colocar os cabos no indivíduo, identificado como 15 ml tubos cónicos (do passo 3.1.1) contendo mídia.
- Avaliação da infiltração de células imunes no cérebro e medula espinhal
- Cortar cérebros e medulas espinhais em pequenos pedaços com uma tesoura estéreis. Triturar com o êmbolo de uma seringa de 3 ml através de um filtro celular de 70 uM para um novo tubo de 50 ml, enquanto a lavagem do filtro com meios de comunicação. Trazer cada tubo para um volume de 50 ml com a mídia. Centrifuga-se a 453 xg durante 5 min para as células de pelotas.
- Aspirar o sobrenadante e ressuspender o sedimento em 4 ml de 40% de meio de gradiente de densidade. Cuidadosamente sobrepor o gradiente de densidade de 40%, contendo as células na parte superior de 2 ml de gradiente de densidade de 70% em um novo tubo de 15 mL cónico-pipeta muito lentamente para a parede do tubo cónico para assegurar adequada camadas do gradiente. Giram a 796 xg durante 20 min à temperatura ambiente comum travão.
- Remova cuidadosamente a camada de mielina superior do gradiente com uma pipeta 1 ml, em seguida, remover as células viáveis na interface com uma pipeta 1 ml de transferência e transferência para um novo tubo de 15 ml. Traga o tubo para 15 ml com meio e centrifugar a 448 xg durante 10 min.
- Ressuspender o sedimento em 200 ul meios e colocar em um poço de uma placa de 96 poços de fundo redondo (cada amostra de cada animal vai entrar em seu próprio bem). Centrifugar a placa a 410 xg durante 5 min.
- Flick fora o sedimento sobrenadante e ressuspender em 200 ul de meios de re-estimulação (meio RPMI suplementado com FCS a 10%, 100 IU / ml de penicilina, 100 ug / ml de estreptomicina, 2 mM de L-glutamina, aminoácidos não essenciais 1x, piruvato de sódio 1 mM , e 55 uM β-mercaptoetanol, mais de 50 ng / ml de acetato de miristato de forbol (PMA), 750 ng / ml de ionomicina e o inibidor de transporte de proteínas Brefeldina a). Colocar a placa numa incubadora a 37 ° C durante 4 h.
NOTA: PMA e ionomycin re-estimulação resulta na activação de todos os linfócitos independentemente da sua especificidade para o antigénio T, a fim de avaliar o número total de cada subconjunto de células T no tecido dado. No entanto, as respostas de células T efectoras específicas para o antigénio pode ser avaliada de várias formas, incluindo células com péptido MOG restimulating na presença de Brefeldina A 15,16. - Avaliação de fenótipos de células T CD4 + do SNC
- A seguir à incubação, a placa de centrifugação de fundo redondo de 96 poços (a partir do passo 3.2.5), a 410 xg durante 5 min, e agite fora o sobrenadante. Todos os seguintes passos coloração são realizadas nesta placa.
- Lavar células em 200 ul de PBS com FCS a 2% e centrifugar a 410 xg durante 5 min. Flick off sobrenadante e incubar as células com 200 mL PBS contendo 2% de FCS com Fc Block (clone 2.4G2) para 10 - 15 minutos em gelo.
- Para começar a mancha extracelular, as células de centrifugação a 410 g durante 5 min, filme fora o sobrenadante e pellet ressuspender em 50 &# 956; l de cocktail de mancha de superfície contendo anticorpos fluoróforo marcado contra CD4 (1: 200, 1 ug / ml), TCRβ (1: 200, 1 ug / ml), e corante de viabilidade (1: 500) diluída em PBS durante 15 min em gelo. células centrifugar a 410 xg durante 5 minutos e movimento off sobrenadante. Lavar as células 2 x em 200 ul de PBS, em seguida, centrifugar a 410 xg durante 5 min.
- Após a remoção da nódoa extracelular, dar início ao procedimento de coloração intracelular de fixação / permeabilização seguido por coloração intracelular.
- Para começar, faça um movimento off sobrenadante e corrigir / células permeabilizar com Foxp3 fatores de transcrição reagentes de coloração 17 (de acordo com as instruções do fabricante; ver lista de materiais) durante 30 min a noite a 4 o C.
- Lavar as células em tampão de permeabilização de 150 ul a partir do kit de placa e centrifugar a 410 xg durante 5 min. Flick off células sobrenadante e mancha em tampão de permeabilização 50 pi com fluoróforo marcado com anticorpos contra a IL-17A (1: 200, 1 ug / ml), IFN-γ (1: 200, 1 ug / ml), e Foxp3 (1: 200, 2,5 ug / ml) diluído em PBS durante 30 min em gelo.
- células centrifugar a 410 xg durante 5 minutos e movimento off sobrenadante. Para remover o excesso de anticorpos lavar 3x em tampão de permeabilização de 200 ul, em seguida, centrifugar a 410 xg durante 5 min. Flick off sobrenadante e ressuspender em 200 mL PBS.
- Analise as células por citometria de fluxo, gating em células CD4 + ao vivo TCRβ + células como anteriormente descrito 11 para avaliar a percentagem de células que expressam cada molécula. Contar as células utilizando um hemocitómetro 18 ou outro método validado para determinar o número de células por rato com cada um dos fenótipos de células T CD4 +.
- Usando os dados obtidos, calcular percentual eo número de células CD4 + T infiltrando o cérebro ea medula espinhal de cada ratinho, com um foco particular sobre essas populações que desempenham papéis críticos na EAE patogênese e proteção19: IL-17A + IFN-γ -, IL-17A + + IFN-γ, IL-17A - IFN-γ +, Foxp3 +.
- A avaliação da proliferação de células T periféricas e activação
- Esmagar baço com lâminas de vidro fosco em uma placa de cultura de 60 x 15 mm. Coloque suspensão de células em um tubo de 15 ml usando a mídia a suspender as células. Encha tubo para 15 ml com células media e centrifugar a 448 xg durante 5 min.
- Aspirar media e ressuspender o sedimento em 2 ml de tampão de lise ACK à TA para lisar as células vermelhas do sangue para cerca de 3 min.
- Traga tubo para volume de 15 ml com a mídia e tensão ao longo de um filtro de células 70 mm para um novo tubo. células centrifugue-as a 448 xg durante 5 min, aspirar o sobrenadante e ressuspender em 2 ml de meio.
- Avaliação de proliferação periférica de células T CD4 + por coloração com Ki-67
- Colocar uma pequena ali quota (tipicamente de 200 uL) de equivalent números de esplenócitos a partir de 3.3.3 em poços individuais (um por exemplo) numa placa de fundo redondo de 96 poços.
- Centrifuga-se a 410 xg durante 5 min e o sobrenadante movimento fora. Ressuspender em 200 ul de PBS contendo 2% de FCS e repetição da centrifugação. Flick off células sobrenadante e ressuspender com PBS contendo 2% de FCS com Fc Block (2.4G2 clone) e incubar durante 10 - 15 min em gelo. Para mancha extracelular repita o passo 3.2.6.3.
- Após a remoção da nódoa extracelular, dar início ao procedimento de coloração intracelular de fixação / permeabilização seguido por coloração intracelular.
- Repita o passo 3.2.6.4.1.
- células centrifugar a 410 xg durante 5 minutos e movimento off sobrenadante. Lavar as células 1x em 200 ul de tampão de permeabilização do kit e centrifugar a 410 xg durante 5 min. Flick as células do sobrenadante e de manchas em tampão de permeabilização de 50 ul com anti-Ki-67 de anticorpo (1: 200, 1 ug / ml) durante 30 min.
- células centrifugar a 410 xg for 5 min e movimento off sobrenadante. Lavar as células 2 x em 200 ul de tampão de permeabilização do kit e centrifugar a 410 xg durante 5 min.
- Flick fora o sobrenadante e lavar as células em 200 ul de 1x PBS e centrifugar a 410 xg durante 5 min. Analise as células por citometria de fluxo, gating em células CD4 + ao vivo TCRβ + células como anteriormente descrito 11, então avaliar Ki-67 + células por cento.
- Avaliação dos fenótipos de células CD4 + T periféricos
- Coloque 200 ul de células (do passo 3.3.3) numa placa de 96 poços de fundo redondo (uma bem por amostra) e centrifugar a 410 xg durante 5 minutos e re-estimular como em 3.2.5.
- Coloque placa em uma incubadora a 37 ° C durante 4 h. Execute o mesmo procedimento de coloração como no passo 3.2.6 e seus sub-etapas. Analisar as células por citometria de fluxo, como em 3.2.6.4.4-3.2.6.5.5.
4. uma imuno-histoquímicad Quantificação
- preparação de tecidos
- Sacrificar ratos EAE em uma experiência separada dos utilizados no passo 3 e seus sub-etapas em qualquer ponto após a indução da EAE (muitas vezes ~ dia 30, durante a fase crônica da doença em camundongos C57BL / 6 ou durante um pico em escores clínicos médios para SJL ratos), seguindo os passos abaixo para determinar a extensão da gliose reacional e desmielinização.
- Anestesiar ratos com 2,5% de isoflurano e 97,5% de oxigênio e confirmar a profundidade adequada da anestesia com um dedo do pé suave beliscar usando uma pinça, à procura de uma falta de resposta. Realização de perfusão transcardíaca conforme descrito no passo 3.1.3. Após a injecção de PBS para o ventrículo esquerdo, use uma nova seringa para injetar 10 ml de paraformaldeído a 4% em PBS. ATENÇÃO: O paraformaldeído é uma pele e pulmão irritante, pode causar sérios danos aos olhos, e é suspeito de causar câncer. Evitar a inalação, ingestão e contacto com a pele e os olhos. Perfusão deve ser realizada numa hotte.
- Remover cérebros e colunas vertebrais conforme descrito nas etapas 3.1.4 - 3.1.6. Amarre colunas vertebrais de varas com corda para garantir o alinhamento direto da medula espinhal.
- Coloque cérebros em frascos de cintilação etiquetados com identificação do animal com cerca de 20 ml de paraformaldeído a 4% em PBS, e medulas espinhais em 50 ml tubos cônicos etiquetados com identificação do animal com cerca de 50 ml de paraformaldeído a 4% em PBS para a pós-corrigir durante a noite.
- Para cryoprotect cérebros, lavar 3 vezes em 1x PBS e armazenar a 4 ° C em 30% de sacarose em 1x PBS. Permitir que os cérebros para cair para o fundo dos seus recipientes (cerca de 3 dias).
- Remover de cálcio a partir da coluna vertebral, por lavagem 3 vezes em PBS 1x e colocá-lo num grande volume (cerca de 50 ml para um rato de medula espinhal) de EDTA 0,5 M em 1x PBS (a partir de pH vai ser ~ 10; pH a ~ 7,8 com N de HCl 6) durante 2 - 3 semanas, até que o osso não é mais rígida. Cryoprotect a coluna vertebral seguindo a etapa 4.1.5.
- cérebros incorporar ecolunas vertebrais em OCT seguintes sub-passos seguintes, logo que eles caem para a parte inferior dos seus recipientes.
- Fazer uma mistura de 1 parte de 30% de sacarose em PBS 1x e 2 partes de outubro (por exemplo, adicionar 15 ml de 30% de sacarose em PBS 1x e 30 ml de outubro).
- Adicione a mistura de outubro / sacarose ao molde incorporação (22 x 22 x 20 mm para cérebros e 22 x 30 x 20 mm para medulas espinhais) até que ele é de cerca de ½ cheio.
- Corte colunas vertebrais em 6 pedaços de tamanho igual, usando uma lâmina de barbear e coloque em uma incorporação de molde 22 x 30 x 20 mm virado para a frente para secções da espinal medula coronal. Coloque cérebros inteiros em 22 moldes x 22 x 20 mm virados para a frente.
- Adicionar outubro mistura / sacarose para cobrir o tecido e deixe descansar por 1 hora. por isso as bolhas podem escapar. Durante esta hora, adicionar 2-metilbutano a um prato que pode conter moldes de incorporação para flash-congelamento. Coloque o prato em gelo seco e cobrir a pré-cool.
- Flash-congelar o molde em 2-metilbutano em gelo seco e armazenar a -80 ° C no interior da acontainer para evitar a desidratação.
- Quando estiver pronto, o tecido seção de 16 mm com um criostato e montagem em lâminas carregadas electrostaticamente. Coloque cada seção 10 th em um slide para cada cérebro ea medula espinhal (por exemplo, deslizar 1 terá seções 1, 11 e 21, e deslize 2 terá seções 2, 12 e 22, e assim por diante). Loja desliza a -80 ° C ou utilizar de imediato para a coloração.
- A coloração para gliose reativa e mielina
- Quando estiver pronto para a coloração, escolha um slide para cada cérebro e medula espinhal por mancha para cada animal na mesma (ou o mais semelhante possível) região. Para o cérebro, escolha slides mostrando o corpo caloso e pacote cíngulo.
- Colocar as lâminas com o tecido em um bloco de calor a 70 ° C durante 7 min. Após 7 min desligar o bloco de calor e deixe esfriar as lâminas no bloco de calor para um outro 10 - 15 min. Isso irá evitar cortes de tecido de cair os slides durante o processo de coloração.
- Lave as lâminas 3 vezes cada em 1X PBS com 0,1% de detergente não iónico (por antigénios intracelulares) ou 1x PBS (para anticorpos dirigidos contra antigénios de superfície) durante 5 min.
NOTA: Uma vez que os anticorpos utilizados neste protocolo são intracelulares, detergentes não iónicos será usado em etapas subsequentes. Nunca deixar as lâminas secar completamente após esta etapa. - Colocar as lâminas em um recipiente e tampa com tampão citrato a pH 3,0. Para fazer tampão citrato, adicionar 0,192 g de ácido cítrico anidro a um volume final de 100 ml em água. Ajustar o pH com ácido acético se acima de pH 3.0 ou NaOH se abaixo.
- Incubar as lâminas a 37 ° C durante 30 min e lava-se 3 vezes em 1X PBS com 0,1% de detergente não iónico durante 5 min.
- Círculo uma área em torno do tecido com uma caneta barreira hidrofóbica e coloque as lâminas numa câmara húmida (por exemplo, uma caixa de lâmina contendo toalhas de papel molhado). Adicionar tampão de bloqueio para o tecido. Incubar durante 30 min à TA.
NOTA: O tampão de bloqueio é constituído de 1x PBSmais detergente não iónico 0,3% e o soro apropriada (5%) com base no hospedeiro do anticorpo secundário, ou seja, soro de cavalo para a proteína básica de mielina (MBP) e proteína glial fibrilar ácida (GFAP), e soro de cabra para Iba1. - Flick tampão de bloqueio fora das lâminas e adicionar o anticorpo primário (1: 1000 ou proteína básica de 0,2 ug / ml de anticorpo de cabra anti-mielina de oligodendrócitos, 1: 1000 ou 1 ng / ml a 3 ng / rato ml de anti-GFAP para astrócitos, ou 1 : 750 ou 0,67 ug / ml de anticorpo de coelho anti-Iba1 para microglia) diluído em tampão de bloqueio apropriada (ver o passo 4.2.6) para a área de um círculo. Deixar a 4 ° C durante a noite na câmara úmida.
- Flick anticorpo em tampão de bloqueio fora das lâminas e as lâminas de lavar 3 vezes em 1X PBS com 0,1% de detergente não iónico durante 5 min.
- Adicionar anticorpo secundário (1: 200 ou 7,5 ug / ml de cavalo anti-ratinho biotinilada para MBP e GFAP, ou de cabra biotinilado anti-coelho para Iba1) diluído em tampão de bloqueio apropriada (ver steP 4.2.6) para a área circulada e deixar as lâminas a incubar na câmara húmida durante 1 h à TA.
- Flick anticorpo em tampão de bloqueio fora das lâminas e as lâminas de lavar 3 vezes em 1X PBS com 0,1% de detergente não iónico durante 5 min.
- Prepare complexo avidina-biotina-peroxidase (ABC) em imunoperoxidase (ver lista de materiais) 30 min antes da utilização e agitar num agitador até ser necessário em 4.2.12. Adicionar 0,3% de H 2 O 2 em metanol à área circulada durante 10 minutos para extinguir a actividade da peroxidase endógena.
- solução Flick fora das lâminas e lavar com 2 vezes em 1X PBS ou PBS 1x com 0,1% de detergente não-iónico, durante 5 min, em seguida uma vez em PBS 1x. Adiciona-se reagente ABC para a área circulada durante 30 min.
- solução Flick fora das lâminas e lavar 3 vezes em 1X PBS durante 5 min, em seguida 2 vezes com água durante 5 min. Fazer a solução de 3,3'-diaminobenzidina (DAB) (veja Lista de Materiais) e adicioná-lo para cobrir as seções.
NOTA: Este passo exige um microscópio para observar melhor detectartempo de iões de coloração e deve ser feito para a mesma quantidade de tempo para as lâminas a serem comparadas. - Lave as lâminas 3 vezes em água por 5 minutos cada. Desidratar o tecido, colocando nas seguintes soluções durante 2 minutos cada: 70% de etanol em água, etanol a 95% em água, 100% de etanol em água, 50% de xilenos e 50% de etanol, 100% de xilenos. Selar uma lamela na lâmina com um meio de montagem resinoso.
- Alternativamente, realizar a coloração por imunofluorescência tal como anteriormente descrito 11 para avaliar a gliose reactiva utilizando anticorpos contra Iba-1 e GFAP.
- Tirar fotos de cada secção da medula espinhal (coradas com anticorpos respectivos usando DAB) com um 4X, 0,13 NA objetivo e salvar as imagens como .tiff. Em alternativa, tomar imagens do corpo caloso e pacote cíngulo no hemisfério esquerdo do cérebro ou para a direita usando um 20X, 0,50 NA objetivo e salvar as imagens como .tiff. Para uma determinação mais detalhada da carga de lesões no cérebro, que é benéfica para incluir tanto hemispherES em análises.
- Medindo área média de fração para gliose reativa (Iba1 e GFAP coloração)
- Baixar NIH ImageJ (http://imagej.nih.gov/ij/) e aberto em um computador. No software ImageJ, utilize o menu cadeia File> Open e selecione uma imagem a partir do passo 4.2.16. Desenhar uma área usando o "seleções polígono" ferramenta na barra de menu. Para medulas espinhais, rastrear toda a seção; para cérebros, corpo caloso e pacote cíngulo. Converter a imagem em 16 bits, vá para Imagem> Tipo e clicando em "16-bit".
- De-ruído na imagem, indo para o Processo> Subtrair fundo e definir o "raio bola rolar" pelo menos ao tamanho do maior objeto que não faz parte do plano de fundo (consulte o guia do usuário ImageJ em http: //rsbweb.nih .gov / ij / docs / guia / 146-29.html).
NOTA: Para uma imagem de 4X Iba-1 coloração usamos 4,0 e para GFAP usamos 50,0, mas esses números podem variar dependendo da ampliação da imagem e int coloraçãoensity. - Marque a opção "Paraboloide deslizante" e clique em "OK". Vá em Image> Adjust> Threshold ... e definir o nível de limiar inferior (barra superior) usando as barras deslizantes. Incluir apenas coloração que é celular e ser consistente em todas as imagens. Para imagens com fundos escuros (aplica-se apenas a coloração fluorescente), verifique se a caixa "Fundo escuro" está marcada.
- Ir para Analisar> Definir Medidas ... e selecione "fração Area" (dá a percentagem de área thresholded dentro da região de interesse). Certifique-se de que "Limit to limite" está desmarcada e "etiqueta Display" está marcada. Clique em "OK" quando terminar.
- Para obter medições, vá para Analisar> Medida. A "Results" caixa de pop-up aparece e esses dados podem ser salvos como é ou copiado para outro programa. Para a análise, comparar os valores de "fração de área" entre os grupos de tratamento.
- A quantificação da coloração por MBP optdensidade de ical
- imagem aberta e desenhar uma área de interesse, tal como descrito no passo 4.3.1. Ir para Analisar> Definir Medidas ... e selecione (a soma dos valores de cinza dentro da seleção, dividido pelo número de pixels) "valor de cinza média". Certifique-se de que "Limit to limite" está desmarcada e "etiqueta Display" está marcada. Clique em "OK" quando terminar.
- Para obter medições, vá para Analisar> Medida. Observar um "Results" caixa de pop-up aparecer. Copiar esses dados e salvar como está ou copiar para outro programa.
- Para a análise, copiar e colar valores em outro programa. Converter valor de cinza média em densidade óptica (OD) utilizando a fórmula: OD = log 10 (255 / Valor médio cinza).
Resultados
Aqui, foram utilizados dois modelos de EAE de entender se um agente farmacológico fornece proteção CNS por qualquer atenuante células T CNS-infiltrantes ou prevenção de mielina e lesão axonal durante o ataque de infiltração de células imunes inflamatória. Para determinar se um agente terapêutico impede a infiltração de células imunitárias para a medula espinal, o modelo de ratinho C57BL / 6 de EAE crónica é utilizado, onde a infiltração de células imunes e patologia da doença está predominantemente localizada na medula espinal (Figura 1A). Para determinar se um fármaco terapêutico proporciona protecção SNC durante a invasão de células imunes para o sistema nervoso central, o modelo animal de SJL remitente-EAE é usado, o que demonstra a patologia da doença, tanto no cérebro e medula espinhal (Figura 1B).
As avaliações clínicas
Avaliações clínicas relevantes são feitas de acordo com a seguinte rubrica para típico (Figura 1C) ou atípica (Figura 1D) de EAE. Para a doença clínica típica, uma pontuação de 0 é nenhum comportamento anormal. Quando apanhado pela base da cauda, a cauda pode rodar rapidamente (bem como um rotor de helicóptero) e as pernas traseiras serão afastados. Uma pontuação clínica de 1 é uma cauda flácida parcialmente, o que pode ser determinado por levantamento do rato pela base da cauda. A rotação normal de helicóptero-like pode ser enfraquecida ou ausente, e parte da cauda pode ser completamente mole. Uma maneira útil para determinar a extensão da paralisia da cauda é executar um do dedo até o comprimento da cauda, como uma cauda unparalyzed geralmente vai enrolar em torno do dedo, enquanto uma cauda parcialmente paralisado não será capaz de fazê-lo. A pontuação clínica de 2 representa uma cauda completamente paralisado. Nenhum movimento da cauda ocorre em tudo ao escolher-se o rato na base da cauda. A pontuação clínica de 3 representa a paralisia dos membros traseiros parcial. Determinação deste pontuação requer que o mouse seja livre para se mover em um flaT superfície. Se um membro posterior está arrastando como o mouse se move para frente, ou se um ou ambos os membros posteriores parecem ser parcialmente paralisado, pode ser dada uma pontuação de 3. A pontuação clínica de 4 representa completa paralisia dos membros traseiros. Com este resultado, um rato não será capaz de mover seus membros posteriores e vai arrastar-se para a frente usando suas patas dianteiras. A pontuação clínica de 5 representa um rato moribunda, ou um mouse com dificuldade movendo-se através de sua gaiola ou respiração. Se um rato não pode arrastar-se ao longo da parte inferior da gaiola ou se a sua respiração é difícil, o rato deve ser humanamente eutanasiados. A pontuação clínica de 6 representa um rato encontrado morto em sua gaiola. A pontuação de 6 é incomum e causas de morte diferentes EAE devem ser investigados.
doença clínica atípica pode ou não ser acompanhada de paralisia. Pode ser necessário incluir dois sistemas de pontuação separados, se um rato apresenta-se com doença atípica mais sintomas típicos. Uma pontuação de 0 não é um comportamento anormal, umas com o sistema de pontuação típico. A pontuação clínica de 1 representa uma virada de cabeça leve ou inclinação enquanto o mouse está andando. Esta pode ser determinada, permitindo que o rato para andar para a frente e observando uma direccionalidade constante esquerda ou para a direita para a sua circulação. A pontuação clínica de 2 representa uma virada de cabeça mais pronunciados e capacidade de endireitamento pobres. Tal como acontece com uma pontuação atípica de 1, o mouse tem direcionalidade ao seu movimento e pode ter ligeira dificuldade com o equilíbrio. A pontuação clínica de 3 representa uma incapacidade de andar em linha reta. O mouse terá dificuldade em equilibrar e pode usar o lado da gaiola para ajudar a direita se como ele anda. A pontuação clínica de 4 representa um mouse coloca em seu lado, incapaz de andar devido a problemas de balanceamento. O rato pode ser capaz de arrastar-se ao longo da parte inferior da gaiola, mas pode ter direccionalidade para o seu movimento. A pontuação clínica de 5 representa voltas sucessivas, a menos suportado. Um rato que atinge essa pontuação deve ser humanamente eutanasiados. Uma clínicapontuação al de 6 representa um rato encontrado morto em sua gaiola. A pontuação de 6 é incomum e causas de morte diferentes EAE devem ser investigados.
Pode ser necessário para permitir a "in-between" pontuações, por exemplo, a adição de 0,5 a uma pontuação, se condição muda de um rato ligeiramente ou se escolher entre duas pontuações é difícil. Por exemplo, um rato que começa a se mover mais lentamente do que suas contrapartes normais, mas não exibe paralisia, ou um rato que aperta suas patas traseiras com a sua frente em vez de splaying suas pernas para fora quando pegou pela cauda pode ser atribuída uma pontuação de 0,5 . Um rato que só pode arrastar-se ao longo da parte inferior da gaiola e só é capaz de se contorcer seus membros posteriores periodicamente ou quando tocado pode ser atribuída uma pontuação de 3,5.
Avaliando uma redução da infiltração celular imunitário
Após a indução de EAE no modelo de ratinho C57BL / 6 (Figura 1A, dia 0), presentati antigénioem e a proliferação de células T no baço ocorrer nos dias 1-5, seguido por infiltração de células imunes para o SNC por volta do dia 7. Cerca de 3 a 5 dias após os ratinhos infiltração de células imunes iniciais apresentam-se com pontuações clínicas. Para avaliar se um agente terapêutico está a bloquear a infiltração de células imunes para a medula espinal, as drogas ou o veículo são introduzidos no dia 7 após a apresentação de antigénio e proliferação nos baços mas antes de iniciar células imunes para se infiltrar na medula espinal. Se a infiltração de células imunes tem sido atenuado, o curso clínico da doença deve reflectir melhorar os resultados clínicos durante a fase crescente da doença dos dias 10 a 15 (Figura 2).
A redução na infiltração de células imunes também resultaria na neuroinflama�o diminuída. astrocitose reactiva e microgliose são considerados grandes marcas para neuroinflamação. A coloração para astrócitos GFAP e com microglia com Iba-1 pode então ser utilizado para avaliar ChangES em coloração média fracção da área de quantificar neuroinflama�o (Figura 3).
Para determinar se a infiltração de células imunitárias é reduzida, as medulas espinais são removidas e processadas para análise por citometria de fluxo no pico da doença (Figura 1A, aproximadamente no dia 18). Isso garante que o maior número de células do sistema imunológico ter entrado para a medula espinhal. Entrada de células T no SNC é considerado o evento inflamatório iniciar e ambas as células Th1 e Th17 são encontrados em modelos animais de EAE, bem como pacientes com EM. Tomados em conjunto, a análise de citometria de fluxo deve incluir a avaliação de ambos os tipos de células T patogénicas. Além disso, Tregs são células T supressoras bem caracterizadas que amortecem doença. Por conseguinte, a percentagem de Tregs a partir de uma população total de células CD4 + deve ser avaliada em comparação com a percentagem de população de células T efectoras. Isto irá revelar se ocorreu uma redução global na infiltração de células T ou se there é um enviesamento de fenótipos de células T no SNC. Gráficos de pontos representativos (Figura 4A) demonstram uma redução no número total de células CD4 + T infiltrando-se em células de medulas espinais de murganhos tratados com a droga em comparação com as medulas espinais de murganhos tratados com veículo (números nos quadrantes superior direito). Para avaliar Th1, Th17, e células Treg as seguintes proteínas de assinatura são avaliadas: IFN-γ +, IL-17 +, e Foxp3 +, respectivamente, e deve ser reduzido (Figura 4A). A análise estatística deve ser realizada em células CD4 +, o IFN-γ +, IL-17 +, e os números de células Foxp3 + para demonstrar uma redução significativa (Figura 4B). Para excluir uma distorção dos subconjuntos de células T, a avaliação estatística da proporção de IFN-γ + IL-17 +, IFN-γ + IL-17 - IL-17 + IFN-γ -, e Foxp3 + células é realizada ( Fifigura 4C).
Para eliminar a possibilidade de que uma redução no SNC-infiltrado de células T é uma consequência da inibição da proliferação, a activação, diferenciação e na periferia, o número de proliferar activamente células T, para além da proporção de subtipos de células T tem de ser avaliada. Não houve alteração na percentagem de células CD4 +, o IFN-γ +, IL-17 +, ou Foxp3 + devem ser encontrados se a activação e a diferenciação não são afectadas (Figura 5A). Além disso, nenhuma mudança em células Ki67 + CD4 + devem ser encontrados se a proliferação não é afectada (Figura 5B). Os tratamentos medicamentosos são introduzidos no dia 7 ou mais tarde, para evitar alterar a apresentação de antigénio inicial e activação de células T na periferia. No entanto, nos modelos genéticos proteínas são frequentemente suprimida de forma constitutiva durante a embriogénese ou induzida antes da indução de EAE fazendo esplenócitos assessment de grande importância.
Avaliando Protecção CNS
Para demonstrar se um agente terapêutico particular modula a patologia da doença no sistema nervoso central depois da infiltração de células imunitárias, as intervenções farmacológicas deve ser administrada durante o primeiro pico na pontuação da doença clínica. O modelo de EAE SJL é vantajoso para estas experiências uma vez que estes ratos apresentam um fenótipo recorrente-remitente. Se um tratamento de droga evita a degeneração da mielina-axónio, uma melhoria das pontuações clínicas irão ser observados (Figura 6). avaliação patológica da mielina deve corroborar uma redução em danos de mielina consistente com escores clínicos melhorados. Para avaliar quantitativamente a integridade da mielina, coloração DAB da proteína básica da mielina (MBP) é realizada, seguida pela análise estatística da densidade óptica para este coloração (Figura 7). Para substanciar ainda que neuroinflamação, é sustentada ou diminuiu therapeintervenções UTIC, gliose reactiva pode ser avaliada medindo a área média fracção de gliose reativa, como descrito acima (Figura 3). Para corroborar que uma intervenção terapêutica está a proteger directamente o CNS, sem efeitos imunomoduladores, atenuação da infiltração de células imunes para o SNC e proliferação nos baços devem ser descontados. Para resolver esta questão, os métodos para a avaliação do cérebro e medula espinal de infiltração de células imunitárias e a avaliação da proliferação de células T periféricas e activação deve ser efectuada tal como descrito acima (Figuras 4 e 5). Tomados em conjunto, os agentes terapêuticos que bloqueiam a lesão da célula no sistema nervoso central com nenhuma evidência de uma diminuição na infiltração de CNS-células T ou a proliferação de células T na periferia está tratamentos CNS-protectores.
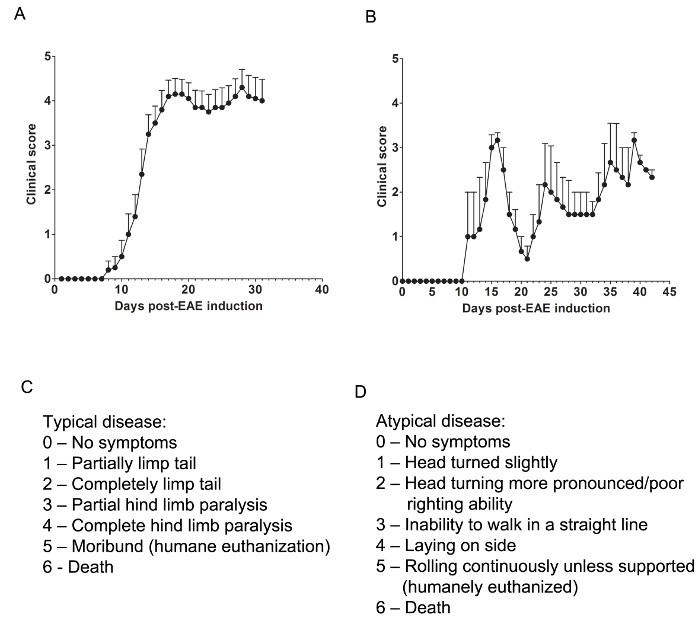
Figura 1. representativas Results de escores clínicos de EAE em ratinhos SJL C57BL / 6 e. Os escores clínicos (A) (média ± SEM) de camundongos C57BL / 6 (n = 10) induzida com MOG 35-55 para produzir EAE com doença crônica. (B) marca clínicos (média ± SEM) de ratinhos SJL (n = 3) induzidas com PLP 139-151 para produzir EAE com doença recorrente-remitente. (C) A rubrica pontuação clínica usado para controlar a progressão da doença em ratinhos EAE típico. (D) A rubrica de pontuação clínica usado para controlar a progressão da doença atípica em ratos EAE. Por favor clique aqui para ver uma versão maior desta figura.
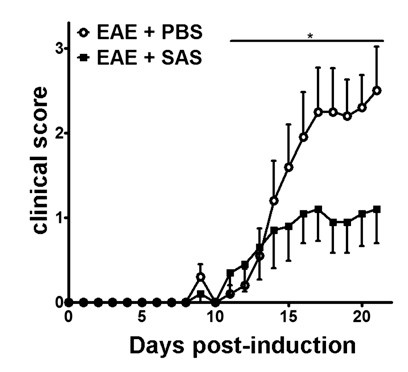
Figura 2. Tratamento Farmacológico antes Imune a infiltração de células em camundongos C57BL / 6 com EAE. pontuações clínicas (média ± SEM) de ratinhos C57BL / 6 tratados com PBS (n = 20) ou SAS (n = 19) a partir de 7 dias após a imunização com MOG 35-55. Os dados são de três experimentos independentes agrupados. diferença estatística foi determinada usando um teste não paramétrico de duas caudas teste de Mann-Whitney U, * p <0,05. Re-imprimir com a permissão de (11).
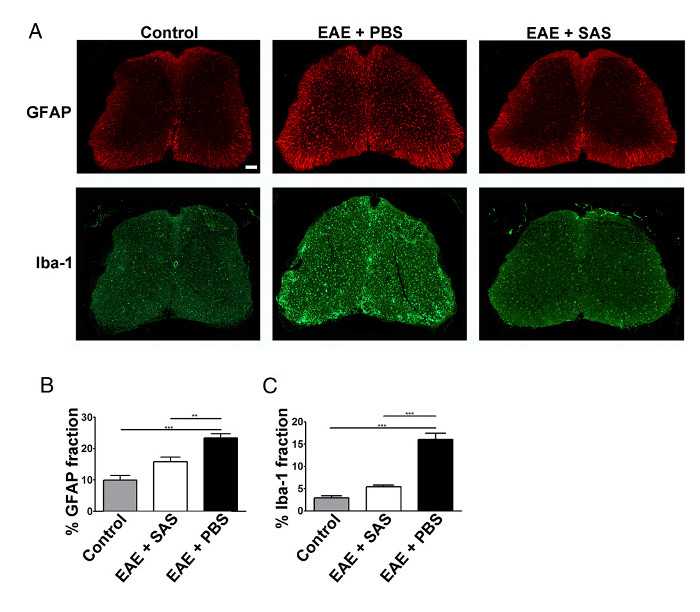
Figura 3. imunofluorescência Coloração e Quantificação de Reactive Gliose em Spinal Cabos de controle, EAE e tratados camundongos C57BL / 6. (A) rotulagem fluorescente para GFAP (astrócitos) e Iba-1 (microglia) nas medulas espinhais de controle (não imunizado ) ratos (da esquerda painéis) e ratos EAE tratados com PBS (painéis de média) ou SAS (painéis da direita). Barra de escala = 100 pm. Quantificação da coloração foi determinada utilizando a técnica fracção da área para medir cento immunopárea ositive para GFAP (B) e Iba-1 (C). Média ± SEM, n = 3, controlo, n = 3-tratada SAS, ou n = 4 ratinhos tratados com PBS, 6 secções por ratinho. As diferenças estatísticas foram determinadas utilizando um ANOVA de uma via, * p <0,05, ** P <0,01, *** p <0,001. Re-impressão com a permissão do (11). Por favor clique aqui para ver uma versão maior desta figura.
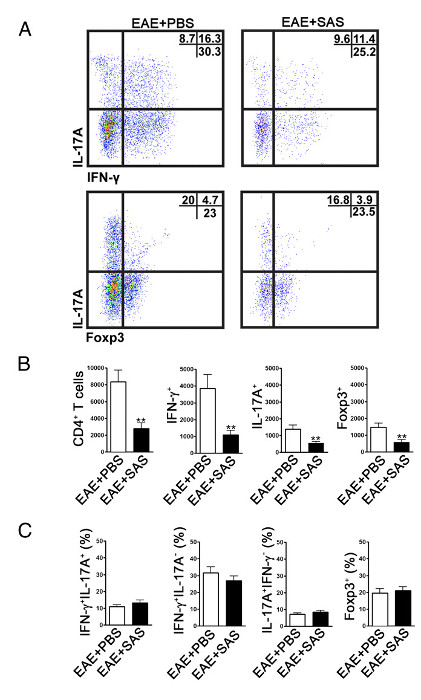
Figura 4. Análise de FACS de EAE C57BL / 6 mouse espinais Cordões demonstrando reduziu a infiltração de células T em ratinhos tratados. Ratinhos C57BL / 6 foram tratados com a SAS ou PBS, a partir de 7 d pós-indução de EAE. Medulas espinais foram obtidas no dia 15. Os gráficos de pontos representativos (A) mostram Th1 (IFN-γ + / IL-17 -) e Th17 (IFN-γ- / IL-17 +) em células CD4 + portão (painéis superiores) e células T reguladoras (Foxp3 +) (painéis inferiores). gráficos de pontos mostram percentagens em quadrante superior direito. (B) os números absolutos de células CD4 +, bem como o IFN-γ +, IL-17A + + Foxp3, e as células foram analisados estatisticamente. (C) A alteração na percentagem de populações de células T entre SAS- e ratinhos EAE tratados com PBS foi também examinada. Média ± SEM, n = 10 para tratados com PBS, e n = 9 para o SAS tratados a partir de duas experiências independentes. teste t bicaudal foi utilizado para todos os gráficos de barras. ** P <0,01. Re-impressão com a permissão do (11). Por favor clique aqui para ver uma versão maior desta figura.
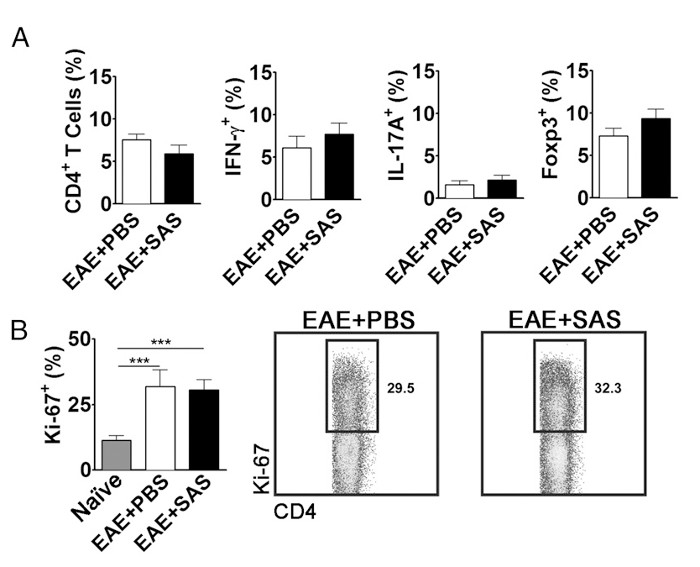
Figura 5. FACS Análise de EAE C57BL / 6 mouse baços Demonstrando perfis de expressão de células equivalentes T e proliferação em camundongos tratados e não tratados. Baços de PBS e os ratos tratados com SAS foram analisados 15 d pós-indução de EAE. (A) A percentagem de células CD4 + T, Th1 (IFN-γ + / IL-17, -), Th17 (IFN-y - / IL-17 +), e células T reguladoras (Foxp3 +) em PBS a partir de baços tratado (n = 10) e SAS-tratado (n = 9) a partir de ratinhos duas experiências independentes. (B, painel da esquerda) A percentagem de células Ki-67 + na população de CD4 + de baço ingénuas (n = 4), bem como a partir de PBS (n = 5) e ratinhos tratados com a SAS (n = 5) com o induzido EAE. A one-way ANOVA demonstrou significância estatística entre a proporção de Ki-67 + células de baço ingénuas em comparação com qualquer baços EAE tratados com SAS PBS ou. Não houve significância entre PBS e os baços EAE tratados com SAS. (B, painel da direita) gráficos de pontos representativos; números indicam proporção de proliferação. gráficos de pontos mostram percentagens. Os gráficos de barras representam o teste t de duas caudas, *** p <0,001. Re-impressão com a permissão do (11). Por favor clique aqui para ver uma versão maior desta figura.
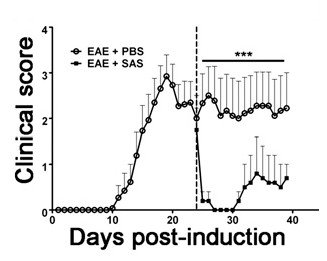
Figura 6. Tratamento farmacológico depois Imunitário infiltração de células em ratos SJL com EAE. Pontuações clínicas (média ± SEM) de ratinhos SJL tratados com PBS (n = 8) ou SAS (n = 8) a partir do dia 24 após a imunização (linha a tracejado) com PLP 139-151. Os dados são média ± SEM de pontuações clínicas. diferença estatística foi determinada usando um não-paramétrico, teste bicaudal de Mann-Whitney U, *** p <0,001. linha superior representa os valores utilizados para fins estatísticosanálise. Re-imprimir com a permissão de (11).
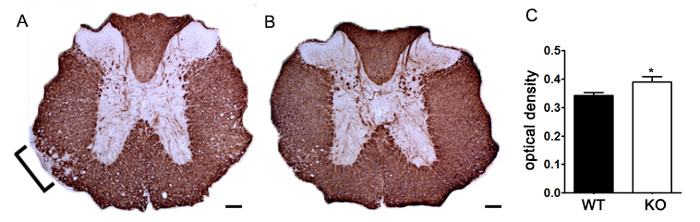
Figura 7. Quantificação da MBP coloração usando densidade óptica. (A) coloração Representante da MBP na medula espinhal torácica de um ratinho knockout genética não especificado em relação ao controle littermate C57BL 6 mouse / induzidos com EAE. Bracket indica área representativa de redução da MBP coloração desmielinização indicando. (B) MBP coloração da medula espinhal torácica de um nocaute genético não especificado C57BL / 6 mouse. (C) os ratinhos knockout genéticos não especificados induzidos com EAE (KO; n = 6 ratos, 2-4 lombar e secções torácicas por animal) exibem uma densidade óptica superior (OD) de coloração de MBP na espinal medula do que o tipo selvagem (WT; n = 3 ratos, 2-4 lombares e torácicas secções por animal) ratos induzidos com EAE. usi analisados estatisticamenteng um teste t de duas caudas, * p <0,05. As barras de erro representam SEM. A barra de escala 100? M.
Discussão
Os pacientes com MS continuar a ter recaídas da doença ao tomar medicamentos que atenuam a ativação de células T e / ou infiltração no sistema nervoso central, garantindo o desenvolvimento de opções de tratamento que protegem directamente o CNS. A EAE foi classicamente utilizado para modelar os sintomas da esclerose múltipla e pode ser uma ferramenta poderosa ao estudar a natureza das interacções entre o sistema imunitário e do SNC in vivo. Usando temporização de considerações de tratamento na EAE, por exemplo, antes ou após o início da doença, em conjugação com o exame infiltração imune celular no sistema nervoso central e a proliferação e activação na periferia, é possível delinear os efeitos de tratamentos em ambos os sistema imunitário e o SNC.
Enquanto EAE no ratinho C57BL / 6 é mais amplamente utilizado, a EAE em ratinhos SJL pode ser mais representativo da maioria dos casos de EM, uma vez que estes ratos têm um fenótipo recorrente-remitente e infiltração de células imunitárias no parênquimado cérebro 10. SJL têm clara recuperação durante a remissão, bem como, tornando possível para começar o tratamento depois que a doença tem apresentado, mas durante os períodos de redução da inflamação. É importante considerar que os ratos SJL nem sempre recaída e remeter em sincronia, resultando em potencialmente grande variabilidade quando os resultados são agrupados. Portanto, alguns pesquisadores podem optar por mostrar resultados representativos para escores clínicos de um animal, tendo os ratos para análise FACS e histologia em pontos individualizados na progressão da doença.
Considerando quando manipulações são feitos aos ratos EAE pode auxiliar na determinação de como um tratamento afecta o sistema imunitário ou do SNC. Há muitas opções para quando o tratamento começa, cada um com sua própria conotação para se células imunes entraram no CNS e como eles podem estar interagindo com o CNS. Tratamento antes do início dos sintomas implica que células do sistema imunológico ainda não entraram ou causado dano ao CNS.Tratamento após o início dos sintomas implica que as células imunes ter entrado no sistema nervoso central e ter causado algum dano. Utilizando murganhos da estirpe SJL, o tratamento pode também começar durante uma recaída, em que as células imunes são activamente infiltrante e causando inflamação, ou durante a remissão, em que as células imunes pode ser menos prevalente no SNC com menor inflamação. As hipóteses iniciais sobre como tratamentos afetam o SNC e sistema imunológico pode ser feito quando se considera que as células imunes são no processo patológico durante o tratamento.
Há um certo número de maneiras em que os tratamentos podem afectar as células do sistema imunológico e o sistema nervoso central, cada um com o resultado final de reduzir a gravidade dos sintomas de EAE. Portanto, é necessário o uso de análise de citometria de fluxo e imuno-histoquímica para ver como as células imunes são afectadas na periferia e no SNC, células do sistema imunológico se ter introduzido o SNC, e como o sistema nervoso central reage ao tratamento. Enquanto a análise de citometria de fluxo da medula espinal pode determinar quantas células have entrou no SNC em um determinado momento, não se pode determinar que este efeito é devido à reduzida tráfico de células imunitárias, a menos que a proliferação de células imunes não é afectado no baço. Por conseguinte, é necessário analisar ambos os tecidos periféricos e sistema nervoso central e determinar o que resultados médios mecanicamente quando ambos os tecidos são comparados. É também possível para perfis de actividade de células imunitárias de ser alterada por tratamento, por exemplo, possuindo um interruptor em um perfil de célula T auxiliar-pesado patogénico para um perfil de célula-T reguladoras pesada. Olhando para marcadores para os diferentes tipos de células e comparando a percentagem de expressão entre os animais tratados e não tratados, por conseguinte, é também uma consideração importante. Um conceito emergente de pesquisa MS sugere que as células B desempenham um papel importante na desmielinização auto-imune. Isto baseia-se em estudos que mostram que as células B são necessárias para a reactivação das células T 20. Este conceito é apoiado pelo sucesso dos tratamentos, tais como rituximab, um anticorpo contra CD20 expressionada na superfície de células B 21,22. Como demonstrado pelo sucesso do anticorpo monoclonal ocrelizumab em ensaios clínicos, fármacos dirigidos a diferentes epitopos de CD20 pode melhorar a eficácia da terapêutica alvo de células-B 23.
Uma limitação das técnicas aqui apresentados é que é possível que as células imunes para entrar no SNC, mas ser incapaz de viajar no parênquima. A imuno-histoquímica pode ser usada para detectar infiltrados perivasculares de células do sistema imunológico e avaliar a distância percorrida no parênquima entre animais tratados e não tratados. Outra limitação potencial envolve os efeitos do microbioma na EAE patogênese. Commensal microbiota intestinal pode influenciar fortemente doença patogênese 24; portanto, os ratos alojados em diferentes colônias e até mesmo em gaiolas diferentes podem ter grandes diferenças na gravidade da doença. Assim, é sempre preferível sempre que possível usar controles da mesma ninhada levantadas na mesma gaiola paraexperimentos envolvendo EAE. Uma observação final é que se experimentalmente que é desejável para eliminar os efeitos de alterações proliferativas de células imunitárias na periferia, pode ser possível fazê-lo usando indução transferência passiva em vez da indução activo descrito neste protocolo.
A confirmação adicional para a neuroprotecção pode ser conseguida utilizando um sistema de co-cultura para testar 11 mecanismos específicos de morte celular ou através da utilização de ratinhos knockout condicionais que permite a eliminação de proteínas selectivamente em um tipo de célula. Além disso, para estender a exploração de agentes farmacológicos que são neuroprotectores, marcadores de transecção axonal e morte neuronal deve ser incluída. Outra área de grande importância é a remielinização. axônios lesionados são incapazes de remielinar dando mais apoio que tratamentos neuroprotetores devem ser uma parte importante de terapias remielinização. Além disso, os axônios não mielinizados são mais vulneráveis a lesões do que myelinaaxônios o Ted. Isto sugere que, quando um axônio torna-se intervenções terapêuticas de desmielinização que promovem a remielinização oportuna irá impedir lesão axonal. Para explorar estas pistas, outros modelos in vivo para a desmielinização e remielinização pode ser utilizado (isto é, cuprizona e lisolecitina). O método aqui descrito foco na avaliação neuroproteção, quantificando a perda de mielina. Para a avaliação da remielinização o número de células progenitoras, bem como a sua capacidade para proliferar e amadurecer também seria importante para investigar. Com a menção desses modelos alternativos, deve-se também considerar diferentes modelos de encefalite que são viralmente mediadas. Existem dois bem caracterizados modelos virais de ARN que produzem a perda de mielina: um é encefalomielite de Theiler murino, um vírus não envelopados Picornaviridae, e o outro é o vírus da hepatite do rato, um membro da família Coronaviridae vírus 25,26.
EAE é uma ferramenta valiosa para studies de manipulações como tratamentos ou afectam o sistema imunológico e o sistema nervoso central in vivo. O protocolo aqui descrito pode ajudar a determinar onde os tratamentos estão a afectar o processo da doença, quer seja na periferia, na barreira sangue-cérebro, ou no sistema nervoso central. Não há tratamentos atuais para MS curar a doença e os pacientes muitas vezes experiência de declínio ao longo do tempo. Da mesma forma, outras doenças envolvendo a infiltração de células imunes para o SNC e degradação de mielina, incluindo a encefalomielite aguda disseminada, mielite transversa, e neuromielite óptica, tratamentos falta que protegem o sistema nervoso central, uma vez que está diretamente sob ataque por infiltração de células do sistema imunológico. Tomando em consideração o tempo de tratamento e utilizando análise de citometria de fluxo do baço e da medula espinhal em conjunto com imuno-histoquímica do SNC para avaliar a inflamação e dano irá permitir determinações mecanicistas a ser feita sobre tratamentos.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho foi financiado pelo NINDS P30-NS069324, The National Multiple Sclerosis SocietyRG 4587-A-1, A Fundação Civitan International Research, The Mike L. Jezdimir Myelitis transversal Foundation, The University of Alabama Serviços Fundação de Saúde - Fundo Geral Endowment, The National Science Foundation 1355183, e T32 AI007051 do Instituto Nacional de Alergia e Doenças Infecciosas, Instituto Nacional de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
Referências
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados