Method Article
Die Bestimmung Unterdrückung des Immunsystems gegen ZNS-Schutz für pharmakologische Interventionen im Bereich der Autoimmun- Demyelinisierung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Zusammenfassung
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Einleitung
Multiple Sklerose (MS) wird durch Entzündungsläsionen vorwiegend in der weißen Substanz Regionen des Gehirns in frühen Krankheits charakterisiert. Nach langfristige Progression wird graue Substanz Atrophie durch MRT-Bildgebung erfasst und markiert die neurodegenerative Phase der Krankheit. Reaktive Gliose, Demyelinisierung und axonale Schäden in der weißen Substanz an CNS-infiltrierenden Immunzellen zugeschrieben. Keine der Behandlungen derzeit in MS verwendet umkehren oder direkt Neurodegeneration im ZNS verhindern - sondern sie reduzieren Entzündung durch T-Zell-Aktivierung zu dämpfen und / oder Infiltration in das ZNS. Da es keine Heilung für MS und Patienten aktuellen Behandlungen weiterhin Fortschreiten der Krankheit zu erfahren, Entdeckungen von Medikamenten, die Demyelinisierung und neuronalen Verlust verhindern sind von entscheidender Bedeutung. Jedoch kann experimentell schwer, wie das Ergebnis sein , zwischen den Effekten auf Immunzellen und die auf das ZNS Differenzierung - dh reduzierte Schädigung des ZNS - sieht die same unabhängig von den Mechanismen, durch die sie auftritt. Daher Beurteilung von CNS Schutz muss mit Bewertungen von CNS-infiltrierenden Immunzellen und Proliferation von Immunzellen in der Peripherie zusammengeschlossen werden, um zu bestimmen, wie pharmakologische Wirkstoffe Krankheitsmechanismen beeinflussen.
Experimentelle autoimmune Enzephalomyelitis (EAE) ist ein gut etabliertes Tiermodell der Autoimmunentzündungserkrankungen , die direkt verantwortlich für die Entdeckung von Arzneimitteln zur Zeit verwendet wurde , um MS 1-4 behandeln. Mäuse werden häufig für EAE verwendet, mit C57BL / 6-Mäuse eine beliebte Stamm basiert auf der Verfügbarkeit von genetischen Varianten. C57BL / 6-Mäuse induziert mit EAE zeigen chronischen Krankheitsverlauf mit Beginn um Tag 10 nach Induktion. Die Infiltration des Rückenmarks Parenchym und Cerebellum sind charakteristisch für die Histopathologie dieser Tiere, mit der Abwesenheit der Infiltration im Rindenparenchym 5. Zusätzlich kortikalen Läsionen und Demyelinisierung in der bregen sind Kennzeichen der Krankheit 6-9, die in C57BL / 6 - Mäuse relativ fehlen. Daher kann es bevorzugt sein , wenn möglich SJL - Mäuse zu verwenden, die sowohl gefunden rezidivierend-remittierender Erkrankung und Läsionen im Gehirn und Rückenmark, die mit denen in MS 10 ähnlich erscheinen.
Die Behandlung kann nicht als neuroprotektive eingestuft werden, wenn Immunzellen nie das ZNS erreichen. Daher macht dieses Protokoll Gehirnen Verwendung von Durchflußzytometrie - Analyse, Rückenmark und Milz von Mäusen EAE Wirkungen der Behandlung auf die Immunzellinfiltration in das ZNS und die Proliferation von Immunzellen in der Peripherie zu bestimmen, wie zuvor 11 gezeigt. Immunhistochemische Analysen von ZNS-Gewebe Ausmaß und die Art der Neuroprotektion zu bestimmen, wird ebenfalls beschrieben. Kombination dieser Methoden ermöglicht die Bestimmung, ob Immunzellen in der Peripherie aktiviert und proliferiert wurden, ob Immunzellen des ZNS eingegeben, und ob der CNS war protected von Entzündung oder Beschädigung. Wenn neuroprotektive Effekte trotz Auswirkungen auf das Immunsystem im Verdacht stehen, können Experimentatoren verändern Behandlungszeiten nach Immunzellinfiltration Start in das ZNS aufgetreten ist.
Hier stellen wir ein Protokoll unter Verwendung von zwei verschiedenen Modellen aktiver EAE, einem T-Zell-vermittelte Tiermodell der MS, und Zytometrie-Analyse mit Immunhistochemie zu verschiedenen Zeitpunkten während des Krankheits kombinierte Strömungs die Wirksamkeit von experimentellen Therapien, die auf verschiedene Aspekte der zu bestimmen, MS Pathogenese. Diese Methode wird den Forschern helfen, zwischen Auswirkungen auf die Immunzellproliferation und Infiltration gegen ZNS-Schutz bei der Differenzierung, so dass es leichter zu verengen, wie Drogen auf Pathogenese der Erkrankung handeln.
Protokoll
Die experimentellen Methoden Mäuse beinhalten, müssen mit einschlägigen institutionellen und gesetzlichen Bestimmungen entsprechen. Für die vorliegende Studie wurden Mäuse untergebracht und in Übereinstimmung mit National Institutes of Health und der University of Alabama in Birmingham Institutional Animal Care und Use Committee Richtlinien behandelt.
1. EAE Induktion und Scoring
- Induziert EAE in C57BL / 6 - Mäusen , 11-13 oder SJL - Mäuse 10,11 , wie zuvor beschrieben 13.
HINWEIS: Die Experimentatoren sollte ein Modell ideal für ihre Forschungsfrage wählen (siehe Diskussion für weitere Details). - Die Bilanz Partituren täglich , wie zuvor beschrieben 11 für jede Maus am Tag 7 beginnt nach Induktion. Vergleichen Sie die durchschnittlichen täglichen Scores über die Zeit zwischen den Behandlungsgruppen.
2. Behandlung
- Behandeln Sie EAE Mäuse vor Ausbruch der Krankheit zu bestimmen, ob die Behandlung Immunzellinfiltration oder Proliferation beeinflusst.
- Wählen Sie eine Behandlung, michthode der Lieferung, und die Häufigkeit der Behandlung, während die Blut-Hirn-Schranke, Halbwertszeit, und die Dosierung des Medikaments unter Berücksichtigung.
HINWEIS: EAE erhöht Barriere Permeabilität der Blut-Hirn und kann Medikamente das ZNS zu erreichen lassen, die bei gesunden Tieren nicht sonst in der Lage sein würde. Durchführung von Experimenten zur Dosis-Wirkungs-Kurven Blick auf EAE klinischen Scores können bei der Auswahl einer geeigneten Dosis des Arzneimittels helfen. Fahrzeugkontrollen sollten parallel zur medikamentösen Behandlung durchgeführt werden. Alternativ Knockout-Mäuse können mit littermates als Kontrollen verwendet werden. - Verwenden SJL oder C57BL / 6-Mäuse für dieses Experiment. Behandeln Mäuse früh nach EAE Induktion (Tag 7), vor Beginn der Symptome die gewählte Methode der Lieferung mit.
- Opfern und sezieren Mäuse auf Höhepunkt der Krankheit (ungefähr Tag 15), wie in Schritt 3.1 und dessen Unterschritte auf der Grundlage der höchsten klinischen Score Durchschnitt über die Zeit.
- Betragen Durchflusszytometrie auf Maus Rückenmark (wie in Schritt 3.2) von Immunzellen, um zu bestimmen infiltration des ZNS und auf Milzen (wie in Schritt 3.3) Immunzellproliferation in der Peripherie zu bestimmen. Auf separaten Mäusen Verhalten Immunhistochemie (wie in Schritt 4) Astrozyten und Mikroglia, und die Erhaltung der Myelin zu quantifizieren.
- Wählen Sie eine Behandlung, michthode der Lieferung, und die Häufigkeit der Behandlung, während die Blut-Hirn-Schranke, Halbwertszeit, und die Dosierung des Medikaments unter Berücksichtigung.
- Behandeln Sie EAE Mäuse nach Ausbruch der Krankheit zu bestimmen, ob die Behandlung des ZNS nach Immunzellinfiltration aufgetreten schützt.
- Wiederholen Sie Schritt 2.1.1.
- Verwenden SJL-Mäuse für dieses Experiment, da diese Mäuse messbarer Krankheit Remissionen aufweisen. Behandlung von Mäusen während der ersten Spitze in Erkrankung (oder, falls gewünscht, an der Spitze eines nachfolgenden Rückfall), wie durch das durchschnittliche klinischen Scores gemessen.
- Sacrifice Mäuse zu einem gewünschten Zeitpunkt post-EAE Induktion. Weil Infiltration bereits aufgetreten ist, kann es nicht sinnvoll sein, die Infiltration durch FACS-Analyse zu messen. Allerdings nehmen Rückenmark reaktive Gliose und Myelin zu bestimmen, zu quantifizieren, wenn es Schutz CNS trotz Immunzellinfiltration.
3. Durchflusscytometrieanalyse
- Präparation
- Etikett drei 15 ml konische Röhrchen (eine für Gehirn, eine für Rückenmark und eine für Milz) pro Tier mit dem Tier-ID und der Art des Gewebes enthalten. Halten Sie alle Gewebe in getrennten Röhren für das gesamte Verfahren auf Eis.
- Kohlendioxid mit einer Flussrate von etwa 15% Behältervolumen pro Minute für FACS-Analyse von Milzen, opfern Mäuse auf Höhepunkt der Krankheit (~ Tag 15 post-EAE Induktion) mit 2 - 3 Minuten. Bestätigen Sie die Euthanasie durch den Mangel an Atmung. Nach Opfer jeder Maus, entfernen Sie die Milz 14 und Platz zu einem individuellen, markierte 15 ml konischen Röhrchen (aus Schritt 3.1.1) mit eiskaltem RPMI mit 2% FCS, 100 IE Penicillin und 100 ug / ml Streptomycin ( bezeichnet als "Medien" in der gesamten protocol).
- Für die FACS-Analyse von Gehirn und Rückenmark, führen durch Herzperfusion die Maus des rechten Vorhofs mit chirurgischen Schere schneiden circulatin zu löseng Blut und Stechen des linken Ventrikels mit einer Nadel an einer Spritze mit 10 ml eiskaltem PBS gefüllt verbunden. die 10 ml PBS langsam injizieren.
- Schneiden Sie die Maus den Kopf ab und machen eine die Mittellinie der Kopfhaut mit einer chirurgischen Schere geschnitten. Schälen Sie die Haut mit der Hand zurück oder mit einer Pinzette und machen eine die Mittellinie des Schädels mit chirurgischen Schere zerschneiden, den Eintrittspunkt des Rückenmarks als Startplatz verwenden.
- Ziehen Sie den Schädel mit Mikropinzette entfernt und nutzen eine Kugel das Gehirn zu befreien. Legen Sie die Gehirne in markierte 15 ml konischen Röhrchen (aus Schritt 3.1.1), die Medien.
- Entfernen Sie die Haut der Maus mit einer Pinzette und chirurgische Scheren und Ausweiden der Maus chirurgische Schere. Schneiden Sie die Gliedmaßen, Schwanz, Rippen aus, und jede umgebende Muskel mit chirurgischen Schere, um die Wirbelsäule zu befreien.
- Schneiden Sie die Wirbelsäule in etwa 5 etwa gleich große Stücke mit chirurgischen Scheren und quetschen ein Ende aus einem Stück mit einem hemostat, und dann eine andere hemostat t verwendeno weiterhin quetschen, entlang dem Stück zu bewegen, bis das Rückenmark aus dem oberen quetscht. Wiederholen Sie diesen Vorgang für jedes Stück der Wirbelsäule und legen Sie die Kabel in einzelne, markierte 15 ml konischen Röhrchen (aus Schritt 3.1.1), die Medien.
- Bewertung der Immunzellinfiltration in Gehirn und Rückenmark
- Schneiden Sie Gehirn und Rückenmark in kleinere Stücke mit einer sterilen Schere. Crush mit dem Kolben aus einer 3 ml Spritze über einen 70 & mgr; m Zelle Sieb in eine neue 50-ml-Röhrchen, während das Sieb mit den Medien zu spülen. Bringen jedes Röhrchen in ein 50 ml Volumen mit Medien. Zentrifuge bei 453 × g für 5 min auf Pellet-Zellen.
- Absaugen Überstand und Pellet in 4 ml 40% Dichtegradientenmedien. Vorsichtig überlagern, die 40% Dichtegradienten-Zellen auf die Oberseite von 2 ml von 70% Dichtegradienten in einem neuen 15 ml konischen Röhrchen-Pipette sehr langsam an die Wand des konischen Rohrs enthält richtige Schichtung des Gradienten zu gewährleisten. Spin bei 796 xg für 20 min bei RT mitaus einer Bremse.
- Entfernen Sie vorsichtig in ein neues 15 ml konischen Röhrchen den oberen Myelinschicht aus dem Gradienten mit einer 1 ml Transferpipette, dann lebensfähige Zellen an der Grenzfläche mit einer 1 ml Transferpipette und Übertragung entfernt werden. Bringen Sie das Rohr auf 15 ml mit Medien und Zentrifuge bei 448 × g für 10 min.
- Pellet in 200 ul Medien aufnehmen und in eine Vertiefung einer 96-Well-Rundbodenplatte (jede Probe von jedem Tier wird in einen eigenen Brunnen gehen). Zentrifugieren Sie die Platte bei 410 xg für 5 min.
- Flick den Überstand und Pellet in 200 ul Restimulation Medien (RPMI, supplementiert mit 10% FCS, 100 IE / ml Penicillin, 100 ug / ml Streptomycin, 2 mM L-Glutamin, 1x nicht-essentiellen Aminosäuren aus, 1 mM Natriumpyruvat und 55 & mgr; M β-Mercaptoethanol, plus 50 ng / ml Phorbolmyristatacetat (PMA), 750 ng / ml Ionomycin, und das Protein Transport Inhibitor Brefeldin A). Die Platte wird in einem Inkubator bei 37 ° C für 4 Stunden.
HINWEIS: PMA und ionomycin Restimulation führt zur Aktivierung aller T-Lymphozyten-unabhängig von ihrer Antigenspezifität, um die Gesamtzahl der einzelnen T-Zell-Untergruppe in dem gegebenen Gewebe zu beurteilen. Jedoch kann antigenspezifischen Effektor - T - Zell - Reaktionen auf verschiedene Weise bewertet werden, einschließlich Zellen , die mit MOG - Peptid in Gegenwart von Brefeldin A 15,16 Restimulation. - Beurteilung von CNS CD4 + T - Zell - Phänotypen
- Nach der Inkubation Zentrifuge der 96-Well-Rundbodenplatte (aus Schritt 3.2.5), bei 410 xg für 5 min und der Überstand wegwedeln. Alle der folgenden Färbungsschritte werden in dieser Platte durchgeführt.
- Waschen Zellen in 200 ul PBS mit 2% FCS und Zentrifuge bei 410 × g für 5 min. Flick aus Überstand und inkubieren Zellen mit 200 ul PBS, enthaltend 2% FCS mit Fc-Block (Klon 2.4G2) 10 - 15 min auf Eis.
- Um die extrazelluläre Färbung, Zentrifuge Zellen bei 410 xg für 5 min, Flick off Überstand beginnen, und Pellet in 50 &# 956; l von Oberflächenflecken Cocktail mit Fluorophor markierten Antikörper gegen CD4 (1: 200, 1 & mgr; g / ml), TCR & bgr; (1: 200, 1 & mgr; g / ml), und die Lebensfähigkeit Farbstoff (1: 500) für 15 in PBS verdünnt min auf Eis. Centrifuge Zellen bei 410 xg für 5 min und Flick off Überstand. Wasche die Zellen 2x in 200 ul PBS dann für 5 min bei 410 xg zentrifugiert.
- Nach der extrazellulären Fleckenentfernung, initiieren die intrazelluläre Färbeverfahren durch Fixierung / Permeabilisierung durch die intrazelluläre Färbung gefolgt.
- Um zu beginnen, Flick aus Überstand und fixieren / Permeabilisierung Zellen mit Foxp3 Transkriptionsfaktor Färbereagenzien 17 (gemäß den Anweisungen des Herstellers, siehe Materialliste) für 30 min bis über Nacht bei 4 o C
- Wash-Zellen in 150 & mgr; l Permeabilisierung Puffer aus dem Kit und Zentrifugenplatte bei 410 xg für 5 min. Flick off Überstand und Flecken Zellen in 50 & mgr; l Puffer Permeabilisierung mit Fluorophor markierten-Antikörper gegen IL-17A (1200, 1 & mgr; g / ml), IFN-γ (1: 200, 1 & mgr; g / ml) und Foxp3 (1: 200, 2,5 & mgr; g / ml) für 30 min auf Eis in PBS verdünnt.
- Centrifuge Zellen bei 410 xg für 5 min und Flick off Überstand. Zum Entfernen überschüssigen Antikörper 3x waschen in 200 ul Permeabilisierung Puffer dann bei 410 · g zentrifugiert werden für 5 min. Flick off Überstand und resuspendieren in 200 ul PBS.
- Analysieren Sie die Zellen mittels Durchflusszytometrie, Gating auf Live - CD4 + TCR & bgr; + Zellen wie zuvor 11 beschrieben Prozentsatz der Zellen zu beurteilen , jedes Molekül exprimieren. Zähle die Zellen mit einem Hämozytometer 18 oder anderen validierten Methode unter Verwendung der Anzahl von Zellen pro Maus zu bestimmen , die mit jedem der CD4 + T - Zell - Phänotypen.
- Unter Verwendung der erhaltenen Daten, berechnen Prozentsatz und die Anzahl der CD4 + T - Zellen , die das Gehirn und das Rückenmark von jeder Maus infiltrieren, mit einem besonderen Fokus auf diese Populationen , die eine entscheidende Rolle bei EAE Pathogenese und Schutz spielen19: IL-17A + IFN-γ -, IL-17A + IFN-γ +, IL-17A - IFN-γ +, Foxp3 +.
- Beurteilung der peripheren T-Zell-Proliferation und Aktivierung
- Crush Milz mit Milchglasobjektträger in einem 60 x 15 mm Kulturschale. Platzieren Zellsuspension in einem 15 ml konischen Röhrchen Medien unter Verwendung von Zellen zu suspendieren. Füllrohr zu 15 ml mit Medium und zentrifugieren Zellen bei 448 xg für 5 min.
- Aspirat Medien und Pellet in 2 ml ACK Lyse bei RT Puffer für etwa 3 min roten Blutkörperchen zu lysieren.
- Bringen Rohr 15 ml Volumen mit Medien und Dehnung über einen 70 & mgr; m Zellsieb in ein neues Röhrchen. Zentrifuge Zellen bei 448 xg für 5 min, Überstand absaugen und Resuspension in 2 ml Medium.
- Beurteilung der peripheren CD4 + T - Zellproliferation von Ki-67 - Färbung
- Legen Sie eine kleine Teilmenge (typischerweise 200 ul) equivalent Anzahlen von Splenozyten aus 3.3.3 in einzelne Vertiefungen (eine pro Probe) in einer 96-Well-Rundbodenplatte.
- Zentrifuge bei 410 xg für 5 min und Flick off Überstand. Resuspendieren in 200 ul PBS mit 2% FCS und wiederholen Zentrifugation. Flick off Überstand und resuspendieren Zellen mit PBS, enthaltend 2% FCS mit Fc-Block (Klon 2.4G2) und Inkubation für 10 bis 15 Minuten auf Eis. Für extrazellulären Fleck wiederholen Sie Schritt 3.2.6.3.
- Nach der extrazellulären Fleckenentfernung, initiieren die intrazelluläre Färbeverfahren durch Fixierung / Permeabilisierung durch die intrazelluläre Färbung gefolgt.
- Wiederholen Sie Schritt 3.2.6.4.1.
- Centrifuge Zellen bei 410 xg für 5 min und Flick off Überstand. Wasche die Zellen 1x in 200 ul Permeabilisierung Puffer aus dem Kit und Zentrifuge bei 410 × g für 5 min. Flick off Überstand und Flecken Zellen in 50 & mgr; l Puffer Permeabilisierung mit Anti-Ki-67-Antikörper (1: 200, 1 & mgr; g / ml) für 30 min.
- Centrifuge Zellen bei 410 · g for 5 min und Flick off Überstand. Wasche die Zellen 2x in 200 ul Permeabilisierung Puffer aus dem Kit und Zentrifuge bei 410 × g für 5 min.
- Flick aus Überstand und waschen Sie die Zellen 1x in 200 ul PBS und Zentrifuge bei 410 xg für 5 min. Analysieren Sie die Zellen mittels Durchflusszytometrie, Gating auf Live - CD4 + TCR & bgr; + Zellen wie zuvor 11 beschrieben, dann Prozent Ki-67 + Zellen beurteilen.
- Beurteilung der peripheren CD4 + T - Zell - Phänotypen
- Platzieren 200 ul Zellen (aus Schritt 3.3.3) in einer 96-Well-Rundbodenplatte (eine Vertiefung pro Probe) und Zentrifuge bei 410 × g für 5 min und erneut zu stimulieren, wie in 3.2.5.
- Legen Sie die Platte in einem Inkubator bei 37 ° C für 4 Stunden. Führen die gleiche Färbeverfahren wie in Schritt 3.2.6 und dessen Unterschritten. Analysieren Sie die Zellen mittels Durchflusszytometrie als in 3.2.6.4.4-3.2.6.5.5.
4. Immunhistochemie eind Quantifizierung
- Gewebepräparation
- Sacrifice EAE Mäuse in einem separaten Experiment von den in dem Schritt 3 und deren Teilschritte an jedem beliebigen Punkt nach EAE Induktion (oft ~ Tag 30, während der chronischen Phase der Krankheit für C57Bl / 6-Mäuse oder während einer Spitze im Durchschnitt klinischen Scores für SJL-Mäuse) in den folgenden Schritten Ausmaß der reaktiven Gliose und Demyelinisierung zu bestimmen.
- Anesthetize Mäuse mit 2,5% Isofluran und 97,5% Sauerstoff und bestätigen entsprechende Tiefe der Anästhesie mit einer sanften Zehe Prise Pinzette, für einen Mangel an Antwort suchen. Führen Sie transcardiac Perfusion, wie in Schritt 3.1.3 beschrieben. PBS in den linken Ventrikel, verwenden Sie eine neue Spritze zu injizieren 10 ml 4% Paraformaldehyd in PBS VORSICHT Nach der Injektion. Paraformaldehyd ist eine Haut und Lunge reizend, kann zu schweren Schäden an den Augen, und Verdacht , krebserregend. Vermeiden Sie das Einatmen, Verschlucken und Kontakt mit Haut und Augen. Perfusion sollte in einem Abzug durchgeführt werden.
- Entfernen Sie Gehirne und Wirbelsäulen wie in den Schritten 3.1.4 - 3.1.6. Binden Sie Wirbelsäulen zu Sticks mit einer Schnur gerade Ausrichtung des Rückenmarks zu gewährleisten.
- Setzen Sie Gehirne in Szintillationsgefäße mit der ID des Tieres, markiert mit etwa 20 ml 4% Paraformaldehyd in PBS und Rückenmark in 50 ml konische Röhrchen mit der ID des Tieres, markiert mit etwa 50 ml 4% Paraformaldehyd in PBS über Nacht post beheben.
- Um cryoprotect Gehirne, spülen Sie 3 - mal in 1x PBS und lagern bei 4 ° C in 30% Saccharose in 1x PBS. Lassen Sie die Gehirne auf den Boden ihrer Behälter (ca. 3 Tage) fallen zu lassen.
- Entfernen von Calcium aus der Wirbelsäule durch 3 mal in 1x PBS gespült und in einem großen Volumen (etwa 50 ml für eine Maus Rückenmark) von 0,5 M EDTA in 1x PBS Plazieren (pH beginnend wird ~ 10; pH auf ~ 7,8 mit 6 N HCl) für 2 - 3 Wochen, bis der Knochen nicht mehr starr. Cryoprotect die Wirbelsäule Schritt 4.1.5 folgen.
- Einbetten Gehirne undWirbelsäulen in OCT folgenden Teilschritte unten, sobald sie auf den Boden ihrer Behälter fallen.
- Machen Sie eine Mischung aus 1 Teil 30% Saccharose in 1x PBS und 2 Teile OCT (zum Beispiel 15 ml 30% Saccharose in 1x PBS auf 30 ml OCT).
- In Oktober / Saccharose-Gemisch in die Einbettform (22 x 22 x 20 mm für Köpfe und 22 x 30 x 20 mm für Rückenmark), bis sie etwa ½ voll ist.
- Schneiden Sie Wirbelsäulen in 6 gleich große Stücke mit einer Rasierklinge und in einen 22 x 30 x 20 mm Einbettform nach vorn für Koronalschnitte Rückenmark gegenüber. Legen Sie ganze Gehirne in 22 x 22 x 20 mm Formen nach vorne.
- In Oktober / Saccharose-Gemisch, das Gewebe zu bedecken und lassen Sie es für 1 Stunde sitzen. so können Blasen entweichen. Während dieser Stunde, fügen 2-Methyl zu einem Gericht, das Einbetten von Formen für Flash-Einfrieren halten kann. Die Schale auf Trockeneis und decken vorzukühlen.
- Flash - gefrieren die Form in 2-Methyl auf Trockeneis und bei -80 o C innerhalb von acontainer Austrocknung zu verhindern.
- Wenn Sie bereit sind, Gewebeschnitt bei 16 & mgr; m mit einem Kryostaten und montieren Sie an elektrostatisch geladene Objektträger. Legen Sie alle 10 th Abschnitt auf einer Folie jeweils für Gehirn und Rückenmark (zum Beispiel schieben 1 1 Abschnitte haben, 11 und 21, und 2 gleiten haben Abschnitte 2, 12 und 22, und so weiter). Shop gleitet bei -80 o C oder sofort verwenden für die Färbung.
- Die Färbung für reaktive Gliose und Myelin
- Wenn Sie bereit sind für die Färbung, wählen Sie eine Dia jedes für Gehirn und Rückenmark pro Fleck für jedes Tier in der gleichen (oder so ähnlich wie möglich) Region. Für das Gehirn, wählen Sie gleitet das Corpus callosum und Cingulum Bündel zeigt.
- Objektträger mit Gewebe auf einem Heizblock bei 70 ° C für 7 min. Nach 7 min den Wärmeblock auszuschalten und lassen Sie die Folien auf dem Heizblock abkühlen für eine weitere 10 bis 15 min. Dies wird Gewebeschnitte von Abfallen die Folien während der Färbung verhindern.
- Wasch gleitet je 3 mal in 1x PBS mit 0,1% nicht-ionisches Detergens (für die intrazelluläre Antigene) oder 1x PBS (auf Antikörper-Targeting-Oberflächenantigene) für 5 min.
HINWEIS: Da die Antikörper in diesem Protokoll verwendet intrazellulär sind, werden nichtionische Detergentien in den nachfolgenden Schritten verwendet werden. Lassen Sie niemals Folien vollständig nach diesem Schritt, um zu trocknen. - Die Objektträger in einem Behälter und Deckel mit Citratpuffer pH 3,0. Zu machen Citratpuffer, fügen 0,192 g wasserfreie Zitronensäure bis zu einem Endvolumen von 100 ml in Wasser. Der pH-Wert mit Essigsäure, wenn pH-Wert über 3,0 oder NaOH, wenn unten.
- Inkubiere Objektträger bei 37 ° C für 30 min und wäscht 3 mal in 1x PBS mit 0,1% nichtionisches Detergens für 5 min.
- Kreis ein Bereich um das Gewebe mit einer hydrophoben Barriere Stift und Objektträger in einer feuchten Kammer (zum Beispiel ein Gleitkastens nasse Papiertücher enthält). Hinzufügen Puffer zum Gewebe zu blockieren. Inkubieren für 30 min bei RT.
HINWEIS: Blockierungspuffer besteht aus 1x PBSplus 0,3% nicht - ionisches Detergens und die entsprechende Serum (5%) , basierend auf dem Host des sekundären Antikörpers, dh Pferdeserum für basisches Myelinprotein (MBP) und glial fibrillary acidic protein (GFAP) und Ziegenserum für Iba1. - Flick puffern off Blockierung der Folien und fügen primären Antikörper (1: 1,000 oder 0,2 & mgr; g / ml Ziege-anti-basisches Myelinprotein für Oligodendrocyten, 1: 1000 oder 1 ug / ml bis 3 & mgr; g / ml Maus-Anti-GFAP für Astrozyten oder 1 : 750 oder anti-Iba1 für Mikroglia 0,67 ug / ml Kaninchen) in dem entsprechenden Blockierungspuffer verdünnt (Schritt 4.2.6) an den eingekreisten Bereich zu sehen. Lassen Sie bei 4 ° C über Nacht in der feuchten Kammer.
- Flick-Antikörper in die Blockierung der Dias und waschen Sie die Folien 3-mal in 1x PBS mit 0,1% nicht-ionische Waschmittel für 5 min Puffer ab.
- Hinzufügen sekundärem Antikörper (1: 200 oder 7,5 & mgr; g / ml biotinyliertem Pferde-anti-Maus für MBP und GFAP oder biotinyliertem Ziege-anti-Kaninchen für Iba1) in dem entsprechenden Blockierungspuffer verdünnt (siehe step 4.2.6) an den eingekreisten Bereich und lassen gleitet in der befeuchteten Kammer für 1 Stunde bei RT inkubiert.
- Flick-Antikörper in die Blockierung der Dias und waschen Sie die Folien 3-mal in 1x PBS mit 0,1% nicht-ionische Waschmittel für 5 min Puffer ab.
- Bereiten Sie Avidin-Biotin-Peroxidase-Komplex (ABC) in Immunperoxidase (siehe Materialliste) 30 min vor dem Gebrauch und agitieren auf einem Schüttler bis in 4.2.12 benötigt. Zugabe von 0,3% H 2 O 2 in Methanol in den eingekreisten Bereich für 10 min endogene Peroxidase - Aktivität zu quenchen.
- Flick-Lösung aus den Folien und waschen in 2-mal in 1x PBS oder 1x PBS mit 0,1% nicht-ionische Waschmittel für 5 Minuten, dann 1 Mal in 1x PBS. Hinzufügen ABC Reagenz zum eingekreisten Bereich für 30 min.
- Flick-Lösung aus den Folien und wasche 3mal in 1x PBS für 5 min und dann 2-mal in Wasser für 5 min. Machen Sie 3,3'-Diaminobenzidin (DAB) -Lösung (siehe Materialliste) und fügen Sie die Abschnitte zu bedecken.
HINWEIS: Dieser Schritt erfordert ein Mikroskop optimal zu beobachten, erkennenIonen Zeit der Färbung und muss für die gleiche Zeit für Dias im Vergleich zu erfolgen. - Wasch gleitet 3 Mal in Wasser für jeweils 5 Minuten. 70% Ethanol in Wasser, 95% Ethanol in Wasser, 100% Ethanol in Wasser, 50% Xylole und 50% Ethanol, 100% Xylole: jedes entwässern das Gewebe von 2 min in den folgenden Lösungen stellen. Siegel ein Deckglas auf dem Objektträger mit einem harzigen Eindeckmediums.
- Alternativ Immunfluoreszenzanfärbung auszuführen , wie zuvor 11 beschriebenen reaktiven Gliose zu bewerten Antikörper gegen Iba-1 und GFAP verwenden.
- Nehmen Sie Bilder von jedem Rückenmark Abschnitt (gefärbt mit entsprechenden Antikörpern DAB) mit einem 4X, 0,13 NA-Objektiv und speichern Sie die Bilder als Tiff. Alternativ dazu können Sie Bilder des Corpus callosum und Cingulum Bündel in der linken oder rechten Gehirnhälfte ein 20X, 0,50 NA-Objektiv verwendet und die Bilder als TIFF speichern. Für eine umfassendere Bestimmung der Läsion Last im Gehirn, ist es vorteilhaft, sowohl hemispher einzubeziehenes in Analysen.
- Mess mittlere Fraktion Bereich für reaktive Gliose (Iba1 und GFAP-Färbung)
- Download von NIH ImageJ (http://imagej.nih.gov/ij/) und offen auf einem Computer. Auf ImageJ Software, verwenden Sie das Menü String Datei> Öffnen und wählen Sie ein Bild aus dem Schritt 4.2.16. Zeichnen Sie einen Bereich der "Polygon Auswahl" Werkzeug in der Menüleiste. den gesamten Abschnitt Für Rückenmark, Spuren; für Gehirne, das Corpus callosum und Cingulum Bündel. Wandeln Sie das Bild auf 16-Bit, indem Sie auf Bild> Typ und einem Klick auf "16-Bit".
- De-Rauschen das Bild durch zu Prozess in Gang> subtrahieren Hintergrund und stellen Sie die "Rollkugelradius" , um zumindest die Größe des größten Objekt , das nicht Teil des Hintergrundes ist (siehe ImageJ Benutzerhandbuch unter http: //rsbweb.nih gov / ij / docs / guide / 146-29.html).
HINWEIS: Für eine 4X Bild von Iba-1-Färbung verwenden wir 4.0 und für GFAP verwenden wir 50,0, aber diese Zahlen können je nach Bildvergrößerung und Färbung int abhängigichte. - Check "Sliding paraboloid" und klicken Sie auf "OK". Zum Bild> Anpassen> Schwellenwert ... und stellen Sie den unteren Schwellenwert (die obere Leiste) unter Verwendung der Gleitschienen. Fügen Sie Färbung nur, dass ist es, zelluläre und über Bilder konsistent sein. Bei Bildern mit dunklen Hintergründen (gilt für Fluoreszenzfärbung nur), stellen Sie sicher, dass die "Dark Hintergrund" aktiviert ist.
- Zum Analysieren> Set Messungen ... und wählen Sie "Area-Fraktion" (gibt den Prozentsatz der schwellen Bereich innerhalb der Region von Interesse). Stellen Sie sicher, dass "Beschränken auf Schwelle" deaktiviert und "Display Label" aktiviert ist. Klicken Sie auf "OK", wenn Sie fertig sind.
- Um Messungen zu erhalten, gehen Sie zu analysieren> Messen. A "Ergebnisse" Popup-Fenster erscheint und diese Daten können gespeichert werden, wie, oder in ein anderes Programm kopiert. Für die Analyse, zu vergleichen, "Area-Fraktion" Werte zwischen den Behandlungsgruppen.
- Die Quantifizierung der MBP-Färbung durch optische Dichte
- Bild öffnen und einen Bereich von Interesse ziehen, wie in Schritt 4.3.1 beschrieben. Zum Analysieren> Set Messungen ... und wählen Sie "Mittlerer Grauwert" (die Summe der Grauwerte innerhalb der Auswahl durch die Anzahl der Pixel unterteilt). Stellen Sie sicher, dass "Beschränken auf Schwelle" deaktiviert und "Display Label" aktiviert ist. Klicken Sie auf "OK", wenn Sie fertig sind.
- Um Messungen zu erhalten, gehen Sie zu analysieren> Messen. Beachten Sie ein "Ergebnisse" Popup-Fenster angezeigt. Kopieren Sie diese Daten und speichern wie oder kopieren Sie in ein anderes Programm.
- Für die Analyse, Kopieren und Einfügen von Werten in ein anderes Programm. Konvertieren mittleren Grauwert in der optischen Dichte (OD) unter Verwendung der Formel: OD = log 10 (255 / mittlere Grauwert).
Ergebnisse
Hier verwendeten wir zwei Modelle von EAE zu verstehen, wenn ein pharmakologisches Mittel CNS bietet Schutz durch die entweder mildernden ZNS-infiltrierenden T-Zellen oder Verhinderung von Myelin und axonalen Schädigung während der Angriff der entzündlichen Immunzellinfiltration. Zu bestimmen , ob ein therapeutisches Mittel , Immunzellinfiltration in das Rückenmark verhindert wird der C57BL / 6 - Maus - Modell der chronischen EAE verwendet , bei denen Immunzellinfiltration und Krankheitspathologie überwiegend im Rückenmark (1A) befindet. Um zu bestimmen , ob ein therapeutisches Arzneimittel Schutz CNS stellt während des Eindringens von Immunzellen in das ZNS, das SJL Tiermodell der rezidivierend-remittierenden EAE verwendet, die in Krankheitspathologie zeigt sowohl das Gehirn und Rückenmark (1B).
Klinische Assessments
Relevante klinische Beurteilungen werden nach der folgenden Rubrik für typische hergestellt (Abbildung 1C) oder atypische (1D) EAE. Für typische klinische Erkrankung, eine Punktzahl von 0 ist kein abnormales Verhalten. Wenn sie durch die Basis des Schwanzes aufgenommen, kann der Schwanz schnell drehen (ähnlich wie bei einem Hubschrauber-Rotor) und die Hinterbeine gespreizt wird. Eine klinische Bewertung von 1 ist eine teilweise schlaffer Schwanz, der durch die Basis des Schwanzes durch Anheben der Maus bestimmt werden kann. Der normale Hubschrauber artige Dreh geschwächt sein oder fehlen, und ein Teil des Schwanzes kann völlig schlaff sein. Ein hilfreicher Weg Ausmaß der Schwanzlähmung zu bestimmen, ist ein Finger, um die Länge des Schwanzes zu laufen, als ein unparalyzed Schwanz in der Regel um den Finger, während eine teilweise gelähmt Schwanz zu tun, wird nicht in der Lage locken wird. Eine klinische Score von 2 stellt eine völlig gelähmt Schwanz. Keine Bewegung des Schwanzes tritt überhaupt, wenn die Maus nach oben an der Basis des Schwanzes Kommissionierung. Eine klinische Score von 3 stellt teilweise Lähmung der hinteren Gliedmaßen. Die Bestimmung dieser Partitur erfordert, dass die Maus auf einem fla zu bewegen frei seint Oberfläche. Wenn ein Hinterbein ziehen wird wie bewegt sich die Maus nach vorne, oder wenn eine oder beide Hinterbeine teilweise gelähmt zu sein scheinen, eine Punktzahl von 3 gegeben werden kann. Eine klinische Bewertung von 4 stellt vollständige Lähmung der hinteren Gliedmaßen. Mit dieser Punktzahl wird eine Maus nicht in der Lage sein, seine Hinterbeine zu bewegen und wird sich ziehen vorwärts seine vorderen Gliedmaßen mit. Eine klinische Bewertung von 5 eine moribund Maus oder eine Maus mit Schwierigkeiten selbst in seinem Käfig oder Atmung bewegen. Wenn eine Maus sich nicht entlang dem Boden des Käfigs oder wenn seine Atmung gearbeitet ziehen, sollte die Maus euthanasiert artgerecht werden. Eine klinische Score von 6 eine Maus in seinem Käfig tot aufgefunden. Eine Punktzahl von 6 ist ungewöhnlich und Todesursachen andere als EAE untersucht werden sollten.
Atypische klinische Erkrankung kann oder auch nicht durch Lähmung begleitet werden. Es kann notwendig sein, zwei getrennte Scoring-Systeme zu schließen, wenn eine Maus mit atypischen Krankheit sowie typische Symptome präsentiert. Eine Punktzahl von 0 ist kein abnormales Verhalten, eins mit dem typischen Scoring-System. Eine klinische Bewertung von 1 entspricht einem leichten Kopf zu drehen oder kippen, während die Maus ist zu Fuß. Dies kann, indem man die Maus bestimmt werden nach vorne zu gehen und einen konstanten links oder rechts Direktionalität zu seiner Bewegung zu beobachten. Eine klinische Score von 2 stellt eine ausgeprägtere Kopf drehen und schlechte aufrichtende Fähigkeit. Wie bei einer atypischen Punktzahl von 1, hat die Maus, um seine Bewegung Direktionalität und leichte Schwierigkeiten mit dem Gleichgewicht haben. Eine klinische Score von 3 stellt eine Unfähigkeit, in einer geraden Linie zu gehen. Die Maus wird Schwierigkeiten haben, balancieren und die Seite des Käfigs verwenden kann Recht, sich zu helfen, wie es geht. Eine klinische Bewertung von 4 stellt eine Maus auf die Seite legen, lässt sich aufgrund von Balancing Probleme zu gehen. Die Maus kann in der Lage sein, sich des Käfigs entlang des Bodens zu ziehen, aber Direktionalität zu seiner Bewegung haben kann. Eine klinische Bewertung von 5 für ein kontinuierliches Walzen, es sei denn unterstützt. Eine Maus, die diese Punktzahl erreicht werden soll artgerecht eingeschläfert. Eine Klinikal-Score von 6 eine Maus in seinem Käfig tot aufgefunden. Eine Punktzahl von 6 ist ungewöhnlich und Todesursachen andere als EAE untersucht werden sollten.
Es kann notwendig sein , für "in-between" Partituren zu ermöglichen, beispielsweise die Zugabe von 0,5 auf eine Punktzahl , wenn eine Bedingung der Maus leicht ändert oder wenn zwischen zwei Noten die Wahl schwierig ist. Zum Beispiel, dass eine Maus langsamer als ihre normalen Gegenstücke zu bewegen, mehr beginnt, zeigt aber keine Lähmung, oder eine Maus, die die Hinterpfoten mit seiner vorderen umklammert, anstatt Spreizen seine Beine aus, wenn sie vom Schwanz abgeholt kann eine Punktzahl von 0,5 gegeben werden . Eine Maus, die sich nur ziehen entlang dem Boden des Käfigs und ist nur in der Lage seine Hinterbeine periodisch twitch oder bei Berührung eine Punktzahl von 3,5 gegeben werden.
Die Beurteilung einer Verringerung der Immunzellinfiltration
Nach der Induktion von EAE in C57BL / 6 - Mausmodell (1A, Tag 0), Antigen presentatitreten auf und die Proliferation von T-Zellen in der Milz an den Tagen 1 bis 5, gefolgt von Immunzellinfiltration in das ZNS um den Tag 7. Etwa 3 bis 5 Tage nach der ersten Immunzellinfiltration Mäusen vorhanden mit klinischen Scores. Zu beurteilen, ob ein therapeutisches Mittel ist immun-Zell-Infiltration in das Rückenmark zu blockieren, Drogen oder Vehikel werden am Tag 7 nach der Antigenpräsentation und der Proliferation in den Milzen eingeführt, aber bevor Immunzellen beginnen, in das Rückenmark zu infiltrieren. Wenn Immunzellinfiltration gedämpft wurde, sollte die klinische Krankheitsverlauf verbesserte klinische Scores reflektieren während der Anstiegsphase der Krankheit von Tag 10 bis 15 (Abbildung 2).
Eine Verringerung der Immunzellinfiltration würde auch dazu führen, verminderte neuroinflammation. Reaktive Astrozytose und Mikrogliose sind wichtige Merkmale für neuroinflammation betrachtet. Die Färbung für Astrozyten mit GFAP und Mikroglia mit Iba-1 kann dann verwendet werden, chang zu bewertenes in der mittleren Flächenanteil Färbung neuroinflammation (Figur 3) zu quantifizieren.
Zu bestimmen , ob Immunzellinfiltration reduziert wird, werden die Rückenmark entfernt und für die Durchflusszytometrie - Analyse auf dem Höhepunkt der Krankheit verarbeitet (1A, etwa Tag 18). Dies stellt sicher, dass die größte Anzahl von Immunzellen in das Rückenmark eingetreten sind. Eingang von T-Zellen in das ZNS ist der initiierende Entzündungsereignis betrachtet und beide Th1 und Th17 Zellen werden in Tiermodellen von EAE und MS-Patienten gefunden. Zusammengenommen durchflusszytometrischen Analyse sollte Beurteilung der beiden Arten von pathogenen T-Zellen umfassen. Darüber hinaus sind Tregs gut charakterisierte Suppressor-T-Zellen, die Krankheit zu dämpfen. Daher muss der Prozentsatz des Treg von insgesamt CD4 + Population im Vergleich zu dem Prozentsatz der Effektor - T - Zellpopulationen werden ausgewertet. Dies wird zeigen, ob eine allgemeine Verringerung der T-Zell-Infiltration aufgetreten ist oder wenn there ist eine Schiefstellung der T-Zell-Phänotypen im ZNS. Repräsentative Dot - Plots (4A) zeigen eine Verringerung der Gesamtzahl der CD4 + T - Zellen in das Rückenmark von mit Medikamenten behandelten Mäuse im Vergleich mit dem Rückenmark von Fahrzeug-behandelten Mäusen (Zahlen in der rechten oberen Quadranten) infiltriert. Auszuwerten Th1, Th17 und Treg - Zellen folgende Signatur Proteine bewertet werden: IFN-γ +, IL-17 + und Foxp3 + bzw. und sollte (4A) reduziert werden. Die statistische Analyse sollte auf CD4 +, IFN-γ +, IL-17 + und Foxp3 + Zellzahlen durchgeführt werden , eine signifikante Reduktion (4B) zu demonstrieren. Um eine Schiefstellung der T - Zelluntergruppen, die statistische Auswertung des Anteils an IFN-γ ausschließen + IL-17 + IFN-γ + IL-17 -, IL-17 + IFN-γ - und Foxp3 + Zellen durchgeführt ( FiAbbildung 4C).
Um die Möglichkeit auszuschließen, dass eine Reduktion der CNS-infiltrierenden T-Zellen ist eine Folge der Hemmung der Proliferation, Aktivierung und Differenzierung in der Peripherie, die Anzahl der T-Zellen zusätzlich zu dem Anteil der T-Zell-Subtypen aktiv proliferierenden muss ausgewertet werden. Keine Veränderung des Anteils der CD4 +, IFN-γ +, IL-17 + oder Foxp3 + gefunden werden sollte , wenn die Aktivierung und Differenzierung sind nicht betroffen (5A). Darüber hinaus sollte keine Änderung in Ki67 + CD4 + Zellen gefunden werden , wenn die Proliferation unbeeinflußt ist (5B). Drug Behandlungen werden am Tag 7 eingeführt oder später anfängliche Antigenpräsentation und T-Zell-Aktivierung in der Peripherie zu verändern zu vermeiden. Allerdings sind in der genetischen Modelle Proteine oft konstitutiv während der Embryonalentwicklung oder induziert vor der Induktion von EAE machen Splenozyten- asse gelöschtssment von hoher Bedeutung.
Die Beurteilung CNS Schutz
Um zu zeigen, wenn ein bestimmtes therapeutisches Mittel Krankheitspathologie im ZNS nach Immunzellinfiltration moduliert, medikamentöser Interventionen sollten während der ersten Spitze in der klinischen Erkrankung Scoring verabreicht werden. Die SJL Modell der EAE ist für diese Experimente vorteilhaft, da diese Mäuse eine rezidivierende-remittierende Phänotyp aufweisen. Wenn eine medikamentöse Behandlung Myelin-Axon - Degeneration verhindert, wird eine Verbesserung der klinischen Scores beobachtet werden (Abbildung 6). Pathologische Beurteilung von Myelin muss eine Verringerung der Myelinschädigung im Einklang mit verbesserten klinischen Scores untermauern. Quantitativ myelin Integrität, DAB - Färbung von basischem Myelinprotein (MBP) durchgeführt wird , gefolgt von einer statistischen Analyse der optischen Dichte für diesen Färbung (Abbildung 7) auszuwerten. Um diese neuroinflammation untermauern wird aufrechterhalten oder verringert durch therapeUTIC Eingriffe, reaktive Gliose kann durch Messen mittlere Bruchbereich für reaktive Gliose untersucht werden , wie oben (Figur 3) beschrieben. Um untermauern, dass eine therapeutische Intervention direkt ohne immunmodulatorische Effekte auf das ZNS zu schützen, Dämpfung der Immunzellinfiltration in das ZNS und die Proliferation in den Milzen muss ausgeschlossen werden. Um dem abzuhelfen, sollten wie oben beschrieben durchgeführt werden Methoden zum Gehirn und Rückenmark Beurteilung der Immunzellinfiltration und Beurteilung der peripheren T - Zell - Proliferation und Aktivierung (4 und 5). Zusammengenommen therapeutische Mittel, die ohne Anzeichen einer Reduktionszelle Verletzung im ZNS blockieren in CNS-infiltrierenden T-Zellen oder Proliferation von T-Zellen in der Peripherie sind CNS-Schutzbehandlungen.
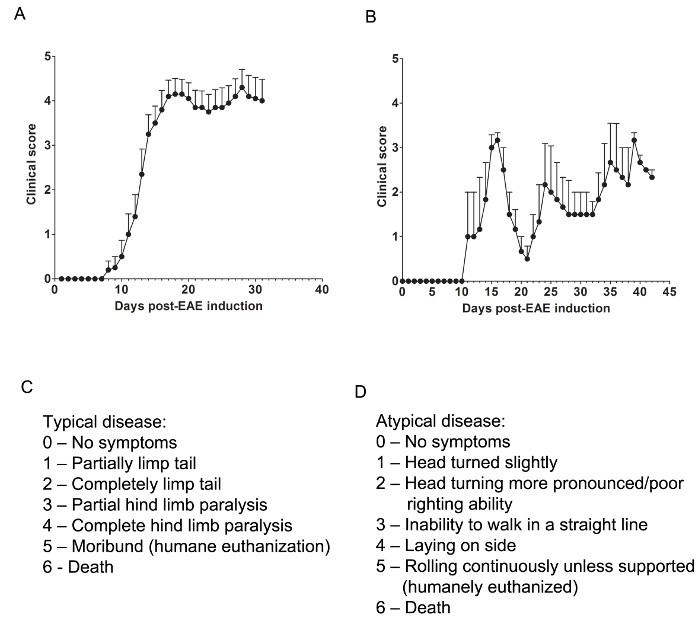
Abbildung 1. Repräsentative ResuLTS von klinischen Scores von EAE in C57BL / 6 und SJL Mäuse. (A) Klinische Scores (Mittelwert ± SEM) von C57BL / 6 - Mäuse (n = 10) induziert mit MOG 35-55 EAE mit einer chronischen Krankheit zu erzeugen. (B) Klinische Scores (Mittelwert ± SEM) von SJL - Mäusen (n = 3) induziert mit PLP 139-151 EAE zu produzieren mit rezidivierend-remittierender Krankheit. (C) Die klinische Scoring Rubrik verwendet in EAE Mäuse typischen Krankheitsverlauf zu verfolgen. (D) Die klinische Scoring Rubrik verwendet , um in EAE Mäuse atypische Krankheitsverlauf zu verfolgen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
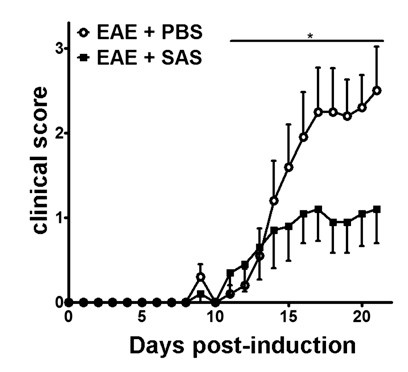
Abbildung 2. Pharmakologische Behandlung vor der Immunzellinfiltration in C57BL / 6 - Mäuse mit EAE. Klinische Scores (Mittelwert ± SEM) von C57BL / 6 - Mäuse , die mit PBS behandelt wurden (n = 20) oder SAS (n = 19) von 35 bis 55 mit MOG Tag 7 der Immunisierung. Die Daten stammen aus drei gepoolten unabhängigen Experimenten. Die statistische Differenz bestimmt eine nichtparametrischer zweiseitigen Mann-Whitney-U-Test, * p <0,05 verwendet. Neudruck mit freundlicher Genehmigung aus (11).
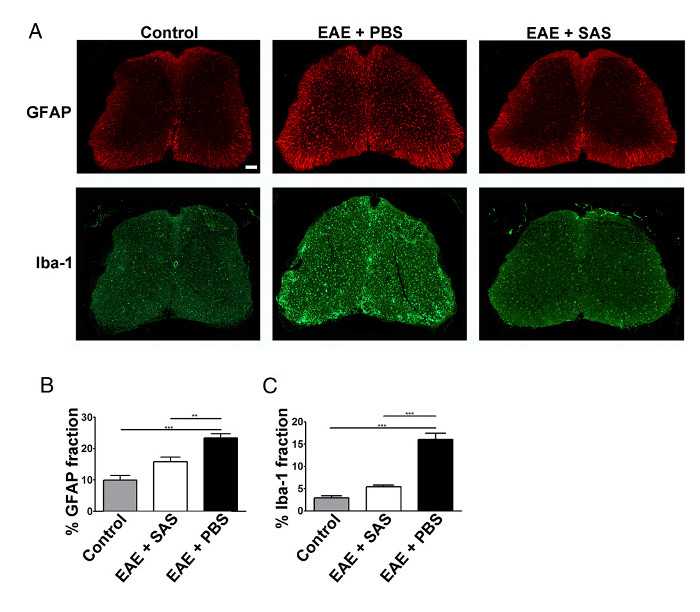
Abbildung 3. Immunfluoreszenzanfärbung und Quantifizierung von reaktiven Gliose in Rückenmark von Kontrolle, EAE und behandelte C57BL / 6 - Mäuse. (A) Fluoreszenzmarkierung für GFAP (Astrozyten) und Iba-1 (Mikroglia) im Rückenmark der Kontrolle (nicht - immunisierten ) Mäuse (linke Felder) und EAE Mäuse mit PBS (mittlere Panels) oder SAS (rechte Felder) behandelt. Maßstabsbalken = 100 & mgr; m. Die Quantifizierung der Färbung wurde mit der Flächenanteil Technik bestimmt zu messen Prozent immunopositive Bereich für GFAP (B) und Iba-1 (C). Mittelwert ± SEM, n = 3 Kontrolle, n = 3 SAS-behandelt, oder n = 4 PBS-behandelten Mäusen, 6 Abschnitte pro Maus. Statistische Unterschiede wurden unter Verwendung eines Einweg-ANOVA bestimmt, * p <0,05, ** p <0,01, *** p <0,001. Re-Print mit freundlicher Genehmigung aus (11). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
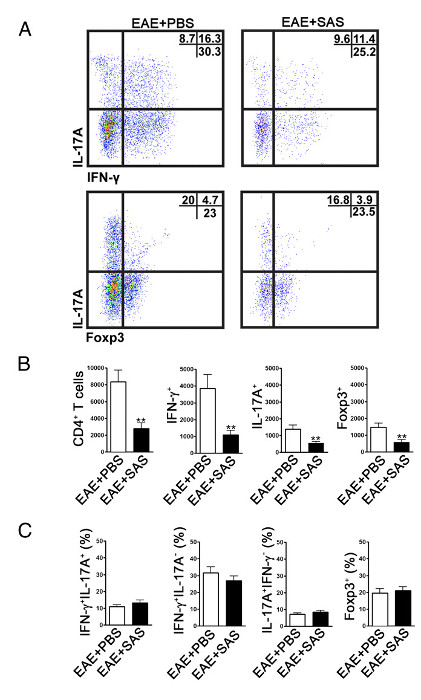
Abbildung 4. FACS Analyse von EAE C57BL / 6 - Maus Spinal Cords Demonstrieren Reduzierte T - Zell - Infiltration in behandelten Mäusen. C57BL / 6 - Mäuse wurden mit SAS oder PBS behandelt, beginnend 7 d postinduction von EAE. Das Rückenmark wurde am Tag erhalten 15 (A) Repräsentative Dot - Plots zeigen Th1 (IFN-γ + / IL-17 -) und Th17 (IFN-γ- / IL-17 +) Zellen in CD4 + Gate (obere Felder) und regulatorischen T - Zellen (Foxp3 +) (untere Tafeln). Dot Plots zeigen Prozentsätze in der rechten oberen Quadranten. (B) Absolute Zahlen der CD4 + Zellen als auch IFN-γ +, IL-17A + und Foxp3 + Zellen wurden statistisch analysiert. (C) Die Veränderung in Prozent der T - Zell - Populationen zwischen SAS- und PBS-behandelten Mäusen EAE wurde ebenfalls untersucht. Mittelwert ± SEM, n = 10 für PBS behandelt und n = 9 für SAS behandelt aus zwei unabhängigen Experimenten. Zwei-tailed t-Test wurde für alle Balkendiagramme verwendet. ** P <0,01. Re-Print mit freundlicher Genehmigung aus (11). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
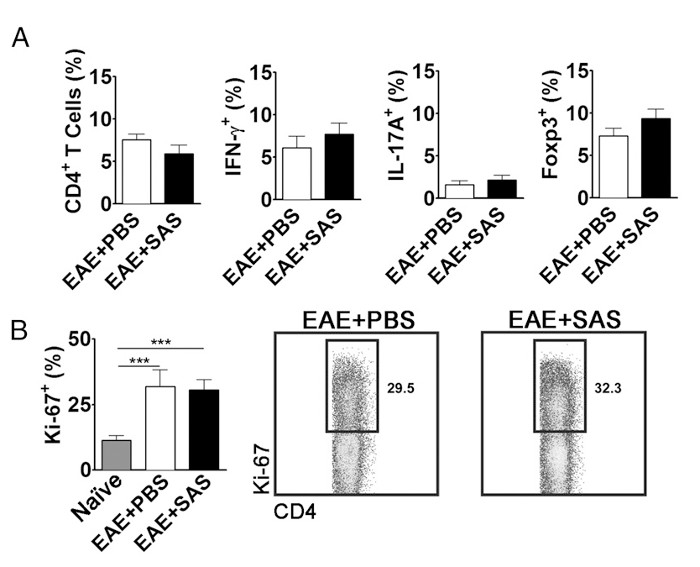
Abbildung 5. FACS Analyse von EAE C57BL / 6 - Maus Milzen Demonstrieren Equivalent T - Zell - Expressionsprofile und Proliferation in behandelten und unbehandelten Mäusen. Milzen von PBS- und SAS-behandelten Mäuse wurden 15 d postinduction von EAE analysiert. (A) Der Prozentsatz der CD4 + T - Zellen, Th1 (IFN-γ + / IL-17 -), Th17 (IFN-γ - / IL-17 +) und T regulatorischen Zellen (Foxp3 +) in die Milzen von PBS- behandelt wurden (n = 10) und SAS-behandelten (n = 9) Mäuse aus zwei unabhängigen Experimenten. (B, linke Tafel) Der Prozentsatz der Ki-67 + Zellen in der CD4 + -Population aus naiven Milzen (n = 4) sowie aus PBS- (n = 5) und SAS-behandelten Mäusen (n = 5) induziert mit EAE. Ein Einweg-ANOVA - Test zeigte eine statistische Signifikanz zwischen dem Anteil der Ki-67 + Zellen aus naiven Milzen verglichen mit entweder PBS- oder SAS-behandelten EAE Milzen. Keine Bedeutung wurde zwischen PBS- und SAS-behandelten EAE Milzen beobachtet. (B, rechts) Repräsentative Dot - Plots; Zahlen zeigen Anteil der Proliferation. Dot Plots zeigen Prozentsätze. Balkendiagramme repräsentieren zweiseitigen t-Test, *** p <0,001. Re-Print mit freundlicher Genehmigung aus (11). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
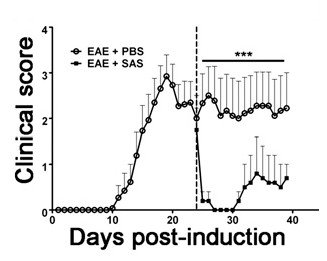
Abbildung 6. Pharmakologische Behandlung nach Immunzellinfiltration in SJL - Mäusen mit EAE. Klinische Scores (Mittelwert ± SEM) von SJL Mäuse mit PBS behandelt wurden (n = 8) oder SAS (n = 8) vom ersten Tag 24 der Immunisierung (gestrichelte Linie) mit PLP 139-151. Daten sind Mittelwerte ± SEM von klinischen Scores. mit einem nichtparametrischer zweiseitigen Mann-Whitney-U-Test wurde Statistische Differenz bestimmt *** p <0,001. Top Linie stellt Werte für die statistische verwendetAnalyse. Neudruck mit freundlicher Genehmigung aus (11).
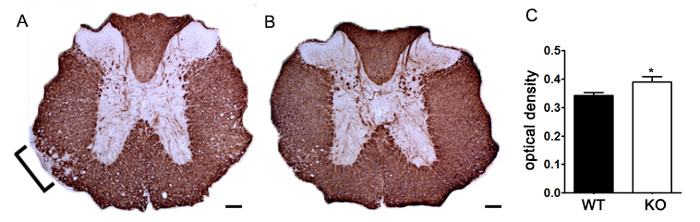
Abbildung 7. Die Quantifizierung der MBP Färbung optischer Dichte verwendet wird . (A) Repräsentative Färbung von MBP in der Thoraxrückenmark von einem nicht näher genetischen Maus - Knockout im Vergleich zu littermate Kontrolle C57BL / 6 - Maus mit EAE induziert. Bracket zeigt repräsentative Bereich reduzierter MBP-Färbung anzeigt Demyelinisierung. (B) MBP - Färbung der thorakalen Rückenmark von einem nicht näher genetischen Knockout C57BL / 6 - Maus. (C) Unspecified genetischen knockout Mäusen induziert mit EAE (KO; n = 6 Mäuse, 2 - 4 Lenden- und Brustabschnitte pro Tier) weisen eine höhere optische Dichte (OD) von MBP - Färbung im Rückenmark als Wildtyp- (WT; n = 3 Mäuse, 2 - 4 Lenden- und Brustschnitte pro Tier) Mäusen mit EAE. Statistisch analysiert using eines zweiseitigen t-Test, * p <0,05. Die Fehlerbalken stellen SEM. Maßstabsbalken 100 um.
Diskussion
Patienten mit MS weiterhin Krankheitsrückfälle zu erleben, während Medikamente, die T-Zell-Aktivierung und / oder Infiltration in das ZNS, rechtfertigen die Entwicklung von Behandlungsmöglichkeiten zu dämpfen, die direkt in das ZNS zu schützen. EAE ist klassisch verwendet worden , um die Symptome der MS zu modellieren und kann ein mächtiges Werkzeug sein , wenn die Natur der Wechselwirkungen zwischen dem Immunsystem und ZNS in vivo zu studieren. Verwendung Zeitpunkt der Behandlung Überlegungen in EAE, beispielsweise vor oder nach der Initiierung der Krankheit, in Verbindung mit der Prüfung Immunzellinfiltration in das ZNS und die Proliferation und Aktivierung in der Peripherie, ist es möglich , die Auswirkungen der Behandlungen auf sowohl das Immunsystem zu umreißen und das ZNS.
Während EAE in der Maus C57BL / 6 wird auf breiterer Ebene genutzt, EAE in SJL-Maus kann mehr repräsentativ für die Mehrheit der MS-Fälle, da diese Mäuse eine rezidivierende-remittierende Phänotyp und Infiltration von Immunzellen im Parenchym habendes Gehirns 10. SJL Mäuse haben deutliche Erholung während der Remission als auch, was es ermöglicht, eine Behandlung zu beginnen, nachdem die Krankheit vorgelegt hat, aber in Zeiten der reduzierten Entzündung. Es ist wichtig zu bedenken, dass SJL-Mäusen nicht immer in Synchronität Rückfall und überweisen, in potenziell große Variabilität führt, wenn Ergebnisse zusammengefasst werden. Daher können sich entscheiden, einige Forscher repräsentative Ergebnisse für die klinische Scores von einem Tier zu zeigen, während Mäuse für FACS-Analyse und Histologie an individualisierten Punkte in den Krankheitsverlauf nehmen.
Berücksichtigung bei Manipulationen EAE Mäuse hergestellt werden bei der Bestimmung der helfen kann, wie eine Behandlung, um das Immunsystem oder ZNS beeinflusst. Es gibt viele Optionen für die Behandlung beginnt, wenn, jede mit ihrer eigenen Konnotation für ob Immunzellen haben die CNS eingegeben und wie sie mit dem CNS interagieren kann. Behandlung vor Auftreten der Symptome impliziert, daß Immunzellen noch nicht eingegeben oder Beschädigung des ZNS verursacht.Die Behandlung nach dem Auftreten der Symptome bedeutet, dass Immunzellen in das ZNS eingegeben haben und einen Schaden verursacht. Verwendung von SJL-Mäusen, die Behandlung kann auch bei einem Rückfall beginnen, wo Immunzellen Entzündung aktiv zu infiltrieren und zu verursachen, oder während der Remission, wo Immunzellen im ZNS weniger verbreitet sein kann mit weniger Entzündung. Erste Hypothesen darüber, wie Behandlungen auf das ZNS und Immunsystem beeinflussen kann gemacht werden, wenn man bedenkt, wo Immunzellen im pathologischen Prozess während der Behandlung sind.
Es gibt eine Reihe von Möglichkeiten, in denen Behandlungen Immunzellen und das ZNS, die jeweils mit dem Ergebnis der Verringerung der Schwere von EAE-Symptome beeinflussen. Daher ist es notwendig, Durchflusszytometrie-Analyse und Immunhistochemie, um zu sehen, wie Immunzellen in der Peripherie und ZNS betroffen sind, ob Immunzellen das ZNS eingegeben haben, und wie das ZNS reagiert auf die Behandlung. Während durchflusszytometrische Analyse des Rückenmarks kann bestimmen, wie viele Zellen have das ZNS zu einem bestimmten Zeitpunkt eingegeben, kann man nicht feststellen, daß dieser Effekt zu einer verminderten Immunzellhandel zurückzuführen ist, es sei denn die Proliferation von Immunzellen unbeeinflußt in der Milz ist. Es ist daher notwendig, sowohl die peripheren und ZNS-Gewebe zu analysieren und zu bestimmen, was mechanistisch Ergebnisse bedeuten, wenn beide Gewebe verglichen werden. Es ist auch möglich, Immunzellaktivitätsprofile durch Behandlung verändert werden, zum Beispiel einen Schalter in einem pathogenen T-Helferzell-heavy Profil mit einer regulatorischen T-Zell-heavy Profil aufweist. Mit Blick auf Marker für verschiedene Zelltypen und Vergleichen Prozent Expression zwischen behandelten und unbehandelten Tieren ist deshalb auch ein wichtiger Gesichtspunkt. Ein aufkommender Konzept in der MS-Forschung legt nahe, dass B-Zellen eine wichtige Rolle im Bereich der Autoimmun- Demyelinisierung spielen. Dies basiert auf Studien , die zeigen , dass B - Zellen notwendig sind , für die Reaktivierung von T - Zellen 20. Dieses Konzept wird durch den Erfolg von Behandlungen wie Rituximab, einem Antikörper gegen CD20 ex unterstützt21,22 auf der Oberfläche von B - Zellen gedrückt wird . Wie durch den Erfolg des monoklonalen Antikörpers Ocrelizumab in klinischen Studien gezeigt, Drogen verschiedene Epitope von CD20 - Targeting kann die Wirksamkeit von B - Zell-gezielte Therapeutika 23 verbessern.
Eine Einschränkung der Techniken, die hier vorgestellt ist, dass es möglich ist, für die Immunzellen des ZNS zu gelangen, aber nicht in der Lage in das Parenchym zu reisen. Immunhistochemie verwendet werden perivaskuläre cuffing von Immunzellen zu erkennen und zu bewerten Abstand im Parenchym gereist zwischen behandelten und unbehandelten Tieren. Eine weitere potentielle Beschränkung beinhaltet, die Auswirkungen der microbiome auf EAE Pathogenese. Commensal Darmmikrobiota kann stark 24 Pathogenese der Erkrankung beeinflussen; daher Mäuse in verschiedenen Kolonien untergebracht und sogar in verschiedenen Käfigen können große Unterschiede in der Schwere der Erkrankung haben. Dementsprechend ist es immer vorzuziehen, wenn möglich, littermate Kontrollen im gleichen Käfig angehoben zu verwenden, umExperimente mit EAE. Eine letzte Anmerkung ist, dass wenn es experimentell wünschenswert ist, die Wirkungen von Immunzellen proliferative Veränderungen in der Peripherie zu beseitigen, kann es möglich sein, so unter Verwendung von passiven Transfer Induktions zu tun, anstatt die aktive Induktion in diesem Protokoll beschrieben.
Eine weitere Bestätigung für die Neuroprotektion 11 kann unter Verwendung eines Co-Kultursystem durchgeführt werden , um spezifische Mechanismen des Zelltods zu testen , oder durch die Verwendung von bedingten Knock - out - Mäusen , die zum Löschen von Proteinen selektiv auf einem Zelltyp ermöglicht. Darüber hinaus die Erforschung von pharmakologischen Mitteln zu erweitern, die neuroprotektive sind, Marker der axonalen transection und neuronalen Tod sollten einbezogen werden. Ein weiterer Bereich von Bedeutung ist die Remyelinisierung. Verletzt Axone sind nicht in der Lage zu remyelinate weitere Unterstützung verleihen, die neuroprotektive Therapien sollte ein wichtiger Bestandteil der Remyelinisierung Therapien sein. Darüber hinaus sind unmyelinated Axone anfälliger für Verletzungen als myelinated Axone. Dies deutet darauf hin, dass, wenn ein Axon demyelinierten therapeutische Interventionen wird die rechtzeitige Remyelinisierung fördern axonalen Verletzungen zu vermeiden. Um diese Alleen, andere in - vivo - Modellen für Demyelinisierung und Remyelinisierung erkunden können verwendet werden (dh Cuprizon und Lysolecithin). Das hier beschriebene Verfahren konzentriert Neuroprotektion auf der Beurteilung von Myelinverlust zu quantifizieren. die Anzahl der Vorläuferzellen sowie deren Fähigkeit, auch zu untersuchen, sich zu vermehren und reifen wäre wichtig für die Bewertung der Remyelinisierung. Mit der Erwähnung dieser alternativen Modellen, muss man auch verschiedene Modelle von Enzephalitis berücksichtigen, die viral vermittelt werden. Es gibt zwei gut charakterisierte RNA - Virusmodelle , die Myelinverlust produzieren: Die eine ist Maus - Enzephalomyelitis der Theiler, ein nicht-umhüllten Picornaviridae - Virus, und der andere ist der Maus - Hepatitis - Virus, ein Mitglied der Coronaviridae Virusfamilie 25,26.
EAE ist ein wertvolles Werkzeug für studies, wie Manipulationen oder Behandlungen das Immunsystem beeinflussen und das ZNS in vivo. Das Protokoll kann hier beschrieben helfen, festzustellen, wo Behandlungen den Krankheitsprozess beeinflussen, sei es in der Peripherie sein, an der Blut-Hirn-Schranke, oder im ZNS. Keine aktuellen Behandlungen für MS heilen die Krankheit und die Patienten oft erleben Rückgang im Laufe der Zeit. Ebenso können andere Krankheiten Immunzellinfiltration in das ZNS und den Abbau von Myelin beteiligt, einschließlich akuter disseminierter Enzephalomyelitis, Querschnittsmyelitis und Optikusneuritis, fehlende Behandlungen, die das ZNS zu schützen, wie es durch die Infiltration Immunzellen direkt unter Beschuss. Unter Berücksichtigung der Zeitpunkt der Behandlung und Verwendung von Durchflußzytometrie-Analyse der Milz und im Rückenmark in Verbindung mit Immunhistochemie des ZNS Entzündung und Schädigung zu beurteilen, wird für mechanistische Bestimmungen erlauben bezüglich Behandlungen gemacht werden.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von NINDS P30-NS069324 finanziert, die National Multiple Sclerosis SocietyRG 4587-A-1, die Civitan International Research Foundation, The Mike L. Jezdimir QuerMyelitis Foundation, The University of Alabama Health Services Foundation - Allgemeine Endowment Fund, The National Science Foundation 1355183 und T32 AI007051 vom nationalen Institut für Allergie und Infektionskrankheiten, National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
Referenzen
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten