需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
为葡萄糖和脂肪酸氧化率在大鼠离体的测定方法
摘要
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
摘要
哺乳动物的心脏是ATP的主要消费和需要能量底物进行收缩的稳定供应。不足为奇的是,心肌代谢的改变已被链接到的收缩功能障碍和心脏衰竭的发展。因此,解开新陈代谢和收缩之间的联系应该在某些领导在疾病状态下心脏适应或适应不良的机制线索。分离的工作大鼠心脏制剂可用于跟踪,同时和实时,心脏收缩功能和能量提供基板到氧化代谢途径的通量。本协议的目的是提供在缓冲器的氧化的葡萄糖和脂肪酸,主要能量提供所述心脏的基板用率的定量测量的制备和利用所采用的方法的详细描述。还讨论了用于样品分析和数据解释的方法。简言之,该技术是基于通过常温晶体灌注的14供给的C放射性标记的葡萄糖和3 H-放射性标记长链脂肪酸对离体心脏跳动。14 CO 2和3 H 2 0,结束副产物参与这些提供能量的基板的利用酶反应,然后定量地从冠状动脉流出物中回收。与所使用的放射性标记的底物的比活性的知识,那么有可能单独定量葡萄糖和脂肪酸的通量在氧化途径。离体心脏的收缩功能可以并行确定与适当的记录设备和直接相关代谢通量的值。该技术是研究响应于各种胁迫条件的代谢/收缩关系极为有用,如在前和负荷和缺血,药物或circula之后改变廷因子,或者在基因产物的表达的改变如下。
引言
临床相关性
在哺乳动物心脏,有基材的通量之间通过氧化代谢途径,ATP的生成和心脏工作1较强的正相关关系。在过去的二十年中,心脏代谢和功能之间的错综复杂的链路的调查已经导致认识到,在心脏代谢的改变是用于在不同类型的心脏疾病2-4的设置收缩功能障碍和可能的病理结构重建的原因。因此,可以预期,我们的管辖强调心脏的代谢重构机制的理解会导致心脏衰竭5-7的预防或治疗的治疗靶的鉴定。从美国心脏协会科学语句的"评估心脏代谢"的最近的出版物强调了科学界的T的兴趣与日俱增他的研究领域8。不过,虽然在心脏成像的技术进步现在允许心脏形态和功能的一个快速,准确的评估,心脏代谢的体内研究仍然有限和繁重:核磁共振(NMR)谱和正电子发射断层扫描(PET)成像可以用来跟随心脏高能磷酸代谢和克雷布斯循环的活性,但这些技术都受到高的操作费用和他们无法困扰,以确定各种基材在稳态条件9的贡献氧化代谢。对此日期体外工作心脏制备代表鞋底和独特的技术可用来研究,同时,实时,收缩功能和底物的助熔剂装入氧化代谢途径7,9。以下方案的目的在于提供在用于确定大鼠试剂的制备和使用的指南在大鼠离体心脏基板利用率上课。
隔离工作鼠类心脏仪器
虽然技术是近半个世纪之久,隔离工作大鼠心脏的准备仍然首选心血管研究的方法。由于与心脏的Langendorff编制,工作啮齿动物心脏提供了一个相对简单,可靠和廉价的方式从其他器官,神经内分泌等循环因子的混杂效应独立测量范围广泛的心脏参数。但与此相反的的Langendorff灌注心脏,工作心脏继续执行近生理心脏工作,为氧化代谢通量的产生是相关的体内条件级的先决条件。这是通过经由连接到左心房的插管递送灌注缓冲液至左心室(LV)的实现,并作为低压填充和合同,该缓冲器是通过对一个确定的负荷静水压力主动脉线喷射。最初由尼利和他的同事描述的10后来被Taegtmeyer,折边和克雷布斯11好转,但灌注设备的设计至今变化不大。如在原始设备描述的,收缩功能可以通过测定心输出量的评估,使用不超过量筒和秒表来测量主动脉和冠状动脉流10,11。一些厂商现在提供完整的工作啮齿动物心脏灌注系统。这些可商购的装置可与flowprobes,压力传感器,一个压力 - 体积导管和必需的所有心功能数据采集和分析的设备来获得。该供应商提供大量的文档和培训课程,熟悉他们的设备新用户。一些评论文章还详细协议的工作心脏仪器和设备行进,而对使用导管来测量在啮齿类动物12-15心脏功能。因为这个原因,我们将只简要地提及灌注装置和记录设备的设置。本协议,而旨在用的,可以被实现同时测量葡萄糖和长链脂肪酸的氧化的速率,在正常心脏两大能量提供衬底的方法的描述,以补充已经可用的信息。我们在这里描述的所有参与利用放射性标记的能量底物的心肌氧化代谢的评估的步骤,从试剂和缓冲液,以样品的回收和处理的制备中,对数据的分析。
该方法的原理
心肌细胞产生它们的能量的对收缩从脂肪酸(主要的长链脂肪酸)和碳水化合物的氧化磷酸化的体(glucose和乳酸)。心脏有非常有限的精力充沛的储量依赖于从循环这些能源提供基板的稳定供应。葡萄糖通过糖酵解途径分解代谢产生丙酮酸,然后通过线粒体内膜的丙酮酸脱氢酶复合脱羧。长链脂肪酸,从循环白蛋白或脂蛋白甘油三酯萃取,首先活化成酰基-CoA分子在细胞质中,并随后输送的线粒体基质内通过肉碱穿梭进入β-氧化途径。由葡萄糖和脂肪酸分解代谢产生的乙酰-CoA分子燃料三羧酸循环来产生其用于通过电子传递链来构建跨线粒体内膜的质子动力的还原当量(NADH和FADH 2)和通过ATP合酶的活性产生的ATP。水和二氧化碳是的端部的副产物酶反应发生的克雷布斯循环回路内。的14 C和3 H-放射性标记的底物的供给(如14 C-放射性标记的葡萄糖和3 H-放射性标记油酸)的分离工作心脏将因此导致生产14 CO 2和3 的 H 2的O其可以定量地从冠脉流出液回收。 14 CO 2的集合由保持离体灌注心脏成密封室以及由冠状动脉流出物在离开心脏立即恢复进行。一个小的阴离子交换柱用于分离和从冠状动脉流出物中回收3 H 2 O操作。从经处理的样品的放射活性用液体闪烁计数器测定,并与所使用的放射性标记的底物的比活性的知识,那么有可能单独定量葡萄糖和脂肪酸中的磁通氧化通路16,17。
研究方案
注:根据对人文关怀和动物用NIH公共卫生服务政策进行所有动物的程序和密西西比医学中心大学的机构动物护理和使用委员会批准。根据密西西比医学中心大学辐射安全办公室的指导方针所有涉及使用放射性同位素的程序进行批准和执行。
1.股票缓冲溶液和试剂的制备
- 克雷布斯,亨氏(KH)缓冲库存解决方案
- 制备2升含有20倍浓缩的盐储液(在摩尔/升)2.37氯化钠,0.0948氯化钾,0.0236 KH 2 PO 4,和0.0236 硫酸镁 * 7H 2 O.一个0.45μm孔径的过滤装置和店铺过滤在室温下长达1个月。
- 制备2升碳酸氢钠的20倍浓缩的(0.5摩尔/升)溶液。该溶液可以是在室温下保存的时间无限期。
- 制备250毫升氯化钙的1摩尔/ L的储备液。一个0.45μm孔径的过滤装置和店铺过滤在室温下长达1个月。
- 阴离子交换树脂的转化率从氯化物形式的氢氧化物形式
- 通过在1升纯水再悬浮它洗涤阴离子交换树脂。让树脂沉降,倒出多余的水。重复此步骤4次以上。
- 倒在安装在一个过滤烧瓶的玻璃微量真空过滤器保持器的树脂。
- 通过22体积的1N NaOH缓慢传递树脂转化为羟基型。用不锈钢刮勺间歇混合的浆料。
- 用超纯水洗涤树脂,直到pH值低于9.0。通过浸渍的pH测试条的树脂浆料的表面附近定期检查pH值。盖,并用超纯水树脂存储到微博rosilicate玻璃瓶避光。不要让树脂使用前晾干。
注:如果存放不当,树脂将持续至少3个月。
- 油酸白蛋白8倍浓缩原液
- 在一个4升锥形烧瓶中,混合200毫升的20倍浓缩的盐储备溶液和200毫升与3.6升超纯水的20倍浓缩的NaHCO 3溶液。
- 使用气体分散管具有多孔筒,气体与二氧化碳5%,氧95%以稳定的pH的混合物15分钟的溶液中。
- 倾470毫升在1L玻璃烧杯中缓冲。添加8.75毫升1摩尔/升的CaCl 2原液残留在4升锥形瓶中3530毫升缓冲液中,放在一边。
- 40克不含脂肪酸的牛血清白蛋白的添加到1升玻璃烧杯中,并搅拌搅拌棒直至溶解。
- 在一个15毫升锥形管,制备4-毫升50%的(体积比)在超纯水中乙醇溶液。添加487毫克sodiu米油和涡流直至粉末完全溶解。
注:一些研究者利用棕榈酸代替油酸灌注缓冲。棕榈酸白蛋白原液可以按照相同的程序来制备。然而,建议预热在70ºC溶液达到棕榈酸钠的完全溶解。 - 的油酸溶液滴添加到不断搅拌下的不含脂肪酸的BSA溶液并等待10更分钟为油酸-BSA复合物形成。
注:溶液应具有浅黄色颜色,并不含可见颗粒。沉淀或不溶性微粒的存在可以指示脂肪酸的BSA的不完全偶联。如果发生这种情况,溶液应被丢弃并且该过程开始一遍。
注意:如果它被允许在吸移管坐,不能滴加棕榈酸酯会沉淀。 BSA的搅拌的溶液可在37ºC被加温以促进结合蛋白摹棕榈酸。不要过热,因为这可能会引起BSA的变性和聚集。
注意:此协议的下一步骤涉及放射性物质的操作。穿戴合适的个人防护装备,并按照该机构的辐射安全办公室设置安全和废物处理的规定。 - 添加160微升(0.8毫居里)[9,10- 3 H]油酸到油酸-BSA的搅拌溶液中,并搅拌另外10分钟。
- 添加2.5的1摩尔/升的CaCl 2原液油酸-BSA的搅拌溶液中。
- 切大约1.2米渗析膜管和漂洗内外用自来水之外。大力擦洗透析管自来水下进行10至15分钟以除去膜的甘油的涂层。可替代地,通过浸泡在温水中透析管在使用前1小时除去涂层。完成用超纯水:洗涤透析管河
- 牢固地打结透析管的一端。与油酸-BSA溶液填充并打结的透析管的另一端。
- 放置填充透析管进KH缓冲的4升锥形烧瓶中,并允许有搅拌棒温和搅拌下,于4ºC透析过夜。
- 第二天,除去来自透析管的8倍浓缩油酸-BSA溶液。在-20ºC立即使用油酸BSA溶液灌注或分装店铺。冷冻等分试样是稳定至少2个月。避免多个冻融,因为这可能会影响油酸-BSA复合物的溶解度。
注:仅使用超纯水(25ºC18.2MΩ.cm的电阻率,总有机碳<10ppb以下,微生物≤1 CFU /毫升,用颗粒大小在0.22微米≤1/ ml)的制备试剂和缓冲液用于心脏灌注。从它的氯化物阴离子交换树脂为转化米至氢氧化物形式可以通过直接购买氢氧化物形式的支付额外费用来避免(参见材料数据表 )。除了油酸或棕榈酸,任何其它类型的天然存在的脂肪酸的也可以使用,只要该脂肪酸的氚化版本可按照其氧化。
2.灌注缓冲液的制备
- 在一个4升锥形烧瓶中,混合200毫升的20倍浓缩的盐储备溶液和200毫升与3.6升超纯水的20倍浓缩的NaHCO 3溶液。气体与二氧化碳5%,氧95%的混合物中15分钟的溶液,然后添加10 1 mol / L的氯化钙原液设置游离Ca 2+的浓度为2.5毫摩尔/升的溶液中。
注意:下面的步骤包括放射性物质的操纵。穿戴合适的个人防护装备,并按照该机构的设置RA安全和废物处理规定diation安全办公室。 - 转移1.750 L KH缓冲到2L硼硅酸盐玻璃瓶中。加入250毫升的8倍的浓油酸-BSA溶液,1.802克D-葡萄糖,400微升胰岛素0.4单位/毫升,和200微升(0.2毫居里)[U- 14 C]葡萄糖。倒置瓶混合。这会给2升含有油酸(0.4毫摩尔/ L)D-葡萄糖(5毫摩尔/升),和胰岛素(40μU/ ml)的完全灌注缓冲液中。
注:2升体积足以灌注非循环条件下工作的成年大鼠心脏至少60分钟。 - 使用一些非放射性KH液来填充两个夹层的菜肴,并放置在冰上冷却。
3.灌注设备的研制
注:研究者可以选择使用一个定制灌注装置诸如通过Taegtmeyer,下摆和克雷布斯11,或市售的系统之一描述的。灌注系统通常由的在下面的图1描述的元件。除了管和玻璃器皿中,记录设备的其余部分是可选的,其利用将取决于研究者的需求,解决了实验问题被提出。然而,我们建议使用氧气微电极,以确定在缓冲区进入O 2浓度和退出冠脉循环( 图1)。这将有助于使心脏与氧气的适量供给研究者控制,而且供氧不实验之间变化。此外,"静脉"氧差的测定可用于计算心肌耗氧量和心效率16,18。
- 接通循环水浴,并在37ºC设置热身灌注装置。
- 打开计算机和数据采集系统,将上可用于测量心脏功能。
- 连接在记录设备(压力导管,压力容积导管,氧气微电极,流量计等 )中的数据采集系统,并执行以下的制造商的说明校准仪器。
- 填用超纯水的缓冲贮存器。打开蠕动泵,并通过所有的管道冲洗出来的水和玻璃器皿冲洗系统。关掉蠕动泵,并确保没有水停留在管道和/或玻璃器皿,因为这可能会影响灌注缓冲液和心脏制剂的浓度。
- 一个新的1.0微米玻璃纤维过滤器连接到该系统。连接含有二氧化碳5%,氧95%的混合物,以补氧室中的气体罐。
注意:下面的步骤包括放射性物质的操纵。穿戴合适的个人防护装备,并按照该机构设定的安全和废物处理规定的辐射安全办公室。 - 填充灌注缓冲液的缓冲液容器。开启泵并确保所有管道和玻璃器皿的灌注缓冲的填充。贯穿在再循环模式中的灌注装置和含氧化合物的灌注缓冲液在使用前至少30分钟。
- 紧紧附着20ml的注射器管内的心脏腔下方,以恢复冠状动脉污水。注射器的前端连接到一个三路活塞的顶部。侧臂连接到3毫升注射器。经由管道底部臂连接到用于液体的放射性废物的容器。
注:当使用脂肪酸的BSA复杂,灌注缓冲液的氧合无法通过直接鼓泡进行用气体分散管,因为这将引起溶液过度发泡。使用膜式氧合( 图1)或用于该目的的片流补氧室中。强烈建议,以验证适当水平Ø˚F氧合是通过将氧的微电极在灌注回路( 图1)到达。
4.大鼠心脏分离和插管
- 权衡的规模老鼠。
- 制备具有150毫克麻醉剂剂量的注射器/ kg的thiobutabarbital钠盐水合物,并用200的USP单位肝素结核菌素注射器。
- 注射thiobutabarbital IP,等待动物失去了知觉。其它诱导剂可以用作只要这不会对实验的目的干扰(见下面的讨论 部分麻醉的选择)。
- 通过确认缺乏脚趾捏反射检查麻醉适当的水平。确保维持麻醉的适当深度,以确保在手术过程中的动物不会感到疼痛。
- 一旦老鼠完全是无意识的,并没有脚趾捏反应,将其放置在其上手术台秒回URE四肢用胶带或引脚。
- 剪辑腹部无发并执行腹部正中切口。请不要在此时打开胸腔呢。移动至胃和小肠一旁以显示下腔静脉。直接注射肝素进入下腔静脉和继续之前等待5到10秒。
- 用剪刀切开隔膜和肋笼的侧面,以暴露胸腔的内容。
- 巧妙抓住拇指,食指和中指和消费都的心脏和肺之间的心脏在一起。在切降主动脉的水平,注意不要损坏的过程中主动脉弓和升主动脉。马上心脏和肺部转移到填充用冰冷的KH缓冲解剖菜肴之一。
- 心脏停止跳动后,转移到第二解剖盘和剪掉任何大块肺组织,同时保持在冰冷的KH液淹没的心脏连接。切降序ING右主动脉弓上方主动脉。
注意:下面的步骤包括放射性物质的操纵。穿戴合适的个人防护装备,并按照该机构的辐射安全办公室设置安全和废物处理的规定。 - 冲洗灌注装置的主动脉线以填充用温缓冲主动脉插管,并消除任何水或空气可能仍然存在于管路。允许灌注缓冲液从主动脉插管滴,以尽量减少空气栓子在心脏附接到所述套管的时间的机会。
- 使用两个微解剖镊子小心地打开主动脉和向上滑动的心脏上的主动脉插管。固定在插管的主动脉用微夹子和启动的心脏的Langendorff灌注。观察心脏再次开始跳动排出所有剩余在秒冠状脉管以下灌注开始的血。
注:要执行4个步骤是非常重要的。图6至4.10尽可能防止对心脏不可逆缺血性损伤一样快。有经验的,整个过程应1和2分钟之间。当滑动主动脉上来就套管,小心不要通过主动脉根部,因为这可能会导致心肌灌注不足而损坏的主动脉瓣。 - 领带主动脉主动脉插管用3-0丝线缝合,并删除微剪辑。找到肺静脉。它可能有必要修整非心脏组织中发现,但不切太多非心脏组织中,因为他们将投放到左心房绑到套管。
- 冲洗灌注装置的左心房线以填充用温缓冲心房插管并消除任何水或空气可能仍然存在于管路。要特别小心,以从装置除去任何气泡,以减少空气栓子在心脏附接到所述套管的时间的机会。
- 使用两个微解剖FORCEPS微妙抢肺静脉开口向上滑动到心脏心房插管。可能有必要通过轻轻转动心房和/或主动脉插管来完成此步骤以重新定位心脏。在任何情况下,确保该程序不会对心脏施以过度劳损而导致的主动脉弯曲。领带的左心房的心房插管以3-0丝线缝合。
- 打开心房线,同时从的Langendorff模式,工作模式切换主动脉线。如果缓冲器漏出从左心房,关闭心房线,切换回主动脉线的Langendorff灌注,并使用另一3-0丝线缝合到更牢固地绑左心房套管。
5.心功能及样品采集的测量
注:代谢通量的测定将所需要的冠状动脉流量(CF)的知识。如下所述,冠状动脉血流值可以是与简单的使用秒表的获取。此外,主动脉流(AF)用相同的方法测量将允许心输出量(CO = CF + AF)的确定,然后可以通过施加用于计算心脏功率(CP),为心脏功能的一般量度式CP = CO(米3 /秒)*后负荷(帕)。可用于心功能的评估的另一种方法依赖于脉冲压力的实时测量与压力换能器( 图3和4)。虽然可选的,心脏收缩功能及血液动力学,包括左心室收缩和舒张功能的确定的最准确和详细的测量,将与使用一个压力 - 体积(PV)电导导管的实现的。本节简要介绍了离体心脏的导管。关于光伏导管的校准和数据分析与统计软件可以更多信息参考文献14,15找到。
注意:下面的步骤包括放射性物质的操纵。穿戴合适的个人防护装备,并按照该机构的辐射安全办公室设置安全和废物处理的规定。
- 如果实验包括具有导管LV功能的直接测量,穿刺LV尖与&G针并通过穿刺引入导管。
- 当使用压力 - 体积导管,仔细地定位导管,使得它的轴与LV纵轴对齐,与远侧电极权利主动脉瓣下方和邻近于心内膜边界,只是心室壁内的近端电极。
- 封心脏入水套式心脏室,并监控与数据采集软件心功能参数。开始记录后基线心脏参数已稳定超过5分钟。
- 确定由MEA冠状动脉血流suring填补附着在心脏腔室下方20毫升注射器管所需的时间。测量后,打开活塞三方清空冠状动脉流出入的放射性废液的容器中。
注:流量测量也可以使用一个流量计和flowprobes进行。 - 使用附连到三路活塞的侧臂以回收约2ml冠状动脉流出物在离开心脏3毫升注射器。传送将0.5ml冠状动脉流出物到2ml无盖微量离心管中,并立即用葡萄糖氧化的速率(下文第6节)的测定进行。
- 在适当标记的微量离心管转移冠状动脉流出物样品(〜1.5ml)中的其余部分,并存储在冰上。
- 重复步骤定期( 例如每5或10分钟),直到灌注实验结束5.4至5.6。
- 如果使用的压力 - 体积的导管,注入高渗盐水的10微升大丸剂(15%)进房线和结束前实验前心房插管权利。使用该推注来计算平行电导(ⅤP),这对于精确确定心脏体积15的关键。
- 开封心脏腔室和从LV取出导管如果已在实验中使用。恢复使用下列选项之一的心脏:
- 如果没有必要分离出心脏的特定区域为下游分析,并且如果灌注设备允许的话,靠近两个心房和主动脉线并立即冷冻夹紧使用Wollenberger钳其插管的心脏预冷于液氮中。
- 另外,切离心脏插管,并把它放到冰冷的KH缓冲区。干燥迅速在纸巾上的心脏,并测量其湿重。随后心脏可以解剖并收集特定测量组织样本。冻结使用Wollenberger塘剩余的组织前S冷却在液氮中。
- 储存在-80ºC冰冻心脏组织,直到确定干重(见第8节计算)的。
6.测定心肌葡萄糖氧化率的
注:该方法包括在14 的 CO 2从与季铵盐的氢氧化物的捕获溶液冠状动脉流出物中定量回收。 14 CO 2的溶解以H 14 CO3-回收以下用高氯酸缓冲的酸化。样品应立即它们作为空气和样品之间的气体的被动扩散将导致14 CO 2随时间损失恢复后进行处理。闪烁小瓶应与橡胶套塞子紧密地密封,以防止加入高氯酸后14 的 CO 2的损失。如果需要的话,封口膜可用于确保橡胶套筒止动件的小瓶( 图2)。
- 加入1ml季铵盐的10倍浓缩的氢氧化玻璃闪烁瓶(每个样品一小瓶+测定背景活动的两个额外瓶)的。
注意:季铵盐氢氧化物是剧毒,可致严重灼伤。咨询适当的处理和储存产品MSDS。 - 使用镊子微妙含有0.5毫升冠状动脉流出物样品2 mL萃取免盖微量离心管转移到小瓶中预先填充有季铵盐的氢氧化物。使用0.5毫升灌注缓冲区为背景活动的决心。
- 帽用橡胶套筒塞子的小瓶。封口膜可用于固定小瓶密封。用1ml注射器和23政长针,注入200μl的高氯酸(60%重量:重量%)通过橡胶套筒塞子并直接进入2 mL萃取无帽管中。
注:冠状动脉流出应该变成白色,由于BSA的沉淀。 - 让小瓶小号它过夜。
注意:高氯酸是高腐蚀性的,可作为氧化剂和/或引起爆炸的危险。咨询适当的处理和储存产品MSDS。 - 第二天,除去橡胶套筒瓶塞。仔细检索与镊子每2ml无帽管与洗管的底部上的开口小瓶用1ml闪烁鸡尾酒顶部检索所有季铵盐的氢氧化物。弃去无盖管适当标记的放射性废物的容器中。
- 添加每瓶再延长9毫升闪烁鸡尾酒。直接添加0.5毫升灌注缓冲液至两个小瓶填充用10ml液体闪烁鸡尾酒的比活性的测定。大力手工摇动小瓶,并等待至少6小时,以允许气泡在适当的设置为双标签实验用液体闪烁计数器测量前消散。
注:使用透明玻璃小瓶以可视化的NEedle刺入橡胶套塞子时。不要跌落高氯酸成季铵盐的氢氧化物,因为这会毁了反应。加入高氯酸释放14 CO 2从冠状动脉流出到空气中。虽然小瓶应紧密地密封并且所有的14 CO 2的应陷入氢氧化物的季铵盐,建议的化学通风橱下执行该测定。
7.测定心肌油酸氧化率的
注:该方法是基于从冠状动脉流出物使用强阴离子交换树脂3 H 2的O的定量分离和回收。不同于14 的 CO 2的回收率,没有样品的稳定性问题和冠状动脉流出物可以被保持在冰上或在冰箱中存放在进行试验之前。
- 制备阴离子交换树脂柱(每个样品+ t的一列WO测定背景活性的)通过用玻璃棉填充3毫升注射器管的尖端的额外的列。用移液管添加树脂/水的浆料,直到树脂到达在注射器管的2毫升标记。
- 通过使2毫升超纯水通过该柱洗涤树脂。重复此步骤两次。
- 将开放闪烁瓶柱下和负载0.5毫升,每列冠脉流出。加载用于确定背景活动为0.5ml灌注缓冲液中。
- 用0.5,1和2ml超纯水依次洗涤列。一旦洗脱完成后,丢弃在适当标记的放射性废物容器的列。
- 每添加闪烁13瓶毫升的液体闪烁鸡尾酒。直接添加0.5毫升灌注缓冲液至两个小瓶填充13毫升的液体闪烁鸡尾酒用于确定具体活性。大力摇晃瓶和液体测量SCI前等待至少6小时ntillation计数器适当的设置为双标实验。
8.计算
- 如果尚未完成,决定着整个灌注心脏的湿重。
注意:不要让冷冻组织解冻,如果分子和生化分析是对其余的组织随后进行。 - 确定从整个灌流-心脏组织样品的湿重(使用整个心脏的约15至30%)。放置组织样品中,在50℃设定过夜烘箱中并测量其干重。使用组织样品的湿重/干重比,以确定整个心脏的以克干重(g干重)。
- 对于每个时间点x表示冠状动脉血流的CF x的以毫升/分钟的值。
- 葡萄糖氧化率的测定
- 平均的14 C-背景活动determi测量两个解体/分钟(DPM)值网元修正系数14C DPM 学士学位 。
- 确定14 C-平均比活度14C衰变SA的价值。
- 通过应用公式确定葡萄糖的dpm /微摩尔(F 谷氨酸 )的比放射性
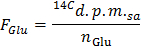
注意:其中n 谷氨酸 (微摩尔)= C 谷氨酸 (微摩尔/升)*样品体积(L)= 2.5在5毫摩尔/升使用葡萄糖时和0.5ml的样品。 - 通过应用公式确定每个时间点x的生产中的dpm /分(A)的14 CO 2的速率
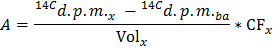
注意:如果卷X(毫升)= 0.5 - 干心脏重量的确定值分割获得生产14 二氧化碳的归一化率(A 规范 )在DPM /分钟。
- 套用公式GO = A 规范 /˚F 谷氨酸获得在每克干重葡萄糖/ min的微摩尔葡萄糖氧化(GO)的速率。
- 油酸的氧化速率的测定
- 平均两个崩解/分钟(DPM)3 H的背景活性,以确定校正因数3H DPM 巴测量的值。
- 确定3小时平均比活度3H衰变SA的价值。
- 通过应用公式确定DPM /微摩尔(F 01 E)油的具体放射性
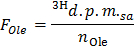
注:其中n OLE(微摩尔)= C 奥莱 (微摩尔/ L)*样品体积(L)= 0.2 0.4 mmol / L的油酸使用时和0.5毫升样品。 - 确定每个添E点应用公式2 O在DPM /分(B)×生产3小时的速度
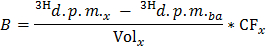
注意:如果卷X(毫升)= 0.5 - 通过干心脏重量的所确定的值除以B至获得生产每克干重的dpm /分钟3 H 2 O( 乙范数 )的归一化速率。
- 套用公式OO = B 规范 /˚F 奥莱获得油氧化(OO)的速度在每克干重油/ min的微摩尔。
结果
两个代表性实验在下面的图中描述。在这两种情况下,一个16周龄的雄性Sprague Dawley大鼠的心脏中分离,并与根据前述方案制备KH液的工作模式灌注。在每个实验中,将心脏经受应力条件影响心脏的工作。心脏收缩功能是由脉压的连续记录通过主动脉线压力传感器的插入和通过测定心肌力量评估。在提供能量的底物的利用每个应力条件下的后果是同时由葡萄糖和油的氧化速?...
讨论
前述协议的细节的方法,通过在隔离工作大鼠心脏葡萄糖氧化和脂肪酸氧化同时量化底物的通量。然后测量可以叠加到所记录的心功能参数,以确定基线和压力条件下,底物的代谢和心脏工作的关系(在工作量的变化,缺血再灌注等 )。它也可以评估如何新陈代谢/收缩关系由先前存在的条件,如心脏衰竭和糖尿病的影响。此外,转基因啮齿动物的心脏可用于询问特定蛋白质对心脏代谢和?...
披露声明
The authors declare that they have no competing financial interests.
致谢
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
材料
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
参考文献
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。