このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単離されたワーキングラット心臓におけるグルコースおよび脂肪酸酸化の宿泊料金を決意するための方法
要約
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
要約
哺乳類の心臓は、ATPの主要な消費者であり、収縮のためのエネルギー基質の一定の供給を必要とします。驚くことではないが、心筋の代謝の変化は、収縮機能障害および心不全の発症に関連しています。したがって、代謝と収縮の間のリンクを解明する疾患状態における心臓の適応や不適応を支配するメカニズムの一部に光を当てる必要があります。単離された作業ラット心臓調製物は、同時に、リアルタイム、心収縮機能および酸化的代謝経路に基質を提供し、エネルギーのフラックスで、追跡するために使用することができます。現在のプロトコルは、グルコースおよび脂肪酸、心臓の基板を提供する主要なエネルギーのための酸化の速度を定量的に測定するための緩衝剤の調製及び利用において使用される方法の詳細な説明を提供することを目的とします。サンプル分析およびデータ解釈のために使用される方法も議論されています。簡単に言えば、この技術は、ex vivoでの14 C-放射性標識グルコースおよび3 H-放射性標識長鎖脂肪酸の供給に基づいて正常体温晶質灌流を介して心臓の鼓動。14 CO 2及び3 H 2 Oの端副産物基板を提供するこれらのエネルギーの利用に関与する酵素反応は、その後、定量的冠動脈流出物から回収されます。使用される放射性標識基質の比活性の知識によれば、個々の酸化経路におけるグルコースおよび脂肪酸のフラックスを定量することが可能です。単離された心臓の収縮機能は、適切な記録装置と並行して決定され、直接代謝フラックス値に相関させることができます。技術は、前および負荷および虚血、薬物またはcircula後の変更などの様々なストレス条件に応答して、代謝/収縮の関係を研究するために極めて有用ですティン因子、または遺伝子産物の発現の変化を以下。
概要
臨床的関連
哺乳類の心臓では、酸化的代謝経路、ATP生成と心仕事1を介して基板のフラックスとの間には強い正の相関があります。過去20年間、心臓の代謝と機能との間の複雑なリンクの調査は心臓代謝の変化は、収縮不全と心臓病2-4の異なるタイプの設定で可能性の病理学的構造の再構築のための原因であることを認識することがつながっています。したがって、ストレス、心臓の代謝リモデリングを支配するメカニズムの理解が心不全5-7の予防または治療のための治療標的の同定につながることが期待されます。 「心臓代謝の評価」に関する米国心臓協会(American Heart Association)からの科学的声明の最近の刊行物はトンのための科学界の関心の高まりを強調します研究8の彼のフィールド。心臓イメージングの技術進歩は今、心形態および機能の迅速かつ正確な評価を可能にしながら、しかし、心臓代謝のin vivoでの研究は限られており、負担のまま:核磁気共鳴(NMR)分光法およびポジトロン放出断層撮影(PET)イメージングはできますエクスビボこの日付.TO 9定常状態での心臓の高エネルギーリン酸代謝及びクレブス回路のアクティビティを追跡するために使用されるが、これらの技術は、高い運用コストによって、および酸化的代謝に様々な基板の寄与を決定することができないことに悩まされています心の準備作業は、酸化的代謝経路7,9に基板の唯一かつユニークな研究に利用可能な技術、同時にかつリアルタイムで、収縮機能とフラックスを表します。以下のプロトコールは、ラットを決定するために使用される試薬の調製および使用のガイドラインを提供することを目的と孤立した作業ラット心臓における基質利用のエス。
分離されたワーキングげっ歯類ハート装置
技術は、ほぼ半世紀の古いですが、孤立した作業ラットの心臓の準備は、心血管研究のための選択の方法のまま。ランゲンドルフ心臓標本と同様に、作業げっ歯類の心臓は神経ホルモン、他の器官、および他の循環要因の交絡影響から独立して心臓パラメータの広い範囲を測定するための比較的簡単で信頼性が高く、安価な方法を提供しています。しかし、ランゲンドルフ灌流心臓とは対照的に、作業の心臓は、近生理学的な心臓の仕事、in vivoの条件に関連するレベルへの酸化代謝フラックスを生成するための前提条件を実行し続けています。この左心房に接続されたカニューレを介して左心室(LV)に潅流緩衝液を提供することによって達成され、LVがいっぱいとの契約としてされ、バッファは、決定された後負荷静水圧に対する大動脈ラインを介して排出されます。もともとニーリーや同僚10によって記述灌流装置の設計は、その後Taegtmeyer、HEMSとクレブス11によって改善されたが、それ以来はほとんど変更されています。元の装置で説明したように、収縮機能は、心拍出量の決意、メスシリンダーよりも多くを使用していないと大動脈と冠状動脈の流れ10,11を測定するためのストップウォッチを介して評価することができます。いくつかのベンダーは現在、完全な作業げっ歯類心臓灌流システムを提供しています。これらの市販の装置はflowprobes、圧力変換器、圧力 - 容積カテーテルと心臓機能データの取得および分析のために必要なすべての機器を用いて取得することができます。ベンダーは、自社の機器を持つ新しいユーザーを理解するために大規模なドキュメントやトレーニングセッションを提供します。また、いくつかの総説論文の作業心臓instrumに詳細プロトコルentationおよびげっ歯類12-15で心機能を測定するためのカテーテルの使用に関する。この理由のため、我々は簡単に潅流装置と記録装置のセットアップを言及します。現在のプロトコルではなく、同時に2つの主要なエネルギーは、正常な心臓で基質を提供し、グルコースの速度と長鎖脂肪酸酸化を測定するために実施することができる方法の説明ですでに利用可能な情報を補完することを目指しています。私たちは、サンプルの回収および処理するための試薬および緩衝液の調製から、データ分析のために、心筋の酸化的代謝の評価のための放射性標識されたエネルギー基質の利用に関わるすべての手順ここで説明します。
法の原則
心筋細胞は、(脂肪酸(主に長鎖脂肪酸)および炭水化物の酸化的リン酸化からの収縮のためのエネルギーの大部分を生成glucoseおよび乳酸)。心は非常に限られた精力的な埋蔵量を有しており、循環から基板を提供するこれらのエネルギーの安定供給に依存しています。解糖経路を介したグルコースの異化は、その後、ミトコンドリア内膜のピルビン酸デヒドロゲナーゼ複合体によって脱炭酸さピルビン酸を生成します。アルブミンまたはリポタンパク質トリグリセリドの循環から抽出された長鎖脂肪酸は、第一の細胞質ゾル中のアシル-CoA分子に活性化し、続いてβ酸化経路を入力するカルニチンシャトルを介してミトコンドリアのマトリックスの内部に搬送されます。グルコースおよび脂肪酸の異化作用によって生成されるアセチル-CoA分子は、ミトコンドリア内膜を横切ってプロトン起動力を構築する電子伝達系によって使用される還元当量(NADH及びFADH 2)を生成するクレブス回路を燃料とATP合成酵素の活性を介してATPを生成します。水および二酸化炭素は、端副生成物でありますクレブス回路の内部で起こっている酵素反応。 14 C-及び3 H-放射性標識された基質の供給を単離し作業心臓に(例えば14 C放射標識グルコースおよび3 H放射性標識オレイン酸のような)その結果、14 CO 2及び3 H 2 Oの生成をもたらすであろうことができます定量的冠動脈流出物から回収されます。 14 CO 2の回収は、密封されたチャンバー内に単離された灌流心を保つことによって、それが心を出るときに、すぐに冠動脈流出物を回収することによって行われます。小さな陰イオン交換カラムは、冠状動脈流出物から3 H 2 Oを分離し、回収するために使用されます。処理されたサンプルからの放射活性を液体シンチレーションカウンターで測定し、そして使用される放射性標識基質の比活性の知識を持って、それを個別におけるグルコースおよび脂肪酸のフラックスを定量することが可能です酸化は16,17の経路。
プロトコル
注:すべての動物の手順はヒューマンケアと動物の使用に関するNIH公衆衛生局・ポリシーに従って行われたとミシシッピ大学医療センターの施設内動物管理使用委員会によって承認されました。放射性同位元素の使用を含むすべての手順は、ミシシッピ大学医療センターの放射線安全事務所によって設定されたガイドラインに従って承認され、実施されました。
ストック緩衝溶液および試薬の調製
- クレブス - ヘンゼライト(KH)緩衝原液
- (モル/ Lで)を含む20倍濃縮された塩ストック溶液2Lの2.37のNaCl、0.0948のKCl、0.0236 KH 2 PO 4、および0.0236のMgSO 4 * 7H 2 Oを準備までの1ヶ月間室温で孔径0.45μm濾過ユニットとストアでフィルタリングします。
- NaHCO 3の20倍濃縮された(0.5モル/ L)の溶液2 Lを準備します。解決策は、することができます無期限に室温で保存。
- CaCl 2の1モル/ Lの原液250ミリリットルを準備します。までの1ヶ月間室温で孔径0.45μm濾過ユニットとストアでフィルタリングします。
- 塩化フォームから水酸化物形態の陰イオン交換樹脂の変換
- 1Lの超純水に再懸濁することにより、陰イオン交換樹脂を洗浄します。樹脂が落ち着くと過剰の水を注ぐことを許可します。このステップを4回繰り返します。
- フィルタリングフラスコに取り付けられたガラスの微量分析真空フィルタホルダ内の樹脂を注ぎます。
- ゆっくりと1NのNaOHの22容積を通過することにより、水酸化物形態に樹脂を変換します。ステンレス製のへらで断続的にスラリーを混ぜます。
- pHが9.0を下回るまで超純水で樹脂を洗浄します。樹脂スラリーの表面付近のpH試験片を浸漬することにより、定期的にpH値をチェックしてください。 BOに超純水で樹脂をカバーし、保存rosilicateガラス瓶、光から保護します。樹脂は、使用前に乾燥させないでください。
注:適切に保存されている場合には、樹脂は、少なくとも3ヶ月持続します。
- オレイン酸 - アルブミン8倍濃縮原液
- 4Lの三角フラスコに、20倍濃縮された塩ストック溶液200ml及び3.6 Lの超純水で20倍濃縮のNaHCO 3溶液200mlを混合します。
- フリットシリンダとガス分散チューブを使用して、pH値を安定させるために二酸化炭素の混合物5%と酸素95%で15分間この溶液をガス。
- 470ミリリットルを1 Lのガラスビーカー内で緩衝液を注ぎます。 4Lの三角フラスコ内に残存する3530ミリリットルバッファに1モル/ LのCaCl 2ストック溶液8.75 mlおよび設定はさておき加えます。
- 1 Lのガラスビーカーに脂肪酸を含まないBSAを40gを加え、溶解するまで撹拌棒で撹拌しました。
- 超純水中のエタノール溶液:15ミリリットルの円錐管では、50%(V V)の4ミリリットルを準備します。 487ミリグラムsodiuを追加します。粉末までメートルオレイン酸と渦が完全に溶解されます。
注:一部の研究者は、灌流緩衝液にパルミチン酸の代わりにオレイン酸を使用しています。パルミチン酸 - アルブミン原液を同じ手順に従って調製することができます。しかし、パルミチン酸ナトリウムの完全な可溶化を達成するために、70ºCで溶液を温めることをお勧めします。 - 一定の撹拌下に脂肪酸フリーのBSA溶液にオレイン酸溶液を滴下して加え、形成するオレイン酸-BSA複合体のために10以上の分を待ちます。
注:ソリューションが淡黄色の色を持っているし、目に見える粒子を欠いているでなければなりません。沈殿物または不溶性粒子の存在は、BSAに対する脂肪酸の不完全な結合を示すことがあります。この問題が発生した場合、溶液を廃棄しなければならないとプロセスが再びやり直します。
注:ピペットで放置すると滴下することができない場合にパルミチン酸が沈殿します。 BSAの撹拌溶液にバインディンを容易にするために、37ºCで加温してもよいですパルミチン酸のG。 BSAの変性および凝集を引き起こす可能性があり、このように過熱しないでください。
注意:このプロトコルの次のステップは、放射性物質の操作を伴います。適切なPPEを着用し、施設の放射線安全事務所によって設定された安全性と廃棄物処理条例に従ってください。 - オレイン酸-BSAの撹拌溶液に160μlの(0.8 MCI)[9,10- 3 H]オレイン酸を加え、さらに10分間攪拌します。
- オレイン酸-BSAの撹拌溶液に1モル/ LのCaCl 2ストック溶液2.5ミリリットルを追加します。
- 約1.2メートル透析膜チューブをカットし、水道水で内側と外側の両方にすすいでください。膜のグリセロールコーティングを除去するために10〜15分間水道水で激しく透析チューブをスクラブ。また、使用前に1時間、暖かい水に透析チューブを浸漬することによりコーティングを除去。超純ウォートで透析チューブを洗浄することで完了rを。
- しっかり透析チューブの一方の端を縛ります。オレイン酸-BSA溶液で充填し、透析チューブのもう一方の端を縛ります。
- KHバッファの4 L三角フラスコに充填透析チューブを置き、攪拌棒で穏やかに攪拌下、4ºCで一晩透析することができます。
- 翌日、透析チューブから8倍に濃縮オレイン酸-BSA溶液を除去。 -20ºCで灌流またはアリコートとストアのすぐオレイン酸-BSA溶液を使用してください。凍結アリコートを、少なくとも2ヶ月間安定です。これはオレイン酸-BSA複合体の溶解性を損なう可能性があるように、複数の凍結融解の繰り返しは避けてください。
注:のみを使用し、超純水(25ºCで18.2MΩ.cmの抵抗率、全有機炭素は、<10 ppbで、微生物≤1 CFU / mlを、0.22μmの≤1/ mlのオーバーサイズの微粒子)は、試薬および緩衝液を調製し、心臓灌流のために使用されます。その塩化物から陰イオン交換樹脂のための変換水酸化物形態へのmは、追加費用で水酸化物形の直接購入することによって回避することができる( 材料表を参照してください)。オレイン酸またはパルミチン酸の他に、天然に存在する脂肪酸の任意の他のタイプはまた、脂肪酸のトリチウム化バージョンはその酸化を追跡するために利用可能である限り、使用することができます。
灌流バッファーの調製
- 4Lの三角フラスコに、20倍濃縮された塩ストック溶液200ml及び3.6 Lの超純水で20倍濃縮のNaHCO 3溶液200mlを混合します。二酸化炭素の混合物5%と酸素95%で15分間溶液をガスし、次いで遊離Caの濃度を設定する2+ 2.5ミリモル/ Lに1モル/ LのCaCl 2ストック溶液10mlを加えます。
注意:次の手順は、放射性物質の操作を伴います。適切なPPEを着用し、機関のRAによって設定された安全性と廃棄物処理条例に従ってくださいdiation安全オフィス。 - 2 Lホウケイ酸ガラスボトルに1.750 L KHバッファを転送します。 8倍の250ミリリットルは、オレイン酸-BSA溶液、1.802グラムのD-グルコース、0.4 U / mlで400μlのインスリン、および200μlの(0.2 MCI)[U- 14 C]グルコースを濃縮する追加します。混合するために、ボトルを反転。これは、オレイン酸(0.4ミリモル/ L)、D-グルコース(5ミリモル/ L)、およびインスリン(40μU/ ml)を含む完全な潅流バッファの2 Lを与えます。
注:2 Lの量は、少なくとも60分間、非循環状態で作業成体ラットの心臓を灌流するのに十分です。 - 2解剖皿を埋めるために非放射性KHバッファの一部を使用し、冷却するために氷の上に置きます。
灌流装置の調製
注:研究者は、このようなTaegtmeyer、HEMSとクレブス11、または商業的に利用可能なシステムの1によって説明したもののようにカスタムビルド灌流装置を使用するように選択することができます。潅流システムは、通常で構成されています以下の図1に記載の要素。チューブとガラス製品のほかに、記録装置の残りの部分は任意であり、その利用が求められている実験的な質問に対処するために、研究者のニーズに依存します。それにもかかわらず、我々は、バッファ入り中のO 2濃度を決定するために酸素微小電極の使用を推奨し、冠循環( 図1)を出ました。これは、心臓が酸素の適切な量が供給される研究者の制御を助ける、および酸素供給は実験間で変化しないこと。また、「動」の酸素差の決意は、心筋酸素消費量及び心臓効率16,18を計算するために使用することができます。
- 循環水浴をオンにして、灌流装置を温めるために37ºCに設定してください。
- コンピュータとするデータ収集システムをオンにします心機能を測定するために使用することができます。
- データ収集システムへの記録装置(圧力カテーテル、圧-容積カテーテル、酸素微小電極、流量計など )を接続し、製造元の指示に従って機器のキャリブレーションを行います。
- 超純水でバッファ容器を埋めます。蠕動ポンプの電源を入れ、システムを洗浄するために、すべてのチューブとガラス製品を通して水を洗い流します。蠕動ポンプの電源をオフにして、これは灌流緩衝液の濃度と心の準備に影響を与える可能性があるとして、水がチューブおよび/またはガラス製品に留まるないことを確認してください。
- システムに新しい1.0μmのガラス繊維フィルターを接続します。酸素供給室に二酸化炭素5%と酸素95%の混合物を含むガスのタンクを接続します。
注意:次の手順は、放射性物質の操作を伴います。適切なPPEを着用し、機関によって設定された安全性と廃棄物処理条例に従ってください放射線安全事務所。 - 灌流バッファーでバッファ容器を埋めます。ポンプの電源をオンにし、灌流緩衝液ですべてのチューブとガラス製品の充填を確保します。使用前に少なくとも30分間再循環モードと含酸素で灌流装置を介して灌流バッファを実行します。
- しっかりと冠状動脈流出液を回収するために、心臓の室の下に20ミリリットルの注射器のチューブを取り付けます。三方活栓のトップに注射器の先端を接続します。 3ミリリットルシリンジにサイドアームを接続します。液体放射性廃棄物用の容器にチューブを介して、下アームを接続します。
注:脂肪酸BSA複合体を使用する場合、これは溶液の過度の発泡を引き起こすように、灌流緩衝液の酸素化は、ガス分散管を直接バブリングにより行うことができません。膜型人工肺( 図1)またはその目的のためにシートフロー酸素供給室を使用してください。非常に適切なレベルのOていることを確認することをお勧めしますF酸素は灌流回路( 図1)の酸素微小電極を配置することによって達成されます。
4.ラット心臓の単離とカニューレ挿入
- 規模でラットを計量。
- 150ミリグラムの麻酔薬の投与量で注射器を準備/ 200 USP単位のヘパリンをチオブタバルビタールナトリウム塩の水和物とツベルクリン注射器をkgです。
- チオブタバルビタールIPを注入し、意識を失うために動物を待ちます。これは実験の目的を妨げないように、他の誘導剤は、(下のディスカッション セクションで麻酔薬の選択を参照してください)限り使用することができます。
- つま先ピンチ反射の欠如を確認することにより、麻酔の適切なレベルを確認してください。動物が処置中に痛みを感じていないことを保証するために、麻酔の適切な深さを維持することを確認します。
- ラットは、完全に無意識であり、手術台と秒に背の上に置き、つま先のピンチに応答しないいったんテープまたはピンとUREの手足。
- 髪の腹部自由をクリップし、腹部の正中切開を行います。まだこの時点では胸腔を開けないでください。下大静脈を明らかにすることはさておき、胃や腸を移動します。下大静脈に直接ヘパリンを注入し、先に進む前に5〜10秒待ってください。
- はさみを使用して振動板をカットし、胸郭の側面は、胸腔の内容を公開します。
- 微妙に親指、人差し指と中指の間に心をつかみ、一緒に心臓や肺の両方を切り出します。プロセスにおける大動脈弓と上行大動脈を損傷しないように注意しながら、下行大動脈のレベルでカットします。直ちに氷冷KH緩衝液で満たされた解剖皿の一つに心臓や肺を転送します。
- 心臓が鼓動を停止した後、第二解剖皿に移し、氷冷KHバッファに沈め心を保ちながら、添付の肺組織のいずれかの大部分を切り落とします。下降をカット右大動脈弓の上行大動脈をる。
注意:次の手順は、放射性物質の操作を伴います。適切なPPEを着用し、施設の放射線安全事務所によって設定された安全性と廃棄物処理条例に従ってください。 - 暖かい緩衝液で大動脈カニューレを埋めるために潅流装置の大動脈ラインをフラッシュし、まだチューブ中に存在し得る任意の水や空気を排除します。灌流バッファは心臓がカニューレに接続されている時に空気塞栓の可能性を最小限にするために、大動脈カニューレから滴下することを可能にします。
- 2つのマイクロ解剖鉗子を使用すると、慎重に大動脈を開き、大動脈カニューレに心をスライドさせます。マイクロクリップでカニューレに大動脈を確保し、心臓のランゲンドルフ灌流を開始します。再び暴行を開始し、灌流の開始後数秒で冠血管系に残っている全ての血を追放心を守ってください。
注:ステップ4を実行することが非常に重要です。心臓への不可逆的な虚血性損傷を防ぐため、できるだけ速く4.10を通じて6。経験により、全体の手順は、1〜2分を取る必要があります。カニューレに大動脈をスライドすると、これは心筋の低灌流と大動脈弁の破損の原因となり大動脈基部に合格しないように注意してください。 - 3-0絹縫合糸で大動脈カニューレに大動脈を結ぶマイクロクリップを削除します。肺静脈の位置を確認します。それを見つけるために、非心臓組織をトリミングする必要があるかもしれないが、彼らはカニューレに左心房を結ぶために役立つような非心臓組織のあまりカットしないでください。
- 暖かい緩衝液で心房カニューレを埋めるために、まだチューブ中に存在し得る任意の水や空気を除去するための灌流装置の左心房ラインをフラッシュします。心臓がカニューレに接続されている時に空気塞栓の可能性を最小限にするための装置から任意の気泡を除去するために特に注意してください。
- 2つのマイクロ解剖FORCを使用して、EPSは微妙に肺静脈の開口部をつかみ、心房カニューレに心をスライドさせます。静かにこのステップを達成するために、心房および/または大動脈カニューレを回転させることによって、心臓の位置を変更する必要があるかもしれません。いずれの場合も、手順は心臓に過度の負担を課すと大動脈の曲げ起こさないことを確認してください。 3-0絹縫合糸で心房カニューレに左心房を接続します。
- 心房ラインを開き、同時に作業モードにランゲンドルフモードから大動脈ラインを切り替えます。バッファは、左心房から漏れ出す場合は、ランゲンドルフ灌流に大動脈の行を戻す、心房ラインを閉じ、カニューレに、より安全に左心房を結ぶために、別の3-0絹縫合糸を使用しています。
心機能及びサンプル収集の5.測定
注:代謝フラックスの決意は冠血流(CF)の知識が必要になります。以下に説明するように、冠状動脈流量値とすることができますストップウォッチの簡単な使用で得られました。さらに、同様の方法で大動脈流の測定(AF)を適用することによって、心機能の一般的な尺度として心臓パワー(CP)を計算するために使用することができる心拍出量(CO = CF + AF)の決意を可能にします式CP = CO(/ S M 3)*後負荷(PA)。心臓機能の評価のために利用できる別の方法は、圧力変換器( 図3および4)のパルス圧力の実時間測定に依存しています。オプションが、左心室の収縮期および拡張期機能の決意を含む、心収縮機能および血行動態の最も正確で詳細な測定は、圧力 - 体積(PV)コンダクタンスカテーテルを使用して達成されます。本節では、単離された心臓のカテーテル法を説明します。統計ソフトウェアとPVカテーテルおよびデータ分析のキャリブレーションに関する追加情報は、することができます参考文献14,15で見つかりました。
注意:次の手順は、放射性物質の操作を伴います。適切なPPEを着用し、施設の放射線安全事務所によって設定された安全性と廃棄物処理条例に従ってください。
- 実験は、カテーテルとLV機能の直接測定が含まれている場合は、26 G針でLVの頂点を穿刺し、穿刺を介してカテーテルを導入します。
- 圧 - 容積カテーテルを使用する場合は、そのシャフトが遠位右大動脈弁下の電極と心内膜境界線に隣接し、ちょうど心室壁の内部近位電極と、LV縦軸と整列されるように、慎重にカテーテルを配置します。
- ウォータージャケット心室に心を密封し、データ収集ソフトウェアと心臓機能パラメータを監視します。ベースライン心臓パラメータは5分間以上安定している後に記録を開始します。
- MEAによって冠動脈の流れを決定します心腔の下添付20mLの注射筒に充填するのに必要な時間をジューリング。測定後、放射性廃液容器に冠状動脈流出液を空にするために三方活栓を開きます。
注:フロー測定は、流量計とflowprobesを用いて行うことができます。 - それは心を出るときに冠状動脈の流出〜2ミリリットルを回復するために、三方活栓のサイドアームに取り付けられた3ミリリットル注射器を使用してください。 2ミリリットルキャップレスマイクロ遠心チューブに冠状動脈流出物の0.5ミリリットルを移し、直ちにグルコース酸化(下記第6節)の速度の決意を進めます。
- 適切に標識されたマイクロチューブに冠動脈流出物サンプル(〜1.5ミリリットル)の残りの部分を転送し、氷上で保存します。
- 繰り返しは灌流実験終了まで( 例えばごとに5または10分)、一定の間隔で5.4〜5.6を繰り返します。
- 圧 - 容積カテーテルを使用している場合は、高張食塩水の10μlのボーラスを注入(15%)心房ラインに、右の実験を締結する前に、心房カニューレの前に。心臓容積15の正確な決意のために重要である並列コンダクタンス(V pを )、計算するためにこのボーラス注射を使用してください。
- 心室を開封し、1は実験に用いた場合、LVからカテーテルを除去します。次のいずれかのオプションを使用して、心を回復します:
- 下流の分析のための灌流装置は、ライン心房と大動脈の両方に近い、それを可能にし、直ちに凍結クランプの心をそのカニューレにWollenbergerトング液体窒素で予冷しを使用している場合は、心臓の特定の領域を分離する必要がない場合。
- また、カニューレから心をカットし、氷冷KHバッファにドロップします。迅速ペーパータオル上で心を乾燥し、その湿重量を測定します。心臓は、その後、解剖し、組織試料は、特定の測定のために収集することができます。 Wollenbergerトングを使って残りの組織を凍結Sは、液体窒素中であらかじめ冷却しました。
- (部8の計算を参照してください)乾燥重量の決意するまで-80ºCで凍結した心臓組織を保管してください。
心筋グルコース酸化料金の6決意
注:この方法は、ハイアミンの水酸化物の捕獲溶液と冠状動脈流出液からの14 CO 2の定量的回収で構成されています。 H 14 CO3-として溶解14 CO 2は、過塩素酸によるバッファの酸性化後に回収されます。空気と試料との間のガスの受動拡散は、時間をかけて14 CO 2の損失につながるようにサンプルがすぐに回復した後に処理されるべきです。シンチレーションバイアルをしっかりと過塩素酸を添加した後、14 CO 2の損失を防ぐために、ゴムスリーブ栓で密封されるべきです。必要に応じて、パラフィルムは、ゴムスリーブストッパを固定するために使用することができバイアル( 図2)。
- ガラス製シンチレーションバイアルにハイアミンの10倍濃水酸化(サンプル当たり1つのバイアル+バックグラウンド活性の決意のための2つの余分なバイアル)の1ミリリットルを追加します。
注意:ハイアミンの水酸化物は非常に毒性があり、重度の火傷を引き起こします。適切な取り扱いと保管のため、製品のMSDSを参照してください。 - ピンセットを使用すると、微妙ハイアミンの水酸化物で予め充填されたバイアルに0.5ミリリットルを冠動脈流出物サンプルを含む2ミリリットルキャップレスマイクロチューブを移します。バックグラウンド活性の決意のために0.5ミリリットル灌流バッファを使用します。
- ゴムスリーブストッパーでバイアルをキャップ。パラフィルムは、バイアルのシールを確保するために使用することができます。 (:%ワット60%のワット)ゴムスリーブストッパーを通って直接2ミリリットルキャップレスチューブに1mlシリンジと23 G長い針を使用して、過塩素酸の200μLを注入します。
注:冠状動脈の流出が原因で、BSAの沈殿に白い有効にしてください。 - バイアル秒をしてみましょうそれを一晩。
注意:過塩素酸は腐食性が高く、酸化剤として作用し、および/または爆発の危険を引き起こす可能性があります。適切な取り扱いと保管のため、製品のMSDSを参照してください。 - 翌日、ゴムスリーブのストッパーを外します。慎重にピンセットで各2ミリリットルキャップレスチューブを取り出し、ハイアミンの水酸化物のすべてを取得するために、1ミリリットルのシンチレーションカクテルとオープンバイアルの上にチューブの底を洗います。適切に標識された放射性廃棄物容器にキャップレスチューブを捨てます。
- 1バイアルあたり追加の9ミリリットルのシンチレーションカクテルを追加します。比活性の決意10mlの液体シンチレーションカクテルを充填した2つのバイアルに直接0.5mLの潅流バッファーを加えます。勢いよく手でバイアルを振ると、気泡が適切にデュアルラベル実験のために設定し、液体シンチレーションカウンターで測定する前に消散させることができるように少なくとも6時間を待ちます。
注:NEを可視化するために透明なガラスバイアルを使用しますゴムスリーブ栓を貫通するときedle。この反応を台無しにするようハイアミンの水酸化物に過塩素酸を落とさないでください。過塩素酸を追加すると、空気中に冠動脈流出液からの14 CO 2を放出します。バイアルを密封しなければならないと14 CO 2の全てが水酸化物のハイアミンにトラップされるべきであるが、化学ヒュームフードの下で、このアッセイを実行することをお勧めします。
心筋オレイン酸酸化料金の7決意
注:この方法は、強力な陰イオン交換樹脂を用いて冠動脈流出物からの3 H 2 Oの定量的分離・回収に基づいています。 14 CO 2の回収とは異なり、サンプルの安定性の問題がないと冠動脈流出物は、アッセイを行う前に、氷上に保持または冷凍庫で保存することができます。
- 陰イオン交換樹脂カラムを準備します(サンプル+トンあたり1列グラスウールで3 mlシリンジチューブの先端を充填することによってバックグラウンド活性の決意)のための追加の列WO。樹脂は、注射筒に2ミリリットルマークに到達するまでトランスファーピペットを用いて樹脂/水スラリーを追加します。
- カラムを通して2ミリリットルの超純水を通過させることにより、樹脂を洗浄します。このステップをさらに2回繰り返します。
- 列の下でオープンシンチレーションバイアルを置き、0.5ミリリットルを列ごとに冠状動脈流出液をロードします。バックグラウンド活性の決意に対する負荷0.5mLの潅流緩衝液。
- 0.5、1、2mlの超純水で順次カラムを洗浄します。溶出が完了すると、適切に標識された放射性廃棄物容器内の列を捨てます。
- シンチレーションバイアル当たり13ミリリットルの液体シンチレーションカクテルを追加します。具体的な活動の決意のために13ミリリットルの液体シンチレーションカクテルを充填した2つのバイアルに直接0.5ミリリットル灌流バッファを追加します。積極的にバイアルを振ると液体SCIで測定する前に少なくとも6時間を待ちますntillationカウンタが適切にデュアルラベル実験のために設定します。
8.計算
- まだ行っていない場合は、全体の灌流心臓の湿重量を決定します。
注:分子および生化学的解析は、その後残りの組織上で実行される場合、凍結組織を解凍しないようにしてください。 - 全体散らすハート(心臓全体の約15〜30%を使用)からの組織サンプルの湿重量を決定します。一晩50℃に設定したオーブンで組織試料を置き、その乾燥重量を測定します。グラムで心臓全体の乾燥重量を決定するために、組織サンプルの湿重量/乾燥重量比を使用してください(g乾燥重量)。
- 各時間点xのml /分で冠血流CF xの値を表します。
- グルコース酸化の速度の決意
- determiに14 Cのバックグラウンド活性のために測定された2つの崩壊/分(DPM)の値を平均化補正係数14Cの DPMのBAをネブラスカ。
- 14 Cは、比活性14Cの DPM SAの値を平均化決定。
- 式を適用することによって、DPM /マイクロモル(F のGlu)におけるグルコースの比放射能を決定
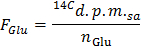
注:ここで、n のGlu(マイクロモル)= C のGlu(モル/ L)*サンプル体積(L)= 2.5 5ミリモル/ Lのグルコースを使用し、0.5ミリリットルのサンプル。 - 式を適用することによって、DPM /分(A)中の14 CO 2の生成速度X各時点について決定
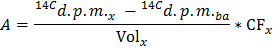
注:ここで、巻のx(ミリリットル)= 0.5 - 14 CO 2の生産の正規化速度を得るために、乾燥心臓重量の決定された値で除算A( ノーム )g乾燥重量あたりのdpm /分インチ
- GOはg乾燥重量当たりのグルコース/分のマイクロモルのグルコース酸化(GO)の速度を得るためにノーム / F のGluを =数式を適用します。
- オレイン酸酸化速度の決意
- 補正係数3Hの DPMのBAを決定するために、3 Hのバックグラウンド活性のために測定された2つの崩壊/分(DPM)の値を平均します。
- 3 Hは、比活性3Hの DPM SAの値を平均化決定。
- 式を適用することによって、DPM /マイクロモル(F オル電子 )におけるオレイン酸の比放射能を決定
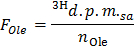
注:ここで、nは オレ (マイクロモル)= C オーレ (モル/ L)*サンプル体積(L)= 0.2〜0.4ミリモル/ Lでオレイン酸を使用し、0.5ミリリットルのサンプル。 - 各ティムのために決定式を適用することによって、DPM /分(B)中の3 H 2 Oの生成速度X E点
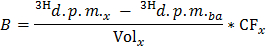
注:ここで、巻のx(ミリリットル)= 0.5 - g乾燥重量あたりのdpm /分で3 H 2 O(Bの規格 )の生産の正規化速度を得るために、乾燥心臓重量の決定された値で除算B。
- g乾燥重量あたりのオレイン酸/分のマイクロモルでオレイン酸酸化(OO)の速度を得るために、式OO = B ノーム / F オレを適用します。
結果
2つの代表的実験は、以下の図に記載されています。どちらの場合も、16週齢の雄性Sprague Dawley系ラットの心臓を単離し、前述のプロトコルに従って調製KH緩衝液を用いて作業モードで灌流。各実験では、心臓は心臓の作業に影響を与えるためにストレス条件に供しました。心臓の収縮機能は、大動脈ラインの圧力変換器の挿入を通って心臓パワーの決意により脈圧を?...
ディスカッション
前のプロトコルが同時に分離された作業用ラット心臓におけるグルコース酸化および脂肪酸酸化を介して基板のフラックスを定量化する方法を詳しく説明します。測定値は、その後、ベースラインとストレス条件(ワークロードの変化、虚血再灌流、 等 ...)の下での基質代謝と心仕事との関係を決定するために記録された心臓機能パラメータに重ね合わせることができます。代謝/収?...
開示事項
The authors declare that they have no competing financial interests.
謝辞
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
資料
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
参考文献
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved