Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İzole Çalışma Sıçan Kalp Glukoz ve Yağ Asidi Oksidasyonu Oranlarının Belirlenmesine Yöntemleri
Bu Makalede
Özet
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
Özet
Memeli kalp ATP önemli bir tüketici ve daralma enerji substratların sabit bir kaynağı gerektirir. Şaşırtıcı olmayan bir şekilde, miyokard metabolizması değişiklikleri kasılma disfonksiyonu ve kalp yetmezliği gelişimine bağlantılı olmuştur. Bu nedenle, metabolizma ve daralma arasındaki bağlantıyı çözülüyor hastalık durumlarında kardiyak adaptasyon veya davranışsal sorunlar düzenleyen mekanizmaların bazıları da ışık tutmalıdır. çalışmakta olan sıçan kalbi hazırlığı aynı anda ve gerçek zamanda, kalp kasılma fonksiyonunun ve oksidatif metabolik yollar içinde alt-tabakaların temin enerji akı takip etmek için kullanılabilir. Mevcut protokol glikoz ve yağ asitleri, kalp substratlar sağlayan ana enerji oksidasyon oranları kantitatif ölçümü için tamponların hazırlanması ve kullanımında kullanılan yöntemlerin ayrıntılı bir açıklamasını sunmayı amaçlamaktadır. Örnek analizi ve veri yorumlama için kullanılan yöntemler de ele alınmıştır.Kısaca, bu teknik normotermik kristalloid perfüzyon yoluyla bir ex vivo dayak kalbe 14 arz C radyo-etiketli glukoz ve 3H-radyo-etiketli, uzun zincirli yağ asidi dayanır. 14 CO2 ile 3 H2O, son yan ürünleri bu enerji sağlayan alt-tabakaların kullanımına katılan enzimatik reaksiyonlar, ardından nicel koroner çıkış maddesinden geri kazanılır. kullanılan radyoaktif işaretli substratlar spesifik aktivitesi bilgisi ile, tek tek oksidasyon yolaklarında glükoz ve yağlı asit akışı ölçmek için mümkündür. izole edilmiş kalbin kasılma işlevi uygun kayıt cihazının paralel olarak belirlenir ve doğrudan metabolik akı değerleri ile ilişkili olabilir. teknik, öncesi ve yük ve iskemi, bir ilaç veya bir dolaşım sistemlerini sonra değişiklikler gibi çeşitli stres koşullarına cevaben metabolizma / daralma ilişkisini incelemek için son derece yararlıdırbir gen ürününün ekspresyonu değiştirilmesinden ting faktörü veya.
Giriş
klinik Alaka
Memeli kalbinde, oksidatif metabolik yollar, ATP üretimi ve kalp işi 1 ile substratların akı arasında güçlü bir pozitif ilişki vardır. Son yirmi yılda, kalp metabolizması ve fonksiyon arasındaki karmaşık bağlantı soruşturma kalp metabolizmasında değişiklikler kalp hastalığının 2-4 farklı türde ortamında kasılma disfonksiyon ve patolojik yapısal yeniden bir nedeni olduğunu fark yol açmıştır. nedenle, stresli kalp metabolik biçimlenme düzenleyen mekanizmaların anlaşılması, kalp yetmezliği, 5-7 önlenmesi ya da tedavisi için bir terapötik hedeflerin tanımlanmasına yol açacağı beklenmektedir. "Kardiyak Metabolizma Değerlendirilmesi" Amerikan Kalp Derneği bilimsel deyimi son yayın t bilimsel topluluğun artan ilgi vurgularAraştırmanın 8 onun alanı. Kardiyak görüntülemede teknolojik gelişmeler artık kardiyak morfoloji ve fonksiyon hızlı ve doğru bir değerlendirme için izin verirken Ancak, kalp metabolizması in vivo çalışma sınırlı ve külfetli kalır: Nükleer Manyetik Rezonans (NMR) spektroskopisi ve Pozitron Emisyon Tomografisi (PET) görüntüleme can ex vivo olarak bu tarihten .To kararlı durum koşullarında oksidatif metabolizma çeşitli yüzeylerde katkısını 9 belirlemek için kalp yüksek enerji fosfat metabolizması ve Krebs döngüsü aktivitesini izlemek için kullanılabilir, ancak bu teknikler yüksek işletme maliyetleri ile ve kendi yetersizlik boğulmuş kalp hazırlık çalışma eş zamanlı ve gerçek zamanlı, oksidatif metabolik yollar 7,9 içine kasılma fonksiyonu ve substratların akı, çalışmak için tek ve benzersiz tekniği kullanılabilir temsil eder. Aşağıdaki protokol sıçan belirlemek için kullanılan reaktiflerin hazırlanması ve kullanımı yönergeleri sağlamayı amaçlarİzole çalışma sıçan kalbinde substratlar kullanım es.
İzole Çalışma Kemirgen Kalp Aparatı
teknik neredeyse yarım asırlık olmasına rağmen, izole çalışma sıçan kalp hazırlık kardiyovasküler araştırma için seçim yöntemi olmaya devam etmektedir. Langendorff kalp hazırlanması gibi, çalışma kemirgen kalp nörohormonal diğer organların ve diğer dolaşım faktörlerin karıştırıcı etkilerinden bağımsız olarak kalp parametreleri geniş bir yelpazede ölçmek için nispeten basit, güvenilir ve ucuz bir yol sağlar. Ancak Langendorff perfüze kalp aksine, çalışma kalp yakın fizyolojik kalp işi, in vivo koşullarında alakalı seviyelere oksidatif metabolik akışın üretilmesi için bir ön koşul yerine devam eder. Bu, sol atrium bağlı bir kanül aracılığı ile sol ventrikül (LV) perfüzyon tampon elde ederek ve AG, doldurur ve sözleşmeler gibidirtampon kararlı afterload hidrostatik basınca karşı aort hattı üzerinden çıkarılır. Başlangıçta 10 daha sonra Taegtmeyer, hems ve Krebs 11 tarafından geliştirilen, fakat Neely ve arkadaşları tarafından tarif edilen perfüzyon aparatı tasarımı zamandan beri çok az değişmiştir. Orijinal cihaz tarif edildiği gibi, kontraktil fonksiyon aort ölçmek için herhangi bir daha fazla dereceli silindirler ve bir kronometre kullanılarak kalp çıkışının saptanması yoluyla tespit edilebilir ve koroner 10,11 akar. Çeşitli satıcılar artık tam çalışma kemirgen kalp perfüzyon sistemleri sunuyoruz. Bu ticari olarak temin edilebilen bir düzen flowprobes, basınç gücü çeviricisi, bir basınç-hacim kateter ve kalp işlevsel veri alımı ve analizi için gerekli tüm ekipman ile elde edilebilir. satıcıları, kendi ekipman ile yeni bir kullanıcı tanımak için kapsamlı dokümantasyon ve eğitim oturumları sağlamak. çalışma kalp instrum birkaç da inceleme makaleleri detay protokollerientation ve kateter kullanımı ile ilgili kemirgenler 12-15 kardiyak fonksiyonunu ölçmek için. Bu nedenle, sadece kısa bir süre perfüzyon aparatı ve kayıt donanımları set-up değineceğim. Mevcut protokol yerine eş zamanlı olarak glikoz ve uzun zincirli yağ asidi oksidasyon oranları, normal kalpte iki büyük enerji sağlayan yüzeyler ölçmek için uygulanabilecek yöntemler bir açıklama ile zaten mevcut bilgiyi tamamlamayı amaçlamaktadır. Veri analizi, örneklerin kurtarma ve işleme reaktif ve tampon hazırlanmasından, miyokard oksidatif metabolizma değerlendirilmesi için radyoaktif işaretli enerji substratların kullanımı dahil burada tüm adımları açıklar.
Yönteminin İlkeleri
Kardiyomiyositlerde (glikoz yağ asidi (özellikle uzun zincirli yağ asidi) ve karbonhidrat oksidatif fosforilasyon ile ilgili daralma enerjilerinin bir kısmını oluştururE ve laktat). Kalp çok enerjik rezervleri sınırlı ve dolaşımdan bu enerji sağlayan substratların sürekli bir tedarik dayanmaktadır etti. glikolitik bir yol üzerinden glikoz katabolizması daha sonra iç mitokondriyal zarın piruvat dehidrojenaz kompleksi tarafından dekarboksile edilir piruvat elde edilir. albümin ya da lipoprotein trigliseritleri dolaşımdaki ekstre uzun zincirli yağlı asitler, ilk sitoplazmada asil-CoA moleküllere aktif ve daha sonra p-oksidasyon yolu girmek için karnitin transfer yoluyla mitokondrial matris içinde taşınmaktadır. Glukoz ve yağ asitlerinin katabolizması ile üretilen asetil CoA moleküller iç mitokondriyal membran boyunca proton motiv güç oluşturmak için elektron taşıma zinciri tarafından kullanılan indirgeyici eşdeğerleri (NADH ve FADH 2) oluşturmak için Krebs döngüsü yakıt ve ATP sentaz aktivitesi ile ATP üretir. Su ve karbondioksit sonu yan ürünleridirKrebs döngüsü içinde yer alan enzimatik reaksiyonlar. 14 C- ve 3H-radyo-etiketli substratlar tedarik çalışmakta olan kalp (örneğin, 14, C-radyo-etiketli glukoz ve 3-radyo işaretli oleik asit gibi), bunun sonucu olarak 14 CO 2 ve 3 H2O üretimine yol açacaktır olabilir kantitatif koroner atık geri kazanılabilir. 14 CO 2 koleksiyonu kapalı bir bölmeye izole perfüze kalbi tutarak ve kalbi çıkarken hemen koroner atık kurtarma tarafından yürütülmektedir. Küçük bir anyon değiştirme sütunu ayırmak ve koroner çıkış maddesinden 3 H2O kurtarmak için kullanılır. işlenmiş numuneler arasında radyoaktivite bir sıvı sintilasyon sayacı vasıtasıyla ölçüldü ve ikinci radyo-etiketli substratlar spesifik aktivitenin bilgisi ile birlikte, tek tek glukoz ve yağlı asit akışı ölçmek mümkün olur olanoksidasyon 16,17 yolaklarıyla.
Protokol
NOT: Tüm hayvan prosedürleri İnsan Hayvanların Bakım ve Kullanımına İlişkin NIH Halk Sağlığı Servisi Politikası göre yapıldı ve Mississippi Tıp Merkezi Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından kabul edildi. radyoizotop kullanımını içeren tüm işlemler Mississippi Üniversitesi Tıp Merkezinin radyasyon güvenliği bürosu tarafından belirlenen esaslara göre onaylanmış ve gerçekleştirilmiştir.
Stok Tampon Çözümleri ve Reaktiflerin hazırlanması 1.
- Krebs-Henseleit (KH) Tampon Stok Çözümleri
- (Mol / L cinsinden) ihtiva eden bir 20x konsantre tuzlu stok çözeltisi 2 L 2.37 NaCl, 0,0948 KCI, 0,0236 KH 2 PO 4 ve 0,0236 MgSO 4 * 7H 2 O hazırlanması 1 aya kadar oda sıcaklığında 0.45 mikron gözenek boyutu filtrasyon ünitesi ve mağaza Filtre.
- NaHCO 3 20x konsantre edildi (0.5 mol / L) çözeltisi 2 L hazırlayın. çözüm olabilirbelirsiz bir süre için, oda sıcaklığında saklandı.
- CaCI2, 1 mol / L stok çözeltisi 250 ml hazırlayın. 1 aya kadar oda sıcaklığında 0.45 mikron gözenek boyutu filtrasyon ünitesi ve mağaza Filtre.
- Klorür form hidroksit oluşturmak için anyon değişimli reçine Dönüşüm
- 1 L saf su içinde yeniden süspanse edilerek bir anyon değişim reçinesi yıkayın. Reçine yerleşmek ve fazla suyu dökmek için izin verin. Bu adımı 4 kez daha tekrarlayın.
- bir filtreleme şişesi üzerine monte edilmiş bir cam mikroanaliz vakum filtre tutucu reçine dökün.
- yavaş 1 N NaOH 22 hacim geçirilerek hidroksit formuna reçine dönüştürün. paslanmaz çelik spatula ile aralıklı olarak bulamaç karıştırın.
- pH değeri, aşağıda 9,0 düşene kadar ultra-saf su ile reçine yıkanır. reçine bulamacı yüzeye yakın pH test şeridini batırarak düzenli olarak pH değerini kontrol edin. Kapak ve bir bo içine saf su ile reçine saklamakrosilicate cam şişe ve ışıktan korur. Reçine Kullanmadan önce kurumasını izin vermeyin.
NOT: Düzgün depolandığında, reçine en az 3 ay sürecek.
- Oleik Asit-albümin 8x Konsantre Stok Çözüm
- 4 L'lik bir Erlenmeyer şişesi içinde, 20x konsantre tuzlu stok çözeltisi, 200 ml 3.6 L saf su ile 20x konsantre edilmiş NaHCO 3 çözeltisi 200 ml karıştırın.
- bir tavlanmış cam silindiri ile bir gaz dağıtım borusu kullanılarak, karbon dioksit,% 5 ve oksijen pH stabilize% 95 içeren bir karışım, 15 dakika boyunca çözeltiden gaz.
- 470 mi, 1 litrelik bir cam beher içinde tampon dökün. 4 litrelik bir Erlenmeyer şişesi içinde geri kalan 3530 ml tampon için 1 mol / L CaCI2 stok çözeltisi 8.75 mi ve set yana ekleyin.
- çözülene kadar bir karıştırma çubuğuna sahip olan 1 litrelik bir cam behere yağlı asit içermeyen BSA 40 g ekleyin ve karıştırın.
- (V: v), aşırı saf su içinde etanol çözeltisi 15 ml konik bir tüp içinde,% 50 4 ml hazırlar. 487 mg sodiu eklemetoz kadar m oleat ve vorteks tamamen çözülür.
NOT: Bazı araştırmacılar perfüzyon tampon maddesi içinde palmitik asit yerine oleik asit kullanılır. Bir palmitik asit, albümin stok çözeltisi aynı prosedür takip edilerek hazırlanabilir. Bununla birlikte, sodyum palmitat tam çözülmesini sağlamak için 70 ° C'de çözelti ısınmaya önerilir. - sabit karıştırma altında yağ asidi içermeyen BSA çözeltisine oleat çözeltisi damla damla ilave edin ve oluşturulması için yağ asidi-BSA kompleksi 10 dakika daha bekleyin.
NOT: çözelti açık sarı bir renge sahip ve görünür taneciklerin olmaması gerekliliğidir. bir çökelti ya da çözünmeyen parçacıkların varlığı BSA'ya yağ asidi eksik konjugasyon gösterebilir. Bu durumda, çözüm atılır ve işlem tekrar başlanmalıdır.
Not: bir pipet oturmasına izin verilir ve damla damla ilave edilemiyorsa Palmitat çökelecektir. BSA karıştırılmış bir bağlanma özelliğinin kolaylaştırmak için 37 ° C'de ısıtılmış edilebilirpalmitik asit örn. BSA denatürasyon ve toplanmasına neden olabileceği için aşırı ısıtmayın.
DİKKAT: Bu protokolün sonraki adımlar radyoaktif maddenin manipülasyon içerir. Uygun PPE giymek ve kurumun radyasyon güvenliği ofisi tarafından belirlenen güvenlik ve atık yönetmelikleri takip edin. - Oleik asit-BSA karıştırılan çözeltiye 160 ul (0.8 mCi) [9,10 3H] oleik asit ilave edin ve 10 dakika daha karıştırıldı.
- Oleik asit-BSA karıştırılan çözeltisine, 1 mol / L CaCI2 stok solüsyonu 2.5 ml.
- Yaklaşık 1,2 m diyaliz membran tüp kesin ve iç ve dış musluk suyu ile hem durulayın. 10 ila 15 dakika membranın gliserol kaplama kaldırmak için musluk suyu altında kuvvetlice diyaliz tüp fırçalayın. Seçenek olarak ise, kullanımdan önce 1 saat süreyle ılık suda diyaliz tüpüne ıslatarak kaplama çıkarın. ultra saf Wate ile diyaliz tüp durulayarak bitirinr.
- Güvenli diyaliz hortumun bir ucunu kapalı kravat. oleik asit-BSA çözeltisi ile doldurun ve diyaliz Hortumun diğer ucunu kapalı kravat.
- KH tamponu 4 litrelik bir Erlenmeyer şişesi içine dolduruldu diyaliz tüpüne koyun ve bir karıştırma çubuğuna sahip olan hafif karıştırma altında 4 ° C'de gece boyunca diyaliz sağlar.
- Ertesi gün, diyaliz tüp 8x konsantre oleik asit-BSA çözüm kaldırmak. -20 ° C'de perfüzyon veya tablet ve mağaza için hemen oleik asit-BSA çözüm kullanın. Donmuş madde şişeleri en az 2 ay boyunca stabildir. Bu yağ asidi-BSA kompleksinin çözünürlüğünü tehlikeye atabilir gibi birden fazla donma-erime döngülerinden kaçınmak.
NOT: Sadece saf su (25 ºC'de 18.2 MΩ.cm resistivite, toplam organik karbon <10 ppb, mikro-organizmalar ≤ 1 CFU / ml, 0.22 mikron ≤1 / ml üzerinde boyutu olan partiküller) reaktifler ve tamponlar hazırlamak kalp perfüzyon için kullanılır. Bunu klorürden anyon değiştirme reçine dönüşümühidroksit formuna M bir ek masraf hidroksit biçiminin doğrudan satın alma ile önlenebilir (Malzeme Tablo). oleat veya palmitat Bunun yanı sıra, doğal olarak ortaya çıkan yağlı asidin başka bir türü, yağlı asit, bir toz haline getirilmiş sürümü, oksidasyon takip mevcut olduğu sürece, kullanılabilir.
Perfüzyon Tamponu 2. Hazırlık
- 4 L'lik bir Erlenmeyer şişesi içinde, 20x konsantre tuzlu stok çözeltisi, 200 ml 3.6 L saf su ile 20x konsantre edilmiş NaHCO 3 çözeltisi 200 ml karıştırın. Karbon dioksit,% 5 ve oksijen% 95 içeren bir karışım, 15 dakika boyunca çözeltiden gaz ve daha sonra 2.5 mmol / L serbest Ca2 + konsantrasyonunu ayarlamak için, 1 mol / L CaCI2 stok çözeltisi 10 ml.
DİKKAT: Aşağıdaki adımlar radyoaktif madde manipülasyon içerir. Uygun PPE giymek ve kurumun ra tarafından belirlenen güvenlik ve atık düzenlemeleri takipdiation güvenlik ofisi. - 2 L borosilikat cam şişeye 1.750 L KH tampon aktarın. 8x 250 mi Oleik asit-BSA çözeltisi, 1.802 g D-glikoz, 0.4 U / ml, 400 ul insülin ve 200 ul (0.2 mCi) [U-14C] Glukoz konsantre edildi ekleyin. karıştırmak için şişeyi ters çevirin. Bu oleik asit (0.4 mmol / L), D-glikoz (5 mmol / L) ve insülin (40 μU / ml) ihtiva eden tam bir perfüzyon tamponu 2 litresine verecektir.
Not 2 litrelik bir hacme en az 60 dakika boyunca olmayan çevrimli koşullarında çalışan bir yetişkin sıçan kalbi serpmek için yeterlidir. - İki diseksiyon yemekleri doldurmak için radyoaktif olmayan KH tampon kullanmakta ve soğumaya buz üzerine yerleştirin.
Perfüzyon Aparatı 3. hazırlanması
NOT: Araştırmacı gibi Taegtmeyer, hems ve Krebs 11 veya ticari olarak temin sistemlerinden biri tarafından tarif edilen gibi bir özel yapılmış perfüzyon aparatı kullanmayı tercih edebilirsiniz. Perfüzyon sistemleri tipik haliyle oluşmaktadırAşağıda, Şekil 1 'de tarif edilen elemanlar. boru ve cam yanı sıra, kayıt ekipmanları geri kalanı isteğe bağlıdır ve deneysel soruyu ele araştırmacının ihtiyaçlarına bağlıdır onun kullanım isteniyor. Yine de, tampon giren O 2 konsantrasyonunu belirlemek için oksijen Mikroelektronlar kullanılmasını tavsiye ve koroner dolaşımı (Şekil 1) çıkarken. Bu kalp oksijen uygun bir miktarda verilir araştırmacı kontrolü yardımcı olacak ve oksijen kaynağı deneyler arasında farklılık olmadığını. Buna ek olarak, "arteriovenöz" Oksijen farkının belirlenmesi miyokardiyal oksijen tüketimi ve kardiyak verimliliğini 16,18 hesaplamak için kullanılabilir.
- Dolaşan su banyosu açın ve perfüzyon aparatı ısınmak için 37 ºC olarak belirlenmiştir.
- bilgisayar ve irade veri toplama sistemi açınkardiyak fonksiyonu ölçmek için kullanılabilir.
- Veri toplama sistemine kayıt cihazlarını (basınç kateteri, basınç-hacim kateteri, oksijen Mikroelektronlar, debimetreler vs) bağlayın ve üretici talimatlarına göre araçların kalibrasyonu yapın.
- ultra saf su ile tampon doldurun. peristaltik pompa açın ve tüm boru yoluyla su dışarı floş ve sistem durulayın züccaciye. peristaltik pompa kapatın ve bu şekilde boru ve / veya cam hiç su kalır perfüzyon tamponu ve kalp hazırlık konsantrasyonu etkileyebilir emin olun.
- sisteme yeni bir 1.0 um bir cam elyaf filtre bağlayın. oksijenleme odası karbon dioksit,% 5 ve oksijen,% 95 bir karışımını ihtiva eden gaz tanktan.
DİKKAT: Aşağıdaki adımlar radyoaktif madde manipülasyon içerir. Uygun PPE giymek ve kurum tarafından belirlenen güvenlik ve atık düzenlemeleri takip'Nin radyasyon güvenliği ofisi. - Perfüzyon tamponu tampon doldurun. Pompanın açın ve perfüzyon tamponu ile tüm boru ve cam doldurma sağlamak. kullanımdan önce en az 30 dakika boyunca perfüzyon resirkülasyon durumunda cihaz ve oxygenate aracılığıyla perfüzyon tamponu çalıştırın.
- Sıkıca koroner atık kurtarmak için kalp odasının altında bir 20 ml'lik şırınga tüp takmak. Üç yollu en şırınga ucu bağlayın. 3 ml şırınga yan kolu takın. Sıvı radyoaktif atık için bir kap boru yoluyla alt kolu takın.
Not: yağ asidi-BSA kompleksi kullanıldığında, bu çözeltinin fazla köpük oluşmasına neden olacak gibi, perfüzyon tamponu oksijenasyon bir gaz dispersiyon borusu ile doğrudan baloncuklar yoluyla gerçekleştirilebilir değildir. Bir membran oksijenatörü (Şekil 1) ya da bu amaçla bir tabaka akış oksijenleme haznesi. Oldukça uygun seviye o doğrulamak için tavsiye edilirf oksijenasyon perfüzyon devresi (Şekil 1) bir oksijen mikroelektrot koyarak ulaşılır.
4. Fare kalp İzolasyon ve kanülasyonu
- bir ölçekte sıçan tartılır.
- 150 mg anestezi dozu ile bir şırınga Hazırlama / tiyobutabarbital sodyum tuzu hidrat ve 200 USP birim heparin, bir tüberkülin şırıngası kg.
- tiyobutabarbital IP enjekte edilir ve bilincini kaybetmek hayvan için bekleyin. Bu deneyin amacı, engel olmaz gibi diğer indüksiyon maddeleri (aşağıda tartışılacak anestezik Seçimi bakınız) olduğu sürece kullanılabilir.
- ayak tutam refleksi eksikliği onaylayarak anestezi uygun düzeyde olup olmadığını kontrol edin. Hayvan prosedürü sırasında ağrı hissetmez sağlamak için anestezi uygun derinliğini korumak için emin olun.
- Sıçan tamamen bilinçsiz ve ameliyat masasına ve sn sırtını üzerine yerleştirin, ayak tutam yanıt vermiyor kezbant veya iğneler ile ure bacaklarda.
- saç karın ücretsiz klip ve karın orta hat kesi yapmak. Henüz bu noktada göğüs boşluğunu açmayın. mide Taşı ve inferior vena kava ortaya çıkarmak için bir kenara bağırsak. inferior vena kava doğrudan heparin enjekte edilir ve devam etmeden önce 5 sn 10 bekleyin.
- Kullanarak makas göğüs boşluğunun içeriğini ortaya çıkarmak için diyafram ve kaburga kafesinin yanlarını kesti.
- Ince birlikte başparmak, işaret ve orta parmakları ve tüketim kalp ve akciğerler arasındaki kalbi kapmak. sürecinde aort arkı ve çıkan aort zarar vermemek için dikkatli olmak, inen aorta düzeyinde kesin. Hemen buz gibi soğuk KH tampon ile dolu diseksiyon yemekleri birine kalp ve akciğerler aktarın.
- Kalp yenerek durduktan sonra, ikinci diseksiyon kabına aktarın ve buz gibi soğuk KH tampon batık kalbi tutarken bağlı akciğer dokusunun herhangi bir büyük parçalarını keserek. inmek Cutsağ aortik ark üzerinde aort ing.
DİKKAT: Aşağıdaki adımlar radyoaktif madde manipülasyon içerir. Uygun PPE giymek ve kurumun radyasyon güvenliği ofisi tarafından belirlenen güvenlik ve atık yönetmelikleri takip edin. - Sıcak tamponu ile aort kanülüne doldurmak için yine boru içinde mevcut olabilecek herhangi bir su veya havanın elimine olması için perfüzyon aparatı aort enjekte et. perfüzyon tampon kalp kanül takılı anda hava emboli riskini en aza indirmek için aort kanül damlamaya izin verin.
- iki mikro kesme forseps kullanarak dikkatlice aort açın ve aort kanül üzerine kalbi yukarı doğru kaydırın. Bir mikro klip ile kanül üzerinde aorta Güvenli ve kalp Langendorff perfüzyon başlatır. kalbin yeniden atmaya başlar ve perfüzyon başında şu saniyeler içinde koroner damar sisteminde kalan tüm kanı sınırdışı gözlemleyin.
NOT: adımları 4 gerçekleştirmek için çok önemlidir.kalp geri dönüşümsüz iskemik hasarı önlemek için mümkün olduğunca hızlı 4.10 ile 6. tecrübesi ile, tüm prosedürü 1 ila 2 dakika almalıdır. kanül üzerinde aorta kadar kaydırarak bu aort kapak miyokard hipoperfüzyon ve hasara neden olabileceğinden, aort kökü geçmesi için dikkatli olun. - 3-0 ipek sütür ile aort kanül aort kravat ve mikro klibi çıkarın. Pulmoner ven bulun. Onu bulmak için non-kardiyak dokuları kesmek için gerekli olabilir, ama onlar kanül sol atrium bağlamak için hizmet edecek şekilde non-kardiyak dokuların çok fazla kesmeyin.
- Sıcak tamponla atriyal kanül doldurmak için yine boru içinde mevcut olabilecek herhangi bir su veya havanın elimine olması için perfüzyon düzeneğinin sol atriyal enjekte et. Kalp kanül takılı anda hava emboli riskini en aza indirmek için aparat herhangi bir hava kabarcığı kaldırmak için özellikle dikkatli olun.
- İki mikro kesme forc kullanılmasıeps ince pulmoner venin açılmasını kapmak ve atriyal kanül üzerine kalbi yukarı doğru kaydırın. Yavaşça bu adımı gerçekleştirmek için, atriyal ve / veya aortik kanül döndürerek kalp yeniden konumlandırmak için gerekli olabilir. Herhangi bir durumda, prosedür, kalp üzerinde aşırı gerginliği empoze aort eğilmesine neden olmamasını sağlamak. 3-0 ipek sütür ile atriyal kanül ile sol atrium kravat.
- Atriyal çizgi açın ve aynı anda çalışma moduna Langendorff modundan aort çizgi geçin. dışarı sol atrium tampon sızıntıları, atriyal çizgi kapatmak Langendorff perfüzyon aort hattı geri dönmek ve kanül daha güvenli sol atrium kravat başka 3-0 ipek sütür kullanın.
Kalp Fonksiyonu ve Numune Toplama 5. Ölçüm
NOT: Metabolik akı belirlenmesi koroner akım (CF) bilgisini gerektirir. Aşağıda tarif edildiği gibi, koroner akım değerleri olabilirBir kronometre basit kullanımı ile elde edilmiştir. Buna ek olarak, aynı yöntemle aortik akış ölçümü (AF) daha sonra uygulanması ile kalp fonksiyonunun genel ölçüsü olarak kalp gücü (SP) hesaplamak için kullanılabilir kardiyak çıkışı (CO = CF + AF) belirlenmesini sağlar formül CP = CO (m 3 / s) * art yük (Pa). Kalp fonksiyonu değerlendirilmesi için kullanılabilir Başka bir yöntem, bir basınç dönüştürücü ile nabız basıncının gerçek zamanlı ölçümü (Şekil 3 ve 4) dayanır. isteğe bağlı olmasına rağmen, sol ventrikül sistolik ve diyastolik fonksiyonlarının belirlenmesi de dahil olmak üzere kalp kasılma fonksiyonu ve hemodinami, en doğru ve ayrıntılı ölçümler, bir basınç-hacim (PV) iletkenlik kateter kullanımı ile elde edilecektir. Bu bölümde kısaca izole kalp kateterizasyon açıklar. olabilir istatistik yazılımı ile PV kateterlerin kalibrasyon ve veri analizi ile ilgili ek bilgilerreferanslar 14,15 bulundu.
DİKKAT: Aşağıdaki adımlar radyoaktif madde manipülasyon içerir. Uygun PPE giymek ve kurumun radyasyon güvenliği ofisi tarafından belirlenen güvenlik ve atık yönetmelikleri takip edin.
- Deney bir kateter ile LV fonksiyonu doğrudan ölçümü içeriyorsa, bir 26 G iğne ile LV apeks delinme ve delinme yoluyla kateter tanıtmak.
- bir basınç-hacim kateter kullanırken şaftı distal sağ aort kapak altında elektrot ve endokardiyal sınırına bitişik ve sadece ventriküler duvar içinde yakın elektrot ile LV boyuna ekseni ile aynı hizada olacak şekilde, dikkatlice kateter yerleştirin.
- Su ceketli kalp odasına kalbine mühür ve veri toplama yazılımı ile kardiyak fonksiyonel parametreleri izler. temel kardiyak parametreler fazla 5 dakika süreyle istikrarlı sonra kayıt başlatın.
- mea koroner akışını belirlemekKalp odasının altına bağlı 20 ml şırınga tüp doldurmak için gereken süreyi suring. ölçümden sonra, radyoaktif sıvı atık kabına koroner atık boşaltmak için üç yollu stopcock açın.
Not: Akış ölçümleri de bir akış ölçer ve flowprobes kullanılarak gerçekleştirilebilir. - o kalbi çıkarken koroner atık ~ 2 ml kurtarmak için üç yollu vana yan kolu bağlı 3 ml şırınga kullanın. 2 ml kapaksız mikrosantrifüj tüp içine koroner akıntıdan 0.5 ml aktarın ve derhal glikoz oksidasyonu oranları (aşağıda Bölüm 6) belirlenmesi ile devam edin.
- Uygun bir şekilde etiketlenmiş bir mikrosantrifüj tüpü içinde, koroner çıkış örneği (~ 1.5 mi) geri kalan aktarın ve buz üzerinde muhafaza edin.
- Tekrarlayın 5.4 perfüzyon deneyin sonuna kadar düzenli aralıklarla (örneğin her 5 veya 10 dakika) 5.6 için yineleyin.
- bir basınç-hacim kateter kullanıyorsanız, hipertonik salin 10 ul bolus enjekte (% 15)Atriyal hattına ve sağ deney sonucuna varmadan önce atriyal kanül önce. Kalp hacmi 15 doğru bir şekilde belirlenmesi için kritik olan, paralel iletkenlik (V P) hesaplamak için bu bolus enjeksiyon kullanın.
- Kalp odasını açmak ve bir deneyde kullanılması durumunda LV kateteri çıkarın. Aşağıdaki seçeneklerden birini kullanarak kalbini kurtarmak:
- Orada aşağı analizler için kalbin belirli alanlarda izole etmek gerek yoktur ve perfüzyon aparatı hemen yakın atriyal ve aort hem hatlarına izin verir ve eğer Wollenberger maşa kullanarak kanüller üzerinde kalbini dondurarak kelepçe eğer sıvı azot içinde önceden soğutulmuş.
- Alternatif olarak, kanüller kapalı kalbini kesip buz KH tampon içine bırakın. Hızlı bir kağıt havlu üzerine kalbi kurutun ve ıslak ağırlığını ölçmek. Bundan sonra, kalp disseke ve doku örnekleri belirli ölçümler için toplanabilir. Wollenberger maşa kullanılarak kalan doku dondurmas, sıvı nitrojen içinde önceden soğutulmuş.
- kuru ağırlık (Bölüm 8. Hesaplamaları bakınız) belirleninceye kadar -80 ° C'de dondurulmuş kalp dokusu saklayın.
Miyokard Glikoz Oksidasyon Oranlarının Belirlenmesi 6.
NOT: yöntem temin edilebilen Plamine® ve hidroksit yakalama çözeltisi ile koroner atık 14 CO 2 nicel iyileşme oluşur. H 14 CO3- perklorik asit ile tampon asitleştirmeyi takiben elde edilmektedir 14 CO2 çözündürüldü. Numuneler zamanla 14 CO2 kaybına neden olur hava ve numune arasındaki gaz pasif difüzyon olarak iyileşme hemen sonra işleme tabi tutulmalıdır. Parıldama şişeler sıkı perklorik asit ekledikten sonra 14 CO2 kaybını önlemek için kauçuk kol stoper kapatılmalıdır. Gerekirse, parafilm ile kauçuk t sabitlemek için kullanılabilirşişeler (Şekil 2).
- Cam sintilasyon şişelerine tarafından temin edilebilen Plamine® 10x konsantre edilmiş hidroksit (örnek başına bir şişe + arka plan aktivitesi tayini için iki ilave şişeleri) 1 ml ilave edilir.
DİKKAT: temin edilebilen Plamine® ve hidroksit yüksek derecede toksik ve ciddi yanıklara neden olur. Uygun kullanım ve depolama için ürün MSDS başvurun. - Cımbızları ince bir şişe temin edilebilen Plamine® bir hidroksit ile önceden doldurulmuş, 0.5 mi, koroner çıkış örneği içeren 2 mi kapaksız mikrosantrifüj tüpü aktarın. Arka plan aktivitesi tayini için, 0.5 ml perfüzyon tamponu kullanın.
- Bir lastik kol tıpa ile flakon Cap. Parafilm şişenin sızdırmazlık sağlamak için kullanılabilir. (:% 60 w% ağırlık) lastik kovan tıpa ile doğrudan 2 mL kapaksız tüpüne 1 ml şırınga ve 23 G, uzun bir iğne kullanarak, perklorik asit, 200 ul enjekte edilir.
NOT: Koroner atık nedeniyle BSA yağış beyaz dönmelidir. - şişeler s Letbir gecede.
UYARI: Perchloric asit son derece aşındırıcı bir oksitleyici olarak hareket ve / veya patlama tehlikesine neden olabilir. Uygun kullanım ve depolama için ürün MSDS başvurun. - Ertesi gün, lastik kol tıpa kaldırın. Dikkatle cımbız ile, her 2 mi kapaksız tüp almak ve temin edilebilen Plamine® hidroksid tüm almak için 1 ml sintilasyon kokteyli ile açık bir viyal üst borunun alt yıkayın. Uygun bir şekilde etiketlenmiş radyoaktif atık konteynerine kapaksız tüp atın.
- flakon başına ek 9 ml sintilasyon kokteyli ekleyin. spesifik aktivitesinin belirlenmesi için 10 ml sıvı sintilasyon kokteyli ile doldurulmuş iki şişeye doğrudan 0.5 mi perfüzyon tamponu ekleyin. kuvvetlice elle şişeleri sallamak ve hava kabarcıkları uygun çift etiket deneyler için ayarlanmış bir sıvı sintilasyon sayacı ölçüm önce dağıtmak için izin için en az 6 saat bekleyin.
NOT: Ne görselleştirmek için şeffaf cam şişeleri kullanınEdle kauçuk kol tıpa delici zaman. Bu reaksiyonu berbat edecek şekilde temin edilebilen Plamine® ve hidroksit içine perklorik asit düşürmeyin. Perklorik asit bültenleri havaya koroner atık 14 CO 2 ekleme. Şişeler sıkıca kapatılmalıdır ve 14 CO 2 tüm hidroksit temin edilebilen Plamine® içine sıkışmış gerekmesine rağmen, kimyasal davlumbaz altında bu testte gerçekleştirmek için tavsiye edilir.
Miyokard oleat Oksidasyon Oranlarının Belirlenmesi 7.
Not: Yöntem kuvvetli anyon değiştirme reçinesi kullanılarak koroner akıntıdan, 3, H2O kantitatif ayırma ve geri kazanım dayanır. 14 CO 2 kurtarma aksine, hiçbir örnek istikrar sorunu var ve koroner atık tahlil yapmadan önce buz üzerinde tutulmalıdır veya derin dondurucuda saklanabilir.
- anyon değiştirici reçine sütunları (numune + t başına bir sütun hazırlayıncam yünü ile 3 ml şırınga tüplerin ucu doldurarak zemin aktivitesi tayini) için ekstra sütunlar wo. Reçine şırınga tüp 2 ml işaretine kadar bir transfer pipet yardımıyla reçine / su bulamacı ekleyin.
- sütun üzerinden 2 ml saf su geçirilerek reçine yıkayın. Bu adımı iki kez daha tekrarlayın.
- sütunların altında açık parıldama şişeleri yerleştirin ve 0.5 ml kolon başına koroner atık yükleyin. arka plan aktivitesinin belirlenmesi için 0.5 ml perfüzyon tampon yükleyin.
- 0.5, 1 ve 2 mi ultra saf su ile arka arkaya sütun yıkayın. elüsyon yapıldıktan sonra, uygun bir şekilde etiketlenmiş radyoaktif atık konteynerine sütunları atın.
- sintilasyon flakon başına 13 ml sıvı sintilasyon kokteyli ekleyin. spesifik aktivitesinin belirlenmesi için 13 ml sıvı sintilasyon kokteyli ile doldurulmuş iki şişeye doğrudan 0.5 mi perfüzyon tamponu ekleyin. kuvvetlice şişeleri sallayın ve bir sıvı bilim ölçüm önce en az 6 saat bekleyinntillation sayacı uygun ikili etiket deneyler için ayarlanmış.
8. Hesaplamalar
- Eğer hala yapmadıysanız, bütün perfüze kalp ıslak ağırlığını belirlemek.
NOT: moleküler ve biyokimyasal analizler sonra kalan dokuda yapılacak eğer dondurulmuş doku Çözülme izin vermeyin. - Bütün perfuse-kalpten bir doku örneğinin ıslak ağırlığını belirlemek (bütün kalbi yaklaşık 15 ila 30% kullanın). gece boyunca 50 ° C'ye ayarlanmış bir fırın içinde ince dokulu numuneyi ve kuru ağırlığı ölçülür. gram bütün kalp kuru ağırlığının belirlenmesi için doku örneğinin yaş ağırlığı / kuru ağırlık oranı kullanarak (g kuru ağ.).
- Her zaman noktası x ml / dak koroner akım CF x değerini ifade eder.
- glikoz oksidasyonu hızının belirlenmesi
- Belirlenme 14 ° C arka plan aktivitesi için ölçülen iki parçalanma / dk (dpm) değerleri ortalamasınıdüzeltme faktörü 14C dpm ba KD.
- 14 C spesifik aktivite 14C dpm sa değerini ortalama belirleyin.
- Formülü uygulayarak dpm / umol (F Glu) glikoz özel radyoaktivite tespit
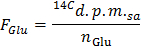
NOT: Burada n, Glu (umol) = C Glu (umol / L) * Numune hacmi (L) = 2.5, 5 mmol / L glukoz kullanılarak ve 0.5 ml örnek. - Aşağıdaki formüle uygulayarak dpm / dakika (A), 14 CO2 üretim hızının X, her bir zaman noktası için belirleme
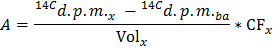
NOT: Nerede Cilt x (ml) = 0.5 - Kuru kalp ağırlığının belirlenen değerine göre Divide A 14 CO 2 üretimi normalize oranı (A Norm elde etmek için ) dpm / dak.
- GO A Norm / F Glu g kuru ağırlık başına glukoz / dk umol glikoz oksidasyonu (GO) oranını elde etmek için = formülü uygulayın.
- Oleat Yükseltgenme Oranı Belirlenmesi
- Düzeltme faktörü 3H dpm ba belirlemek için 3 H arka plan aktivitesi için ölçülen iki parçalanma / dk (dpm) değerlerinin ortalamasını alın.
- 3H spesifik aktivite 3H dpm sa değerini ortalama belirler.
- Formülü uygulayarak dpm / umol (F Ol e) oleat özel radyoaktivite tespit
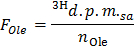
NOT: Nerede n Ole (umol) = C Ole (mmol / L) * örnek hacmi (L) = 0.2 0.4 mg / L oleat kullanılarak ve 0.5 ml örnek. - Her tim için belirlemeE noktası dpm / dakikada (B) 'de 2, aşağıdaki formüle uygulayarak 3H üretim oranı x
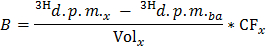
NOT: Nerede Cilt x (ml) = 0.5 - Kuru kalp ağırlığına saptanmış değeri ile bölün B g kuru ağırlık başına dpm / dak 3 H2O (B norm) üretim normalleştirilmiş oranı elde edildi.
- = B Norm / F Ole g kuru ağırlık başına oleat / dk umol içinde oleat oksidasyon (OO) oranını elde etmek için formül OO uygulayın.
Sonuçlar
İki Örnek deneyler aşağıdaki şekillerde tarif edilmektedir. Her iki durumda da, 16 haftalık erkek Sprague Dawley sıçan kalbi izole edilmiştir ve önceki protokole göre hazırlandı KH tamponu ile çalışma modunda perfüze. Her deneyde, kalp, kalp çalışma değiştirmek için bir stres durumu tabi tutulmuştur. Kalp kasılma fonksiyonu aort hattına bir basınç transdüktörünün yerleştirilmesi ile ve kalp gücünün belirlenmesi ile nabız basıncı sürekli kayıt ile...
Tartışmalar
önceki protokol aynı zamanda izole çalışma sıçan kalbinde glukoz oksidasyonu ve yağ asidi oksidasyon yoluyla substratın akı ölçmek için yöntemler göstermektedir. Ölçümler daha sonra (... vb iş yükü değişimi, iskemi-reperfüzyon) taban ve stres koşullarında yüzeyler metabolizma ve kalp çalışma arasındaki ilişkiyi belirlemek için kaydedilen kardiyak fonksiyonel parametrelere yerleştirilebilir. Metabolizma / daralma ilişkisi, kalp yetmezliği ve diyabet gibi önceden var olan koş...
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
Referanslar
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır