A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטות לקביעת המחירים של גלוקוז ו חומצות שומן חמצון שבלב עכברוש העבודה המבודד
In This Article
Summary
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
Abstract
הלב היונק הוא צרכני גדולה של ATP ודורש אספקה קבועה של מצעי אנרגיה להתכווצות. באופן לא מפתיע, שינויים של חילוף החומרים בשריר הלב קושרו להתפתחות של ליקוי התכווצות ואי ספיקת לב. לכן, לפרום את הקשר בין מטבוליזם והתכווצות צריך לשפוך אור על כמה מן המנגנונים השולטים הסתגלות לב או maladaptation במדינות מחלה. הכנת לב עכברוש המבודדת עובדת יכולה לשמש כדי לעקוב אחר, בו זמני ובזמן אמת, פונקצית התכווצות לב שטף של אנרגית מתן מצעים לתוך מסלולי מטבוליים חמצונים. הפרוטוקול הנוכחי נועד לספק תיאור מפורט של השיטות המשמשות בהכנה וסילוק מאגרים למדידת כמותית של שיעורי חמצון עבור הגלוקוז וחומצות שומן, האנרגיה העיקרית בו תינתן מצעים של הלב. השיטות השונות שהופעלו לניתוח מדגם נתונים לפרשנות גם הם דנו.קיצורו של דבר, הטכניקה מבוססת על אספקת 14 C- גלוקוז רדיואקטיבי וכן 3 H- חומצת שומן ארוכת שרשרת רדיואקטיבי אל הלב הפועם vivo לשעבר דרך זלוף גְבִישָׁן normothermic. 14 CO 2 ו -3 H 2 O, תוצרי לוואי סוף התגובות האנזימטית המעורבות בניצול מצעי מתן אלה אנרגיה, הם התאוששו באופן כמותי מן השפכים כלילית. עם ידע של הפעילות הספציפית של המצעים רדיואקטיבי בשימוש, אז זה ניתן בנפרד לכמת את השטף של גלוקוז וחומצה שומני מסלולי החמצון. פונקצית התכווצות של הלב המבודד ניתן לקבוע במקביל ציוד ההקלטה המתאים ו בקורלציה ישירות לערכי שטף מטבולית. טכניקה זו שימושית מאוד ללמוד את הקשר מטבוליזם / התכווצות בתגובה לתנאי קיצון שונים כגון שינויים טרום ואחרי עומס איסכמיה, תרופה או circulaגורם טינג, או בעקבות שינוי בביטוי של תוצר הגן.
Introduction
רלוונטי קליני
בלב היונק, קיים קשר חיובי חזק בין השטף של מצעים דרך מסלולי מטבוליים חמצונים, דור ה- ATP ו -1 עבודת לב. במהלך שני העשורים האחרונים, חקירת הקישור המורכב בין מטבוליזם לב והתפקוד הובילה להכיר כי השינויים במטבוליזם לב הן גורמות לטיפול באין התכווצות ואולי שיפוץ מבני פתולוגיים את ההגדרה של סוגים שונים של מחלות לב 2-4. לכן, צפוי כי הבנתנו את המנגנונים השולטים שיפוץ המטבולית של הלב הדגיש תוביל לזיהוי מטרות טיפוליות למניעה או לטיפול באי ספיקת לב 5-7. הפרסום האחרון של קביעה מדעית מן איגוד הלב האמריקאי על "הערכת מטבוליזם לב" מדגיש את העניין הגובר של הקהילה המדעית לאבתחום המחקר שלו 8. אבל בעוד ההתקדמות הטכנולוגית בתחום ההדמיה הלב עכשיו לאפשר הערכה מדויקת ומהירה של מורפולוגיה לב ותפקוד, המחקר in vivo של מטבוליזם הלב נשאר מוגבל ומכבידות: תהודה מגנטית גרעינית ספקטרוסקופיה (NMR) ו טומוגרפיית פליטת פוזיטרונים (PET) יכול הדמיה להשתמש כדי לעקוב אחר מטבוליזם פוספט גבוה אנרגית לב ופעילות מחזור קרבס, אבל טכניקות אלה הם הטרידו עלויות תפעול גבוהות ועל ידי חוסר היכולת שלהם לקבוע את התרומה של מצעים שונים כדי מטבוליזם חמצונים בתנאים יציבים 9 .כדי למועד זה vivo לשעבר עבודה הכנה הלב מייצג את הטכניקה היחידה וייחודי לטובת לימודים, בו זמנית ובזמן אמת, הפונקציה התכווצות ושטף של מצעים לתוך מסלולים מטבוליים חמצוני 7,9. הפרוטוקול הבא נועד לספק הנחיות בהכנה וסילוק חומרים כימיים המשמשת לקביעת העכברושes של ניצול מצעים בלב עכברוש עבודה המבודד.
מנגנון הלב המבודד עבודה המכרסמת
למרות הטכניקה היא כמעט בן חצי מאה, הכנת לב עכברוש המבודדת עובדת נשארת שיטת הבחירה של מחקר לב וכלי דם. כמו במקרה של הכנת לב Langendorff, בלב מכרסמי עבודה מציע דרך פשוטה יחסית, אמינה, ולא יקרה כדי למדוד מגוון רחב של פרמטרי לב במנותק תופעות הבלבול של איברים אחרים, neurohormonal וגורם במחזור שני. אלא שבניגוד בלב-perfused Langendorff, בלב העבודה ממשיך לבצע עבודת לב הכמעט פיזיולוגית, דרישה מוקדמת עבור הדור של שטף מטבולים של חמצון לרמות שרלוונטיות תנאי in vivo. זו מושגת על ידי מתן למאגר זלוף אל החדר השמאלי (LV) באמצעות צינורית מחובר הפרוזדור השמאלי, וככל LV מילויי חוזים,החיץ נפלט דרך קו אב העורקים כנגד לחץ ההידרוסטטי afterload נחוש. העיצוב של מנגנון זלוף תאר במקור על ידי ונילי ועמיתיו 10 השתפרו לאחר מכן על ידי Taegtmeyer, אמרות שמלות וקרבס 11, אבל השתנה מעט מאוד מאז. כפי שתואר במנגנון המקורי, הפונקציה התכווצות ניתן להעריך באמצעות קביעת תפוקת הלב, באמצעות לא יותר משורה ו סטופר למדוד אבי העורקים הכליליים זורם 10,11. מספר ספקים מציעים כעת מערכות זלוף הלב מכרסם עבודה מלאה. ניתן לרכוש מסחרית אלה מנגנון זמין עם flowprobes, מתמרים ללחץ, קטטר לחץ-נפח וכל הציוד הדרוש לרכישת נתונים תפקודית לב וניתוח. הספקים לספק הפעלות תיעוד והכשרה מקיפות להכיר המשתמש החדש עם הציוד שלהם. מאמרי ביקורת אחדים גם פרוטוקולים בפירוט על instrum הלב עובדentation ועל השימוש צנתרים למדוד תפקוד הלב במכרסמים 12-15. מסיבה זו, אנו בקצרה רק לדבר על ההגדרה של מנגנון זלוף וציוד ההקלטה. הפרוטוקול הנוכחי דווקא שואפת להשלים את המידע שכבר זמין עם תיאור של שיטות שניתן ליישם בו זמנית למדוד את שיעורי גלוקוז וחמצון חומצות שומן ארוכות שרשרת, שני מצעים לספק אנרגיה מרכזי בלב נורמלי. אנו מתארים כאן את כל השלבים הכרוכים בשימוש מצעים אנרגיה radiolabeled להערכת מטבוליזם חמצוני שריר הלב, מן ההכנה של ריאגנטים מאגרים להתאוששות ועיבוד של דגימות, לניתוח נתונים.
עקרונות השיטה
Cardiomyocytes ליצור את חלק הארי של האנרגיה שלהם התכווצות מן זרחון חמצוני של חומצות שומן (חומצות שומן ארוכות שרשרת בעיקר) ופחמימות (glucosדואר ומיניקות). הלב מאוד מוגבל עתודות אנרגטיות מסתמך על אספקה סדירה של מצעי מתן אלה אנרגיה מהמחזור. פירוק של גלוקוז דרך מסלול glycolytic מניב פירובט אשר decarboxylated מכן על ידי מורכבות פירובט דהידרוגנאז של קרום המיטוכונדריה הפנימית. חומצות שומן ארוכות שרשרת, המופק במחזור טריגליצרידים אלבומין או ליפופרוטאין, מופעלים הראשון למולקולות acyl-CoA reductase ב cytosol ובהמשך מועבר בתוך מטריקס המיטוכונדריה דרך הסעות קרניטין להיכנס מסלול-חמצון בטא. המולקולות-CoA אצטיל המיוצרות על ידי הפירוק של הגלוקוז וחומצות שומן לתדלק במעגל קרבס על מנת ליצור את ושווי הצמצום (NADH ו FADH 2) אשר נמצאים בשימוש על ידי שרשרת העברת אלקטרונים לבנות את כוח פרוטון-המניע פני קרום המיטוכונדריה הפנימי ליצור ATP דרך הפעילות של ה- ATP synthase. מים ופחמן דו חמצני הם תוצרי לוואי הסוףהתגובות האנזימטית המתרחשות בתוך במעגל קרבס. אספקת 14 C- ו -3 H- מצעים רדיואקטיבי (כגון 14 גלוקוז C-רדיואקטיבי ו -3 H-רדיואקטיבי חומצה אולאית) ללב עובד מבודד וכתוצאה מכך יוביל לייצור 14 CO 2 ו -3 H 2 O אשר יכול להיות התאושש כמותית מן השפכים כלילית. האוסף של 14 CO 2 מתבצע על ידי שמירה על לב perfused מבודד לתוך תא אטום על ידי מייד לשחזר את השפכים כלילית עם יציאתו בלב. טור אניוני קטן משמש להפריד ולשחזר 3 H 2 O מן השפכים כלילית. רדיואקטיביות ממדגמים המעובד נמדדת עם מונה נצנץ נוזלי, ועם ידע של הפעילות הספציפית של המצעים רדיואקטיבי בשימוש, אז זה ניתן בנפרד לכמת את השטף של גלוקוז וחומצה שומניחמצון מסלולי 16,17.
Protocol
הערה: כל הנהלים בעלי חיים בוצעו בהתאם למדיניות השירות לבריאות NIH ציבורי על טיפוח האדם ושימוש בחיות ואושרו על ידי טיפול בבעלי חיים מוסדיים ועדת שימוש של אוניברסיטת מיסיסיפי המרכז הרפואי. כל הנהלים בתחום השימוש רדיואיזוטופים אושרו ובוצעו על פי הנחיות שקבע המשרד בטיחות קרינה של המרכז הרפואי של אוניברסיטת מיסיסיפי.
1. הכנת תמיסות בופר סטוק ריאגנטים
- קרבס-Henseleit (KH) פתרונות למלאי
- כן 2 ליטר של פתרון מניות מלח מרוכזים 20x המכיל (ב mol / L) 2.37 NaCl, KCl 0.0948, 0.0236 KH 2 PO 4, ו 0.0236 MgSO 4 * 7H 2 O. סנן על יחידת סינון גודל 0.45 מיקרומטר הנקבוביות ולאחסן בטמפרטורת החדר למשך חודש עד 1.
- כן 2 ליטר של פתרון 20x מרוכז (0.5 mol / L) של NaHCO 3. הפתרון יכול להיותלאחסן בטמפרטורת החדר לתקופה בלתי מוגבלת של זמן.
- כן 250 מיליליטר של פתרון מניות 1 mol / L של CaCl 2. סנן על יחידת סינון גודל 0.45 מיקרומטר הנקבוביות ולאחסן בטמפרטורת החדר למשך חודש עד 1.
- המרה של אניוני שרף מן כלורידי לטופס הידרוקסיד
- שטפו את שרף אניוני ידי resuspending אותו במים ultrapure 1 L. אפשר שרף להתיישב ויוצקים את המים העודפים. חזור על שלב זה 4 פעמים יותר.
- יוצק את השרף בבעל מסנן אבק הזכוכית microanalysis רכוב על בקבוק סינון.
- המרת שרף לטופס הידרוקסיד ידי עובר לאט עד 22 כרכים של 1 N NaOH. מערבבים את התערובת הדלילה לסירוגין עם מרית נירוסטה.
- לשטוף את השרף עם מי ultrapure עד pH יורד מתחת 9.0. בדוק את ה- pH קבוע על ידי טבילת רצועת pH בדיקה קרובה לפני השטח של slurry שרף. מכסים ושומרים שרף עם מי ultrapure לתוך boבקבוק זכוכית rosilicate ולהגן מפני אור. אל תאפשרו שרף להתייבש לפני השימוש.
הערה: כאשר הם מאוחסנים כיאות, השרף יימשך 3 חודשים לפחות.
- חומצה אולאית אלבומין פתרון 8x מרוכז במלאי
- בבקבוק 4 L Erlenmeyer, לערבב 200 מ"ל של פתרון המניות מלח מרוכזת 20x ו -200 מ"ל של 20x הפתרון NaHCO 3 מרוכז עם מים ultrapure 3.6 L.
- באמצעות צינור פיזור גז עם גליל fritted, גז הפתרון במשך 15 דקות בתערובת של פחמן דו-חמצני 5% וחמצן 95% כדי לייצב את רמת החומציות.
- יוצקים 470 מ"ל חיץ בתוך כוס זכוכית 1 ליטר. להוסיף 8.75 מ"ל של תמיסת 1 mol / L CaCl 2 המניות למאגר 3530 מ"ל הנותרים בבקבוק 4 L Erlenmeyer ומניחים בצד.
- להוסיף 40 גרם של BSA נטול חומצה שומן אל כוס 1 ליטר זכוכית ומערבבים עם בר ומערבבים עד שהיא נמסה.
- בתוך צינור חרוטי 15 מ"ל, להכין 4 מ"ל של 50% (v: v) פתרון אתנול במים ultrapure. להוסיף 487 מ"ג sodiuמ oleate ו מערבולת עד שהאבקה נמסה לגמרי.
הערה: חוקרים אחדים להשתמש בחומצה פלמיטית במקום חומצה אולאית במאגר זלוף. פתרון מניות פלמיטית וחומצה-אלבומין ניתן הוכן לאחר אותו ההליך. עם זאת, מומלץ לחמם את הפתרון ב 70 ºC להשיג solubilization המלא של palmitate נתרן. - מוסיפים את dropwise פתרון oleate לפתרון BSA נטול חומצה שומן תחת בחישה מתמדת ולהמתין 10 דקות יותר עבור תרכובת חומצות-BSA אולאית להיווצר.
הערה: צריך הפתרון בצבע צהוב בהיר ולהיות נטול חלקיקים גלויים. נוכחות של משקע או חלקיקים מסיסים עשויה להצביע על נטייה שלמה של חומצת שומן BSA. אם זה יקר, הפתרון צריך להיות מושלך ואת התהליך התחיל מהתחלה.
הערה: Palmitate יהיה להאיץ אם זה מותר לשבת פיפטה ולא ניתן להוסיף dropwise. פתרון בחש של BSA יכול להיות מחומם ב 37 ºC כדי להקל bindinגרם של חומצה פלמיטית. לא לחמם יותר מדי מכיוון שהם עלולים לגרום denaturation וצבירה של BSA.
זהירות: השלבים הבאים של פרוטוקול זה כרוך המניפולציה של חומר רדיואקטיבי. תלבש PPE המתאים ובצע את תקנות סילוק בטיחות ופסולת שקבעו משרד בטיחות קרינה של המוסד. - להוסיף 160 μl (0.8 MCI) [9,10- 3 ח] חומצה אולאית לפתרון התעוררות של BSA חומצה אולאית ומערבבים במשך 10 דקות אחר.
- להוסיף 2.5 מיליליטר של פתרון 1 mol / L CaCl 2 מניות פתרון ההתעוררות של BSA חומצה אולאית.
- חותכים כ -1.2 מ 'צינורות קרום דיאליזה ולשטוף ומחוצה עם מי ברז. שפשפו את צינורות דיאליזה במרץ תחת מי ברז במשך 10 עד 15 דקות כדי להסיר את הציפוי גליצרול של הממברנה. לחילופין, להסיר את הציפוי על ידי השריית צינורות דיאליזה במים חמים למשך שעה 1 לפני השימוש. סיום על ידי שטיפת צינורות דיאליזה עם שתיית ultrapurer.
- מאובטח לקשור את קצה אחד של צינור הדיאליזה. מלא את פתרון חומצת אולאית BSA ולקשור את הקצה השני של צינור הדיאליזה.
- מניח את צינורות דיאליזה המלאות לתוך 4 בקבוק Erlenmeyer L של חיץ KH ולאפשר dialyzing הלילה ב 4 מעלות צלזיוס מתחת ערבוב עדין עם בר ומערבב.
- למחרת, להסיר את הפתרון חומצה אולאית BSA מרוכז 8x מן צינורות דיאליזה. השתמש פתרון חומצה אולאית BSA מיד זלוף או aliquot ולאחסן ב -20 ºC. aliquots הקפוא יציב במשך 2 חודשים לפחות. הימנע מחזורים להקפיא להפשיר מרובים כמו זה עשוי לסכן את המסיסות של תרכובת החומצות-BSA אולאית.
הערה: מים ultrapure השתמש רק (התנגדות של 18.2 MΩ.cm ב 25 ºC, פחמן אורגני כללי <10 ppb, מיקרו-אורגניזמים ≤ 1 CFU / ml, חלקיקים עם גודל מעל 0.22 מיקרומטר ≤1 / מ"ל) כדי להכין את ריאגנטים מאגרים המשמש זלוף לב. המרה של שרף אניוני מ כלוריד שלה עבורמ לטופס הידרוקסיד יכול להימנע על ידי רכישה ישירה של טופס הידרוקסיד חשבון נוסף (ראה לוח חומרים). מלבד oleate או palmitate, כל סוג אחר של חומצת שומן טבעית יכול לשמש גם, כל עוד גרסת tritiated של חומצת השומן זמינה לעקוב החמצון שלה.
2. הכנת מאגר זלוף
- בבקבוק 4 L Erlenmeyer, לערבב 200 מ"ל של פתרון המניות מלח מרוכזת 20x ו -200 מ"ל של 20x הפתרון NaHCO 3 מרוכז עם מים ultrapure 3.6 L. בגז הפתרון במשך 15 דקות בתערובת של פחמן דו-חמצני 5% וחמצן 95%, ולאחר מכן להוסיף 10 מ"ל של פתרון 1 mol / L CaCl 2 המניות כדי לקבוע את הריכוז של Ca חינם 2 + 2.5 מילימול / ליטר.
זהירות: השלבים הבאים לערב את המניפולציה של חומר רדיואקטיבי. תלבש PPE המתאים ובצע את תקנות הבטיחות ופסולת לרשות שקבע ra של המוסדמשרד בטיחות diation. - העבר 1.750 L KH חיץ בקבוק זכוכית בורוסיליקט 2 L. הוסף 250 מ"ל של 8x מרוכזת פתרון חומצה אולאית BSA, 1.802 גרם D- גלוקוז, 400 אינסולין μl 0.4 U / ml, ו -200 μl (0.2 MCI) [U- 14 C] גלוקוז. הפוך בקבוק לערבב. זה ייתן 2 ליטר של חיץ זלוף מלא המכיל חומצה אולאית (0.4 mmol / L), D- גלוקוז (5 mmol / L), ואינסולין (40 μU / מיליליטר).
הערה: נפח של 2 ליטר מספיקה כדי perfuse לב חולדה בוגרת עבודה בתנאי הלא הסירקולציה המחודשת לפחות 60 דק '. - להשתמש בחלק למאגר KH שאינם רדיואקטיביים למלא שתי מנות לנתיחה ומניחים על קרח כדי לקרר.
3. הכנה של מנגנון זלוף
הערה: החוקר יכול לבחור להשתמש במנגנון שהותקן זלוף כגון זה המתואר על ידי Taegtmeyer, אמרות שמלות וקרבס 11, או אחת מהמערכות הזמינות המסחרי. מערכות זלוף בדרך כלל מורכבות שלאלמנטים כמתואר באיור 1 להלן. מלבד הצינורות וכלי הזכוכית, שאר ציוד ההקלטה הוא אופציונאלי והניצול שלה יהיה תלוי על הצרכים של החוקר להתייחס לשאלה הניסיונית שהתבקש. עם זאת, אנו ממליצים על שימוש microelectrodes חמצן כדי לקבוע את ריכוז O 2 ב חדיר החיץ והיציאה במחזור הכליליים (איור 1). זה יעזור השליטה החוקר כי הלב מסופק עם כמות מתאימה של חמצן, וכי אספקת החמצן אינו משתנה בין הניסויים. בנוסף, קביעת הבדל החמצן "arteriovenous" יכולה לשמש כדי לחשב את צריכת חמצן של שריר לב יעיל לב 16,18.
- הפעל באמבט מים במחזור ולהגדיר ב 37 ºC לחמם את מנגנון זלוף.
- הפעל את המחשב ואת מערכת לאיסוף וניתוח נתונים כי יהיהלשמש למדידת תפקוד הלב.
- חבר את התקני ההקלטה (קטטר לחץ, קטטר לחץ-נפח, microelectrodes חמצן, מדידת זרימה, וכו ') למערכת רכישת נתונים ולבצע כיול של המכשירים הבאים הוראות היצרן.
- מלאו את מיכל חיץ עם מים ultrapure. הפעל את משאבת peristaltic ו לרוקן את המים דרך כל הצינורות ומוצרי זכוכית כדי לשטוף את המערכת. כבה את המשאבה peristaltic ולוודא לא נשאר מים בצינור ו / או כלי זכוכית, מכיוון שהדבר עלול להשפיע על ריכוז של למאגר זלוף הכנת הלב.
- חבר מסנן סיב זכוכית חדש 1.0 מיקרומטר למערכת. חבר את מיכל הדלק המכיל תערובת של פחמן דו חמצני 5% וחמצן 95% לתא מחמצנים.
זהירות: השלבים הבאים לערב את המניפולציה של חומר רדיואקטיבי. תלבש PPE המתאים ובצע את תקנות הבטיחות ופסולת לרשות שקבע המוסדמשרד בטיחות קרינה s '. - מלאו את מיכל חיץ עם חיץ זלוף. הפעל את המשאבה ולהבטיח מילוי של כל צינורות זכוכית עם למאגר זלוף. הפעל למאגר זלוף דרך מנגנון זלוף במצב הסירקולציה המחודשת ואת oxygenate לפחות 30 דקות לפני השימוש.
- בחוזקה לצרף את הצינור של מזרק 20 מ"ל מתחת לתא הלב לשחזר את השפכים כלילית. חבר את קצה המזרק לחלק העליון של שסתום משולש. חבר הזרוע בצד מזרק 3 מ"ל. חבר את הזרוע התחתונה דרך צינורות אל מיכל לפסולת רדיואקטיבית נוזלית.
הערה: בעת שימוש חומצות השומן-BSA המורכב, חמצון של למאגר זלוף לא יכול להתבצע באמצעות מבעבע ישיר עם צינור פיזור גז כמו זה יגרום הקצפה מופרזת של הפתרון. השתמש oxygenator קרום (איור 1) או בתא oxygenating זרימת גיליון למטרה זו. מומלץ מאוד לאמת כי o ברמה מתאימהf חמצון הוא הגיע על ידי הצבת microelectrode חמצן במעגל זלוף (איור 1).
בידוד 4. עכברוש לב Cannulation
- לשקול עכברוש בסולם.
- הכן מזרק עם מינון ההרדמה של 150 מ"ג / ק"ג מימה מלח נתרן thiobutabarbital ומזרק טוברקולין עם 200 הפרין יחידות USP.
- להזריק thiobutabarbital IP ולחכות החיה לאבד את ההכרה. סוכני אינדוקציה אחרים יכולים לשמש עוד כמו זה יהיה לא להפריע מטרת הניסוי (ראו בחירה של ההרדמה בסעיף הדיון בהמשך).
- בדקו אם רמה מתאימה של הרדמה על ידי מאשר היעדר רפלקס קמצוץ בוהן. הקפד לשמור על עומק נאות של הרדמה כדי להבטיח כי בעל החיים לא מרגישים כאב במהלך ההליך.
- לאחר העכברוש הוא מחוסר הכרה לחלוטין אינו מגיב קמצוץ בוהן, למקם אותו על גבה על שולחן הניתוחים השניגפיים יור עם קלטת או סיכות.
- קליפ חינם הבטן של השיער לבצע חתך קו האמצע של הבטן. אין לפתוח את בית החזה בשלב זה עדיין. זוז בקיבה ובמעי הצידה כדי לחשוף את הווריד הנבוב הנח. להזריק את הפרין ישירות לתוך הווריד הנבוב הנח ולחכות 5 עד 10 שניות לפני שתמשיך.
- מספרי שימוש לחתוך את הסרעפת ואת צידי בית החזה כדי לחשוף את התוכן של חלל החזה.
- בעדינות לתפוס את הלב בין האגודל, האצבע והאמה ובלו הן הלב והריאות יחד. חותכים ברמה של אבי העורקים היורד, נזהר שלא לפגוע קשת אבי העורקים ואת האאורטה עולה בתהליך. מייד להעביר לב וריאות לאחד הכלים לנתיחה מלאים חיץ קר כקרח KH.
- אחרי הלב מפסיק לפעום, להעביר לתוך הצלחת לנתיחה השנייה לקצץ את כל חתיכות גדולות של רקמת ריאה מחוברות תוך שמירה על הלב שקוע חיץ KH קר כקרח. חותך את היורדיםing האאורטה ממש מעל קשת אבי העורקים.
זהירות: השלבים הבאים לערב את המניפולציה של חומר רדיואקטיבי. תלבש PPE המתאים ובצע את תקנות סילוק בטיחות ופסולת שקבעו משרד בטיחות קרינה של המוסד. - שטוף את קו אבי העורקים של מנגנון זלוף למלא צינורית אבי העורקים עם חיץ חם ולמען הסר מים או אוויר שעשויים עדיין להיות נוכח בצינור. אפשר למאגר זלוף לטפטף מן צינורית אב העורקים כדי לצמצם את הסיכוי של תסחיפי אוויר אז בלב מחובר הצינורית.
- השימוש בשתי מלקחיים לנתח מיקרו לפתוח בזהירות את אבי העורקים והחלק את הלב לעלות על צינורית אבי העורקים. אבטח את אבי העורקים על צינורית עם קליפ מיקרו וליזום זלוף Langendorff של הלב. שים הלב מתחיל לפעום שוב לגרש את כל הדם שנותר בכלי הדם הכליליים בשניות לאחר תחילת זלוף.
הערה: חשוב מאוד כדי לבצע שלבים 4.6 עד 4.10 מהר ככל האפשר כדי למנוע נזק בלתי הפיך איסכמי ללב. עם ניסיון, ההליך כולו צריך לקחת בין 1 ו -2 דקות. כאשר הזזה האאורטה על צינורית, היזהר שלא להעביר את שורש האאורטה מכיוון שהדבר עלול לגרום hypoperfusion שריר הלב ונזק שסתום אבי העורקים. - לקשור את אבי העורקים אל אבי העורקים צינורית עם תפר משי 3-0 ולהסיר את הקליפ מיקרו. אתר את עורק הריאה. זה עשוי להיות נחוץ כדי לקצץ את הרקמות הלא לב למצוא אותו, אבל לא לחתוך יותר מדי של הרקמות הלא לב כפי שהם ישרתו לקשור הפרוזדור השמאלי הצינורית.
- שטוף את קו פרוזדורים השמאלי של מנגנון זלוף למלא צינורית פרוזדורים עם חיץ חם ולמען הסר מים או אוויר שעשויים עדיין להיות נוכח בצינור. היזהר במיוחד כדי להסיר כל בועות אוויר מן המנגנון כדי לצמצם את הסיכוי של תסחיפי אוויר אז בלב מחובר הצינורית.
- השימוש בשתי forc לנתח מיקרוeps בעדינות לתפוס את פתיחת עורק הריאה והחלק את הלב לעלות על צינורית פרוזדורים. זה עשוי להיות נחוץ כדי לשנות את מיקום הלב על ידי החלפה בעדינות צינורית פרוזדורים ו / או אבי העורקים כדי להשיג את הצעד הזה. בכל מקרה, יש לוודא כי ההליך אינו מטיל עומס יתר על הלב ולגרום כיפוף של אב העורקים. לקשור את אטריום שמאל כדי צינורית פרוזדורים עם תפר משי 3-0.
- פתח את קו פרוזדורים ובמקביל לעבור לקו אבי העורקים ממצב Langendorff למצב פעולה. אם הדלפות חיץ מן הפרוזדור השמאלי, לסגור את קו הפרוזדורים, לחזור לקו אב העורקים אל זלוף Langendorff, ולהשתמש 3-0 אחר תפר משי לקשור הפרוזדור השמאלי בצורה מאובטחת יותר הצינורית.
מדידת 5. של תפקוד לב אוסף דוגמאות
הערה: הקביעה ונתיבים מטבולית תחייב את הידע של הזרימה כלילית (CF). כפי שנראה בהמשך, ערכי תזרים כלילית יכול להיותשהושגו עם שימוש פשוט של סטופר. בנוסף, מדידת זרימת אב עורקים (AF) עם השיטה הזהה תאפשר קביעת תפוקת לב (CO = CF + AF), אשר לאחר מכן ניתן להשתמש כדי לחשב כוח לב (CP) כאמצעי כללי של תפקוד לב על ידי יישום הנוסחה CP = CO (מ 3 / s) * afterload (Pa). שיטה נוספת זמינה עבור ההערכה של תפקוד לב מסתמכת על מדידה בזמן אמת של לחץ דופק עם מתמר לחץ (איורים 3 ו -4). למרות אופציונאלי, המדידות המדויקות והמפורטות ביותר של פונקצית התכווצות לב ופרמטרים המודינמיים, לרבות קביעת הסיסטולי של חדר השמאלי ופונקציות הדיאסטולי, תושגנה עם השימוש קטטר המוליכות לחץ-נפח (PV). סעיף זה מתאר בקצרה את צנתור הלב המבודד. מידע נוסף לגבי כיול המכשירים צנתרים PV וניתוח נתונים עם תוכנה סטטיסטית יכול להיותנמצא אזכור 14,15.
זהירות: השלבים הבאים לערב את המניפולציה של חומר רדיואקטיבי. תלבש PPE המתאים ובצע את תקנות סילוק בטיחות ופסולת שקבעו משרד בטיחות קרינה של המוסד.
- אם הניסוי כולל מדידה ישירה של תפקוד LV עם קטטר, לנקב את איפקס LV עם מחט 26 G ו להכניס את הקטטר באמצעות ניקור.
- בעת שימוש קטטר לחץ-נפח, בזהירות למקם את הקטטר כך פיר שלה מיושר עם ציר האורך LV, עם האלקטרודה דיסטלי ממש מתחת מסתם אאורטלי ובצמוד לגבול endocardial, ואת אלקטרודה הפרוקסימלי רק בתוך קיר החדר.
- חותם את הלב לתוך תא לב-במעיל מים וניטור פרמטרים פונקציונלי הלב עם תוכנת רכישת נתונים. התחל הקלטה לאחר פרמטרים לב בתחילת המחקר היו יציבים במשך יותר מ -5 דקות.
- קובע את זרימת כלילית ידי meaSuring את הזמן הדרוש כדי למלא את הצינור מזרק 20 מ"ל מצורף מתחת לתא הלב. לאחר המדידה, פתח את השסתום המשולש לרוקן את השפכים כלילית לתוך המכל פסולת הנוזלי רדיואקטיבי.
הערה: מדידות זרימה יכול גם להתבצע באמצעות מד זרימה ו flowprobes. - השתמש מזרק 3 המ"ל מצורף הזרוע בצד של השסתום המשולש להתאושש ~ 2 מיליליטר שפכים כלילית עם יציאתו בלב. העבר 0.5 מ"ל של הקולחים כלילית לתוך צינור microcentrifuge בלי כומתה, 2 מ"ל ומיד להמשיך עם קביעת שיעורי חמצון הגלוקוז (סעיף 6 להלן).
- מעבירים את שאר המדגם השפכים כלילית (~ 1.5 מ"ל) בצינור microcentrifuge שכותרתו כראוי ולאחסן על הקרח.
- חזור על שלבים 5.4 כדי 5.6 במרווחי זמן קבועים (למשל כל 5 דקות או 10) עד סוף הניסוי זלוף.
- אם באמצעות קטטר לחץ-נפח, להזריק בולוס 10 μl של תמיסת מלח היפרטוני (15%)לתוך קו הפרוזדורים וממש לפני צינורית הפרוזדורים לפני כריתת הניסוי. השתמש הזרקת בולוס זה כדי לחשב את המוליכות המקבילות (V p), שהוא קריטי עבור קביעה מדויקת של נפח לב 15.
- Unseal חדר הלב ולהסיר את הקטטר מן LV אם אחד שימש בניסוי. שחזור הלב באמצעות אחת מהאפשרויות הבאות:
- אם אין צורך לבודד אזורים ספציפיים של הלב עבור ניתוחים במורד ואם מנגנון זלוף מאפשר זאת, קרוב שתי השורות פרוזדורים אבי העורקים ומיד להקפיא-מהדק את הלב על קנולות שלה באמצעות מלקחיים Wollenberger מראש מקורר בחנקן נוזלי.
- לחלופין, לחתוך את הלב את קנולות ושחרר אותו למאגר KH קר כקרח. במהירות לייבש את הלב על מגבת נייר ולמדוד המשקל הרטוב שלה. הלב אז יכול להיות גזור דגימות רקמה שנאספו מדידות ספציפיות. להקפיא את הרקמה הנותרת באמצעות טונג Wollenbergerהים מראש מקורר בחנקן נוזלי.
- אחסן את רקמת הלב קפואה ב -80 ºC עד קביעת משקל יבש (ראה סעיף 8. חישובים).
6. קביעת מחירי חמצון גלוקוז שריר לב
הערה: השיטה מורכבת בהתאוששות כמותית של 14 CO 2 מן השפכים כלילית עם פתרון לכיד של הידרוקסיד של hyamine. 14 CO 2 מומס כמו H 14 CO3- הוא התאושש לאחר החמצה של חיץ עם חומצה על-כלורית. דוגמאות צריכות להיות מעובד מייד לאחר החלים דיפוזיה פסיבית של גז בין האוויר מדגם תגרום להפסד של 14 CO 2 לאורך זמן. צלוחיות הנצנץ צריכים להיות סגורות היטב עם פקקי גומי שרוול כדי למנוע האובדן של 14 CO 2 לאחר הוספת חומצה על-כלורית. במידת הצורך, ניתן להשתמש parafilm להבטחת פקקי שרוול גומי אלבקבוקונים (איור 2).
- הוסף 1 מיליליטר של 10x הידרוקסיד מרוכז של hyamine כדי בקבוקוני נצנץ זכוכית (בקבוקון אחד לדגימה + שני בקבוקונים נוספים לקביעת פעילות הרקע).
זהירות: הידרוקסיד של hyamine הוא רעיל ביותר וגורם לכוויות קשות. התייעץ עם MSDS המוצר לטיפול ואחסון מתאימים. - פינצטה שימוש בעדינות להעביר את צינור 2 מ"ל בלי כומתה microcentrifuge המכיל את המדגם השפכים 0.5 מ"ל כלילית על טרום מלא בקבוקון עם הידרוקסיד של hyamine. השתמש 0.5 מ"ל חיץ זלוף לקביעת הפעילות ברקע.
- כיסוי או בקבוקון עם פקק שרוול גומי. Parafilm ניתן להשתמש כדי לאבטח איטום של הבקבוקון. באמצעות מזרק 1 מ"ל ו מחט ארוכה 23 G, להזריק 200 μl של חומצה על-כלורית (60% w: w%) באמצעות פקק גומי שרוול ישירות לתוך הצינור בלי כומתה, 2 מ"ל.
הערה: השפכים כלילית צריך להלבין בשל משקעים של BSA. - תן s הבקבוקוניםאותו לילה.
זהירות: חומצה על-כלורית הוא מאכל מאוד, יכול לשמש מחמצן ו / או לגרום למפגע פיצוץ. התייעץ עם MSDS המוצר לטיפול ואחסון מתאימים. - למחרת, להסיר את פקקי שרוול גומי. בזהירות לאחזר צינור אחד בלי כומתה, 2 מ"ל עם פינצטה ולשטוף את החלק התחתון של הצינור על גבי הבקבוקון פתוח עם קוקטייל 1 מ"ל הנצנץ לאחזר כל הידרוקסיד של hyamine. מחק את הצינור בלי כומתה, מיכל פסולת רדיואקטיבית שכותרתו כראוי.
- הוסף קוקטייל נצנץ נוסף 9 מיליליטר לכל בקבוקון. הוסף 0.5 מיליליטר זלוף חיץ ישירות שתי צלוחיות מלאות 10 מיליליטר קוקטייל נצנץ נוזל קביעת הפעילות הספציפית. לנער את הצלוחיות נמרצות ביד ולהמתין לפחות 6 שעות כדי לאפשר בועות אוויר להתפוגג לפני המדידה מונה נצנץ נוזלי להגדיר כראוי לניסויי תווית כפולים.
הערה: השתמש צלוחיות זכוכית שקופות כדי להמחיש את needle כאשר פירסינג פקקי שרוול גומי. אל תפיל חומצה על-כלורית לתוך הידרוקסיד של hyamine כמו זה יהרוס לך את התגובה. הוספת משחרר חומצה על-כלורית 14 CO 2 מן השפכים כלילית לאוויר. למרות הצלוחיות צריכות להיות אטומות היטב וכל 14 CO 2 יש לכודים לתוך hyamine של הידרוקסיד, מומלץ לבצע assay זה מתחת למכסת מנוע הקטר הכימית.
קביעת 7. של שריר הלב Oleate חמצון המחירים
הערה: השיטה מבוססת על הפרדה כמותית והתאוששות של 3 H 2 O מן השפכים הכליליים באמצעות שרף אניוני חזק. בניגוד ההתאוששות של 14 2 CO, אין בעיה ליציבות מדגם הקולחים כלילית יכולים להישמר על הקרח או לאחסן במקפיא לפני ביצוע assay.
- הכן עמודות שרף אניוני (עמודה אחת לדגימה + tוו עמודות נוספות לקביעת פעילות רקע) על ידי מילוי קצה צינורות מזרק 3 מ"ל עם צמר זכוכית. מוסיף את slurry שרף / מים עם טפטפת העברה עד השרף מגיע לנקודת ציון של 2 מיליליטר על צינור המזרק.
- שטפו את שרף על ידי העברת מים ultrapure 2 מ"ל דרך העמודה. חזור על פעולה זו עוד פעמיים.
- מניח צלוחיות נצנץ פתוחות תחת העמודות ולטעון 0.5 מיליליטר שפכים כלילית לכל עמודה. טען 0.5 מ"ל חיץ זלוף לקביעת פעילות ברקע.
- שטוף את העמודות ברציפות עם 0.5, 1 ומי ultrapure 2 מיליליטר. לאחר elution נעשה, לבטל את העמודות מיכל פסולת רדיואקטיבית שכותרתו כראוי.
- הוסף קוקטייל נצנץ נוזלי 13 מ"ל לכל בקבוקון הנצנץ. הוסף 0.5 מ"ל זלוף חיץ ישירות שתי צלוחיות מלאות 13 מ"ל קוקטייל נצנץ נוזלי לקביעת פעילות ספציפית. לנער את הצלוחיות במרץ ולחכות לפחות 6 שעות לפני המדידה בתוך sci נוזלדלפק ntillation להגדיר כראוי לניסויי תווית כפולים.
8. חישובים
- אם לא עשה, לקבוע את המשקל הרטוב של הלב perfused כולו.
הערה: אל תאפשרי הרקמה קפואה להפשיר אם ניתוחים מולקולריים ביוכימיים הם שיבוצעו לאחר מכן על הרקמה הנותרת. - קבע את המשקל הרטוב של דגימת רקמה מן Perfuse-בלב השלם (השתמש כ 15 עד 30% של כל הלב). מניחים את דגימת רקמה בתנור על 50 מעלות צלזיוס למשך הלילה ולמדוד במשקל היבש שלה. השתמש המשקל הרטוב / יחס המשקל היבש של דגימת הרקמה כדי לקבוע את המשקל היבש של הלב כולו בגרמים (wt היבש גרם.).
- עבור כל x נקודת זמן לבטא את הערך של x CF זרימה כלילית מ"ל / דקה.
- קביעת קצב חמצון הגלוקוז
- ממוצע שתי ההתפוררות / min (DPM) ערכים נמדדים עבור פעילות הרקע של 14 C כדי determine בסיס מ DPM 14 ג גורם התיקון.
- קבע את 14 C ערכים ממוצעים של sa DPM 14 ג פעילות ספציפית.
- קבע את הרדיואקטיביות הספציפית של גלוקוז DPM / μmol (Glu F) על ידי יישום הנוסחא
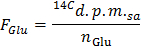
הערה: כאשר n Glu (μmol) = C Glu (μmol / L) * נפח דגימה (L) = 2.5 בעת שימוש גלוקוז בשעה 5 mmol / L ו 0.5 מ"ל מדגם. - לקבוע עבור כל נקודת זמן x את קצב הייצור של 14 CO 2 ב DPM / min (א) על ידי יישום נוסחת
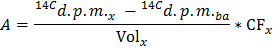
הערה: איפה כרך x (מ"ל) = 0.5 - מחיצה ידי הערך הנחוש של משקל לב יבש להשיג השיעור המנורמל של ייצור של 14 CO 2 (נורמה ) ב DPM / min per WT יבש גרם.
- להחיל את הנוסחה GO = נורמה / F Glu להשיג קצב חמצון הגלוקוז (GO) ב μmol של גלוקוז / min per WT יבש גרם.
- קביעת קצב חמצון Oleate
- ממוצע שני התפוררות / min (DPM) הערכים הנמדדים עבור פעילות רקע של 3 H כדי לקבוע את ba DPM 3H גורם התיקון.
- קבע את 3 H ערכים ממוצעים של sa DPM 3H פעילות ספציפית.
- קבע את הרדיואקטיביות הספציפית של oleate ב DPM / μmol (ה Ol F) על ידי יישום הנוסחא
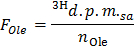
הערה: כאשר n אולה (μmol) = C אולה (μmol / L) * נפח דגימה (L) = 0.2 בעת שימוש oleate 0.4 מילימול / ליטר ו 0.5 מ"ל מדגם. - לקבוע עבור כל timהנקודה E x את קצב הייצור של 3 H 2 O ב DPM / min (B) על ידי יישום נוסחת
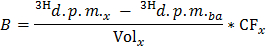
הערה: איפה כרך x (מ"ל) = 0.5 - B פרד על ידי הערך הנחוש של משקל לב יבש כדי להשיג את השיעור המנורמל של ייצור של 3 H 2 O (נורם B) ב DPM / min per WT היבש גרם.
- החל את OO הנוסחה = B נורם / F אולה להשיג קצב חמצון oleate (OO) ב μmol של oleate / min per WT יבש גרם.
תוצאות
שני ניסויים נציג מתוארים באיורים הבאים. בשני המקרים, בלב עכברוש גבר בן 16 בשבוע ספראג Dawley היה מבודד perfused במצב עבודה עם חיץ KH מוכן לפי הפרוטוקול הקודם. בכל ניסוי, בלב היה נתון במצב מתח להשפיע עבודת לב. הפונקציה התכווצות הלב הוערכה על ידי הקלטה רציפה של ל...
Discussion
הפרוטוקול הקודם מפרט את שיטות לכמת את השטף של המצע בו זמנית באמצעות חימצון גלוקוז וחמצון חומצות שומן בלב עכברוש עבודה מבודד. המדידות אז יכולות להיות על גבי לפרמטרים הפונקציונליים הלב נרשמו כדי לקבוע את הקשר בין מטבוליזם מצעים ולעבוד לב בתנאי בסיס ומתח (שינוי בעומס ע?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Materials
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
References
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved