Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Methoden zur Bestimmung von Preisen von Glucose und die Oxidation von Fettsäuren in der isolierten Arbeitsrattenherz
In diesem Artikel
Zusammenfassung
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
Zusammenfassung
Die Säuger Herz ist ein großer Verbraucher von ATP und erfordert eine ständige Energiezufuhr für Substrate Kontraktion. Es überrascht nicht, Veränderungen der myokardialen Stoffwechsel wurden zur Entwicklung der Kontraktions Dysfunktion und Herzinsuffizienz verknüpft. Daher sollte auf einige der Mechanismen beleuchten den Zusammenhang zwischen Stoffwechsel und Kontraktion entwirren Herz Anpassung oder Fehlanpassung bei Krankheitszuständen regeln. Die isolierte Rattenherz arbeitet Zubereitung kann folgen verwendet werden, gleichzeitig und in Echtzeit, Herzkontraktionsfunktion und Energiefluß Substrate in oxidativen Stoffwechselwege bereitstellt. Das vorliegende Protokoll zielt darauf ab, eine detaillierte Beschreibung der Verfahren zur Herstellung und Verwendung von Puffern für die quantitative Messung der Geschwindigkeiten der Oxidations für Glukose und Fettsäuren zur Verfügung zu stellen, der Hauptenergiesubstrate des Herzens bereitstellt. Die Verfahren zur Probenanalyse und Dateninterpretation verwendet werden ebenfalls diskutiert.Kurz gesagt, ist die Technik , die auf die Lieferung von 14 C- radiomarkierten Glucose und einem 3 H radioaktiv markierten Fettsäure langkettige zu einem ex vivo schlagendes Herz über normothermic kristalloider Perfusion. 14 CO 2 und 3 H 2 O, Ende Nebenprodukte die enzymatischen Reaktionen in der Nutzung dieser Energie liefert Substrate beteiligt sind, werden dann quantitativ aus dem koronaren Ausflusses gewonnen. Bei Kenntnis der spezifischen Aktivität der radiomarkierten Substraten verwendet wird, ist es dann möglich, individuell auf den Fluss von Glukose und Fettsäure in der Oxidationswege quantifizieren. Kontraktionsfunktion des isolierten Herz kann mit dem entsprechenden Aufnahmegeräte und direkt korreliert metabolischen Flusswerte parallel bestimmt werden. Die Technik ist sehr nützlich, um den Stoffwechsel / Kontraktionsverhältnis in Antwort auf verschiedene Stressbedingungen, wie beispielsweise Veränderungen in pre und nach der Belastung und Ischämie zu untersuchen, ein Medikament oder ein circulating Faktor oder Produkt nach der Veränderung der Expression eines Gens.
Einleitung
Klinische Relevanz
Im Säugerherz, gibt es eine starke positive Beziehung zwischen dem Fluß von Substraten durch oxidativen Stoffwechselwege, ATP Erzeugungs- und Herzarbeit 1. In den vergangenen zwei Jahrzehnten hat sich die Untersuchung der komplizierten Verbindung zwischen Herz-Stoffwechsel und Funktion führte zu erkennen , dass Veränderungen in der Herzstoffwechsel eine Ursache für die Kontraktions Dysfunktion sind und möglicherweise pathologischen strukturellen Umbau bei der Festlegung der verschiedenen Arten von Herzerkrankungen 2-4. daher wird erwartet , dass unser Verständnis der Mechanismen metabolischen Umbau des belasteten Herzleitungs wird zur Vorbeugung oder Behandlung von Herzinsuffizienz 5-7 zur Identifizierung therapeutischer Targets führen. Die jüngste Veröffentlichung einer wissenschaftlichen Erklärung der American Heart Association zum Thema "Beurteilung der Herz Metabolism", betont das wachsende Interesse der wissenschaftlichen Gemeinschaft für tsein Forschungsgebiet 8. Doch während die technologischen Fortschritte in der Herzbildgebung jetzt für eine schnelle und genaue Bewertung der kardialen Morphologie und Funktion zu ermöglichen, die in - vivo - Studie von Herz-Stoffwechsel bleibt begrenzt und beschwerlich: Nuclear Magnetic Resonance (NMR) Spektroskopie und Positronen - Emissions - Tomographie (PET) Bildgebung kann werden verwendet , um Herzenergiereichen Phosphatstoffwechsel und Krebs - Zyklus - Aktivität, aber diese Techniken sind geplagt durch hohe Betriebskosten und durch ihre Unfähigkeit zur Bestimmung des Beitrags der verschiedenen Substrate zu oxidativen Stoffwechsel in stationären Bedingungen 9 .To diesem Zeitpunkt der ex vivo verfolgen Herz Vorbereitung Arbeits stellt die einzige und einzigartige Technik zur Verfügung, gleichzeitig zu studieren und in Echtzeit, Kontraktionsfunktion und Fluss von Substraten in oxidativen Stoffwechselwege 7,9. Das folgende Protokoll zielt darauf ab, Richtlinien für die Herstellung und Verwendung von Reagenzien zu schaffen, verwendet die Ratte zu bestimmen,es von Substraten Nutzung in der isolierten Arbeitsrattenherz.
Die isolierte Arbeits Nagetier-Herz-Apparat
Obwohl die Technik Hälfte ist fast ein Jahrhundert alt, bleibt die isolierte Arbeitsrattenherz Vorbereitung eine Methode der Wahl für Herz-Kreislauf-Forschung. Wie bei der Langendorff-Herz der Zubereitung bietet das Arbeits rodent Herz eine relativ einfache, zuverlässige und kostengünstige Möglichkeit, eine Vielzahl von Herzparameter unabhängig von den verwirrenden Effekte anderer Organe, neurohormonal und andere zirkulierende Faktoren zu messen. Aber im Gegensatz zu dem Langendorff perfundierten Herzen, das Arbeits Herz weiterhin nahezu physiologischen Herzarbeit, eine Voraussetzung für die Bildung von oxidativen metabolischen Flusses auf ein Niveau durchzuführen , die zu in vivo - Bedingungen relevant sind. Dies wird durch die Bereitstellung der Perfusionspuffer mit dem linken Ventrikel (LV) über eine Kanüle mit dem linken Vorhof erreicht, und da der LV füllt und Verträge, diePuffer wird durch die Aorten-Leitung gegen einen entschlossenen Nachbelastung hydrostatischem Druck ausgestoßen. Das Design der Perfusionsapparatur beschrieben ursprünglich von Neely und Kollegen 10 wurde anschließend durch Taegtmeyer verbessert, Säume und Krebs 11, hat aber nur sehr wenig verändert seitdem. Wie in der ursprünglichen Gerät beschrieben, kann Kontraktionsfunktion durch Bestimmung der Herzleistung beurteilt werden, nicht mehr als Messzylinder mit und eine Stoppuhr Aorten zu messen und koronare fließt 10,11. Mehrere Hersteller bieten nun komplette Arbeits Nagetier Herz Perfusionssystemen. Diese kommerziell erhältlichen Vorrichtung kann mit flowprobes, Druckwandler erfaßt werden, ein Druck-Volumen-Katheter und die gesamte Ausrüstung, die für Herzfunktionsdatenerfassung und -analyse. Die Hersteller bieten eine umfangreiche Dokumentation und Schulungen den neuen Benutzer mit ihrer Ausrüstung vertraut zu machen. Einige Übersichten auch Detail-Protokolle auf dem Arbeits Herz instrumentation und über die Verwendung von Kathetern , Herzfunktion in Nagetieren 12-15 zu messen. Aus diesem Grund werden wir nur kurz auf die Set-up des Perfusionsgerät erwähnen und dem Aufnahmegerät. Das vorliegende Protokoll vielmehr soll die bereits vorhandenen Informationen mit einer Beschreibung der Methoden zu ergänzen, die gleichzeitig durchgeführt werden können, um die Raten der Glukose und langkettigen Fettsäureoxidation, die beiden großen Energie liefert Substrate in der normalen Herz messen. Wir beschreiben hier all die Schritte bei der Verwendung von radiomarkiertem Energiesubstrate für die Beurteilung der myokardialen oxidativen Metabolismus, aus der Herstellung von Reagenzien und Puffer zur Gewinnung und Verarbeitung von Proben, zur Datenanalyse.
Prinzipien des Verfahrens
Kardiomyozyten erzeugen den größten Teil ihrer Energie für die Kontraktion von der oxidative Phosphorylierung von Fettsäuren (hauptsächlich langkettige Fettsäuren) und Kohlenhydrate (glucose und Laktat). Das Herz hat eine begrenzte sehr energisch Reserven und stützt sich auf eine ständige Zufuhr dieser Energie liefert Substrate aus dem Kreislauf. Der Katabolismus von Glucose durch den glykolytischen Weg ergibt Pyruvat, das dann durch die Pyruvat-Dehydrogenase-Komplex von der inneren Mitochondrienmembran decarboxyliert wird. Langkettige Fettsäuren, extrahiert aus Triglyceriden Albumin oder Lipoprotein Zirkulieren werden zuerst in Acyl-CoA-Molekülen in das Cytosol aktiviert und anschließend in der mitochondrialen Matrix durch die Carnitin-Shuttle transportiert, um die beta-Oxidationswegs ein. Die Acetyl-CoA - Molekülen durch den Katabolismus von Glucose und Fettsäuren , die den Krebs - Zyklus Kraftstoff die Reduktionsäquivalente (NADH und FADH 2) , die durch die Elektronentransportkette , verwendet werden zur Erzeugung der Protonen-Antriebskraft über die innere Mitochondrienmembran zu bauen und ATP durch die Aktivität der ATP-Synthase erzeugen. Wasser und Kohlendioxid sind die End-Nebenproduktedie enzymatischen Reaktionen im Inneren des Krebs-Zyklus stattfindet. Die Lieferung von 14 C- und H- 3 radiomarkierte Substrate (wie beispielsweise 14 C-radioaktiv markiertem Glukose und 3 H-radiomarkierten Ölsäure) zum isolierten Arbeits Herz wird folglich für die Produktion von 14 CO 2 und 3 H 2 O führen, wo quantitativ aus dem koronaren Abwasser zurückgewonnen werden. Die Sammlung von 14 CO 2 wird durch Halten der isoliert perfundierten Herzen in eine abgedichtete Kammer und durch sofortiges Gewinnen des koronaren Abflusses durchgeführt , wie es das Herz verlässt. Eine kleine Anionenaustauschsäule verwendet 3 H 2 O aus dem koronaren Ausfluß zu trennen und zu gewinnen. Die Radioaktivität aus den verarbeiteten Proben wird mit einem Flüssigszintillationszähler gemessen und mit Kenntnis der spezifischen Aktivität der radiomarkierten Substraten verwendet, ist es dann möglich, den Fluss von Glukose und Fettsäure in der individuell QuantifizierenOxidationswege 16,17.
Protokoll
HINWEIS: Alle Tierversuche wurden nach der NIH Public Health Service Politik durchgeführt auf der Human Care und Verwendung von Tieren und wurden von der Institutional Animal Care und Use Committee der University of Mississippi Medical Center genehmigt. Alle Verfahren, die die Verwendung von Radioisotopen beteiligt sind, wurden genehmigt und erfolgt nach den Richtlinien der Strahlenschutzstelle der Universität von Mississippi Medical Center eingestellt.
1. Herstellung von Stammpufferlösungen und Reagenzien
- Krebs-Henseleit (KH) Puffer-Stammlösungen
- Bereiten 2 L eines 20fach konzentrierten Salzstammlösung enthält (in mol / L) 2,37 NaCl, 0,0948 KCl, 0,0236 KH 2 PO 4, und 0,0236 MgSO 4 * 7H 2 O. Filter auf einem 0,45 um Porengröße Filtrationseinheit und bei Raumtemperatur lagern bis zu 1 Monat.
- Bereiten 2 L eines 20fach konzentrierten (0,5 mol / l) Lösung von NaHCO 3. Die Lösung kann seinbei Raumtemperatur für eine unbestimmte Zeit gespeichert.
- Bereiten 250 ml einer 1 mol / L Stammlösung von CaCl 2. Filter auf einem 0,45 um Porengröße Filtrationseinheit und bei Raumtemperatur lagern bis zu 1 Monat.
- Umwandlung von Anionenaustauscherharz aus dem Chlorid-Form zur Hydroxidform
- Waschen des Anionenaustauscherharzes, indem sie es in 1 L Reinstwasser Resuspendieren. Lassen Sie das Harz absetzen und das überschüssige Wasser abgießen. Wiederholen Sie diesen Schritt 4 weitere Male.
- Gießen Sie das Harz in einem Glas-Mikroanalyse Vakuumfilterhalter auf einem Filterkolben angebracht war.
- Wandeln das Harz in die Hydroxidform durch langsames bis 22 Volumina 1 N NaOH geben. Mischen Sie den Brei intermittierend mit einem Spatel aus rostfreiem Stahl.
- Das Harz wird mit Reinstwasser, bis der pH-Wert unter 9,0 sinkt. Den pH-Wert regelmäßig von einem pH-Teststreifen in der Nähe der Oberfläche des Harz Aufschlämmung eintaucht. Decken Sie und speichern Sie das Harz mit Reinstwasser in einem borosilicate Glasflasche und vor Licht schützen. Nicht in das Harz vor der Verwendung zu trocknen.
HINWEIS: Bei korrekter Lagerung wird das Harz mindestens 3 Monate dauern.
- Oleic Acid-Albumin 8x konzentrierte Stammlösung
- In einem 4 - Kolben-Erlenmeyer, mischen 200 ml des 20fach konzentrierten Salzstammlösung und 200 ml des 20fach konzentrierten NaHCO3 - Lösung mit 3,6 l Reinstwasser.
- Verwendung eines Gasdispersionsrohr mit einem Frittenzylinder, Gas die Lösung 15 min mit einer Mischung aus Kohlendioxid und 5% Sauerstoff 95% den pH-Wert zu stabilisieren.
- Gießen 470 ml in einem 1 L Becherglas puffern. In 8,75 ml der 1 mol / l CaCl 2 Stammlösung zu dem 3530 ml Puffer noch in der 4 L Erlenmeyerkolben und beiseite stellen .
- In 40 g fettsäurefreies BSA zum 1 L Becherglas und rühren Sie mit einem Rührstab, bis es gelöst.
- In einem 15 ml konischen Röhrchen, Herstellung von 4 ml einer 50% (v: v) Ethanollösung in Reinstwasser. In 487 mg sodium Oleat und Wirbel, bis das Pulver vollständig gelöst hat.
HINWEIS: Einige Forscher verwenden Palmitinsäure anstelle von Ölsäure in der Perfusions-Puffer. A Palmitinsäure-Albumin-Stammlösung kann nach demselben Verfahren hergestellt werden. Es wird jedoch empfohlen, die Lösung bei 70 ºC erwärmen vollständige Solubilisierung von Natriumpalmitat zu erreichen. - Fügen Sie die Oleat Lösung tropfenweise zu der fettsäurefreies BSA-Lösung unter konstantem Rühren und warten weitere 10 min für die Ölsäure-BSA-Komplex zu bilden.
HINWEIS: Die Lösung sollte eine hellgelbe Farbe haben und von sichtbaren Partikeln frei sein. Vorhandensein eines Präzipitats oder unlösliche Teilchen zeigen unvollständige Konjugation der Fettsäure an BSA. Wenn dies geschieht, sollte die Lösung verworfen und der Prozess gestartet neuem.
HINWEIS: Palmitate ausfällt, wenn es erlaubt ist, in eine Pipette zu sitzen und nicht tropfenweise hinzugefügt werden können. Die gerührte Lösung von BSA kann bei 37 ºC erwärmt werden, um zu erleichtern Binding Palmitinsäure. Nicht überhitzen, da diese Denaturierung und Aggregation von BSA verursachen kann.
ACHTUNG: Die nächsten Schritte dieses Protokolls betreffen die Manipulation von radioaktivem Material. Tragen Sie geeignete PSA und befolgen Sie die Sicherheits- und Entsorgungsvorschriften festgelegt durch das Strahlenschutzamt Institution. - Hinzufügen , 160 ul (0,8 mCi) [9,10- 3 H] Ölsäure zu der gerührten Lösung von Ölsäure-BSA zu und rührt weitere 10 min.
- In 2,5 ml der 1 mol / l CaCl 2 Stammlösung zu der gerührten Lösung von Ölsäure-BSA.
- Schneiden Sie ca. 1,2 m Dialysemembran Schlauch und spülen Sie sowohl innen als auch außen mit Leitungswasser. Scrub die Dialyseschlauch kräftig unter Leitungswasser für 10 bis 15 min die Glycerinschicht der Membran zu entfernen. Alternativ nehmen Sie die Beschichtung durch den Dialyseschlauch in warmem Wasser für 1 Stunde vor dem Gebrauch Einweichen. Fertig durch die Dialyseschläuche mit Reinstwasser wate Spülenr.
- Sicher ein Ende des Dialyseschlauch abbinden. Füllen Sie mit der Ölsäure-BSA-Lösung und binden das andere Ende des Dialyseschlauch ab.
- Legen Sie die gefüllte Dialyseschlauch in den 4 L Erlenmeyerkolben von KH Puffer und ermöglichen über Nacht bei 4 ° C unter leichtem Rühren mit einem Rührstab Dialysieren.
- Am nächsten Tag, entfernen Sie die 8-fach konzentrierte Ölsäure-BSA-Lösung aus dem Dialyseschlauch. Verwenden Sie die Ölsäure-BSA-Lösung sofort für die Perfusion oder aliquoten und bei -20 ° C. Gefrorene Aliquots werden für mindestens 2 Monate stabil. Vermeiden Sie mehrere Gefrier-Auftau-Zyklen, da dies die Löslichkeit der Ölsäure-BSA-Komplex beeinträchtigen kann.
HINWEIS: Verwenden Sie nur Reinstwasser (spezifischer Widerstand von 18,2 MΩ.cm bei 25 ºC, gesamter organischer Kohlenstoff <10 ppb, Mikroorganismen ≤ 1 KBE / ml, Partikel mit einer Größe von über 0,22 um ≤1 / ml) die Reagenzien und Puffer zur Vorbereitung für Herzperfusion verwendet. Umwandlung des Anionenaustauscherharzes aus seiner Chloridm auf der Hydroxid - Form kann durch den direkten Kauf von der Hydroxid - Form zu einem zusätzlichen Aufwand (siehe Materialien Tabelle) vermieden werden. Neben Oleat oder Palmitat, jede andere Art von natürlich vorkommende Fettsäure kann auch verwendet werden, solange eine tritiierten Version der Fettsäure vorhanden ist ihre Oxidation zu folgen.
2. Herstellung des Perfusionspuffer
- In einem 4 - Kolben-Erlenmeyer, mischen 200 ml des 20fach konzentrierten Salzstammlösung und 200 ml des 20fach konzentrierten NaHCO3 - Lösung mit 3,6 l Reinstwasser. Gas durch die Lösung für 15 min mit einer Mischung aus Kohlendioxid 5% und 95% Sauerstoff, und fügen Sie dann 10 ml der 1 mol / l CaCl 2 Stammlösung die Konzentration an freien Ca 2+ bei 2,5 mmol / l eingestellt werden .
ACHTUNG: Die folgenden Schritte, um die Manipulation von radioaktivem Material beinhalten. Tragen Sie geeignete PSA und befolgen Sie die Sicherheits- und Entsorgungsvorschriften festgelegt durch die RA Institutionstrahlung Sicherheit Büro. - Übertragen 1.750 L KH Puffer in einen 2 l Glasflasche. Nach Eintragen von 250 ml des 8 - fach konzentrierten Glucose Ölsäure-BSA - Lösung, 1,802 g D-Glucose, 400 & mgr; l Insulin bei 0,4 U / ml, und 200 ul (0,2 mCi) [U- 14 C]. Invert Flasche zu mischen. Dies gibt 2 l vollständigen Perfusionspuffer Ölsäure (0,4 mmol / L), D-Glucose (5 mmol / l) enthält, und Insulin (40 & mgr; U / ml).
HINWEIS: Ein Volumen von 2 L ist ausreichend für mindestens 60 min ein Arbeits erwachsenen Rattenherz in nicht-rezirkulierenden Bedingungen zu perfundieren. - Verwenden Sie einige der nicht-radioaktiven KH Puffer zwei Dissektion Gerichte zu füllen und auf Eis zu kühlen.
3. Herstellung der Perfusionsgerät
HINWEIS: Die Ermittler können wählen , eine maßgeschneiderte Perfusionsgerät zu verwenden , wie die von Taegtmeyer, Hems und Krebs 11 beschrieben, oder eine der im Handel erhältlichen Systeme. Perfusions-Systeme sind in der Regel von der zusammengesetztElemente in Figur 1 unten beschrieben. Neben dem Schlauch und Glaswaren, ist der Rest des Kontrollgeräts optional und deren Nutzung auf die Prüfer Bedürfnisse hängen die experimentelle Frage aufgefordert zu werden. Dennoch empfehlen wir die Verwendung von Sauerstoff - Mikroelektroden die O 2 -Konzentration in der Puffer Ein- und Aussteigen das Herz - Kreislauf- (Abbildung 1) zu bestimmen. Dadurch wird der Prüfer Steuer helfen, die das Herz mit einer geeigneten Menge an Sauerstoff zugeführt wird, und dass die Sauerstoffzufuhr variiert nicht zwischen den Experimenten. Darüber hinaus kann die Bestimmung der "arteriovenöse" oxygen Differenz verwendet werden 16,18 myokardialen Sauerstoffverbrauch und kardialen Effizienz zu berechnen.
- Schalten Sie das zirkulierendes Wasserbad und eingestellt bei 37 ºC die Perfusionsgerät aufzuwärmen.
- Schalten Sie den Computer und das Datenerfassungssystem das wirdwerden verwendet, die Herzfunktion zu messen.
- Schließen Sie die Aufnahmegeräte (Druckkatheter, Druck-Volumen - Katheter, Sauerstoff - Mikroelektroden, Durchflussmesser, etc.) an das Datenerfassungssystem und führen Sie eine Kalibrierung der Instrumente den Anweisungen des Herstellers folgen.
- Füllen Sie den Pufferbehälter mit Reinstwasser. Schalten Sie die peristaltische Pumpe und spülen das Wasser durch alle Schläuche und Glaswaren, das System zu spülen. Drehen Sie die peristaltische Pumpe aus und stellen Sie sicher, dass kein Wasser bleibt in der Rohrleitung und / oder Glas, da dies die Konzentration des Perfusionspuffer beeinflussen und das Herz Vorbereitung.
- Verbinden eines neuen 1,0 & mgr; m-Glasfaserfilter auf das System. Verbinden den Gastank eine Mischung aus Kohlendioxid und 5% Sauerstoff 95% auf der Sauerstoffanreicherungskammer enthält.
ACHTUNG: Die folgenden Schritte, um die Manipulation von radioaktivem Material beinhalten. Tragen Sie geeignete PSA und befolgen Sie die Sicherheits- und Entsorgungsvorschriften von der Institution festgelegt'S Strahlensicherheit Büro. - Füllen Sie den Pufferbehälter mit Perfusionspuffer. Schalten Sie die Pumpe und gewährleisten Füllung aller Schläuche und Glas mit dem Perfusions-Puffer. Führen Sie die Perfusionspuffer durch die Perfusionsapparatur im Umluftbetrieb und Oxygenat für mindestens 30 min vor der Verwendung.
- Dicht befestigen das Rohr einer 20 ml Spritze unterhalb der Herzkammer des koronaren Ausflusses zu erholen. Verbinden Sie die Spitze der Spritze an die Spitze eines Dreiwegehahn. Schließen Sie den Seitenarm mit einem 3-ml-Spritze. Verbinden Sie den unteren Arm über einen Schlauch in einen Behälter für flüssige radioaktive Abfälle.
HINWEIS: Wenn die Säure-BSA-Komplex Fett verwenden, die Sauerstoffversorgung des Puffer Perfusion kann nicht mit einem Gasdispersionsrohr durch direkte Blubbern durchgeführt werden, da dies eine übermäßige Schaumbildung der Lösung führen wird. Verwenden Sie einen Oxygenator (Abbildung 1) oder eine Blattflusssauerstoffanreicherungskammer zu diesem Zweck. Es ist sehr, dass ein angemessenes Niveau o, um zu überprüfen empfohlenf die Sauerstoffversorgung wird , indem ein Sauerstoff - Mikroelektrode im Perfusionskreislauf (Figur 1) erreicht.
4. Rattenherz Isolation und Kanülierung
- Wiegen Ratte auf einer Skala.
- Bereiten Sie eine Spritze mit Betäubungsmittel Dosis von 150 mg / kg Thiobutabarbital Natriumsalz-Hydrat und ein Tuberkulin-Spritze mit 200 USP-Einheiten Heparin.
- Injizieren Thiobutabarbital IP und warten, bis das Tier das Bewusstsein verlieren. Andere Induktionsmittel können verwendet werden , solange dies nicht mit dem Zweck des Experiments stören (siehe Wahl des Anästhetikums in der Diskussion weiter unten).
- Überprüfen Sie für angemessene Höhe der Anästhesie durch den Mangel an toe Prise Reflex bestätigt. Achten Sie darauf, die richtige Tiefe der Anästhesie zu halten, um sicherzustellen, dass das Tier keine Schmerzen während des Verfahrens fühlt.
- Einmal ist die Ratte vollständig bewusstlos und reagiert nicht auf die Zehen Prise, legen Sie es auf dem Rücken auf dem Operationstisch und sure Gliedmaßen mit Klebeband oder Stifte.
- Befestigen Sie den Bauch frei von Haaren und führen Sie einen Mittelschnitt des Bauches. noch nicht die Brusthöhle an dieser Stelle öffnen. Bewegen Sie den Magen und Darm zur Seite der unteren Hohlvene zu offenbaren. Spritzen Sie das Heparin direkt in die untere Hohlvene und warten Sie 5 bis 10 Sekunden, bevor Sie fortfahren.
- Mit einer Schere schneiden Sie die Blende und die Seiten des Brustkorbs, den Inhalt der Brusthöhle zu belichten.
- greifen Zart das Herz zwischen Daumen, Zeige- und Mittelfinger und Verbrauch sowohl Herz und Lunge zusammen. Schneiden Sie auf der Ebene der absteigenden Aorta, wobei darauf geachtet, nicht den Aortenbogen und aufsteigende Aorta in den Prozess nicht zu beschädigen. Unmittelbar übertragen Herz und Lunge zu einer der Dissektion Gerichte mit eiskaltem KH Puffer gefüllt.
- Nachdem das Herz aufhört zu schlagen, Transfer in die Schale zweite Dissektion und schneiden Sie die große Stücke von Lungengewebe ab angebracht, während das Herz in eiskaltem KH Puffer unter Wasser zu halten. Schneiden Sie den Abstieging Aorta direkt über dem Aortenbogen.
ACHTUNG: Die folgenden Schritte, um die Manipulation von radioaktivem Material beinhalten. Tragen Sie geeignete PSA und befolgen Sie die Sicherheits- und Entsorgungsvorschriften festgelegt durch das Strahlenschutzamt Institution. - Spülen Sie die Aorten-Linie der Perfusionsgerät die Aortenkanüle mit warmem Puffer zu füllen und um Wasser oder Luft zu beseitigen, die noch in der Röhre vorhanden sein können. Erlauben es dem Perfusionspuffer aus der Aortenkanüle tropft die Möglichkeit des Luftembolien zu der Zeit zu minimieren, das Herz an der Kanüle befestigt ist.
- Die Verwendung von zwei Mikro Dissektionszangen vorsichtig die Aorta öffnen und das Herz nach oben auf die Aortenkanüle gleiten. Sichern Sie die Aorta an der Kanüle mit einem Mikro-Clip und Langendorff-Perfusion des Herzens einzuleiten. Beachten Sie das Herz beginnen wieder zu schlagen und zu vertreiben das ganze Blut in die Koronargefäße in den verbleibenden Sekunden nach Beginn der Perfusion.
HINWEIS: Es ist sehr wichtig, Schritte auszuführen, 4.6 bis 4,10 so schnell wie möglich irreversible ischämische Schädigung des Herzens zu verhindern. Mit der Erfahrung sollte das gesamte Verfahren zwischen 1 und 2 Minuten dauern. Wenn die Aorta an der Kanüle gleitend nach oben, darauf achten, nicht die Aortenwurzel zu passieren, wie dies in myokardiale Hypoperfusion und Schäden an der Aortenklappe führen kann. - Binden Sie die Aorta in die Aortenkanüle mit einer 3-0 Seidennaht und entfernen Sie den Mikro-Clip. Suchen Sie die Lungenvenen. Es kann notwendig sein, die nicht-kardialen Gewebe zu schneiden, es zu finden, aber nicht zu viel schneiden der nicht-Herzgewebe, wie sie den linken Vorhof in die Kanüle zu binden dienen.
- Spülen Sie das linke Vorhofleitung der Perfusionsgerät die atriale Kanüle mit warmem Puffer zu füllen und um Wasser oder Luft zu beseitigen, die noch in der Röhre vorhanden sein können. Seien Sie besonders vorsichtig jede Luftblase aus dem Gerät zu entfernen, die Möglichkeit von Luftembolien zu der Zeit zu minimieren, das Herz an der Kanüle befestigt ist.
- Die Verwendung von zwei Mikro Sezieren forceps zart die Öffnung der Pulmonalvene greifen und das Herz nach oben auf die atriale Kanüle gleiten. Es kann notwendig sein, um das Herz zu positionieren, indem Sie vorsichtig die atriale und / oder Aortenkanüle Drehen Sie diesen Schritt zu erreichen. In jedem Fall ist sicherzustellen, dass das Verfahren nicht übermäßige Belastung für das Herz und verursachen erlegt der Aorta zu biegen. Binden Sie den linken Vorhof in die Vorhof Kanüle mit einem 3-0 Seidennaht.
- Öffnen Sie die atriale Leitung und gleichzeitig schalten die Aorten-Linie von der Langendorff-Modus in den Arbeitsmodus. Wenn Puffer entweicht aus dem linken Vorhof, schließen Sie die atriale Leitung, schalten Sie die Aorten-Linie Langendorff-Perfusion zurück, und verwenden Sie ein anderes 3-0 Seidennaht den linken Vorhof mehr sicher an der Kanüle zu binden.
5. Messung der Herzfunktion und Probenentnahme
HINWEIS: Die Bestimmung der metabolischen Flüsse wird die Kenntnis des Koronarflusses (CF) erfordern. Wie unten beschrieben, können koronare Flusswerte sein,mit der einfachen Verwendung einer Stoppuhr erhalten. Darüber hinaus wird die Messung der Aortafluss (AF) mit dem gleichen Verfahren die Bestimmung der Herzleistung (CO = CF + AF) erlauben, die dann verwendet werden können, Herzleistung (CP) als allgemeines Maß für die Herzfunktion zu berechnen, indem die Formel CP = CO (m 3 / s) * Nachlast (Pa). Ein anderes Verfahren für die Bewertung der Herzfunktion beruht auf Echtzeitmessung des Pulsdruck mit einem Druckwandler (3 und 4). Obwohl optional, die präzise und detaillierte Messungen der Herzkontraktionsfunktion und die Hämodynamik, einschließlich der Bestimmung der linksventrikulären systolischen und diastolischen Funktionen, werden mit der Verwendung eines Druck-Volumen (PV) Konduktanz Katheter erreicht werden. Dieser Abschnitt beschreibt kurz die Katheterisierung des isolierten Herzens. Weitere Informationen über die Kalibrierung von PV-Katheter und Datenanalyse mit statistischer Software kann seinin Referenzen 14,15 gefunden.
ACHTUNG: Die folgenden Schritte, um die Manipulation von radioaktivem Material beinhalten. Tragen Sie geeignete PSA und befolgen Sie die Sicherheits- und Entsorgungsvorschriften festgelegt durch das Strahlenschutzamt Institution.
- Wenn das Experiment direkte Messung der LV-Funktion mit einem Katheter enthält, durchstechen die LV-Apex mit einer 26 G-Nadel und den Katheter über den Einstich einzuführen.
- Wenn ein Druck-Volumen-Katheter, sorgfältig den Katheter zu positionieren, so daß seine Welle mit der LV Längsachse ausgerichtet ist, wobei die distale Elektrode direkt unterhalb der Aortenklappe und angrenzend an die endokardiale Grenze und die proximale Elektrode gerade innerhalb der Ventrikelwand.
- Dichten Sie das Herz in die Wassermantel Herzkammer und zu überwachen Herzfunktionsparameter mit der Datenerfassungssoftware. Starten Sie die Aufnahme nach der Ausgangs-Herz Parameter stabil gewesen sein für mehr als 5 min.
- Bestimmen Sie die koronare Fluss durch measuring die Zeit benötigt, um die 20-ml-Spritze Rohr unterhalb der Herzkammer angebracht zu füllen. Nach der Messung öffnen Sie das Dreiwegehahn der koronaren Abwasser in die radioaktive Abfallbehälter zu leeren.
HINWEIS: Strömungsmessungen können auch einen Durchflußmesser und flowprobes durchgeführt werden. - Verwenden Sie die 3 ml Spritze mit dem Seitenarm des Absperrhahns Dreiwege angebracht ~ 2 ml koronaren Ausflusses zu erholen, wie es das Herz verlässt. Übertragen Sie 0,5 ml der koronaren Abwasser in ein 2 ml deckellosen Mikrozentrifugenröhrchen und sofort gehen Sie mit der Bestimmung der Raten der Glukoseoxidation (Abschnitt 6).
- Übertragen Sie den Rest der koronaren Abwasserprobe (~ 1,5 ml) in einem entsprechend gekennzeichneten Mikrozentrifugenröhrchen und auf Eis halten.
- Wiederholen Sie die Schritte 5,4-5,6 in regelmäßigen Abständen (zB alle 5 oder 10 min) bis zum Ende der Perfusion Experiments.
- Wenn ein Druck-Volumen-Katheter, injizieren einer 10 ul-Bolus von hypertonischen Salzlösung (15%)in die atriale Leitung und direkt vor der Vorhof Kanüle vor dem Experiment abzuschließen. Verwenden Sie dieses Bolusinjektion die Parallelleitfähigkeit (V p) zu berechnen, die für eine genaue Bestimmung des Herzvolumens 15 kritisch ist.
- der Herzkammer entsiegeln und der Katheter aus dem LV entfernen, wenn man in dem Experiment verwendet wurde. Gewinnen Sie das Herz einer der folgenden Optionen:
- Wenn keine Notwendigkeit besteht, bestimmte Bereiche des Herzens für den Downstream-Analysen zu isolieren, und wenn die Perfusionsapparatur ermöglicht es, in der Nähe sowohl Vorhof- und aortic Linien und sofort das Herz auf der Kanülen verwenden Wollenberger Zange vorgekühlt in flüssigem Stickstoff gefrier festzuklemmen.
- Alternativ schneiden das Herz aus den Kanülen und in eiskaltes KH Puffer fallen. trocknen schnell das Herz auf einem Papiertuch und messen seine Nassgewicht. Das Herz kann dann für bestimmte Messungen präpariert und Gewebeproben gesammelt werden. Frieren Sie das verbleibende Gewebe mit tong Wollenbergers vorgekühlten in flüssigem Stickstoff.
- Lagern Sie das gefrorene Herzgewebe bei -80 ° C bis zur Bestimmung des Trockengewichts (siehe Abschnitt 8. Berechnungen).
6. Bestimmung der myokardialen Glukoseoxidationsraten
HINWEIS: Das Verfahren besteht in der quantitativen Rückgewinnung von 14 CO 2 aus dem koronaren Ausflusses mit einem Trapping - Lösung von Hydroxid von Hyamin. Die 14 CO 2 gelöst als 14 H CO3- folgende Versauerung des Puffers mit Perchlorsäure gewonnen wird. Proben sollten unmittelbar nach ihrer Gewinnung als passive Diffusion von Gas zwischen der Luft und der Probe verarbeitet werden in einem Verlust von 14 CO 2 im Laufe der Zeit führen. Die Szintillationsgefäße werden sollten eng mit den Gummimanschette Stopfen verschlossen , den Verlust von 14 CO 2 zu verhindern , nachdem Perchlorsäure hinzugefügt wird . Falls erforderlich, können Parafilm verwendet werden, um die Gummihülse Stoppern zu der zu sichernFläschchen (Abbildung 2).
- 1 ml 10-fach konzentrierten Hydroxid von Hyamin zu Szintillationsrährchen aus Glas (ein Fläschchen pro Probe + zwei zusätzliche Fläschchen zur Bestimmung der Hintergrundaktivität).
ACHTUNG: Hydroxid von Hyamin ist hochgiftig und verursacht schwere Verätzungen. Konsultieren Sie die Produkt SDB für sachgemäßer Handhabung und Lagerung. - Mit einer Pinzette vorsichtig übertragen Sie die 2 ml deckellosen Mikrozentrifugenröhrchen, die 0,5 ml koronarer Abwasserprobe in ein Fläschchen vorgefüllt mit dem Hydroxid von Hyamin enthält. Verwenden 0,5 ml Perfusionspuffer zur Bestimmung der Hintergrundaktivität.
- Verschließen Sie die Fläschchen mit einer Gummimanschette Stopper. Parafilm kann verwendet werden, Abdichtung der Ampulle zu sichern. Unter Verwendung einer 1 ml Spritze und einer 23 G lange Nadel injizieren 200 ul Perchlorsäure (60% w: w%) durch die Gummihülse Topfen und direkt in die deckellosen 2 ml Röhrchen.
HINWEIS: Die koronare Abwasser sollte weiß werden durch die Ausscheidung von BSA. - Lassen Sie die Fläschchen ses über Nacht.
ACHTUNG: Perchloric Säure ist stark ätzend, kann wirken als Oxidationsmittel und / oder verursachen eine Explosionsgefahr. Konsultieren Sie die Produkt SDB für sachgemäßer Handhabung und Lagerung. - Am nächsten Tag, entfernen Sie die Gummimanschette Stopfen. je 2 ml deckellosen Rohr mit einer Pinzette vorsichtig abzurufen und den Boden des Röhrchens auf der Oberseite der offenen Ampulle mit 1 ml Szintillationscocktail waschen alle der Hydroxid von Hyamin abzurufen. Entsorgen Sie die deckellosen Rohr in einem entsprechend radioaktiven Abfallbehälter markiert.
- Fügen Sie eine weitere 9 ml Szintillationscocktail pro Fläschchen. 0,5 ml Perfusionspuffer direkt an zwei mit 10 ml flüssigem Szintillationscocktail befüllten Vials zur Bestimmung der spezifischen Aktivität. Schütteln Sie die Fläschchen kräftig von Hand und warten Sie mindestens 6 Stunden Luftblasen zu ermöglichen, vor der Messung in einem Flüssigszintillationszähler zu zerstreuen in geeigneter Weise für Dual-Label Experimente eingerichtet.
HINWEIS: Verwenden Sie klare Glasfläschchen, die ne zu visualisierenedle, wenn Durchstechen der Gummimanschette Stopfen. Nicht Perchlorsäure in das Hydroxid von Hyamin fallen, da dies die Reaktion ruinieren. Das Hinzufügen der Perchlorsäure löst die 14 CO 2 aus dem koronaren Abwasser in die Luft. Obwohl die Fläschchen sollten dicht verschlossen werden und alle der 14 CO 2 sollte in die Hyamin von Hydroxid gefangen werden, wird empfohlen , diesen Test unter dem Abzug durchzuführen.
7. Bestimmung der myokardialen Oleate Oxidationsraten
HINWEIS: Die Methode basiert auf der quantitativen Abtrennung und Gewinnung von 3 H 2 O aus dem koronaren Abflusses ein starkes Anionenaustauscherharz verwendet wird . Anders als bei der Rückgewinnung von 14 CO 2, gibt es keine Probenstabilitätsproblem und der koronaren Abwasser kann vor dem Test in der Tiefkühltruhe auf Eis oder lagern.
- Bereiten Sie Anionenaustauscherharz Spalten (eine Spalte pro Probe + two zusätzliche Spalten zur Bestimmung der Hintergrundaktivität) durch die Spitze von 3 ml Spritze Röhrchen mit Glaswolle gefüllt wird. Fügen Sie die Harz / Wasser-Schlamm mit einer Transferpipette, bis das Harz die 2-ml-Markierung auf dem Spritzenrohr erreicht.
- Das Harz 2 ml Reinstwasser durch die Säule, indem. Wiederholen Sie diesen Schritt zwei weitere Male.
- Legen Sie offen Szintillationsgefäße unter den Säulen und laden 0,5 ml koronarer Abwasser pro Säule. Last 0,5 ml Perfusionspuffer zur Bestimmung der Hintergrundaktivität.
- Waschen Sie die Spalten nacheinander mit 0,5, 1 und 2 ml Reinstwasser. Sobald die Elution durchgeführt wird, entsorgen Sie die Spalten in einem entsprechend radioaktiven Abfallbehälter markiert.
- In 13 ml Flüssigkeit Szintillationscocktail pro Szintillationsphiole. 0,5 ml Perfusionspuffer direkt an zwei mit 13 ml Flüssigkeit Szintillationscocktail befüllten Vials zur Bestimmung der spezifischen Aktivität. Schütteln Sie die Fläschchen kräftig und warten Sie mindestens 6 Stunden, bevor sie in einem flüssigen sci Messntillation Zähler passend für Dual-Label Experimente eingerichtet.
8. Calculations
- Falls noch nicht geschehen, das Nassgewicht des gesamten perfundierten Herzen bestimmen.
HINWEIS: Lassen Sie das gefrorene Gewebe aufzutauen, wenn molekularen und biochemischen Analysen werden anschließend auf dem verbleibenden Gewebe durchgeführt werden. - Bestimmen Sie das Nassgewicht einer Gewebeprobe aus dem gesamten perfuse-Herz (verwenden Sie etwa 15 bis 30% des gesamten Herzens). Legen Sie die Gewebeprobe in einem Ofen bei 50 ° C eingestellt über Nacht und messen sein Trockengewicht. Verwenden Sie das Nassgewicht / Trockengewichtsverhältnis der Gewebeprobe das Trockengewicht des ganzen Herzens in Gramm zu bestimmen (g Trockengewicht.).
- Für jedes x Zeitpunkt den Wert der koronaren Fluss CF x in ml / min auszudrücken.
- Bestimmung der Rate der Glukoseoxidation
- Der Mittelwert der beiden Zerfall / min (dpm) für die Hintergrundaktivität von 14 C Messwerte Bestimne der Korrekturfaktor 14C dpm ba.
- Bestimmen Sie die 14 C - Wert der spezifischen Aktivität 14C dpm sa gemittelt.
- Bestimmen Sie die spezifische Radioaktivität von Glucose in dpm / & mgr; Mol (F Glu) durch Anwendung der Formel
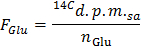
ANMERKUNG: wo n Glu (& mgr; mol) = C Glu (umol / L) * Probenvolumen (L) = 2,5 , wenn die Glucose in 5 mmol / L und eine 0,5 ml Probe verwendet wird . - Bestimmen Sie für jeden Zeitpunkt x die Geschwindigkeit der Produktion von 14 CO 2 in dpm / min (A) durch Anwendung der Formel
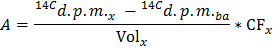
HINWEIS: Wo Vol x (ml) = 0,5 - Teilen A durch den ermittelten Wert von trockenem Herzgewicht der normalisierten Produktionsrate von 14 CO 2 (A - Norm zu erhalten ) in dpm / min pro g Trockengewicht.
- Tragen Sie die Formel GO = A Norm / F Glu die Rate der Glukoseoxidation (GO) in & mgr; mol Glucose / min pro g Trockengewicht zu erhalten.
- Die Bestimmung der Rate von Oleate Oxidation
- Der Mittelwert der beiden Zerfall / min (dpm) Werte für die Hintergrundaktivität von 3 H gemessen , um den Korrekturfaktor 3H dpm ba zu bestimmen.
- Bestimmen Sie die 3 H - Wert der spezifischen Aktivität 3H dpm sa gemittelt.
- Bestimmen Sie die spezifische Radioaktivität von Oleat in dpm / & mgr; Mol (F Ol e) durch Anwendung der Formel
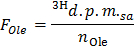
ANMERKUNG: wo n Ole (umol) = C Ole (umol / L) * Probenvolumen (L) = 0,2 , wenn Oleat bei 0,4 mmol / L und eine 0,5 ml Probe verwendet wird . - Bestimmen Sie für jeden time - Punkt x die Geschwindigkeit der Produktion von 3 H 2 O in dpm / min (B) durch Anwendung der Formel
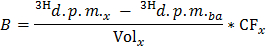
HINWEIS: Wo Vol x (ml) = 0,5 - Teilen B von dem ermittelten Wert von trockenem Herzgewicht der normalisierten-Produktionsrate von 3 H 2 O (B - Norm) in dpm / min pro g Trockengewicht zu erhalten.
- Tragen Sie die Formel OO = B Norm / F Ole die Rate der Oleat Oxidation (OO) in & mgr; mol Oleat / min pro g Trockengewicht zu erhalten.
Ergebnisse
Zwei repräsentativen Experimente sind in den Figuren unten beschrieben ist. In beiden Fällen wurde das Herz eines 16 Wochen alten männlichen Sprague-Dawley-Ratten isoliert und in den Arbeitsmodus mit KH-Puffer nach dem vorhergehenden Vorschrift hergestellt perfundiert. In jedem Experiment wurde das Herz mit einem Spannungszustand unterworfen Herzarbeit zu beeinflussen. Herzkontraktionsfunktion wurde durch kontinuierliche Aufzeichnung von Pulsdruck durch Einsetzen eines Druckwandlers i...
Diskussion
Der vorstehende Protokoll beschreibt die Methoden, um gleichzeitig den Fluss des Substrats durch Glucose-Oxidation und die Oxidation von Fettsäuren in der isolierten Arbeitsrattenherzen zu quantifizieren. Die Messungen können dann auf die aufgezeichneten Herzfunktionsparameter überlagert werden , um die Beziehung zwischen den Substraten Stoffwechsel und Herzarbeit unter der Basislinie und Belastungsbedingungen (Veränderung der Arbeitsbelastung, Ischämie-Reperfusion, etc ...) zu bestimmen. Es ist auch mögl...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
Referenzen
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten