Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методы определения ставок глюкозы и жирных кислот Окисление в изолированной рабочей сердца крысы
В этой статье
Резюме
The following protocol describes the preparation and utilization of buffers for the quantitative measurement of rates of glucose and fatty acid oxidation in the isolated working rat heart. The methods used for sample analysis and data interpretation are also discussed.
Аннотация
Сердце млекопитающих является основным потребителем АТФ и требует постоянного притока энергетических субстратов для сокращения. Не удивительно, что изменения метаболизма миокарда, были связаны с развитием сократительной дисфункции и сердечной недостаточности. Таким образом, распутывая связь между обменом веществ и сокращения должны пролить свет на некоторые из механизмов, регулирующих сердца адаптации или дезадаптации в болезненных состояниях. Выделенную подготовки рабочей сердце крысы может быть использован, чтобы следовать, одновременно и в реальном времени, сердечной сократительной функции и потока энергии, обеспечивающей субстратов в окислительных метаболических путей. Настоящий Протокол призван обеспечить детальное описание методов, используемых при подготовке и использовании буферов для количественного измерения скоростей окисления для глюкозы и жирных кислот, основной энергии, обеспечивающей субстраты сердца. Обсуждаются также методы, используемые для анализа проб и интерпретации данных.Короче говоря, этот метод основан на поставку 14 C- меченного глюкозы и 3 Н- меченного с длинной цепью жирной кислоты в естественных условиях ех бьющееся сердце через нормотермической кристаллоидным перфузией. 14 CO 2 и 3 H 2 O, концевые субпродукты ферментативные реакции, участвующие в использовании этих энергетических субстратов при условии, затем количественно извлекают из коронарного сточных вод. Со знанием специфической активности радиоактивно меченных субстратов, используемых, то тогда можно индивидуально количественно оценить поток глюкозы и жирных кислот в пути окисления. Сократительной функции изолированного сердца может быть определено параллельно с соответствующим оборудованием для записи и непосредственно коррелирует с метаболическими значений потока. Методика является чрезвычайно полезным для изучения взаимосвязи метаболизма / сокращения в ответ на различные стрессовых условиях, таких как изменения в до и после нагрузки и ишемии, препарат или циркуляциейтин фактор, или после изменения в экспрессии продукта гена.
Введение
Клиническая значимость
В сердце млекопитающих, существует сильная положительная связь между потоком субстратов через окислительных метаболических путей, АТФ поколения и работы сердца 1. За последние два десятилетия исследование сложной взаимосвязи между заболеванием сердца метаболизма и функции привело признать , что изменения в сердечной метаболизма являются причиной для сократительной дисфункции и , возможно , патологической структурной перестройки в установке различных типов заболеваний сердца 2-4. Таким образом, ожидается , что наше понимание механизмов , регулирующих метаболические ремоделирование напряженном сердца приведет к идентификации терапевтических мишеней для профилактики или лечения сердечной недостаточности 5-7. Недавняя публикация научного высказывания из Американской кардиологической ассоциации на тему «Оценка сердечного метаболизма» подчеркивает растущий интерес научного сообщества для тего область исследований 8. Но в то время как технологические достижения в области визуализации сердца в настоящее время позволяют для быстрой и точной оценки сердечной морфологии и функции, исследование в естественных условиях сердечного метаболизма остается ограниченным и обременительным: ядерного магнитного резонанса (ЯМР) спектроскопии и позитронно - эмиссионной томографии (ПЭТ) может можно использовать , чтобы следовать сердца высокой энергии фосфатный метаболизм и активность цикла Кребса, но эти методы страдают от высоких операционных затрат и их неспособностью определить вклад различных субстратов для окислительного метаболизма в стационарных условиях 9 .to эту дату экс естественных условиях рабочая подготовка сердца представляет единственный и уникальный метод доступен для изучения, одновременно и в реальном масштабе времени, сократительной функции и потока субстратов в окислительных метаболических путей 7,9. Следующий протокол направлен на обеспечение руководящих принципов в подготовке и использовании реагентов, используемых для определения крысуэс утилизации субстратов изолированного сердца крысы. Рабочая
Изолированные Аппарат сердца Рабочая Грызун
Несмотря на то, что техника почти полвека назад, изолированная рабочая подготовка крысы сердце остается методом выбора для сердечно-сосудистых исследований. Как и при подготовке Лангендорфа сердца, рабочее грызун сердце предлагает сравнительно простой, надежный и недорогой способ измерить широкий диапазон параметров сердца независимо от искажающих эффектов других органов, нейрогуморальных и других циркулирующих факторов. Но в отличие от Langendorff-перфузируемом сердце, рабочее сердце продолжает выполнять почти физиологическую работу сердца, что является необходимым условием для формирования окислительного метаболического потока до уровней , которые имеют отношение к условиям в естественных условиях. Это достигается за счет предоставления буфера перфузионного в левый желудочек (ЛЖ) через канюлю, соединенного с левым предсердием, а также Л.В. заполняет и контракты, тоБуфер выбрасывается через аортальный линии против определенного постнагрузки гидростатического давления. Конструкция аппарата перфузионного первоначально описанной Neely и коллегами 10 была впоследствии улучшена Taegtmeyer, рубчики и Кребса 11, но очень мало изменилось с тех пор. Как описано в исходном устройстве, сократительная функция может быть оценена путем определения сердечного выброса, используя не более , чем градуированные цилиндры и секундомер для измерения аортального и коронарного потоки 10,11. Некоторые производители в настоящее время предлагают полный рабочий грызуна системы сердца перфузионных. Эти коммерчески доступные аппараты могут быть приобретены с flowprobes, датчиками давления, давление объема катетера и все оборудование, необходимое для остановки функционального сбора и анализа данных. Производители предоставляют обширную документацию и учебные сессии для ознакомления нового пользователя с их оборудованием. Несколько обзорных статей также подробно протоколы о работающем сердце INSTRUMентация и об использовании катетеров для измерения сердечной функции у грызунов 12-15. По этой причине, мы лишь кратко упомянуть настройку аппарата перфузионного и записывающего оборудования. Настоящий протокол скорее нацелен дополнить уже имеющуюся информацию с описанием методов, которые могут быть реализованы для одновременного измерения скорости глюкозы и окисления длинноцепочечных жирных кислот, два основных энергетических субстратов в обеспечении нормального сердца. Здесь мы опишем все шаги, связанные с использованием меченных энергетических субстратов для оценки окислительного метаболизма миокарда, от подготовки реагентов и буферов для восстановления и обработки образцов, для анализа данных.
Основы метода
Кардиомиоциты генерируют большую часть своей энергии для сжатия из-за окислительного фосфорилирования жирных кислот (главным образом, длинноцепочечные жирные кислоты) и углеводы (glucosе и лактата). Сердце имеет очень ограниченный энергетические запасы и опирается на постоянное снабжение этих энергетических субстратов из обеспечения циркуляции. Катаболизм глюкозы через гликолиза приводит к пирувата, который затем декарбоксилируют пируватдегидрогеназного комплекса внутренней митохондриальной мембраны. Длинноцепочечные жирные кислоты, извлекаемые из циркулирующих альбумин или липопротеинов триглицериды, которые сначала активируют в молекулы ацил-КоА-редуктазы в цитозоле, а затем транспортируется в митохондриях через челнок карнитина, чтобы войти в пути бета-окисления. В ацетил-СоА - молекул , продуцируемых катаболизма глюкозы и жирных кислот топлива цикл Кребса для генерации восстанавливающих эквивалентов (NADH и FADH 2) , которые используются в цепи переноса электронов для создания протон-движущей силы поперек внутренней митохондриальной мембраны и генерации АТФ через активность АТФ-синтазы. Вода и углекислый газ являются конечными субпродуктовферментативные реакции, происходящие внутри цикла Кребса. Подачу 14 С- и 3 Н- радиоактивно меченных субстратов (например, 14 С-меченного глюкозы и 3 Н-меченного олеиновой кислоты) к изолированному рабочего сердца будет , следовательно , приводить к получению 14 CO 2 и 3 H 2 O , который может количественно извлекают из коронарного вытекающего потока. Сбор 14 CO 2 осуществляют путем поддержания изолированных перфузии сердца в герметичную камеру и сразу же восстановление коронарного потока , выходящего при его выходе из сердца. Небольшая колонна анионообменной используется для разделения и восстановления 3 H 2 O из коронарного стоках. Радиоактивность из обработанных образцов измеряют с помощью жидкостного сцинтилляционного счетчика, и со знанием специфической активности радиоактивно меченных субстратов, используемых, то тогда можно индивидуально количественно оценить поток глюкозы и жирных кислот вокисления дорожками 16,17.
протокол
Примечание: Все процедуры на животных были проведены в соответствии с политикой службы NIH общественного здравоохранения по уходу за человека и использовании животного мира и были одобрены Institutional Animal Care и использование комитета Университета Миссисипи медицинского центра. Все процедуры, связанные с использованием радиоизотопов были утверждены и проведены в соответствии с руководящими принципами, установленными радиационной безопасности офиса Университета Миссисипи медицинский центр.
1. Подготовка буферный растворов и реактивов
- Кребса-(KH) буферного запаса Решения
- Подготовьте 2 л 20x солевых исходного раствора , содержащего (в моль / л) 2,37 NaCl, KCl 0,0948, 0,0236 KH 2 PO 4 и 0,0236 MgSO 4 * 7H 2 O. Фильтр на единицу размера фильтрации 0,45 мкм пор и хранить при комнатной температуре в течение 1 месяца.
- Подготовка 2 л концентрированной (0,5 моль / л) раствор NaHCO 3 20x. Решение может бытьхранить при комнатной температуре в течение неопределенного периода времени.
- Приготовьте 250 мл 1 моль / л исходного раствора CaCl 2. Фильтр на единицу размера фильтрации 0,45 мкм пор и хранить при комнатной температуре в течение 1 месяца.
- Преобразование анионообменной смолой из хлоридной форме к форме гидроксидом
- Промыть анионообменной смолы путем ресуспендирования его в 1 л воды высшей степени очистки. Дайте смоле отстояться и слейте лишнюю воду. Повторите этот шаг еще 4 раза.
- Налить смолу в стакане микроанализа держатель вакуумного фильтра, установленного на фильтровальной колбе.
- Превратить смолу в форму гидроокиси, медленно проходя через 22 объемами 1 N NaOH. Смешайте суспензии прерывисто с помощью шпателя из нержавеющей стали.
- Промыть смолу сверхчистой водой до тех пор, пока рН не падает ниже 9,0. Проверяют рН регулярно путем погружения тест-полоски рН вблизи поверхности суспензии смолы. Накрыть крышкой и хранить смолы с сверхчистой воды в мальrosilicate стеклянная бутылка и защиты от света. Не допускайте попадания смолы высохнуть перед использованием.
ПРИМЕЧАНИЕ: При правильном хранении, смола будет длиться не менее 3 месяцев.
- Олеиновая кислота-раствор альбумина 8х Концентрированный со
- В колбу 4 л Эрленмейера, смешайте 200 мл 20х концентрированного солевого раствора и 200 мл 20х концентрированного раствора NaHCO 3 с 3,6 л ультрачистой воды.
- Используя газораспределительную трубку с пористым цилиндром, газ раствора в течение 15 мин со смесью двуокиси углерода 5% и кислород 95% для стабилизации рН.
- Залить 470 мл буфера в стеклянный стакан объемом 1 л. Добавить 8,75 мл 1 моль / л CaCl 2 маточного раствора в 3530 мл буфера , оставшийся в колбе Эрленмейера 4 л и отложить в сторону.
- Добавьте 40 г не содержащего жирных кислот бычьего сывороточного альбумина в стеклянный стакан на 1 л и перемешивают мешалкой до растворения.
- В 15 мл коническую пробирку, подготовить 4 мл 50% -ного (по объему) раствором этанола сверхчистой воды. Добавить 487 мг sodiuм олеат и вихревое, пока порошок полностью не растворится.
Примечание: Некоторые исследователи используют пальмитиновую кислоту вместо олеиновой кислоты в буфере перфузии. Кислота-альбумин раствор пальмитиновая, могут быть получены по той же методике. Тем не менее, рекомендуется, чтобы нагреть раствор при 70 ° С, чтобы достичь полной солюбилизации пальмитат натрия. - Добавьте по каплям олеат раствора к не содержащего жирных кислот раствором БСА при постоянном перемешивании и подождать еще 10 мин для олеиновой комплекса кислотно-БСА с образованием.
Примечание: Раствор должен иметь светло-желтый цвет и не содержать видимых частиц. Наличие осадка или нерастворимых частиц может указывать на неполную конъюгации жирной кислоты к БСА. Если это произойдет, то решение должно быть отброшено, и процесс начинается снова.
Примечание: пальмитат будет выпадать в осадок, если это разрешено сидеть в пипетку и не может быть добавлен по каплям. Перемешиваемый раствор бычьего сывороточного альбумина может быть нагрет при температуре 37 ° С, чтобы облегчить bindinг пальмитиновой кислоты. Не перегревать, так как это может привести к денатурации и агрегации БСА.
ВНИМАНИЕ: Следующие шаги этого протокола предусматривают манипуляции радиоактивного материала. Используйте соответствующие средства индивидуальной защиты и соблюдать правила безопасности и утилизации отходов, установленные радиационной безопасности офиса учреждения. - Добавьте 160 мкл (0,8 мКи) [9,10 3Н] олеиновой кислоты к перемешиваемому раствору олеиновой кислоты-БСА и перемешивают в течение еще 10 мин.
- Добавить 2,5 мл 1 моль / л CaCl 2 маточного раствора к перемешиваемому раствору олеиновой кислоты-BSA.
- Отрежьте приблизительно 1,2 м диализной мембраны трубки и промыть внутри и снаружи водопроводной водой. Scrub диализной трубки энергично под проточной водой в течение от 10 до 15 мин, чтобы удалить глицерол покрытие из мембраны. В качестве альтернативы, удалить покрытие путем замачивания диализной трубки в теплой воде в течение 1 часа перед использованием. Готово путем промывки диализной трубки с сверхчистого водоснар.
- Надежно свяжите один конец диализной трубки. Заполните раствором олеиновой кислоты-БСА и свяжите другой конец диализной трубки.
- Поместите заполненные диализной трубки в 4-литровую колбу Эрленмейера буфера KH и позволить диализ в течение ночи при 4 ° С при слабом перемешивании мешалкой.
- На следующий день, удалить 8х концентрированный раствор олеиновой кислоты-БСА из диализной трубки. С помощью олеиновой кислоты раствор-BSA немедленно для перфузии или аликвоты и хранить при температуре -20 ° С. Замороженные аликвоты стабильны в течение по крайней мере 2-х месяцев. Избегайте многократных циклов замораживания-оттаивания, поскольку это может поставить под угрозу растворимость кислотно-БСА комплекса олеиновой.
Примечание: Используйте только сверхчистой воды (Удельное сопротивление 18.2 MΩ.cm при 25 ° С, общее содержание органического углерода <10 частей на миллиард, микроорганизмы ≤ 1 КОЕ / мл, твердые частицы с размером более 0,22 мкм ≤1 / мл) для приготовления реагентов и буферов используется для сердца перфузии. Превращение анионообменной смолы из его хлорида длям в виде гидроксида , можно избежать путем прямой покупки форме гидроксида за дополнительную счет (см Материалы таблицу). К тому же, олеат или пальмитат, любой другой тип природных жирных кислот также могут быть использованы, до тех пор, как тритий вариант жирной кислоты можно следовать его дальнейшему окислению.
2. Подготовка перфузии буфера
- В колбу 4 л Эрленмейера, смешайте 200 мл 20х концентрированного солевого раствора и 200 мл 20х концентрированного раствора NaHCO 3 с 3,6 л ультрачистой воды. Газовая раствора в течение 15 мин со смесью двуокиси углерода 5% и 95% кислорода, а затем добавляют 10 мл 1 моль / л CaCl 2 маточного раствора , чтобы установить концентрацию свободного Са 2+ в дозе 2,5 ммоль / л.
ВНИМАНИЕ: Следующие шаги включают в себя манипулирование радиоактивными материалами. Используйте соответствующие средства индивидуальной защиты и соблюдать правила техники безопасности и утилизации отходов, установленные ра учреждениячений безопасности офиса. - Передача 1.750 L KH буфера 2 л из боросиликатного стекла бутылку. Добавить 250 мл 8х концентрированный раствор олеиновой кислоты , бычий сывороточный альбумин, 1,802 г D-глюкозы, 400 мкл инсулина на уровне 0,4 Ед / мл, и 200 мкл (0,2 мКи) [U- 14 C] глюкоза. Переверните бутылку, чтобы перемешать. Это даст 2 л полного перфузионного буфера, содержащего олеиновую кислоту (0,4 ммоль / л), D-глюкоза (5 ммоль / л) и инсулин (40 мкЕд / мл).
Примечание: объем 2 л достаточно, чтобы заливать рабочую взрослого сердца крыс в условиях, не рециркуляционных в течение не менее 60 мин. - Используйте некоторые из нерадиоактивного буфера KH, чтобы заполнить два рассечение блюда и поставить на лед, чтобы охладить.
3. Подготовка Perfusion аппарата
Примечание: Исследователь может выбрать для использования по индивидуальному заказу перфузионного устройства , такого как описан с помощью Taegtmeyer, рубчики и Кребса 11, или один из коммерчески доступных систем. системы перфузии, как правило, состоят изэлементы , описанные ниже на рисунке 1. Кроме того, трубы и изделия из стекла, остальная часть записывающего оборудования не является обязательным и его использование будет зависеть от потребностей следователя решить вопрос экспериментального спрашивают. Тем не менее, мы рекомендуем использовать кислородных микроэлектродов для определения концентрации O 2 в буфере входа и выхода из коронарного кровообращения (Рисунок 1). Это поможет контролировать исследователю, что сердце поставляется с соответствующим количеством кислорода, и что подача кислорода не меняется от эксперимента к эксперименту. Кроме того, определение "артериовенозной" разность кислорода может быть использована для расчета потребления кислорода миокардом и сердечную эффективность 16,18.
- Включите ванну оборотной воды и установлена на уровне 37 ° С для разогрева аппарата перфузионного.
- Включите компьютер и системы сбора данных, которые будутиспользоваться для измерения функции сердца.
- Подключите записывающие устройства (катетеров давление, давление объема катетера, кислорода микроэлектродов, расходомеры и т.д.) в систему сбора данных и выполнять калибровку приборов следующих инструкций изготовителя.
- Заполните резервуар буфера сверхчистой водой. Включите шланговый насос и промойте водой через все трубки и стеклянную посуду, чтобы промыть систему. Выключите перистальтический насос и убедитесь в отсутствии воды остается в трубопроводе и / или стеклянную посуду, так как это может повлиять на концентрацию буфера перфузионной и подготовки сердца.
- Подключите новый 1,0 мкм фильтр из стекловолокна в системе. Подключение газовый баллон, содержащий смесь двуокиси углерода 5% и 95% кислорода в Oxygenating камере.
ВНИМАНИЕ: Следующие шаги включают в себя манипулирование радиоактивными материалами. Используйте соответствующие средства индивидуальной защиты и соблюдать правила техники безопасности и утилизации отходов, установленные учреждением'S радиационной безопасности в офисе. - Заполните буферный резервуар с перфузионной буфером. Включите насос и обеспечить заполнение всех трубок и стеклянной посуды с буфером перфузии. Запуск перфузионного буфера через устройство перфузионного в режиме рециркуляционного и кислородсодержащих соединений, по крайней мере, 30 мин перед использованием.
- Плотно присоедините трубку 20 мл шприца под камеры сердца, чтобы восстановить коронарный сточные воды. Подключите кончик шприца к верхней части трехходовым запорным краном. Подключение боковому отводу к 3 мл шприца. Соедините нижнюю руку через трубки в контейнер для жидких радиоактивных отходов.
Примечание: При использовании жирных кислот БСА комплекс, насыщение кислородом буфера перфузионного не может быть осуществлено путем прямого кипела газораспределительную трубку, так как это приведет к избыточному вспениванию раствора. Использование мембраны оксигенатор (рисунок 1) или камеру Oxygenating потока листа для этой цели. Настоятельно рекомендуется проверить, что соответствующий уровень Oе оксигенации достигается путем размещения микроэлектрода кислорода в контуре перфузии (Рисунок 1).
4. Крыса изоляции сердца и катетеризацию
- Взвесьте крысы по шкале.
- Приготовьте шприц с анестезирующего дозе 150 мг / кг thiobutabarbital гидрата натриевой соли и туберкулина шприц с 200 USP единиц гепарина.
- Вводят thiobutabarbital IP и ждать животного, чтобы потерять сознание. Другие индукционные агенты могут быть использованы до тех пор , как это не будет мешать целей эксперимента (см Выбор анестетика в обсуждении материала раздел ниже).
- Проверьте соответствующий уровень анестезии, подтвердив отсутствие пальца ноги пинч рефлекса. Убедитесь в том, чтобы поддерживать надлежащую глубину анестезии, чтобы гарантировать, что животное не чувствует боли во время процедуры.
- После того, как крыса полностью без сознания и не реагирует на носок крайнем случае, положите его на спину на операционном столе и секURE конечностей с лентой или булавками.
- Клип живота, свободной от волос и выполнять срединный разрез брюшной полости. Не открывайте грудной полости в этом месте еще. Перемещение желудка и кишечника в сторону, чтобы открыть нижнюю полую вену. Вводят гепарин непосредственно в нижнюю полую вену и ждать от 5 до 10 секунд, прежде чем продолжить.
- С помощью ножниц вырезать диафрагму и стороны грудной клетки, чтобы выставить содержание грудной полости.
- Деликатно захватить сердце между большим, указательным и средним пальцами и акцизной как сердце и легкие вместе. Вырезать на уровне нисходящей аорты, соблюдая осторожность, чтобы не повредить дуги аорты и восходящей аорты в процессе. Немедленно передать сердце и легкие к одному из рассечение блюд, заполненных ледяным буфером КН.
- После того, как сердце перестает биться, передать во вторую рассечение блюдо и обрезать любые большие куски ткани легкого, присоединенные сохраняя при этом сердце погруженного в ледяном буфере KH. Обрежьте спускИНГ аорту прямо над дугой аорты.
ВНИМАНИЕ: Следующие шаги включают в себя манипулирование радиоактивными материалами. Используйте соответствующие средства индивидуальной защиты и соблюдать правила безопасности и утилизации отходов, установленные радиационной безопасности офиса учреждения. - Промывка аортального линию перфузионной аппарата для заполнения аортального канюлю с теплым буфером и для устранения воды или воздуха, которые все еще могут присутствовать в трубке. Разрешить буфер перфузия капать из аорты канюлю, чтобы свести к минимуму вероятность воздушной эмболии в то время сердце прикреплен к канюле.
- Использование двух микро препаровальный пинцет осторожно откройте аорту и сдвиньте сердце вверх на аорте канюлю. Зафиксировать на аорту канюлю с микро клипа и инициировать Лангендорфа перфузию сердца. Обратите внимание сердце начинают снова бьется и изгнать всю кровь, оставшуюся в коронарных сосудах в секундах после начала перфузии.
Примечание: Очень важно, чтобы выполнить 4 шага.6 через 4.10 как можно быстрее, чтобы предотвратить необратимые ишемические повреждения сердца. С опытом, вся процедура должна занять от 1 до 2 мин. При сдвинув аорту на канюлю, будьте осторожны, чтобы не пропустить корня аорты, так как это может привести к инфаркту гипоперфузии и повреждения клапана аорты. - Привяжите к аорту аорты канюлю с 3-0 шелковым швом и удалить микро-клип. Расположить легочной вены. Это может быть необходимо, чтобы обрезать несердечная ткани, чтобы найти его, но не режут слишком много несердечных тканей, так как они служат, чтобы связать левое предсердие с канюлей.
- Промывка левого предсердия линию перфузионной аппарата для заполнения предсердии канюлю с теплым буфером и для устранения воды или воздуха, которые все еще могут присутствовать в трубке. Необходимо соблюдать особую осторожность, чтобы удалить пузырек воздуха из устройства, чтобы свести к минимуму вероятность воздушной эмболии в то время сердце прикрепляется к канюле.
- Используя два микро рассекает ForcEPS деликатно захватить отверстие легочной вены и сдвиньте сердце вверх на предсердия канюлю. Это может быть необходимо, чтобы изменить положение сердца, осторожно вращая предсердии и / или аортальный канюлю для выполнения этого шага. В любом случае, убедитесь, что процедура не накладывает чрезмерную нагрузку на сердце и вызывает изгиб аорты. Свяжите левое предсердие к мерцательной канюлей с шелковой нитью 3-0.
- Открыть предсердии линию и одновременно переключать аортального линию из режима Лангендорфа в рабочий режим. Если буфер просачивается из левого предсердия, закройте предсердии линию, переключиться обратно аортального линию Лангендорфа перфузией, и использовать другой 3-0 шелковой нити, чтобы связать левое предсердие более надежно к канюле.
5. Измерение функции сердца и сбора проб
Примечание: Определение метаболических потоков потребует знания коронарного потока (CF). Как описано ниже, коронарные значения расхода могут бытьполученные с использованием простого секундомера. Кроме того, измерение потока аорты (AF), с тем же самым способом, позволит определить минутный сердечный выброс (СО = CF + AF), который затем может быть использован для расчета сердечной мощности (CP) в качестве общей меры сердечной функции, применяя формула СР = СО (м 3 / с) * постнагрузки (Па). Другой метод для оценки функции сердца зависит от реального времени измерения импульса давления с датчиком давления (фиг.3 и 4). Несмотря на то, по желанию, наиболее точные и детальные измерения функции сердца и гемодинамики сократительной, включая определение левого желудочка систолического и диастолического функции, будут достигнуты при использовании давления объем (PV) проводимости катетера. В этом разделе кратко описывает катетеризация изолированного сердца. Дополнительная информация о калибровке PV катетеров и анализа данных с статистического программного обеспечения может бытьнайдены в ссылках 14,15.
ВНИМАНИЕ: Следующие шаги включают в себя манипулирование радиоактивными материалами. Используйте соответствующие средства индивидуальной защиты и соблюдать правила безопасности и утилизации отходов, установленные радиационной безопасности офиса учреждения.
- Если эксперимент включает в себя прямое измерение функции ЛЖ с помощью катетера, проколоть верхушку ЛЖ с 26 G иглой и ввести катетер через прокол.
- При использовании давление-объем катетер, осторожно расположить катетер таким образом, чтобы его ось была совмещена с продольной осью ЛЖ, с дистальным электродом прямо ниже аортального клапана и прилегающих к эндокарда границе, а проксимальный электрод только внутри стенки желудочка.
- Уплотнение сердце в сердце камеры с водяной рубашкой и мониторинга сердечных функциональных параметров с помощью программного обеспечения для сбора данных. Начать запись после того, как исходные параметры сердца были стабильными в течение более 5 мин.
- Определить коронарный кровоток по СМЭряется время, необходимое для заполнения шприца трубку объемом 20 мл, прикрепленную под камеры сердца. После измерения, откройте трехходовой запорный кран, чтобы очистить сточные воды в коронарную радиоактивный контейнер жидких отходов.
Примечание: Измерение расхода также могут быть выполнены с использованием расходомера и flowprobes. - Используйте 3 мл шприц, прикрепленный к боковой ручке трехходового запорного крана для восстановления ~ 2 мл коронарная сточные воды, как он выходит из сердца. Передача 0,5 мл коронарного потока, выходящего в 2 мл монолитным микроцентрифужных трубки и сразу же приступить к определению скоростей окисления глюкозы (раздел 6 ниже).
- Перенести остальную часть коронарного отходящем образца (~ 1,5 мл) в помеченную пробирку микроцентрифужных и хранить на льду.
- Повторите шаги 5.4 до 5.6 через равные промежутки времени (например , каждые 5 или 10 мин) до конца эксперимента перфузионного.
- При использовании давление-объем катетера, вводят 10 мкл болюсно гипертонического раствора (15%)в предсердия линии и непосредственно перед мерцательной канюлю прежде, чем завершить эксперимент. Используйте эту инъекцию ударной дозы для расчета параллельной проводимости (V р), которая имеет решающее значение для точного определения сердечного объема 15.
- Распечатывания камеры сердца и удалить катетер из левого желудочка, если был использован в эксперименте. Восстановление сердца, используя один из следующих вариантов:
- Если нет необходимости в изоляции конкретных областей сердца для последующих анализов и если перфузионное устройство позволяет его, закрыть как предсердные и аортального линии и немедленно замораживанием зажимать сердце на его канюль с использованием Wollenberger щипцами предварительно охлажденные в жидком азоте.
- В качестве альтернативы, вырезать сердце от канюли и поместите его в ледяном буфере KH. Быстро высушить сердце на бумажное полотенце и измерить его влажный вес. Сердце затем могут быть разрезаны и образцы тканей собирали для конкретных измерений. Замораживание оставшиеся ткани, используя Wollenberger трубный ключс предварительно охлажденные в жидком азоте.
- Храните замороженный ткани сердца при -80 ° С до определения сухого веса (смотри раздел 8. Расчеты).
6. Определение инфарктом Окисление глюкозы Цены
Примечание: Метод заключается в количественном восстановлении 14 СО 2 из коронарного сточных вод с отлова раствором гидроксида гиамином. 14 CO 2 , растворенного в H 14 CO3- выделяют следующие подкисления буфера с хлорной кислотой. Образцы должны быть обработаны сразу же после того, как их восстановление в качестве пассивной диффузии газа между воздухом и образцом приведет к потере 14 CO 2 в течение долгого времени. Сцинтилляционные флаконы должны быть плотно закрытыми с резиновой манжетой пробками , чтобы предотвратить потерю 14 CO 2 после добавления хлорной кислоты. При необходимости парафильмом может быть использован для защиты резиновой втулки пробками при ОрганизацииФлаконы (рисунок 2).
- Добавьте 1 мл 10х концентрированного гидроксида гиамином в стеклянные сцинтилляционные флаконы (один флакон на пробу + два дополнительных флаконов для определения фоновой активности).
ВНИМАНИЕ: гидроокись гиамином очень токсичен и вызывает сильные ожоги. Обратитесь к MSDS продукта для соответствующей обработки и хранения. - С помощью пинцета осторожно перенести 2 мл монолитным микроцентрифужных пробирку, содержащую 0,5 мл коронарную вытекающий образец в пробирку, предварительно заполненные с гидроксидом гиамином. С помощью 0,5 мл перфузионного буфера для определения фоновой активности.
- Пробирки закрывают крышками с резиновой пробкой рукав. Парафильмом могут быть использованы для обеспечения герметизации флакона. С помощью 1 мл шприца и длинной иглой 23 G, вводят 200 мкл раствора хлорной кислоты (60% вес: вес%) через резиновую пробку и втулки непосредственно в монолитным пробирку 2 мл.
Примечание: ишемическая сточные воды должны белеют из-за осаждения БСА. - Пусть Флаконы Sон в течение ночи.
ВНИМАНИЕ: хлорная кислота чрезвычайно агрессивна, может выступать в качестве окислителя и / или вызвать опасность взрыва. Обратитесь к MSDS продукта для соответствующей обработки и хранения. - На следующий день, снимите резиновый рукав пробками. Осторожно извлечь каждый раз по 2 мл монолитным трубку с помощью пинцета и промыть нижнюю часть трубки в верхней части открытого флакона с 1 мл сцинтиляционной, чтобы получить все гидроксида гиамином. Выбросьте монолитным трубку соответствующим образом маркированный контейнер с радиоактивными отходами.
- Добавьте дополнительный 9 мл сцинтилляционный коктейль в одном флаконе. Добавить 0,5 мл перфузионного буфер непосредственно к двум ампул, заполненных 10 мл жидкого сцинтилляционного коктейля для определения удельной активности. Встряхнуть флаконы энергично рукой и ждать, по крайней мере, 6 часов, чтобы пузырьки воздуха, чтобы рассеять перед измерением в жидком сцинтилляционный счетчик правильно настроен для двух экспериментов этикеток.
Примечание: Используйте четкие стеклянные флаконы для визуализации пеEdle при прокалывания резиновой втулки пробками. Не бросайте хлорной кислоты в гидроксид гиамином, так как это испортит реакцию. Добавление выбросов хлорной кислоты 14 CO 2 из коронарного потока , выходящего в воздух. Хотя флаконы должны быть плотно закрыты , и все 14 CO 2 должны быть захвачены в гиамином гидроксида, рекомендуется проводить этот анализ в соответствии с химической вытяжкой.
7. Определение инфарктом олеат Окисление Цены
Примечание: Метод основан на количественном разделения и извлечения 3 H 2 O от коронарного потока , выходящего с использованием сильной анионообменной смолы. В отличие от восстановления 14 CO 2, не существует проблема стабильности образца и коронарный сточные воды могут быть сохранены на льду или храниться в морозильной камере перед выполнением анализа.
- Приготовьте анионные колонны обменной смолы (один столбец за образец + TWO дополнительные колонки для определения фоновой активности) путем заполнения кончик шприца 3 мл пробирки с стекловатой. Добавляют суспензию смолы / воды с помощью пипетки передачи, пока смола не достигнет отметки 2 мл на шприце трубку.
- Промыть смолу путем пропускания 2 мл сверхчистой воды через колонку. Повторите этот шаг еще два раза.
- Поместите открытые сцинтилляционные флаконы под колонны и загружают 0,5 мл коронарную сточные воды для каждого столбца. Нагрузка 0,5 мл перфузионного буфера для определения фоновой активности.
- Промыть колонны последовательно 0,5, 1 и 2 мл сверхчистой воды. После того, как элюции делается, откажитесь столбцы в надлежащим образом маркированный контейнер с радиоактивными отходами.
- Добавить 13 мл сцинтилляционного коктейль на сцинтилляционный флакон. Добавить 0,5 мл перфузионного буфер непосредственно к двум ампул, заполненных 13 мл жидкого сцинтилляционного коктейля для определения удельной активности. Встряхнуть флаконы энергично и ждать по крайней мере 6 часов перед измерением в жидком ТСМntillation счетчик надлежащим образом настроить для двух экспериментов этикеток.
8. Расчеты
- Если это еще не сделано, определить сырой вес всего перфузию сердца в.
Примечание: Не допускайте замороженной ткани таять, если молекулярные и биохимические анализы должны быть впоследствии выполнены на оставшейся ткани. - Определить Мокрый вес образца ткани со всего заливать-сердца (используют примерно от 15 до 30% от всего сердца). Поместите образец ткани в сушильном шкафу при 50 ° С в течение ночи и измерить ее сухого веса. Используйте / сухой весовое соотношение влажного веса образца ткани для определения сухой вес всего сердца в граммах (г сухого веса.).
- Для каждой временной точки х выразить значение коронарного потока CF х в мл / мин.
- Определение скорости окисления глюкозы
- Средние значения двух дезинтеграции / мин (ПСБ) , измеренные для фоновой активности от 14 С до установОпределим коэффициент коррекции 14C DPM ба.
- Определить 14 C усредненное значение удельной активности 14С распадов в минуту са.
- Определить удельную радиоактивность глюкозы в р / мин мкмоль (F Glu), применив формулу
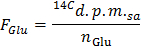
Примечание: где п Глу (мкмол) = С Глу (мкмоль / л) * объем образца (L) = 2,5 при использовании глюкозы в 5 ммоль / л и 0,5 мл образца. - Определите для каждой временной точки х скорости производства 14 CO 2 в р / мин (А), применяя формулу
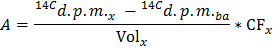
Примечание: Где Vol х (мл) = 0,5 - Разделить по определенному значению сухого веса сердца для получения нормированной скорости производства 14 CO 2 (A Norm ) в ДПМ / мин на г сухого веса.
- Применить формулу GO = A Норм / F Glu , чтобы получить скорость окисления глюкозы (GO) в мкмоль глюкозы / мин на г сухого веса.
- Определение скорости олеата Окисление
- Среднее значение на основании мин значения двух дезинтеграционные / (ДПМ) , измеренных для фоновой активности 3 H для определения коэффициента коррекции 3Н ба DPM.
- Определение 3 H усредненные значения удельной активности 3Н са распадов в минуту.
- Определение удельной радиоактивности олеат в р / мин мкмоль (F Ол е), применив формулу
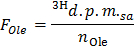
Примечание: Там , где N Ол (мкмол) = С Ол (мкмоль / л) * объем образца (L) = 0,2 при использовании олеат на 0,4 ммоль / л и 0,5 мл образца. - Определите для каждого тиме точки х скорость производства 3 H 2 O в р / мин (B), применяя формулу
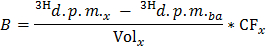
Примечание: Где Vol х (мл) = 0,5 - Разделить Б по определенному значению сухой массы сердца , чтобы получить нормированную-скорость производства 3 Н 2 О (В) в Norm распадов в минуту / мин на г сухого веса.
- Применить формулу OO = B Норм / F Оле , чтобы получить скорость окисления олеат (OO) в мкмоль олеат / мин на г сухого веса.
Результаты
Два репрезентативных экспериментов описаны в приведенных ниже рисунках. В обоих случаях, сердце 16-недельного возраста самцов Sprague Dawley крыс выделяли и перфузию в рабочем режиме с KH буфером, приготовленным в соответствии с предыдущим протоколом. В каждом эксперименте, ?...
Обсуждение
Предшествующий протокол подробно методы для одновременного количественного определения потока субстрата через Окисление глюкозы и окисление жирных кислот в изолированном сердце крысы рабочего. Измерения могут быть наложены к записанным сердца функциональных параметров для опреде...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was supported by National Institutes of Health Grants R00 HL112952 (to R. H.), R01 HL108618 (to J.P.G.), P01 HL051971, and P20 GM104357. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institutes of Health.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium Chloride (NaCl) | Fisher Scientific | BP358 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | P284 | |
| Magnesium Sulfate Heptahydrate (MgSO4*7H2O) | Fisher Scientific | M63 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| AG 1-X8 resin, chloride form, 100 - 200 dry mesh size, 500 g | Bio-Rad | 1401441 | This item can be replaced by purchasing directly the hydoxide form (see reference below), but this will cost almost 8 times more |
| AG 1-X8 resin, hydroxide form, 100 - 200 dry mesh size, 100 g | Bio-Rad | 1432445 | Purchasing this item allows to bypass the conversion of the anion exchange resin from the chloride form to the hydroxide form (See section 1.2 of protocol) |
| Glass Microanalysis Vacuum Filter Holder | Fisher Scientific | 09-753-2 | |
| Sodium Hydroxide (NaOH) | Fisher Scientific | S318 | Corrosive. Consult the product MSDS for appropriate handling and storage. |
| Gas Dispersion Tube with Fritted Cylinder | Fisher Scientific | 11-138B | |
| Probumin Bovine Serum Albumin Fatty Acid Free, Powder | EMD Millipore | 820027 | We recommend the use of a charcoal-defatted BSA, as other purification process such as cold ethanol fractionation may leave residues toxic for the heart. |
| Sodium Oleate | Sigma-Aldrich | O7501 | |
| Oleic Acid, [9,10-3H(N)]- | PerkinElmer | NET289005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Dialysis Membrane Tubing, 29 mm diameter | Fisher Scientific | 08-667E | |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| Glucose, D-[14C(U)]- | PerkinElmer | NEC042B005MC | Radioactive material. Follow your Institution's radiation safety office guidelines for ordering and handling. |
| Humulin R U-100 | Eli Lilly and Company | NDC 0002-8215-01 (HI-210) | |
| Inactin Hydrate | Sigma-Aldrich | T133 | Controlled substance on USDEA Schedule III |
| 3-0 Silk Black Braid | Roboz Surgical | SUT-15-3 | |
| 10x Hyamine Hydroxide | PerkinElmer | 6003005 | Highly toxic and causes severe burns. Consult the product MSDS for appropriate handling and storage |
| 20 ml Glass Scintillation Vials | Fisher Scientific | 03-341-25E | Use glass vials for quantitative recovery of 14CO2 |
| 20 ml HDPE Scintillation Vials | Fisher Scientific | 03-337-23B | Use HDPE vials for quantitative recovery of 3H2O |
| Red Rubber Sleeve Stoppers | Fisher Scientific | 14-126DD | Fit 20 mL scintillation vials; Reusable |
| BD PrecisionGlide Needle 23G x 40 mm | BD | 305194 | Use to inject perchloric acid through the rubber sleeve stopper of the CO2 trap |
| Perchloric Acid, 60% | Fisher Scientific | A228 | Highly corrosive and may act as an oxidizer and/or cause an explosion hazard. Consult the product MSDS for appropriate handling and storage |
| Ultima Gold, Scintillation Cocktail | PerkinElmer | 6013327 | |
| Glass Wool | Fisher Scientific | AC38606 | |
| Decon Dri-Clean Detergent Powder | Fisher Scientific | 04-355 | For cleaning of glassware, plastic parts, and tubing |
| Alconox Tergazyme Enzyme-Active Powered Detergent | Fisher Scientific | 16-000-115 | For cleaning of "hard to reach" surfaces (tubing, glassware) contaminated by fatty acid-BSA residue |
Ссылки
- Neely, J. R., Morgan, H. E. Relationship between carbohydrate and lipid metabolism and the energy balance of heart muscle. Annu Rev Physiol. 36, 413-459 (1974).
- Sen, S., et al. Glucose regulation of load-induced mTOR signaling and ER stress in mammalian heart. J Am Heart Assoc. 2, e004796 (2013).
- Young, M. E., McNulty, P., Taegtmeyer, H. Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation. 105, 1861-1870 (2002).
- Stanley, W. C., Recchia, F. A., Lopaschuk, G. D. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev. 85, 1093-1129 (2005).
- Fillmore, N., Lopaschuk, G. D. Targeting mitochondrial oxidative metabolism as an approach to treat heart failure. Biochim Biophys Acta. 1833, 857-865 (2013).
- Jaswal, J. S., Keung, W., Wang, W., Ussher, J. R., Lopaschuk, G. D. Targeting fatty acid and carbohydrate oxidation--a novel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta. 1813, 1333-1350 (2011).
- Taegtmeyer, H. Cardiac metabolism as a target for the treatment of heart failure. Circulation. 110, 894-896 (2004).
- Taegtmeyer, H., et al. Assessing Cardiac Metabolism: A Scientific Statement From the American Heart Association. Circ Res. , (2016).
- Barr, R. L., Lopaschuk, G. D. Methodology for measuring in vitro/ex vivo cardiac energy metabolism. J Pharmacol Toxicol Methods. 43, 141-152 (2000).
- Neely, J. R., Liebermeister, H., Battersby, E. J., Morgan, H. E. Effect of pressure development on oxygen consumption by isolated rat heart. Am J Physiol. 212, 804-814 (1967).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochem J. 186, 701-711 (1980).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. Am J Physiol Heart Circ Physiol. 303, H156-H167 (2012).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. Am J Physiol Heart Circ Physiol. 301, H2198-H2206 (2011).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nat Protoc. 3, 1422-1434 (2008).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. J Vis Exp. , (2015).
- Harmancey, R., et al. Insulin resistance improves metabolic and contractile efficiency in stressed rat heart. FASEB J. 26, 3118-3126 (2012).
- Harmancey, R., Vasquez, H. G., Guthrie, P. H., Taegtmeyer, H. Decreased long-chain fatty acid oxidation impairs postischemic recovery of the insulin-resistant rat heart. FASEB J. 27, 3966-3978 (2013).
- Goodwin, G. W., Taylor, C. S., Taegtmeyer, H. Regulation of energy metabolism of the heart during acute increase in heart work. J Biol Chem. 273, 29530-29539 (1998).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90, 207-258 (2010).
- Neely, J. R., Denton, R. M., England, P. J., Randle, P. J. The effects of increased heart work on the tricarboxylate cycle and its interactions with glycolysis in the perfused rat heart. Biochem J. 128, 147-159 (1972).
- Katz, J., Dunn, A. Glucose-2-t as a tracer for glucose metabolism. Biochemistry. 6, 1-5 (1967).
- Gillis, A. M., Kulisz, E., Mathison, H. J. Cardiac electrophysiological variables in blood-perfused and buffer-perfused, isolated, working rabbit heart. Am J Physiol. 271, H784-H789 (1996).
- Qiu, Y., Hearse, D. J. Comparison of ischemic vulnerability and responsiveness to cardioplegic protection in crystalloid-perfused versus blood-perfused hearts. J Thorac Cardiovasc Surg. 103, 960-968 (1992).
- Cotter, D. G., Schugar, R. C., Crawford, P. A. Ketone body metabolism and cardiovascular disease. Am J Physiol Heart Circ Physiol. 304, H1060-H1076 (2013).
- Huang, Y., Zhou, M., Sun, H., Wang, Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?. Cardiovasc Res. 90, 220-223 (2011).
- Buse, M. G., Biggers, J. F., Friderici, K. H., Buse, J. F. Oxidation of branched chain amino acids by isolated hearts and diaphragms of the rat. The effect of fatty acids, glucose, and pyruvate respiration. J Biol Chem. 247, 8085-8096 (1972).
- Liepinsh, E., et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state. Metabolism. 63, 127-136 (2014).
- Niu, Y. G., Hauton, D., Evans, R. D. Utilization of triacylglycerol-rich lipoproteins by the working rat heart: routes of uptake and metabolic fates. J Physiol. 558, 225-237 (2004).
- Goodwin, G. W., Arteaga, J. R., Taegtmeyer, H. Glycogen turnover in the isolated working rat heart. J Biol Chem. 270, 9234-9240 (1995).
- Sender, P. M., Garlick, P. J. Synthesis rates of protein in the Langendorff-perfused rat heart in the presence and absence of insulin, and in the working heart. Biochem J. 132, 603-608 (1973).
- Hindlycke, M., Jansson, L. Glucose tolerance and pancreatic islet blood flow in rats after intraperitoneal administration of different anesthetic drugs. Ups J Med Sci. 97, 27-35 (1992).
- Zuurbier, C. J., Keijzers, P. J., Koeman, A., Van Wezel, H. B., Hollmann, M. W. Anesthesia's effects on plasma glucose and insulin and cardiac hexokinase at similar hemodynamics and without major surgical stress in fed rats. Anesth Analg. 106, 135-142 (2008).
- Oguchi, T., Kashimoto, S., Yamaguchi, T., Nakamura, T., Kumazawa, T. Is pentobarbital appropriate for basal anesthesia in the working rat heart model?. J Pharmacol Toxicol Methods. 29, 37-43 (1993).
- Segal, J., Schwalb, H., Shmorak, V., Uretzky, G. Effect of anesthesia on cardiac function and response in the perfused rat heart. J Mol Cell Cardiol. 22, 1317-1324 (1990).
- Webster, I., Smith, A., Lochner, A., Huisamen, B. Sanguinarine non- versus re-circulation during isolated heart perfusion--a Jekyll and Hyde effect?. Cardiovasc Drugs Ther. 28, 489-491 (2014).
- Belke, D. D., Larsen, T. S., Lopaschuk, G. D., Severson, D. L. Glucose and fatty acid metabolism in the isolated working mouse heart. Am J Physiol. 277, R1210-R1217 (1999).
- Iannaccone, P. M., Jacob, H. J. Rats! . Dis Model Mech. 2, 206-210 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены