需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在活细胞悬浮液荧光测定G蛋白选择性GPCR构象测量使用FRET传感器
摘要
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
摘要
Fӧrster共振能量转移(FRET)基中的GPCR信号传导的调查研究已变得越来越普遍。我们的研究小组开发出一种分子内FRET传感器来检测Gα亚基及以下激动剂刺激活细胞G蛋白偶联受体之间的相互作用。在这里,我们对细节处理后用100μM盐酸异丙将β2肾上腺素能受体和GαsC端肽的检测FRET变化协议作为以前的特点1。我们FRET传感器是由一个全长的GPCR,一个FRET受体荧光团(mCitrine)的串联的单个多肽,一个ER / K痉挛(系统蛋白亲和力强度调制)连接体,FRET供体荧光团(mCerulean)和GαÇ末端肽。该协议将详细介绍细胞制备,转染条件,设备安装,试验执行和数据分析。这个实验设计检测小通道安格斯在FRET指示蛋白质 - 蛋白质相互作用,并且也可以用来比较相互作用的跨越配体和G蛋白偶联受体,G蛋白配对的强度。增强信号噪声中的测量,该协议要求在所有步骤升高的精度,并且在这里提出,以使重现的执行。
引言
G蛋白偶联受体(GPCR)是七跨膜受体。人类基因组中单独含有约800个基因编码的GPCR,这是通过各种配体包括光,添味剂,激素,肽,药物和其它的小分子激活。目前市场上的目标GPCR的所有药品的近30%,因为他们在许多疾病状态2发挥很大的作用。尽管几十年来对这个受体家族丰富的工作经验,有留在场上显著悬而未决的问题,特别是关于推动GPCR-效应相互作用的分子机制。迄今为止,只有一个高分辨率晶体结构已发表 ,提供洞察β2 -肾上腺素能受体(β2 -AR)和G蛋白3之间的相互作用。在过去的三十年的广泛研究一起,它重申一个具体结构部件即临界在此互动:Gα亚基C端。这种结构是两个G蛋白活化的GPCR 4和G蛋白选5-6重要。因此,GαC端提供了GPCR的配体刺激和选择性激活G蛋白之间的关键环节。
研究在过去十年中表明的GPCR填充广泛的构象的风景,配体结合的稳定的GPCR的构象的子集。虽然若干技术,包括结晶,核磁共振和荧光光谱,和质谱可用来检查GPCR的构象的风景,有办法一个缺乏以阐明在效应选择7的功能意义。这里,我们概述一个Fӧrster共振能量转移(FRET)基的方法来检测G蛋白选择性GPCR的构象。 FRET依赖于两个荧光团的接近和平行取向具有重叠发射(供体)一次激励(受体)谱8。作为供体和受体荧光团来靠得更近如蛋白质或任一构象变化的蛋白质-蛋白质相互作用的结果,它们之间的FRET增加,并且可以使用各种方法8进行测量。基于FRET的生物传感器已经在GPCR领域9广泛应用。他们已被用于在第三细胞内环和GPCR C端插入供体和受体,探讨在G蛋白偶联受体构象变化;传感器被设计用FRET对10分开贴标GPCR和效应(G蛋白亚基/抑制蛋白)来探测GPCR和效应的相互作用;一些传感器也检测所述G蛋白11的构象变化。这些生物传感器已经启用了现场询问,包括在GPCR和构象变化的效应,GPCR-效应相互作用动力学和变构配体12悬而未决的问题,众说纷纭。我们的组在创建一个能检测激动剂驱动的条件下,g的蛋白构象GPCR生物传感器特别感兴趣。这种生物传感器依靠命名为痉挛(系统蛋白亲和强度调制)13最近开发的技术。 SPASM涉及到使用ER / K连接,控制它们的有效浓度圈养相互作用蛋白结构域。侧翼带有FRET对荧光团的链接器创建一个工具,它可以报告蛋白12之间的相互作用的状态。先前1使用了痉挛模块到GαC-末端系绳到GPCR并监控其与FRET的荧光团的相互作用,mCitrine(通过其通常已知的变体,黄色荧光蛋白(YFP),激发/发射峰在提及的这个协议525分之490纳米)和mCerulean,激发/发射峰四百七十五分之四百三十零纳米)(由它的俗称变种青色荧光蛋白(CFP在本协议中提到的)。从N至C末端,T他的遗传编码的单一多肽包含:全长GPCR,FRET受体(mCitrine / YFP),10纳米的ER / K连接体,FRET供体(mCerulean / CFP)和GαC-末端肽。在这项研究中,传感器被简称为GPCR-接头长度-Gα肽。所有部件都通过一个非结构(甘氨酸-丝氨酸-甘氨酸)4连接子,使每个域的自由旋转分离。以前用两个典型的G蛋白偶联受体进行此类传感器的详细特征:β-AR和视蛋白1。
此传感器被瞬时转染到HEK-293T细胞和基于荧光 - 活细胞实验的FRET对中在存在或不存在配位体的每秒(CPS)计数的任意单位的测量荧光光谱。这些测量用于计算荧光团(YFP 最大值 / CFP 最大值 )之间的FRET比率。在FRET(ΔFRET)的变化,然后减去平均FRET比率计算从配体处理的样品的FRET比率的未处理的样品。 ΔFRET可以跨结构进行比较(β-AR-10纳米Gαs肽与β-AR-10纳米无肽)。这里,我们详细协议来表达活的HEK-293T细胞,这些传感器,监视它们的表达,并安装,执行,和基于荧光 - 活细胞的分析FRET测量未处理与药物处理的条件。虽然该协议是专用于与100μM的异丙酒石酸氢盐处理的β2 -AR-10纳米Gαs肽传感器,它可以为不同的GPCR-Gα对和配体进行优化。
研究方案
1.准备DNA
- 设计的传感器构造采用模块化克隆方案。请参考β-AR传感器设计1先前详述。
- 按照商业miniprep试剂协议准备DNA和洗脱在2毫米的Tris-HCl溶液,pH值8,在浓度≥750纳克/微升,A 260 / 1.7 280 - 1.9,A 260 / 2.0的230 - 2.29。
2.细胞培养制备
- 培养的HEK-293T-的Flp-n的细胞在DMEM含有4.5g / L的D-葡萄糖,补充有10%FBS(热灭活的)(体积/体积),1%L-谷氨酰胺补充,20毫米的HEPES,pH值7.5,在37在5%的CO 2°下在潮湿气氛。处理生物安全罩的后续步骤细胞。
- 允许传代于6孔盘前的细胞生长至汇合单层 。时间,以达到融合依赖于初始接种密度。使用板指来到内1汇合 - 电镀2天六个孔电镀。汇合10厘米组织培养处理过的培养皿具有大约4×10 6个细胞/ ml的细胞密度。参见图1为细胞培养生长的图像。
- 洗涤细胞10毫升PBS,并用0.25%的胰蛋白酶trypsinize(见讨论,第2款)。板8×10 5个细胞/孔在组织的2ml培养基培养处理的六孔菜肴,并允许粘附16 - 20小时。
3.转染条件
- 错开转染对于可能需要不同的时间量,以达到最佳表达构建体(在20 - 36小时)。同步进行统一的实验时间的条件。也有可用于分析过程中的背景噪声和散射减法未转染的对照孔在相当于细胞密度。
- 把转染试剂室温:降低血清培养基,DNA转染试剂。
- 在一个生物安全罩以下列顺序结合试剂在无菌的离心管:混合料2用100μl降低血清介质微克的DNA。穗6微升转染试剂到媒体/ DNA混合物的不接触混合物的表面或管子的一侧。设置各井一转反应。转染条件可以优化(1 - 4的DNA微克,3 - 6微升转染试剂),以取得一致的表达水平。 见表1更加优化的比率。
- 30分钟 - 在生物安全罩15孵育在室温混合。如果离开孵化时间超过30分钟,不要使用反应。
- 添加到在一个逐滴方式的细胞反应跨孔和轻轻摇动六孔以确保彻底混合。添加好每一个反应。
- 表达20小时后,荧光显示器,利用组织培养荧光显微镜。评估与40X在细胞10X物镜和蛋白质定位种群表达。 OBSERVE在质膜(PM)的蛋白的表达。如大量内部注意到,直到显著表达式在PM检测监控转染。
4试剂和设备的准备
- 在-80℃的准备100毫米制药股和存储:重酒石酸异丙肾上腺素(100毫米含有300毫米抗坏血酸卫生署2 O)。制作冰/在寒冷的房间,并立即闪冻结。等分试样可以制造和使用长达一年。
- 准备电池溶液(〜2毫升/条件),并存储在37℃水浴。要让每一天都有新鲜。 Cell的缓冲成分参考表2。
- 制备药物缓冲液(10ml)中并在室温下储存。药品成分的缓冲参考表2。
- 酸洗用浓盐酸试管。用弱碱(1μMKOH)中和,并与卫生署2 O彻底冲洗比色皿
- 准备工作车站周边的荧光有几个10,200,1000微升枪头,一个计时器10分钟倒计时,有技巧比色皿清洗,棘手的任务湿巾可访问的真空管路,并用超H 2 O.喷瓶箱设置
- 热量荧光及热块到37℃外部水浴。
- 打开荧光;设置荧光采集程序收集CFP与激发430nm处,带通8处;发射范围450纳米 - 600纳米,带通4纳米。对于YFP集合只作为传感器控制(见讨论 )一套激发至490纳米,带通8纳米,发射范围500 - 600纳米,带通4纳米。 CFP收集设置将用于收购在这个实验中一个FRET谱。
- 放置在加热块12的1.5 ml离心管,如下面的图2。这些管子是细胞等分管座(500微升离心管。)将一小块组织的持有者1和7,以减轻放在这里的比色皿。
注意:使用单独的试管未经处理的条件和药物条件防止交叉污染。

图2. 微量离心管设置,并在加热块试管位置参考未处理的样品是在位置1。细胞等分管是在位置2 - 6比色皿药物处理过的样品在位置7;细胞等分管是在位置8 - 12。 请点击此处查看该图的放大版本。
- 填充支架2 - 6和8 - 12〜750微升的水以创建微型37℃水浴中。
- 将10 500细胞等分微升离心管到小型水浴场(持有2 - 6,8 - 12)。每个管将是条件的单个重复(5 untreateD,5药物治疗的)。
- 监测表达细胞(见步骤3.6)。
5.实验和数据收集
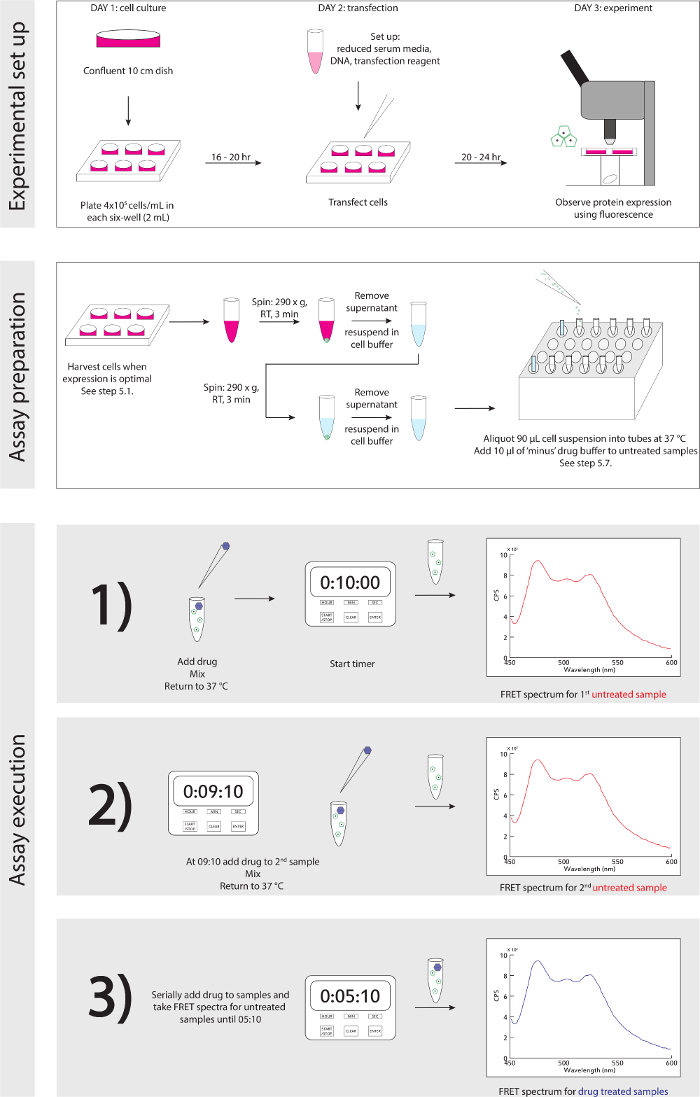
图3.实验原理图,详细的逐步指导实验设置和执行。 请点击此处查看该图的放大版本。
- 参考图3实验原理图。当细胞准备收获的基础上,用荧光显微镜检测蛋白的表达(见讨论,第4段):生物安全罩,轻轻取出约1毫升媒体,悬浮细胞在他们的文化与P1,000和悬浮转移入1.5ml微量离心管中。
注意:避免使用胰蛋白酶,因为它可能消化的N端和/或结合GPCR传感器的口袋里。 - 计数细胞,以确保再悬浮适当的细胞密度。优化4×10 6个细胞/ ml重悬浮体积。
- 旋在摆动斗离心机细胞在室温下,290×g离心3分钟。离心后去除上清液。
- 轻轻重悬细胞于1ml细胞缓冲液(贮存在37℃),并重复步骤5.3。在第二次旋转,从-80收集100毫米毒品股票等分℃。制作1:100稀释药品缓冲1毫米的工作股票,并保持在室温。
- 在第二次离心后,除去上清,轻轻悬浮细胞于1ml细胞缓冲液(4×10 6个细胞/ ml)的。在用1ml细胞和1ml细胞缓冲液作为空白的分光光度计样品的测量的OD 600。分装细胞在一次性塑料杯中,并回传给离心管立即分光光度法以下。
- 对于未转染控制CELL设备状态谱,轻轻悬浮未转染细胞在1毫升细胞缓冲器,P1,000吸管,加入90微升细胞的比色皿,并获得在激发波长430 FRET谱,带通8纳米,发射450 - 600纳米,带通4纳米。收集3 - 5新鲜的90微升细胞重复光谱。保持细胞的库存,在37℃的规格之间,P1,000每个样品等分试样之间轻轻悬浮,并冲洗比色皿用超纯的 H 2ö样本之间。
- 对于实验条件,等分试样90微升转染的细胞以每个固定器2的500微升管 - 6,8 - 在热块12。轻轻悬浮细胞的股票,每个等分之间P1,000吸管。
- 细胞分装后,加入10微升药物缓冲区的管2 - 6未经处理的条件样本。
- 开始加入10微升1mM的药液进入管8的实验中,启动定时器,从10分钟倒数,并轻轻地用P200滴管混合管。关闭管和返回到37°加热块。
- 马上拿起试管2,用P200轻轻混匀(使用新尖),加入90微升细胞悬液,以未经处理的条件比色皿,并在荧光到位。
- 收购在激发波长430,带通8纳米,发射450 FRET谱 - 600纳米,带通4纳米。
- 在9分 - 10秒,秒杀管9与10微升1 mM的药物溶液,轻轻地用P200(使用新尖)混合,并返回管散热模块。
- 重复步骤5.10 - 5.11管3和5.12与管10。
- 以1分钟的间隔(08:10,07:10, 等等 ),直到光谱收集所有未处理的条件的样品,及药物已被添加到所有药物条件样品5.13 -重复步骤5.10。选用一个新鲜提示为每个吸管步骤防止交叉污染。
- 在5分钟 - 10秒,开始搅拌筒8(药物条件)轻轻地用吸管P200,加入90微升细胞悬液分离试管中荧光药物处理的样品和地点。
- 收购˚FRET谱(见步骤5.11设置)。
- 以1分钟的间隔(04:10,03:10, 等等 ),剩余药物样本条件(管9 - 12)5.16 -重复步骤5.15。
- 实验结束后,保存项目文件,彻底清洗试管用超H 2 O和重组股管的一个条件。小心防止在洗涤步骤的交叉污染。改变对H 2 O瓶以及在洗涤之间的真空管线的尖端。
6.数据分析
- 保存并在SPC导出的数据文件格式,以用于分析。分析程序可以从Sivaramakrishnan实验室发布的网站上下载。
- 创建分析软件路径的文件,其中包括分析程序(V9,V15),未转染的样本文件(见步骤5.6未转染的细胞收集频谱),输出数据文件,逗号分隔值(CSV)数据输入文件。
- 输入以下信息成CSV文件(见表3样品),并指定各条件对于每个样品,其中包括:
文件名 - 个人SPC图形文件
受体-候其中GPCR构建体进行了测试( 例如,Β2)
粘合剂-候该构建体的肽变体进行了测试( 例如 ,S)
激动剂 - 候未处理(N)或药物处理(D)的条件
目录 - 在SPC文件保存,通常是由举办日期的文件夹路径
OD - 从分光光度计样品的记录光密度 - 输入未转染的样品(步骤5.6)的文件名来减去样本缓冲区和散射噪声。
- 进入条件进入分析程序。
- 运行程序,分析单独的条件(V9)内和跨环境(V15)的样品。
- 排除这是在数据集中离群明显的示例文件,或者通过增加或减少INDIVI OD值调整减法双文件。
- 数据导出到输出文件访问计算FRET比(525纳米/ 475纳米)。
- 通过从个人的FRET比率减去未处理状态的平均FRET比率处理(药物)的条件下计算ΔFRET。
结果
实验的广义示意设置和执行在图3中详细说明。
为了检测在传感器的窄动态范围内的FRET的变化,它是附着在系统的细微差别粘附到临界。小区质量势在必行蛋白质表达以及在抽样保持一致。 图培养细胞以一致的单层(10X),它是最佳生长的1特征的图像为六孔电镀和转染图1(a)和结块图案生长的细胞铅树突形状图
讨论
在这个系统中FRET测量的严密动态范围强化敏感的质量控制在本协议中的每一个步骤的必要性。以确保成功的FRET实验的最重要的步骤是:1)细胞培养,2)转染3)蛋白表达和4)及时,准确协调的测定执行期间。
细胞的健康和维护/电镀质量可以对实验系统和差细胞健康的信号 - 噪声一个显著影响可以使它不可能检测在FRET任何一致的变化。保守,细胞是健康的大约20代,虽然这可...
披露声明
作者宣称他们没有利益冲突。
致谢
RUM是由美国心脏协会前博士生奖学金(14PRE18560010)的资助。研究是由美国心脏协会的科学家开发格兰特(13SDG14270009)美国国立卫生研究院(1DP2 CA186752-01与1-R01-GM-105646-01-A1),以资助SS
材料
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
参考文献
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。