Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
G Protein-seçici GPCR konformasyoları Canlı Hücre Süspansiyon Fluorometer Deneyinde FRET sensörleri kullanılarak ölçülebilir
Bu Makalede
Özet
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
Özet
Fӧrster rezonans enerji transferi (FRET) çalışmaları GPCR sinyalizasyon soruşturma giderek daha yaygın hale gelmiştir tabanlı. Araştırma grubumuz Gα alt birimlerinin ve agonist stimülasyon takip eden canlı hücrelerde GPCRs arasındaki etkileşimi tespit etmek için bir intra-moleküler FRET sensörü geliştirdi. Burada, ayrıntılı 100 uM izoproterenol hidroklorür ile işlenmesi üzerine β 2-adrenerjik reseptörü ve Gαs C-terminali peptid arasında FRET değişiklikleri tespit etmek için protokol daha önce 1 karakterize edilen. Bizim FRET sensörü, tam uzunlukta bir GPCR, FRET akseptör-floroforu (mCitrine) seri olarak aşağıdakilerden oluşan tek bir polipeptid olup, bir ER / K SPASM (sistematik proteinin afinite gücü modülasyonu) bağlayıcı olarak, bir FRET verici florofor (mCerulean) ve Gα Cı terminal peptid. Bu protokol olacak detay hücre hazırlama, transfeksiyon koşulları, ekipman kurulumu, tahlil yürütme ve veri analizi. Bu deney tasarımı, küçük ch algılarAnges'a FRET protein-protein etkileşimleri göstermektedir ve ayrıca ligandları ve GPCR G proteini eşleşmeleri arasında etkileşim gücünü karşılaştırmak için kullanılabilir. sinyal-gürültü bizim ölçümlerde geliştirmek için, bu protokol her adımda artan hassasiyet gerektirir ve tekrarlanabilir yürütülmesini sağlamak için sunulmuştur.
Giriş
G-proteinine kenetlenmiş reseptörlerin (GPCR'ler) yedi transmembran reseptörlerdir. İnsan genomu tek ışık, koku, hormonlar, peptitler, ilaçlar ve diğer küçük moleküller de dahil olmak üzere, çeşitli ligandlı ile aktive olan GPCR, kodlayan yaklaşık 800 gen içermektedir. Piyasa hedef GPCRs şu anda tüm ilaçların yaklaşık% 30 birçok hastalık durumlarında 2 büyük bir rol oynamaktadır çünkü. Bu reseptör ailesinin üzerinde yapılan kapsamlı çalışmaların yıllardır rağmen, özellikle GPCR-efektör etkileşimleri sürücü moleküler mekanizmaları açısından, alanında önemli seçkin soruları orada kalır. Bugüne kadar, sadece bir yüksek çözünürlüklü kristal yapı β 2 adrenerjik reseptör (β 2-AR) ve Gs proteini 3 arasındaki etkileşim içgörü sağlayarak, yayımlandı. Birlikte son üç yıl içinde kapsamlı bir araştırma ile, bu çok önemlidir belirli bir yapısal bileşen yineledietkileşim: Gα alt birim C-terminali. Bu yapı, GPCR 4 G protein seçiminde 5-6 her iki G protein aktivasyonu için önemlidir. Bu nedenle, Gα C-terminali GPCR ligand uyarılması ve seçici G protein aktivasyonu arasındaki önemli bir bağlantı sağlar.
son on yılda Araştırma GPCR'ler GPCR yapılardan alt kümelerini stabilize ligand bağlama ile, geniş bir yapısal peyzaj doldurmak olduğunu göstermektedir. Kristalografisi, NMR ve floresan spektroskopisi, ve kütle spektrometresi dahil olmak üzere birçok teknik, GPCR yapısal peyzaj incelemek için mevcut iken, efektör seçimi 7 fonksiyonel önemini açıklamak için yaklaşımlar azdır. Burada, G protein seçici GPCR konformasyonlar tespit etmek için bir Fӧrster rezonans enerji transferi (FRET) tabanlı bir yaklaşım özetlemektedir. FRET emisyon (donör) a örtüşen iki fluorophores yakınlığı ve paralel yönde dayanırve tahrik (akseptör) spektrumları 8. Verici ve alıcı floroforlar konformasyonel protein değişikliği veya bir protein-protein etkileşimini bir sonucu olarak daha yakın bir araya geldiğinde, bunlar arasında FRET arttırır ve yöntem 8 bir dizi kullanarak ölçülebilir. FRET tabanlı biyosensörler GPCR alanda 9 yaygın istihdam edilmiştir. Üçüncü hücre döngüsü ve GPCR Cı-terminalindeki verici ve alıcı ekleyerek GPCR konformasyon değişiklikleri incelemek için kullanılmıştır; Sensör ayrı FRET çifti 10, GPCR ve efektör (G protein alt-birimleri / arrestins) etiketleyerek GPCR ve efektör etkileşimlerini incelemek için dizayn edilmiştir; Bazı sensörler ayrıca G-proteinine 11 yapısal değişiklikleri algılar. Bu biyosensörler yapısal GPCR değişiklikler ve efektör, GPCR-efektör etkileşim kinetik ve allosterik ligandlar 12 olmak üzere seçkin sorular çok sayıda sormak alanını sağlamıştır. Bizim grubumuzagonist odaklı koşullar altında G-protein spesifik GPCR konformasyonlar tespit olabilecek bir biyosensör oluştururken özellikle ilgi oldu. Bu biyosensör (sistematik protein afinite gücü modülasyon) 13 SPASM adında bir süre önce geliştirilen teknoloji dayanmaktadır. SPASM etkin konsantrasyonlarını kontrol eden bir ER / K linker kullanılarak bağlama etkileşimli protein alanları içerir. Fluorophores bir FRET çifti ile linker sınırdaş proteinler 12 arasındaki etkileşimin durumunu rapor bir araç oluşturur. Daha önce 1 SPASM modülü GPCR için Gα C-ucunu halata ve FRET fluorophores ile etkileşimlerini izlemek için kullanılan, mCitrine (onun bilinen varyant, Sarı Floresan Protein (YFP), uyarma / emisyon zirve de bu protokolde atıfta bulunulan , uyarma / emisyon zirve 430/475 nm) (onun yaygın olarak bilinen varyant Mavi Floresan Protein (OBP bu protokolde atıfta bulunulan) 490/525 nm) ve mCerulean. N- Cı-terminaline, tonun genetik olarak kodlanmış bir polipeptidi içerir: tam uzunlukta bir GPCR, Alıcı (mCitrine / YFP) FRET, 10 nm ER / K bağlayıcı, FRET verici (mCerulean / CFP) ve Gα C-terminali peptid. Bu çalışmada, sensörler GPCR-bağlayıcı uzunluğu Gα peptidi olarak kısaltılmıştır. Bütün bileşenler her bir alan serbest dönmesine olanak sağlayan bir yapısal olmayan (Gly-Ser-Gly) 4 bağlayıcı ile ayrılır. Sensörler ayrıntılı özellikleri daha önce iki prototipik GPCR'ler kullanılarak gerçekleştirilmiştir: 2-Ar ve opsin 1 β.
Bu sensör geçici HEK-293T hücreleri ve varlığı ya da ligandın yokluğunda saniye (cps) başına keyfi birimler FRET çiftinin florimetre bazlı canlı hücre deneyleri ölçer floresans spektrumları transfekte edilir. Bu ölçümler fluorophores (YFP max / OBP en yüksek) arasında bir FRET oranını hesaplamak için kullanılır. FRET (ΔFRET) bir değişiklik daha sonra ortalama FRET oranının çıkarılmasıyla hesaplanırLigand muamele edilmiş numunelerin FRET oranından işlem görmemiş örnekler. ΔFRET (β 2-AR-10 nm-Gαs peptid 2-AR-10 nm-hayır peptid p olan karşı) yapıları arasında mukayese edilebilir. Burada, detay protokol, canlı HEK-293T hücrelerinde bu sensörleri ifade ifadesini izlemek ve florimetre tabanlı canlı hücrenin kurulumu, yürütme ve analiz ilaç tedavi koşulları karşısında işlenmemiş için ölçüm FRET için. Bu protokol, 100 uM izoproterenol bitartarat ile muamele β 2-AR-10 nm Gαs peptid sensör için özel olsa farklı GPCR Gα çiftleri ve ligandlar için optimize edilebilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. DNA hazırlama
- Tasarım sensörü modüler klonlama şemasını kullanarak oluşturur. Daha önce 1 ayrıntılı β 2 -AR sensör tasarımı başvurun.
- 1.9, 260 / 2.0 bir 230 - - 2.29, 260 / 1.7 280 ticari bir miniprep kiti protokolüne göre DNA hazırlamak ve konsantrasyon ≥ de, 2 mM Tris-HCI çözeltisi pH 8, 750 ng / | il elüte.
2. Hücre kültürü preparasyonu
- ile takviye edilmiş 4.5 g / L D-glikoz, ihtiva eden DMEM içinde kültür HEK-293T-Flp n hücreleri% 10 FBS (ısıyla aktifliği giderilmiş) (hac / hac),% 1 L-glutamin ek, 20 mM HEPES, pH 7.5, 37 ° C'de % 5 CO2 de nemli bir atmosferde ° C. sonraki adımlar için biyolojik güvenlik kabini hücreleri anlaştım.
- Hücreler altı kuyu yemekleri içine Pasajlanması önce konfluent tek tabaka büyümeye izin verin. confluency ulaşmak için zaman ilk kaplama yoğunluğuna bağlıdır. Kullanım plakaları1 içinde birleştirilmek üzere gelecek - için kaplama 2 gün altı-iyi kaplama. Bir birleşik, 10 cm doku kültürü ile muamele edilmiş çanak yaklaşık 4 x 10 6 hücre / ml hücre yoğunluğuna sahiptir. Hücre kültürü büyüme görüntü için Bkz: Şekil 1.
- 10 ml PBS ile hücreleri yıkayın ve% 0.25 tripsin ile trypsinize (Tartışma, paragraf 2'ye bakınız). Levha 8 x 10 5 hücre / göz dokusu ortam 2 ml altı iyi yemekler kültürü ile işlenmiş ve 16 yapışmaya izin - 20 saat süredir.
3. Transfeksiyon koşulları
- (- 36 saat 20 arasında) optimal ekspresyonu başarmak üzere farklı süreler gerektirir yapıları için transfections yerleştiriniz. birleşik deney süresi şartları senkronize. Ayrıca bir untransfected kontrol de eşdeğer hücre yoğunluğu analizi sırasında arka plan gürültü ve saçılma çıkarma için kullanılmalıdır.
- Oda sıcaklığına transfeksiyon reaktifleri getirmek: düşük serum ortamı, DNA transfeksiyon reaktifi.
- İçindebiyolojik güvenlik kapağı aşağıdaki sırada steril mikrosantrifüj tüpü içinde reaktif birleştirir: 100 ul düşük serum ortamında 2 ug DNA karıştırın. Karışımın yüzey veya tüp yan dokunmadan medya / DNA karışımı içine transfeksiyon reaktif 6 ul Spike. kuyu başına bir transfeksiyon reaksiyonu ayarlayın. Tutarlı ekspresyon seviyelerini elde etmek için (transfeksiyon reaktifi 6 ul - 3 - DNA 4 ug 1) Transfeksiyon koşulları optimize edilebilir. Daha fazla optimize edilmiş oranları için Tablo 1'e bakınız.
- 30 dakika - 15 biyolojik güvenlik kabini, oda sıcaklığında inkübe karışımı. 30 dakika boyunca inkübasyona bırakıldı halinde reaksiyon kullanmayın.
- karşısında iyi damla damla bir şekilde hücrelere reaksiyonu ekleyin ve hafifçe iyice karışmasını sağlamak için altı-iyi sallayın. oyuk başına bir reaksiyon ekleyin.
- İfade, 20 saat sonra monitör floresans doku kültür floresan mikroskop kullanılarak. 40X bir hücrede 10X objektif ve protein lokalizasyonu ile nüfus ifadesini değerlendirmek. obsplazma zarı (PM) protein ekspresyonu için erve. önemli içselleştirilmesi kaydetti edilirse önemli ifade PM tespit edilinceye kadar, transfeksiyon monitör.
4. Reaktif ve Ekipmanları Hazırlık
- -80 ° C de 100 mM ilaç stokları ve mağaza hazırlayın: isoproterenol bitartarat (100 mM, 300 mM askorbik asit ihtiva eden dH 2 O). hemen soğuk oda ve flaş dondurucuda / buz üzerinde yapın. Alikot yapılmış ve bir yıla kadar kullanılabilmektedir.
- Celi tamponu hazırlayın (~ 2 mL / durumu), bir 37 ° C su banyosu içinde saklayın. Her gün taze olun. Hücre Tampon bileşenleri için referans Tablo 2.
- İlaç tamponu (10 mi) Hazırlama ve oda sıcaklığında saklayın. İlaç Tampon bileşenleri için referans Tablo 2.
- Asit, konsantre HCI kullanılarak küvetler yıkayın. Zayıf bir baz (1 M KOH) ile nötralize ve iyice DH 2 O. ile küvetler yıkayın
- Birkaç ile florometre etrafında iş istasyonu hazırlayın10, 200 ve 1000 ul pipet uçları, ultra saf H 2 O ile 10 dk geri sayım, küvet temizliği için ipuçları, narin görev mendil ile erişilebilir bir vakum hattına ve fışkırtma şişesi ile ayarlanmış bir zamanlayıcı kutu
- florimetre ve ısı bloğu ile 37 ° C için harici su banyosu ısıtın.
- Florometre açın; 430 nm, bant geçiren 8 nm eksitasyon için OBP toplama floresan toplama programını ayarlamak; emisyon aralığı 450 nm - 600 nm, bant geçiren 4 nm. 600 nm, bant geçiren 4 nm - sadece sensör kontrolü gibi YFP koleksiyonu için 490 nm, bandpass 8 nm, emisyon aralığında 500 set uyarma (Tartışma bakınız). CFP toplama ayarları Bu deneyde, bir FRET spektrumu elde etmek için kullanılır.
- Şekil 2'de gösterildiği gibi, ısı bloğu on 1.5 ml mikrosantrifüj tüpleri yerleştirin. Bu tüpler hücre kısım tüpleri için sahibidir (500 ul mikrosantrifüj tüpler.) Burada yer küvetler minder sahipleri 1 ve 7 doku küçük bir parça yerleştirin.
Not: Tedavi edilmemiş durumda ve çapraz bulaşmayı önlemek için ilaç durum için ayrı küvetler kullanın.

Şekil 2. Mikrosantrifüj Tüp Kurma ve işlenmemiş numuneler için ısı Blok Cuvette pozisyon Referans 1 konumunda olduğunu.; Hücre kısım tüpleri 2 konumlarında - ilaç verilen örnekler için 6. Küvet konum 7'de olduğu; Hücre kısım tüpleri pozisyonlarda 8 - 12. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- mini 37 ° C su banyosu oluşturmak için su ~ 750 ul 12 - 6 ve 8 - tutucuları 2 doldurun.
- mini su banyoları (- 6, 8-12 sahipleri 2) içine hücre alikotları on 500 ul mikrosantrifüj tüpleri yerleştirin. Her tüp (untreate 5 durumun bireysel tekrar olacakD, tedavi edilen 5 ilaç).
- İfade hücreleri Monitör (adım 3.6).
5. Deney ve Veri Toplama
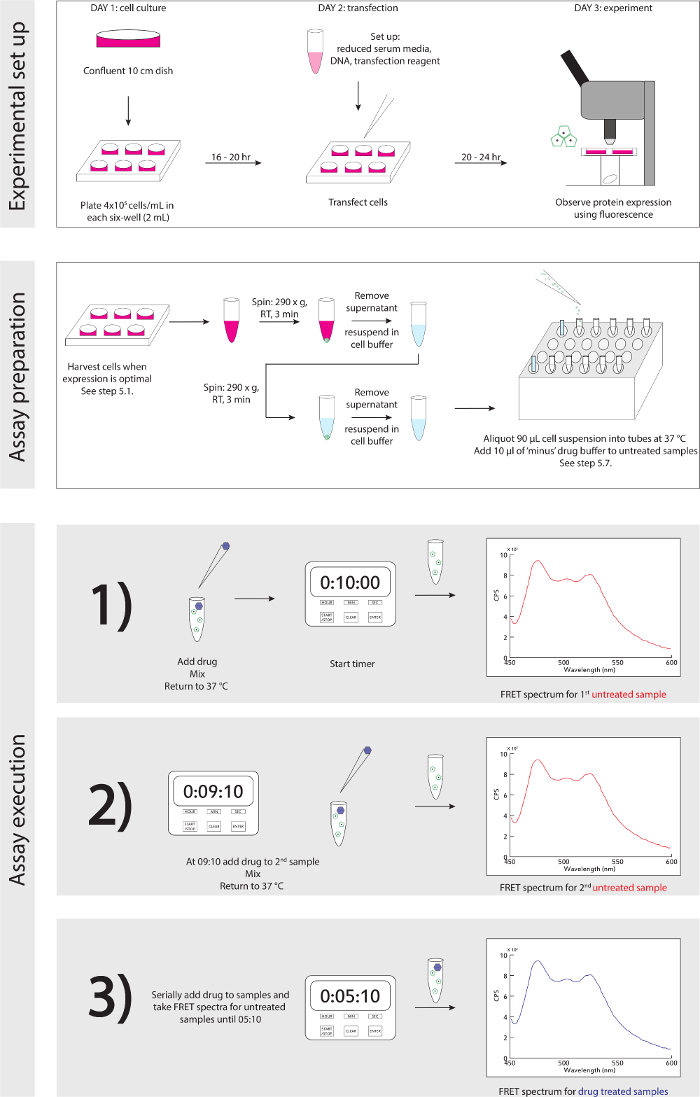
Şekil 3. Deneysel şematik. Deneysel için ayrıntılı adım adım rehber yukarı ve yürütme ayarlayın. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Deneysel şematik için referans Şekil 3. Hücreler floresan mikroskop ile tespit protein ifadesine dayalı, hasat için hazır olduğunuzda (Tartışma, paragraf 4): biyolojik güvenlik kabini, hafifçe bir P1,000 ile kültüründe ~ 1 medyanın ml, tekrar süspansiyon hücreleri çıkarmak ve tabanda transferi 1.5 ml mikrosantrifüj tüp içine.
Not: N-ucunu sindirmek ve olabilir tripsin kullanmaktan kaçının /ya GPCR sensörünün bağlayıcı cebinde. - yeniden süspansiyon uygun hücre yoğunluğu sağlamak için hücre sayımı. 4 x 10 6 hücre / ml tabanda hacmi optimize edin.
- 3 dakika boyunca, oda sıcaklığında, 290 xg sallanan kovalı bir santrifüj hücreleri dönerler. santrifüj sonra süpernatantı.
- Yavaşça (37 ° C'de saklanan), 1 ml hücre tamponu içinde tekrar süspansiyon hücreleri ve adım 5.3 tekrarlayın. İkinci spin sırasında, -80 ° C ila 100 mM ilaç stok kısım toplamak. 1 mM çalışma hisse senedi için İlaç Tampon 100 seyreltme ve oda sıcaklığında tutmak: 1 olun.
- İkinci santrifüj işleminden sonra hücre tamponu (4 x 10 6 hücre / mL), 1 ml supernatant ve yavaşça tekrar süspansiyon hücreleri çıkarmak. Hücre 1 ml ve boş olarak hücre 1 ml tampon ile spektrofotometre örnek Ölçü OD 600. Bir tek kullanımlık plastik küvete hücreleri koyun ve hemen spektrofotometri ardından mikrosantrifüj tüp geri aktarın.
- Bir kontrol edilmemiş Cep telefonl koşulu spektrumu, nazikçe, P1,000 pipet ile 1 ml Hücre Tampon untransfected hücrelerin tekrar süspansiyon küvete ve uyarma 430 nm FRET spektrumunu elde etmek için hücrelerin 90 ul ekleyin, bant geçiren 8 nm, emisyon 450-600 nm, bant geçiren 4 nm. Hücrelerin taze 90 ul 5 tekrar spektrumları - 3 toplayın. Örnekler arasında ultra saf H2O ile küvet, özellikleri arasında, 37 ° C'de hücre stok tutmak her bir örnek kısım arasında P1,000 nazikçe tekrar süspansiyon ve çalkalayın.
- 6, 8 - - ısı bloğu 12 deneysel koşullar, kısım 90 tutucular 2 500 ul tüplerin her birine transfekte edilmiş hücrelerin uL. Yavaşça her kısım arasındaki P1,000 pipet ile hücrelerin stok tekrar süspansiyon.
- tedavisiz örnekleri için 6 - hücreleri aliquoted sonra, 2 tüpler için İlaç Tampon 10 ul ekleyin.
- boru 8 içine doğru 1 mM ilaç çözeltisinin 10 ul ekleyerek deney başlar, 10 dakika geri sayım ve yavaşça P200 pipetiyle tüp karıştırmak için zamanlayıcıyı başlatın. Yakın tüp ve 37 dönüşC ısıtma bloğu °.
- Hemen (yeni bir uç kullanın) P200 ile hafifçe karıştırın, tüp 2 pick up tedavisiz küvete hücre süspansiyonu 90 ul ekleyin ve florometre yer.
- 600 nm, bant geçiren 4 nm - uyarma 430 nm, bant geçiren 8 nm, emisyon 450 FRET spektrum kazanır.
- 9 dk - 10 saniye, yavaşça, 1 mM ilaç çözeltisinin 10 ul tüp 9 spike P200 (yeni uç kullanın) ile karıştırmak ve blok ısı tüp döner.
- tüp 10 ile tüp 3 ve 5.12 ile 5.11 - 5.10 tekrarlayın adımları.
- Spektrumları tüm tedavisiz örnekleri için toplanır ve ilaç tüm uyuşturucu koşulu numunelere ilave edilene kadar 1 dakika aralıklarla (08:10, 07:10, vs.) 5.13 - Tekrar 5.10 adımları. çapraz bulaşmayı önlemek için her pipet adımı için yeni bir ucu kullanın.
- 5 dk - 10 saniye, yavaşça P200 pipetiyle boru 8 (ilaç durum) karıştırılması başlar florometre ilaç ile muamele edilen numune ve yeri için ayrı küvete hücre süspansiyonu 90 ul ekle.
- F edinmeRET spektrumu (ayarları için adım 5.11 bakınız).
- Kalan ilaç durum örneklerinin (- 12 tüpler 9) için 1 dakika aralıklarla (04:10, 03:10, vs.) 5.16 - Tekrar 5.15 adımları.
- Deney bittikten sonra, iyice ultra saf H2O ile küvetleri yıkayın, proje dosyalarını kaydetmek ve bir sonraki durum için tüpler re-stock. yıkama aşamasında çapraz bulaşmayı önlemek için özen gösterin. H2O şişe hem de yıkama arasında vakum hattında uç değiştirme.
6. Veri Analizi
- Kaydet ve KÜB'de ihracat veri dosyaları analiz için kullanılacak biçimlendirmek. Analiz programları Sivaramakrishnan Lab yayın web sitesinden yüklenebilir.
- analiz programları (v9, v15), untransfected örnekleri dosyaları (untransfected hücre spektrum toplama adım 5.6) veri girişi için, ÇIKIŞ veri dosyasını ve virgülle ayrılmış değerler (CSV) dosyaları içerir analiz yazılımı için yol dosyaları oluşturun.
- Aşağıdaki bilgileri girinCSV dosyası içine dahil, her bir örnek için ilgili koşullar (Tablo 3'te örneğe bakın) ve tayin:
Dosya adı - bireysel SPC grafik dosyaları
Reseptör - hangi GPCR yapı adayı test edilmiştir (örneğin, Β2)
Bağlayıcı - adayı olan yapının peptit varyantı test edilmiştir (örneğin, S)
Agonist - (N) muamele edilmemiş belirlemek ya da ilaç ile muamele edilmiş (D) koşullar
Directory - SPC dosyaları genellikle, kaydedilmiş tarihe göre organize edildiği yolu klasör
OD - spektrofotometreden numunenin kaydedilen optik yoğunluk - örneklerden tampon ve saçılma gürültü çıkarmak için untransfected numuneler (adım 5.6) için dosya adlarını girin.
- analiz programı içine koşullarını girin.
- Programları çalıştırma bireysel koşullarına (v9) içinde ve koşullar (v15) karşısında örnekleri analiz etmek.
- veri kümesinde belirgin aykırı olan örnek dosyaları dışlamak veya artan ya Indivi OD değerini düşürerek çıkartma için ayarlamakİkili dosyaları.
- erişmek için hesaplanan için ÇIKIŞ dosyasına İhracat verileri oranları (525 nm / 475 nm) FRET.
- tedavi (ilaç) koşulları için bireysel FRET oranlarından işlenmemiş durum için ortalama FRET oranının çıkarılmasıyla elde ΔFRET hesaplayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Deneyin bir genelleştirilmiş şematik kurmak ve yürütme Şekil 3'te ayrıntılı olarak verilmiştir.
Sensörün dar dinamik aralığındaki bir FRET değişikliği tespit etmek amacıyla, yapıştınlabilir sistemin nüansları uyması önemlidir. Hücre kalitesi örnekleme protein ekspresyonu ve tutarlılık için zorunludur. Optimal tutarlı bir tek tabaka (10X) büyüyen kültürlenmiş hücreler 1 özellikleri görüntüleri Şekil
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu sistemde FRET ölçümlerinin sıkı dinamik aralık Bu protokolün her aşamasında hassas kalite kontrol gerekliliğini güçlendirmektedir. Başarılı bir FRET deneyi sağlamak için en önemli adımlar tahlil yürütülmesi sırasında 1) hücre kültürü, 2) transfeksiyon 3) protein ekspresyon ve 4) zamanında, hassas koordinasyon vardır.
Hücre sağlık ve bakım / kaplama kalitesi imkansız FRET herhangi tutarlı bir değişiklik tespit yapabilirsiniz deneysel sistem ve kötü h...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olduğunu beyan ederim.
Teşekkürler
RUM Amerikan Kalp Derneği Öncesi doktora bursu (14PRE18560010) tarafından finanse edildi. Araştırma Amerikan Kalp Derneği Scientist Kalkınma Grant (13SDG14270009) & SS NIH (1DP2 CA186752-01 ve 1-R01-GM-105646-01-A1) tarafından finanse edildi
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
Referanslar
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır