È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Conformazioni GPCR g di proteine-selettivi misurata utilizzando FRET sensori in un Fluorometer Assay Live Cell Suspension
In questo articolo
Riepilogo
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
Abstract
Fӧrster trasferimento di energia di risonanza (FRET) a base di studi sono diventati sempre più comuni nelle indagini di segnalazione GPCR. Il nostro gruppo di ricerca ha sviluppato un sensore intra-molecolare FRET per rilevare l'interazione tra subunità Gα e GPCR in cellule live che seguono la stimolazione agonista. Qui, abbiamo dettaglio il protocollo per rilevare i cambiamenti nella FRET tra il β 2 del recettore adrenergico ed il Gαs C-terminale del peptide in seguito al trattamento con 100 micron isoproterenolo cloridrato come precedentemente caratterizzati 1. Il nostro sensore FRET è un singolo polipeptide che consiste in serie di un GPCR full-length, un fluoroforo FRET accettore (mCitrine), un ER / K SPASM (sistematica di proteine affinità la forza di modulazione) linker, un fluoroforo FRET donatore (mCerulean), e un Gα C peptide -Terminal. Questo protocollo sarà la preparazione delle cellule dettaglio, le condizioni di trasfezione, installazione di apparecchiature, l'esecuzione del test, e analisi dei dati. Questo disegno sperimentale rileva piccolo changes in FRET indicativi di interazioni proteina-proteina, e può anche essere utilizzato per confrontare la forza di interazione tra ligandi e abbinamenti di proteine GPCR-G. Per migliorare il rapporto segnale-rumore nelle nostre misurazioni, questo protocollo richiede precisione accresciuto in tutte le fasi, ed è presentato qui per consentire l'esecuzione riproducibile.
Introduzione
recettori G-proteina-accoppiati (GPCR) sono recettori sette transmembrana. Il genoma umano contiene solo circa 800 geni codificanti per GPCR, attivati da una varietà di ligandi compresi luce, odoranti, ormoni, peptidi, farmaci e altre piccole molecole. Quasi il 30% di tutti i farmaci attualmente sul GPCR bersaglio mercato perché svolgono un ruolo importante in molti stati di malattia 2. Nonostante decenni di intenso lavoro svolto su questa famiglia di recettori, rimangono significative questioni in sospeso in materia, in particolare per quanto riguarda i meccanismi molecolari che guidano le interazioni GPCR-effettrici. Ad oggi, solo una struttura cristallina ad alta risoluzione è stato pubblicato, permettono di approfondire l'interazione tra il recettore β 2 adrenergico (β 2 -AR) e la proteina Gs 3. Insieme alla vasta ricerca nel corso degli ultimi tre decenni, si ribadisce una specifica componente strutturale che è fondamentale in questointerazione: la subunità Gα C-terminale. Questa struttura è importante sia per l'attivazione della proteina G dalla selezione proteine GPCR 4 e G 5-6. Quindi, il Gα C-terminale fornisce un collegamento cruciale tra la stimolazione del ligando GPCR e l'attivazione della proteina G selettivo.
La ricerca negli ultimi dieci anni suggerisce che i GPCR popolano un vasto paesaggio conformazionale, con ligando vincolante stabilizzazione sottoinsiemi di conformazioni GPCR. Mentre sono disponibili per esaminare il paesaggio conformazionale GPCR diverse tecniche, tra cui la cristallografia, NMR e spettroscopia di fluorescenza, e spettrometria di massa, vi è una scarsità di approcci per spiegare il loro significato funzionale nella selezione effettore 7. Qui, descriviamo un Fӧrster trasferimento di energia di risonanza (FRET) approccio basata su per rilevare proteine G-selettivo conformazioni GPCR. FRET basa sulla prossimità e orientamento parallelo di due fluorofori con sovrapposizione di emissione (donatore) unND eccitazione (accettore) spettri 8. Come fluorofori donatore e accettore avvicinano insieme come risultato di una variazione conformazionale nella proteina o un'interazione proteina-proteina, il FRET tra loro aumenta, e può essere misurata usando una serie di metodi 8. Biosensori FRET-based sono stati impiegati ampiamente nel campo GPCR 9. Essi sono stati utilizzati per sondare cambiamenti conformazione del GPCR inserendo donatore e accettore nel terzo ciclo intracellulare e GPCR C-terminale; I sensori sono stati progettati per sondare GPCR e le interazioni effettrici etichettando separatamente i GPCR e effettrici (proteine G subunità / arrestine) con un paio FRET 10; alcuni sensori rilevano anche i cambiamenti conformazionali nella proteina G 11. Questi biosensori hanno permesso il campo per chiedere una moltitudine di questioni in sospeso, tra cui i cambiamenti conformazionali nella GPCR e effettori, cinetiche di interazione GPCR-effettrici e ligandi allosterici 12. Il nostro gruppoera particolarmente interessato a creare un biosensore in grado di rilevare G specifiche proteine conformazioni GPCR in condizioni di agonisti-driven. Questo biosensore si basa su una tecnologia sviluppata di recente nominato SPASM (sistematica di proteine affinità la forza di modulazione) 13. SPASM coinvolge tethering interagire domini proteici usando un / K linker ER, che controlla le loro concentrazioni efficaci. Accanto al linker con un paio FRET di fluorofori crea uno strumento che può segnalare lo stato dell'interazione tra proteine 12. In precedenza 1 il modulo SPASM è stato utilizzato per legare la Gα C-terminale di un GPCR e monitorare le loro interazioni con fluorofori FRET, mCitrine (di cui al presente protocollo da parte sua variante comunemente noto, giallo fluorescente delle proteine (YFP), di eccitazione / picco di emissione a 490/525 nm) e mCerulean (di cui al presente protocollo per la sua comunemente noto variante Cyan Fluorescent Protein (PCP), di eccitazione / picco di emissione 430/475 nm). Da N- al C-terminale, tla sua geneticamente codificato singolo polipeptide contiene: un full length GPCR, FRET accettore (mCitrine / YFP), 10 nm ER / K linker, FRET donatore (mCerulean / PCP), e il peptide Gα C-terminale. In questo studio, i sensori sono abbreviati come GPCR-linker lunghezza Gα peptide. Tutti i componenti sono separati da una non strutturato (Gly-Ser-Gly) 4 linker che permette la rotazione libera di ciascun dominio. La caratterizzazione dettagliata di tali sensori è stato precedentemente effettuata utilizzando due GPCR prototipo: β 2 -AR e opsin 1.
Questo sensore è transientemente trasfettato in cellule HEK-293T e fluorimetro basato vivo esperimenti cellulari misura spettri di fluorescenza della coppia FRET in unità arbitrarie di conteggi al secondo (CPS) in presenza o assenza di ligando. Queste misurazioni vengono utilizzati per calcolare un rapporto FRET tra i fluorofori (YFP max / CFP max). Un cambiamento di FRET (ΔFRET) viene calcolato sottraendo il rapporto medio FRETcampioni non trattati dal rapporto di FRET di campioni ligando trattati. ΔFRET può essere paragonato attraverso costrutti (β 2 -AR-10 nm-Gαs peptide contro beta2-AR-10 nm-no peptide). Qui, abbiamo dettaglio il protocollo di esprimere questi sensori in cellule HEK-293T dal vivo, monitoriamo la loro espressione, e la messa a punto, l'esecuzione e l'analisi delle cellule vive fluorimetro a base Fret misura per non trattati rispetto a condizioni trattati con farmaci. Anche se questo protocollo è specifico per il sensore di peptide β 2 -AR-10 nm-Gαs trattati con 100 micron isoproterenolo bitartrato, può essere ottimizzato per diverse coppie GPCR-Gα e leganti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione del DNA
- Sensore di design costruisce utilizzando uno schema di clonazione modulare. Si prega di fare riferimento al design del sensore β 2 -AR descritto in precedenza 1.
- Preparare DNA secondo il protocollo kit miniprep commerciale ed eluire in 2 soluzione mM Tris-HCl, pH 8, a concentrazione ≥ 750 ng / ml, A 260 / A 280 di 1,7-1,9, A 260 / A 230 di 2,0-2,29.
2. colture cellulari Preparazione
- cellule Culture HEK-293T-Flp-n in DMEM contenente 4,5 g / L D-glucosio, supplementato con 10% FBS (inattivato con il calore) (v / v), 1% integratore di L-glutammina, 20 mM HEPES, pH 7,5 a 37 ° C in atmosfera umidificata al 5% di CO 2. Maneggiare le cellule in cappa biologica per le fasi successive.
- Consentono alle cellule di crescere ad un monostrato confluenti prima passaging in piatti a sei pozzetti. Tempo per raggiungere confluenza dipende dalla densità di placcatura iniziale. Utilizzare i piatti chevenire a confluenza entro 1 - 2 giorni di placcatura per sei-bene placcatura. Un piatto confluenti 10 centimetri tessuto coltura trattata ha densità cellulare di circa 4 x 10 6 cellule / ml. Vedere la Figura 1 per un'immagine della crescita coltura cellulare.
- Lavare le cellule con 10 ml di PBS, e trypsinize con 0,25% tripsina (vedi la discussione, comma 2). Tavola 8 x 10 5 cellule / pozzetto in 2 ml di media nel tessuto della cultura trattati con sei piatti bene e lasciare ad aderire per 16 - 20 ore.
3. Condizioni Transfection
- Stagger trasfezioni per costrutti che potrebbero richiedere diverse quantità di tempo per raggiungere l'espressione ottimale (tra i 20 - 36 ore). Sincronizzare le condizioni per un tempo esperimento unico. hanno anche un controllo untransfected bene a densità cellulare equivalente da utilizzare per il rumore di fondo e la dispersione sottrazione durante l'analisi.
- Portare i reagenti di trasfezione a temperatura ambiente: i media siero ridotti, il DNA, il reagente di trasfezione.
- In uncappa biologica combinare reagenti in una provetta sterile, nel seguente ordine: mescolare 2 DNA mg con 100 pl ridotti mezzi di siero. Spike 6 ml di trasfezione reagente in media mix / DNA senza la superficie di miscela o il lato del tubo toccare. Impostare una reazione trasfezione per pozzetto. condizioni di trasfezione possono essere ottimizzate (1-4 mg di DNA, 3 - 6 ml di trasfezione reagente) per raggiungere livelli di espressione coerenti. Vedere la Tabella 1 per rapporti più ottimizzato.
- Incubare la miscela a temperatura ambiente in cappuccio di sicurezza biologica per il 15 - 30 min. Non usare reazione se lasciato a incubare per più di 30 min.
- Aggiungere reazione alle cellule in un modo goccia a goccia attraverso bene e agitare delicatamente sei pozzetti per garantire la completa miscelazione. Aggiungere una reazione per pozzetto.
- Dopo 20 ore di espressione, monitor di fluorescenza utilizzando colture di tessuti microscopio a fluorescenza. Valutare l'espressione popolazione con 10 volte la localizzazione oggettiva e proteine in una cellula a 40X. observe per l'espressione della proteina in membrana plasmatica (PM). Se si nota sostanziale interiorizzazione, monitorare trasfezione fino a quando non viene rilevato espressione significativa al PM.
4. reagente agricole per la preparazione
- Preparare 100 titoli di droga mm e conservare a -80 ° C: bitartrato isoproterenolo (100 mm in dH 2 O contenente 300 mm acido ascorbico). Fare sul ghiaccio / in camera fredda, e flash-freeze immediatamente. Aliquote possono essere fatte e utilizzati fino ad un anno.
- Preparare cellulare Buffer (~ 2 ml / condizione) e conservare in un bagno d'acqua C 37 °. Fare fresco ogni giorno. Tabella di riferimento 2 per Buffer costituenti cellulari.
- Preparare Drug Buffer (10 ml) e conservare a temperatura ambiente. Tabella di riferimento 2 per i componenti della droga Buffer.
- Lavaggio acido cuvette con HCI concentrato. Neutralizzare con una base debole (1 M KOH), e lavare accuratamente le provette con dH 2 O.
- Preparare stazione di lavoro intorno fluorimetro con diversiscatole da 10, 200 e 1.000 ml punte per pipette, un timer impostato con 10 minuti di conto alla rovescia, una linea di vuoto raggiungibile con suggerimenti per la pulizia cuvette, delicate salviettine attività, e spruzzatore con ultrapura H 2 O.
- Riscaldare bagno d'acqua esterna per fluorimetro e il calore del blocco a 37 ° C.
- Accendere fluorimetro; impostare il programma di raccolta di fluorescenza per la raccolta dei CFP all'eccitazione 430 nm, banda passante 8 nm; gamma di emissione 450 nm - 600 nm, banda passante 4 nm. Per la raccolta YFP solo come controllo del sensore (vedi Discussione) set di eccitazione a 490 nm, banda passante 8 nm, emissione gamma 500 - 600 nm, banda passante 4 nm. impostazioni di raccolta della PCP verranno utilizzati per acquisire uno spettro FRET in questo esperimento.
- Posizionare dodici 1,5 ml provette da microcentrifuga in blocco di calore come mostrato nella figura 2 qui sotto. Questi tubi sono supporti per tubi aliquote di cellule (provette da microcentrifuga 500 microlitri.) Mettere un piccolo pezzo di tessuto in supporti 1 e 7 per attutire le cuvette messi qui.
Nota: utilizzare cuvette separati per la condizione non trattata e la condizione farmaco per prevenire la contaminazione incrociata.

Figura 2. Microcentrifuga tubo Set Up e posizione di riferimento in Heat Block Cuvette per i campioni non trattati è in posizione 1.; tubi aliquote cellulare sono nelle posizioni 2 - 6. Cuvette per i campioni trattati con farmaci è in posizione 7; tubi aliquote cellulare sono in posizioni 8 - 12. Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Riempire i titolari di 2 - 6 e 8 - 12 con ~ 750 ml di acqua per creare un mini 37 ° C bagnomaria.
- Mettere dieci 500 microprovette microlitri per aliquote di cellule in bagni di mini-acqua (supporti 2 - 6, 8 - 12). Ogni tubo sarà una ripetizione individuale della condizione (5 untreated, 5 droga trattata).
- Monitorare le cellule per l'espressione (vedi punto 3.6).
5. Esperimento & Data Collection
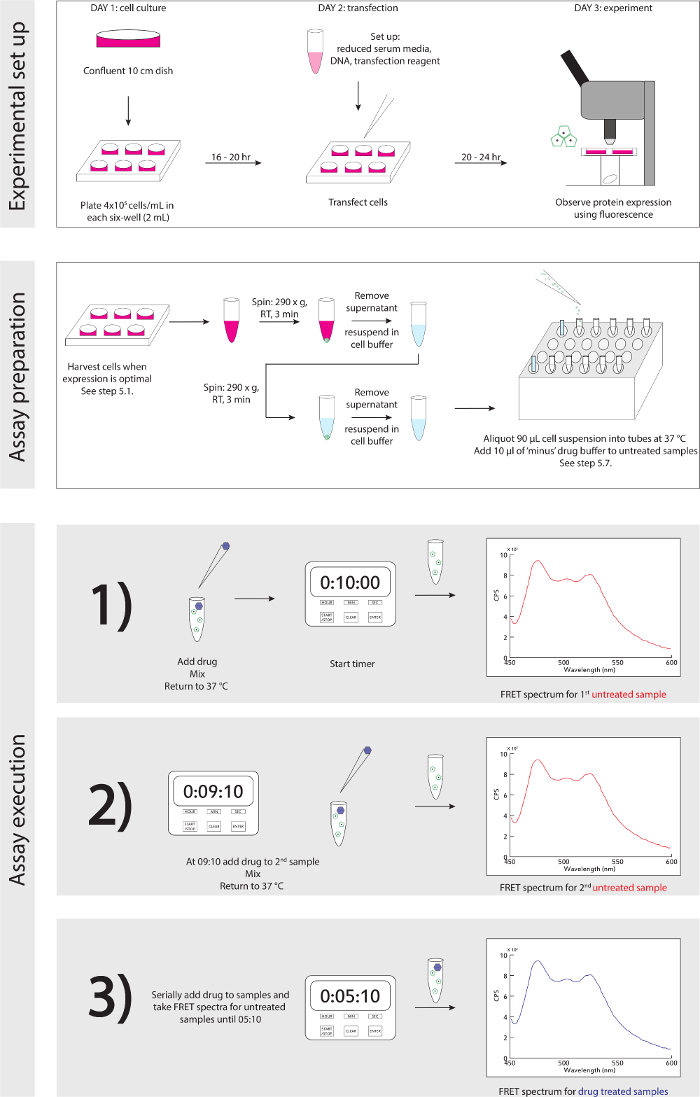
Figura 3. Sperimentale schematica. Una guida dettagliata passo-saggio per set up sperimentale e l'esecuzione. Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Riferimento Figura 3 per schematica sperimentale. Quando le cellule sono pronte per essere raccolte, sulla base di espressione della proteina rilevata con il microscopio a fluorescenza (vedi la discussione, il paragrafo 4): in cappuccio di sicurezza biologica, rimuovere delicatamente ~ 1 ml di media, Risospendere le cellule in loro cultura con un P 1.000 e trasferire risospensione in una provetta da 1,5 ml microcentrifuga.
Nota: Evitare l'uso di tripsina in quanto può digerire l'N-terminale e /o vincolante tasca del sensore GPCR. - Contare le cellule per garantire la corretta densità cellulare in risospensione. Ottimizzare il volume risospensione per 4 x 10 6 cellule / ml.
- Spin cellule oscillante secchio centrifuga a temperatura ambiente, 290 xg per 3 min. Rimuovere il surnatante dopo la centrifugazione.
- Risospendere delicatamente le cellule in 1 ml cellulare Buffer (conservato a 37 ° C) e ripetere il punto 5.3. Durante il secondo giro, raccogliere 100 mM di droga stock aliquota da -80 ° C. Fai la diluizione 1: 100 in Drug tampone per 1 mM magazzino di lavoro e mantenere a temperatura ambiente.
- Dopo la seconda centrifugazione, rimuovere surnatante e cellule delicatamente risospendere in 1 ml di tampone cellulare (4 x 10 6 cellule / ml). Misura OD 600 del campione nello spettrofotometro usando 1 ml di cellule e 1 ml di tampone cellulare come bianco. Erogare le cellule in una provetta di plastica usa e getta e ritorno in una provetta immediatamente dopo spettrofotometria.
- Per un controllo cel untransfectedl condizione di spettro, risospendere delicatamente le cellule untransfected in 1 ml cellulare tampone con P 1.000 pipetta, aggiungere 90 ml di cellule di Cuvette e acquisire spettro FRET a eccitazione 430 nm, banda passante 8 nm, emissione 450-600 nm, banda passante 4 nm. Raccogliere 3 - 5 spettri di ripetizione con freschi 90 ml di cellule. Mantenere magazzino di cellule a 37 ° C tra le specifiche, risospendere delicatamente con P 1.000 tra ciascuna aliquota del campione, e risciacquare provetta con ultrapura H 2 O tra i campioni.
- Per le condizioni sperimentali, aliquote di 90 microlitri di cellule trasfettate per ciascuno dei 500 tubi microlitri in supporti 2 - 6, 8 - 12 nel blocco termico. Risospendere delicatamente magazzino di cellule con P 1.000 pipetta tra ciascuna aliquota.
- Dopo che le cellule sono aliquotati, aggiungere 10 ml di tampone di droga ai tubi 2-6 per non trattati condizione campioni.
- Iniziare esperimento con l'aggiunta di 10 ml di soluzione di 1 farmaco mm nel tubo 8, avviare il timer per il conto alla rovescia da 10 min, e mescolare delicatamente tubo con P200 pipetta. Chiudi tubo e ritorno a 37° C blocco di calore.
- Immediatamente raccogliere tubo 2, mescolare delicatamente con P200 (utilizzare una nuova punta), aggiungere 90 ml di sospensione cellulare per non trattata condizioni cuvetta, e il luogo in fluorimetro.
- Acquisire spettro FRET a eccitazione 430 nm, banda passante 8 nm, emissione 450-600 nm, banda passante 4 nm.
- Alle 9 min - 10 sec, spike tubo 9 con 10 ml di soluzione di 1 farmaco mM, mescolare delicatamente con un P200 (utilizzare una nuova punta), ed il tubo per riscaldare blocco tornare.
- Ripetere i passaggi 5,10-5,11 con tubo 3 e 5.12 con il tubo 10.
- Ripetere i passaggi 5,10-5,13 ad intervalli di 1 minuto (8:10, 7:10, ecc) fino a quando gli spettri sono raccolti per tutte le condizioni campioni non trattati, e di droga è stato aggiunto a tutti i campioni di condizione di droga. Utilizzare una punta fresca per ogni passo pipetta per evitare la contaminazione incrociata.
- A 5 min - 10 sec, iniziare a mescolare tubo 8 (condizione di droga) delicatamente con P200 pipetta, aggiungere 90 ml di sospensione cellulare per cuvetta separata per il campione di droga trattati e il luogo in fluorimetro.
- acquisire Fspettro RET (vedere il punto 5.11 per le impostazioni).
- Ripetere i passaggi 5,15-5,16 ad intervalli di 1 minuto (4:10, 3:10, ecc) per restanti condizioni di droga campioni (tubi 9 - 12).
- Dopo esperimento si conclude, salvare i file di progetto, lavare accuratamente le provette con ultrapura H 2 O, e ri-Stock tubi per il prossimo condizione. Fare attenzione per evitare la contaminazione incrociata nella fase di lavaggio. Cambiare la punta sulla bottiglia H 2 O, nonché sulla linea del vuoto tra lavaggi.
Analisi 6. Dati
- Salvare e file di dati di esportazione in SPC formato da utilizzare per l'analisi. programmi di analisi sono disponibili per il download dal sito web pubblicazione Sivaramakrishnan Lab.
- Creare file di percorso per il software di analisi che includono i programmi di analisi (v9, V15), file di esempi untransfected (vedere il punto 5.6 per la raccolta delle cellule spettro untransfected) file, file di dati di output e valori separati da virgola (CSV) per l'immissione dei dati.
- Inserire le seguenti informazioniin file CSV (vedi esempio nella tabella 3) e designa rispettive condizioni per ogni campione, tra cui:
Il nome del file - singoli file grafico SPC
Receptor - designato quale costrutto GPCR è stato testato (ad esempio, Β2)
Legante - designato quale peptide variante del costrutto è stato testato (ad esempio, S)
Agonist - designare non trattati (N) o le condizioni trattati con farmaci (D)
Directory - la cartella percorso in cui vengono salvati i file SPC, di solito organizzati per data
OD - registrato densità ottica del campione da spettrofotometro - Inserisci i nomi dei file per i campioni untransfected (passo 5,6) per sottrarre buffer e rumore di scattering da campioni.
- Entra condizioni in programma di analisi.
- Eseguire programmi di analizzare campioni all'interno dei singoli condizioni (V9) e le varie patologie (v15).
- Escludere file di esempio, che sono valori anomali evidenti nel set di dati, o regolare per la sottrazione aumentando o diminuendo il valore OD di indivifile doppi.
- Esportare i dati in file di output per l'accesso ai calcolato FRET rapporti (525 nm / 475 nm).
- Calcolare ΔFRET sottraendo il rapporto medio FRET per la condizione trattata dai singoli rapporti di FRET per le condizioni di trattamento (farmaci).
Access restricted. Please log in or start a trial to view this content.
Risultati
Uno schema generalizzato dell'esperimento allestimento e l'esecuzione è illustrato dalla Figura 3.
Per rilevare un cambiamento FRET nella gamma dinamica stretta del sensore, è fondamentale per rispettare le sfumature di sistema da rispettare. Qualità cellulare è indispensabile per l'espressione della proteina e coerenza campionamento. Figura 1 Caratteristiche immagini di cellule coltivate crescono in un monostrato coerente (10X) che è ottima...
Access restricted. Please log in or start a trial to view this content.
Discussione
La gamma dinamica stretta di misurazioni FRET in questo sistema accentua la necessità di controllo di qualità sensibile in ogni fase di questo protocollo. I passi più importanti per assicurare un esperimento riuscito FRET sono 1) la coltura delle cellule, 2) trasfezione 3) l'espressione della proteina e 4) puntuale, preciso coordinamento durante l'esecuzione del test.
la salute delle cellule e la qualità di manutenzione / placcatura possono avere un impatto significativo sul rumo...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi in competizione.
Riconoscimenti
RUM è stato finanziato dalla Compagnia americano Heart Association Pre-dottorato (14PRE18560010). La ricerca è stata finanziata dalla American Heart Association Scientist Development Grant (13SDG14270009) e NIH (1DP2 CA186752-01 & 1-R01-GM-105.646-01-A1) alla SS
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
Riferimenti
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon