Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
G Белково-селективные GPCR Конформации Измеряется с использованием FRET датчиков в прямом эфире клеточной суспензии Флуорометр Пробирной
В этой статье
Резюме
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
Аннотация
Fӧrster резонансный перенос энергии (FRET) основе исследования становятся все более распространенными в исследовании сигналов GPCR. Наша исследовательская группа разработала внутримолекулярной датчик FRET для обнаружения взаимодействия между Gα субъединиц и GPCRs в живых клетках после агонистом стимуляции. Здесь мы подробно протокол для обнаружения изменений в FRET между β 2 адренергического рецептора и С-концевого пептида Gαs после обработки 100 мкМ изопротеренол гидрохлорида , как ранее характеризовался 1. Наш датчик FRET представляет собой единый полипептид, состоящий поочередно из полнометражного GPCR, лобзиком акцепторного флуорофора (mCitrine), ER / K СПАЗМЫ (систематическое сродство белка сила модуляции) линкер, донор FRET флуорофор (mCerulean) и Gα C терминальный пептид. Этот протокол будет подробно подготовка клеток, условия трансфекции, установки оборудования, выполнение анализа и анализа данных. Этот экспериментальный дизайн обнаруживает небольшой чAnges в FRET свидетельствует о белок-белковых взаимодействий, а также могут быть использованы для сравнения силы взаимодействия через лигандов и ХВГФ-G белка спариваний. Для того, чтобы усилить сигнал-шум в наших измерениях, этот протокол требует повышенную точность на всех этапах, и представлена здесь для того, чтобы воспроизводимый исполнение.
Введение
G-белками рецепторы (GPCRs) семь-трансмембранные рецепторы. Один только геном человека содержит около 800 генов, кодирующих GPCR,, которые активируются различными лигандами, включая свет, отдушек, гормонов, пептидов, лекарственных средств и других небольших молекул. Около 30% всех лекарственных средств в настоящее время на целевом рынке GPCRs , потому что они играют большую роль во многих болезненных состояний 2. Несмотря на десятилетия обширной работы, проделанной по этому семейству рецепторов, остаются значительные нерешенные вопросы в этой области, в частности в отношении молекулярных механизмов, которые управляют GPCR-эффекторных взаимодействий. На сегодняшний день только одна кристаллическая структура с высокой разрешающей способностью были опубликованы, обеспечивая представление о взаимодействии между β 2 адренергического рецептора (β 2 -АР) , и белок Gs 3. Вместе с обширные исследования в течение последних трех десятилетий, он повторяет один конкретный структурный компонент, который имеет решающее значение в этомВзаимодействие: The Gα субъединицей С-концевом участке. Эта структура имеет важное значение как для G активации белка путем выбора белка GPCR 4 и G 5-6. Следовательно, Gα С-конец обеспечивает важную связь между лигандом стимуляции GPCR и селективной активации белка G.
Исследования, проведенные за последнее десятилетие показывает, что GPCR, заселить широкий конформационные пейзаж с лиганд-связывающим стабилизирующим подмножеств GPCR конформации. В то время как несколько методов, в том числе кристаллография, ЯМР и флуоресцентной спектроскопии и масс - спектрометрии можно исследовать конформационные ландшафт GPCR, существует недостаток подходов к выяснению их функциональное значение в выборе эффекторной 7. Здесь мы очертить подход Fӧrster -На резонансный перенос энергии (FRET) для обнаружения белка G-селективных GPCR конформации. FRET зависит от близости и параллельной ориентации двух флуорофоров с перекрытием выбросов (доноров) аго возбуждения (акцептор) спектры 8. В качестве донора и акцептора флуорофоров сближаются в результате либо конформационных изменений в белке или белок-белкового взаимодействия, лада между ними увеличивается, и может быть измерена с помощью ряда методов 8. FRET на основе биосенсоров широко используются в области GPCR 9. Они использовались, чтобы исследовать конформационные изменения в GPCR, вставив донора и акцептора в третьем цикле внутриклеточного и GPCR С-конца; Датчики были разработаны для исследования GPCR и эффекторных взаимодействий по отдельности мечения GPCR и эффектор (G белковых субъединиц / arrestins) с FRET пары 10; некоторые датчики также обнаружить конформационные изменения в белке G 11. Эти биосенсоры позволили поле , чтобы задать множество нерешенных вопросов , в том числе конформационных изменений в GPCR и эффектора, кинетика взаимодействия GPCR-эффекторов и аллостерических лигандов 12. Наша группабыл особенно заинтересован в создании биосенсоров, которые могли бы обнаружить белок G-специфический GPCR конформации под агонистом приводом условиях. Этот биосенсора основывается на недавно разработанной технологии под названием СПАЗМЫ (систематическое сродство белка сила модуляции) 13. СПАЗМЫ включает привязывать взаимодействующих доменов белка с использованием ER / K компоновщик, который контролирует их эффективные концентрации. Обрамление линкер с FRET пары флуорофоров создает инструмент , который может сообщать о состоянии взаимодействия между белками 12. Ранее 1 модуль СПАЗМЫ был использован для привязывать к Gα С-концом к GPCR и контролировать их взаимодействие с FRET флуорофоров, mCitrine (далее в данном протоколе его широко известный вариант, желтый флуоресцентный белок (YFP), возбуждение / пик излучения при 490/525 нм) и mCerulean (далее в настоящем протоколе его широко известный вариант Cyan флуоресцентный белок (CFP), возбуждение / пик излучения 430/475 нм). От N- к С-концу, тего генетически кодируемых отдельный полипептид содержит: полная длина ХВГФ, лада акцептор (mCitrine / YFP), 10 нм ER / K компоновщик, лада донор (mCerulean / СФП), а Gα С-конец пептида. В этом исследовании, датчики сокращенно GPCR-линкер длиной Gα пептида. Все компоненты разделены неструктурированной (Gly-Ser-Gly) 4 линкера , который позволяет свободное вращение каждого домена. Подробная характеристика таких датчиков была ранее выполнена с использованием двух прототипические GPCRs: β 2 -АР и опсина 1.
Этот датчик трансфицированы в НЕК-293Т и флуорометре на основе экспериментах с клеточными мера спектров флуоресценции пары FRET в произвольных единицах число импульсов в секунду (CPS) в присутствии или в отсутствие лиганда живого. Эти измерения используются для вычисления соотношения FRET между флуорофоров (YFP макс / CFP макс). Изменение в FRET (ΔFRET) рассчитывается путем вычитания среднего отношения FRETнеочищенных образцов из соотношения лада лиганда образцах, обработанных. ΔFRET можно сравнить между конструкциями (β 2 -АР-10 нм-Gαs пептида по сравнению с не & beta ; 2--AR 10 нм не пептид). Здесь мы подробно протокол, чтобы выразить эти датчики в НЕК-293Т живых клеток, следить за их выражение, а установка, выполнение и анализ Флуорометр на основе живых клеток FRET измерения для необработанных клеток по сравнению условий наркотиков лечение. В то время как этот протокол является специфическим для β 2 -АР-10 нм-Gαs пептидной датчика обрабатывали 100 мкМ изопротеренол битартрат, она может быть оптимизирована для различных пар ХВГФ-Gα и лигандов.
Access restricted. Please log in or start a trial to view this content.
протокол
1. ДНК Приготовление
- Датчик Проектирование конструкций с использованием модульной схемы клонирования. Пожалуйста , ссылки конструкция датчика β 2 -АР подробно ранее 1.
- Готовят ДНК в соответствии с протоколом коммерческого набора Минипрепарат и элюции в 2 мМ раствора Трис-HCl, рН 8, при концентрации ≥ 750 нг / мкл, 260/280 1,7 - 1,9, 260/230 2,0 - 2,29.
2. Культура клеток Приготовление
- Культура НЕК-293Т-FLP-N клеток в среде DMEM, содержащей 4,5 г / л D-глюкозы, дополненной 10% ФБС (инактивированной нагреванием) (об / об), 1% L-глютамин добавка, 20 мМ HEPES, рН 7,5 при 37 ° C в увлажненной атмосфере при 5% СО 2. Обрабатывать клетки в биологической безопасности для колпака последующих шагов.
- Разрешить клеткам расти до сливающийся монослой , прежде чем пассажей в шесть-луночных блюд. Время достижения слитности зависит от начальной плотности металлизации. Используйте пластины, которыеприйти к сплошности в течение 1 - 2 дней обшивки в течение шести-хорошо металлизированный. Сливающийся 10 см тканевой культуры обработанных блюдо имеет плотность клеток примерно 4 × 10 6 клеток / мл. На рисунке 1 изображение роста клеточной культуры.
- Вымойте клеток с 10 мл PBS и Trypsinize с 0,25% трипсина (см Обсуждение, пункт 2). Пластина 8 х 10 5 клеток / лунку в 2 мл среды в тканевой культуре обработанные шесть также блюда и позволяют придерживаться в течение 16 - 20 часов.
3. Трансфекция условия
- Зигзагом трансфекций для конструкций, которые могут потребоваться разное количество времени для достижения оптимального выражения (между 20 - 36 ч). Синхронизировать условия для единого времени эксперимента. Также имеют нетрансфицированные управления скважиной при эквивалентной плотности клеток, которые будут использоваться для фонового шума и вычитанием рассеяния при анализе.
- Доведите реагенты трансфекции до комнатной температуры: уменьшенные сыворотки носитель, ДНК трансфекции реагента.
- ВБиологическое защитный кожух сочетают реагенты в стерильной микроцентрифужных трубки в следующем порядке: смешать 2 мкг ДНК с 100 мкл сыворотки восстановленных средств. Шип 6 мкл реагента для трансфекции в смеси носитель / ДНК, не касаясь поверхности смеси или сторону трубки. Установить одну реакцию трансфекции на лунку. условия Трансфекция могут быть оптимизированы (1 - 4 мкг ДНК, 3 - 6 мкл реагента для трансфекции), чтобы достичь устойчивых уровней экспрессии. В Таблице 1 более Оптимизиирует.
- Выдержите смесь при комнатной температуре в биологической Защитный кожух 15 - 30 мин. Не используйте реакцию, если оставить инкубировать в течение более 30 мин.
- Добавить реакцию клеток в каплям образом через хорошо и осторожно встряхните шесть хорошо, чтобы обеспечить тщательное смешивание. Добавьте одну реакцию на каждую лунку.
- Через 20 ч экспрессии, монитор флуоресценции с использованием тканевой культуры флуоресцентного микроскопа. Оценка экспрессии населения с 10-кратным объективных и белка локализации в клетке на 40Х. ObsЭрве для экспрессии белка в плазматической мембране (ПМ). Если существенная интернализации отмечается, следить за трансфекцию, пока значительное выражение не будет обнаружен в ПМ.
4. Реагент и оборудование Подготовка
- Подготовьте 100 мМ запасы лекарственных средств и хранят при -80 ° C: изопротеренол битартрат (100 мМ в дН 2 O , содержащего 300 мМ аскорбиновой кислоты). Сделайте на льду / в холодном помещении, а также флэш-немедленно заморозить. Порции могут быть получены и использованы до одного года.
- Приготовьте Cell Buffer (~ 2 мл / состояние) и хранить в C водяной бане при 37 °. Сделать свежий каждый день. Справочная таблица 2 для мобильных буферных компонентов.
- Готовят Drug буфер (10 мл) и хранят при комнатной температуре. Справочная таблица 2 для Buffer Drug компонентов.
- Кислотная промывка кюветах с использованием концентрированной HCl. Нейтрализовать со слабым основанием (1 М КОН), и тщательно промыть кюветах с дН 2 O.
- Подготовьте рабочую станцию вокруг флуорометре с несколькимикоробки 10, 200 и 1000 мкл пипеток, таймером , установленным с 10 мин обратный отсчет времени, в доступной вакуумной линии с наконечниками для очистки кювет, деликатных салфетками задач, и впрыскивают бутылка с сверхчистого H 2 O.
- Тепло внешней водяной бани для флуорометр и тепловой блок до 37 ° C.
- Включите флуорометре; установить программу сбора флуоресценции для сбора CFP к возбуждению 430 нм, полоса пропускания 8 нм; Дальность выброса 450 нм - 600 нм, полоса пропускания 4 нм. Для сбора YFP только в качестве контроля датчика (см Обсуждение) множество возбуждения на длине волны 490 нм, полоса пропускания 8 нм, диапазон излучения 500 - 600 нм, полоса пропускания 4 нм. Настройки сбора CFP будут использоваться для получения спектра FRET в этом эксперименте.
- Поместите двенадцать 1,5 мл микроцентрифужных труб в тепловой блок , как показано на рисунке 2. Эти трубки являются держателями для клеток аликвотных трубок (500 мкл микропробирок.) Поместите небольшой кусочек ткани в держателях 1 и 7, чтобы смягчить кюветки помещенные здесь.
Примечание: Используйте отдельные кюветы для необработанного состояния и состояния лекарственного средства для предотвращения перекрестного загрязнения.

Рисунок 2. микроцентрифужных трубки Настройка и Положение Ссылка в тепловой блок кювете для необработанных образцов находится в положении 1. ячейки аликвоты трубы находятся в положениях 2 - 6. Кювета для фармацевтических образцах, обработанных в положении 7; ячейки аликвоты трубы находятся в рабочем положении 8 - 12. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Заполните держатели 2 - 6 и 8 - 12 с ~ 750 мкл воды для создания мини-C на водяной бане 37 °.
- Поместите десять 500 мкл микроцентрифужных пробирок для клеточных аликвоты в мини-водяные бани (держатели 2 - 6, 8 - 12). Каждая трубка будет индивидуальное повторение условия (5 untreateд, 5 лекарственное лечение).
- Монитор клеток для экспрессии (см шаг 3.6).
5. Эксперимент и сбора данных
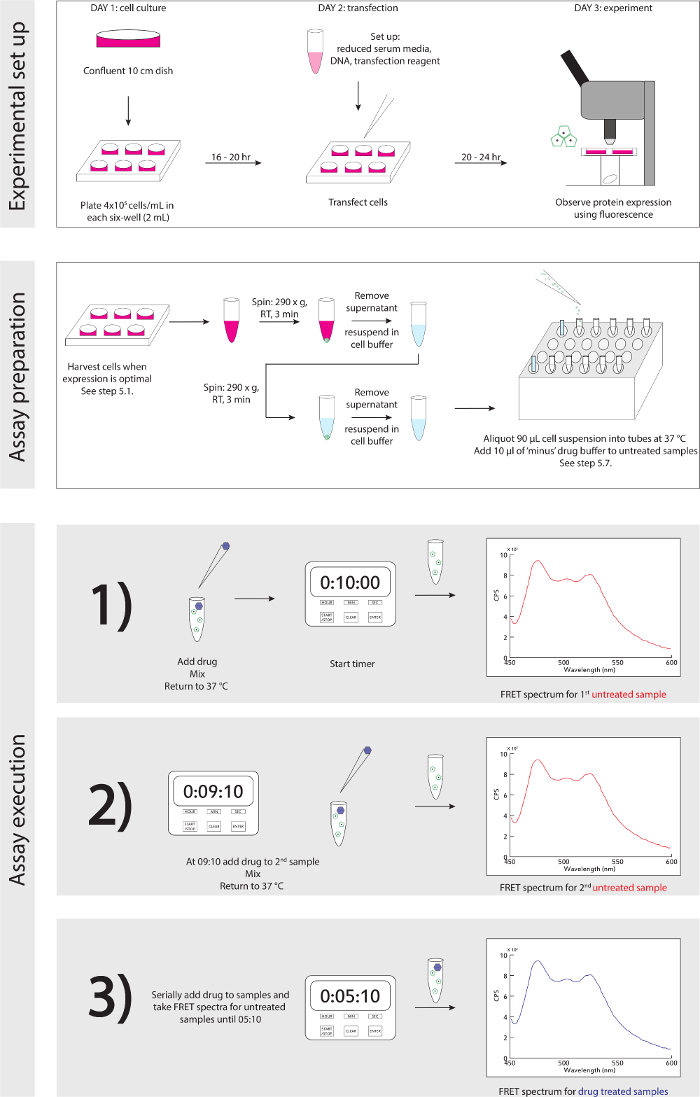
Рисунок 3. Экспериментальная Схема. Подробный пошаговый гид для экспериментальной установки и исполнения. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Для экспериментальной схемы Reference Рисунок 3. Когда клетки готовы быть собраны, на основе экспрессии белка обнаруженного с флуоресцентным микроскопом (см Обсуждение, пункт 4): в биологическом защитном кожухе, осторожно удалить ~ 1 мл сред, ресуспендирования клеток в их культуре с P1,000 и передать взмучивания в 1,5 мл трубки микроцентрифужных.
Примечание: Избегайте использования трипсина, как это может переварить N-конец и /или связывающего кармана датчика GPCR. - Граф клеток, чтобы обеспечить надлежащую плотность клеток в взмучивания. Оптимизация объема ресуспендирования для 4 × 10 6 клеток / мл.
- Спин клетки в Бакет центрифуге при комнатной температуре, 290 мкг в течение 3 мин. Удалить супернатант после центрифугирования.
- ДЖЕНТЛИ ресуспендирования клеток в 1 мл клеточной буфера (хранится при 37 ° C) и повторить шаг 5.3. Во время второго спина, собрать 100 мМ препарат запаса аликвоты от -80 ° C. Сделайте разведение 1: 100 в буфере для лекарственных средств 1 мМ рабочего запаса и держать при комнатной температуре.
- После второго центрифугирования, удаления надосадочной жидкости и осторожно ресуспендирования клеток в 1 мл клеточной буфера (4 × 10 6 клеток / мл). Мера OD 600 образца в спектрофотометр с использованием 1 мл клеток , и 1 мл клеточной буфера в виде заготовки. Разлить клетки в одноразовую пластиковую кювету и передать обратно в микроцентрифужных трубку сразу после спектрофотометрии.
- Для управления нетрансфецированной челл состояние спектра, мягко ресуспендирования нетрансфецированные клеток в 1 мл клеточного буфера с P1,000 пипетку, добавьте 90 мкл клеток в кювете и приобрести FRET спектра при возбуждении 430 нм, полоса пропускания 8 нм, эмиссия 450 - 600 нм, полоса пропускания 4 нм. Соберите 3 - 5 спектров повторных со свежими 90 мкл клеток. Хранить запас клеток при 37 ° С между спецификациями, осторожно ресуспендируют с P1,000 между каждой пробы аликвоту, и прополоскать кювету с сверхчистой H 2 O между выборками.
- Для условий эксперимента, аликвотные 90 мкл трансфицированных клеток в каждую из 500 мкл трубок в держателях 2 - 6, 8 - 12 в тепловом блоке. Аккуратно ресуспендирования запас клеток с P1,000 пипеткой между каждой аликвоты.
- После того, как клетки аликвоты добавляют 10 мкл буфера лекарственных средств в пробирки 2 - 6 для необработанных образцов состояния.
- Начало эксперимента путем добавления 10 мкл 1 мМ раствора лекарственного средства в трубку 8, запустить таймер на обратный отсчет времени от 10 минут и аккуратно перемешать трубку с P200 пипеткой. Закрыть трубки и возврат к 37° тепла блок C.
- Сразу возьмите трубку 2, осторожно перемешать с P200 (используйте новый наконечник), добавьте 90 мкл суспензии клеток в необработанном состоянии кювете, и место в флуорометре.
- Приобретать FRET спектра при возбуждении 430 нм, полоса пропускания 8 нм, эмиссии 450 - 600 нм, полоса пропускания 4 нм.
- В 9 мин - 10 сек, шип трубки 9 с 10 мкл раствора лекарственного средства 1 мМ, осторожно перемешать с P200 (используйте новый наконечник), и возвратная трубка к теплу блок.
- Повторите шаги 5.10 - 5.11 с трубкой 3 и 5,12 с трубкой 10.
- Повторите шаги 5.10 - 5.13 с интервалом в 1 минуту (08:10, 07:10 и т.д.) до тех пор , пока спектры собираются для всех необработанных образцов состояния, и препарат был добавлен для всех образцов состояния лекарственного средства. Используйте свежий наконечник для каждого шага, чтобы предотвратить пипетки перекрестного загрязнения.
- В 5 мин - 10 сек, начинают смесительная трубка 8 (состояние лекарственного средства) осторожно P200 пипеткой, добавляют 90 мкл клеточной суспензии в отдельной кювете для наркотиков обработанного образца и место в флуорометре.
- Приобретать FRET спектр (см шаг 5.11 для настройки).
- Повторите шаги 5.15 - 5.16 с интервалом в 1 минуту (04:10, 03:10 и т.д.) для остальных образцов состоянии наркотическими средствами (трубы 9 - 12).
- После завершения эксперимента, сохраните файлы проекта, тщательно промыть кюветах с сверхчистого H 2 O, и повторно запаса труб для следующего состояния. Позаботьтесь, чтобы предотвратить перекрестное загрязнение в стадии промывки. Изменение наконечник на бутылке H 2 O, а также на вакуумной линии между промывками.
Анализ 6. Данные
- Сохранение и файлы экспорта данных в SPC формате, который будет использоваться для анализа. Программы анализа доступны для загрузки с веб-сайта публикации Сиварамакришнан Lab.
- Создание файлов пути для программного обеспечения для анализа, которые включают программы анализа (V9, V15), нетрансфецированные образцы файлов (шаг 5.6 для нетрансфецированной сбора клеток спектра), файл выходных данных и значений, разделенных запятыми (CSV-файлы) для ввода данных.
- Введите следующую информациюв CSV - файл (см образец в таблице 3) и назначают соответствующие условия для каждого образца, в том числе:
Имя файла - отдельные SPC граф файлы
Рецептор - тестировался Назначенный который GPCR конструкцию (например, Β2)
Связующее вещество - Назначенный , который был испытан пептидный вариант конструкции (например, S) ,
Агонист - обозначают необработанной (N) или наркотиков лечение (D) условия
Directory - папка, в которой путь SPC файлы сохраняются, как правило, организованы по дате
OD - записывается оптическая плотность образца из спектрофотометра - Введите имена файлов для нетрансфецированной образцов (шаг 5.6) вычесть буфер и рассеяние шума из образцов.
- Введите условия в программу анализа.
- Запуск программ для анализа образцов в рамках индивидуальных условий (v9) и через условия (v15).
- Исключить файлы примеров, которые являются очевидными выпадающие в наборе данных, или настроить для вычитания путем увеличения или уменьшения значения ОП Indiviдвойные файлы.
- Экспорт данных в выходной файл для доступа к вычисленным FRET соотношения (525 нм / 475 нм).
- Вычислить ΔFRET путем вычитания среднего отношения FRET для необработанного состояния от индивидуальных FRET соотношений для обработанных условий (наркотиков).
Access restricted. Please log in or start a trial to view this content.
Результаты
Обобщенная схема эксперимента установить и исполнение подробно описана на рисунке 3.
Для того, чтобы обнаружить изменение FRET в узком динамическом диапазоне датчика, важно придерживаться нюансы системы привалировать. Качество клетки является обязательным для ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Плотный динамический диапазон измерений FRET в этой системе усиливает необходимость чувствительного контроля качества на каждом этапе этого протокола. Наиболее важные шаги для обеспечения успешного эксперимента FRET являются: 1) для культивирования клеток, 2) трансфекцию 3) экспрессии бе?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
РОМ финансировалось Американской кардиологической ассоциации Pre-докторских стипендий (14PRE18560010). Исследование финансировалось Американской кардиологической ассоциации Grant Scientist развития (13SDG14270009) и НИЗ (1DP2 CA186752-01 & 1-R01-GM-105646-01-A1) в СС
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
Ссылки
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены