Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Conformations GPCR G Protein-sélectifs mesurée à l'aide de FRET capteurs dans un Fluorometer Assay de cellules vivantes de suspension
Dans cet article
Résumé
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
Résumé
Fӧrster transfert d'énergie par résonance (FRET) à base d'études ont de plus en plus courante dans l'enquête de la signalisation GPCR. Notre groupe de recherche a développé un capteur de FRET intra-moléculaire pour détecter l'interaction entre les sous-unités et les GPCR dans des cellules vivantes après stimulation agoniste Ga. Ici, nous détaillons le protocole pour la détection des changements dans le FRET entre le β 2 adrénergiques et l'extrémité C-terminale Gas peptide lors d'un traitement avec du chlorhydrate d'isoprotérénol 100 uM comme précédemment caractérisé 1. Notre capteur de FRET est un polypeptide constitué en série d'un GPCR de longueur totale, un fluorophore accepteur de FRET (mCitrine), un ER / K SPASME (affinité de la protéine systématique force modulation) de liaison, un fluorophore FRET donneur (mCerulean), et une Ga C peptide -terminale. Ce protocole sera la préparation détaillée de la cellule, les conditions de transfection, la configuration de l'équipement, l'exécution de l'essai et l'analyse des données. Cette conception expérimentale détecte petite changes de FRET indiquant des interactions protéine-protéine et peut également être utilisé pour comparer la force de l'interaction entre les ligands et le GPCR-G paires de protéines. Pour améliorer le rapport signal-bruit dans nos mesures, ce protocole exige une précision accrue dans toutes les étapes, et est présenté ici pour permettre l'exécution reproductible.
Introduction
G récepteurs couplés aux protéines (RCPG) sont des récepteurs à sept domaines transmembranaires. Le génome humain contient environ 800 seuls les gènes codant pour des GPCR, qui sont activés par une variété de ligands, y compris la lumière, des agents odorants, des hormones, des peptides, des médicaments et d'autres petites molécules. Près de 30% de tous les produits pharmaceutiques actuellement sur les RCPG cibles du marché , car ils jouent un rôle important dans de nombreux états pathologiques 2. Malgré des décennies de travail considérable effectué sur cette famille de récepteurs, il reste des questions en suspens importantes dans le domaine, en particulier en ce qui concerne les mécanismes moléculaires qui conduisent les interactions GPCR-effectrices. À ce jour, une seule structure cristalline à haute résolution a été publiée, donnant un aperçu de l'interaction entre le β 2 adrénergiques (β 2 -AR) et la protéine Gs 3. En collaboration avec des recherches approfondies au cours des trois dernières décennies, il réitère une composante structurelle spécifique qui est essentiel dans cel'interaction: la sous-unité Ga C-terminale. Cette structure est importante tant pour activation des protéines G par le GPCR 4 et G sélection de protéines 5-6. Par conséquent, le Ga C-terminale fournit un lien essentiel entre la stimulation du ligand de GPCR et l'activation de la protéine G sélective.
Recherche au cours de la dernière décennie suggère que les GPCR peuplent un vaste paysage conformationnel, avec la liaison ligand-stabilisation des sous-ensembles de conformations GPCR. Bien que plusieurs techniques, incluant la cristallographie, la RMN et la spectroscopie de fluorescence, la spectrométrie de masse sont disponibles pour examiner le paysage conformationnel GPCR, il existe peu d'approches pour élucider leur signification fonctionnelle dans le choix des effecteurs 7. Ici, nous décrivons un Fӧrster transfert d'énergie par résonance (FRET) approche à base de détecter G conformations GPCR protéine-sélective. FRET repose sur la proximité et de l'orientation parallèle de deux fluorophores avec chevauchement des émissions (donneur) ae excitation (accepteur) spectres 8. Étant donné que les fluorophores donneur et accepteur sont rapprochés à la suite de chaque changement conformationnel dans la protéine ou une interaction protéine-protéine, le FRET entre eux augmente, et peut être mesurée en utilisant une variété de méthodes 8. Biocapteurs FRET ont été utilisés largement dans le domaine GPCR 9. Ils ont été utilisés pour sonder des changements de conformation dans le GPCR en insérant le donneur et accepteur dans la troisième boucle intracellulaire et RCPG extrémité C-terminale; les capteurs sont conçus pour sonder le GPCR et les interactions effectrices par marquage séparément le GPCR et effecteur (G sous - unités protéiques / arrestine) avec une paire de FRET 10; certains capteurs détectent également les changements conformationnels dans la protéine G 11. Ces biocapteurs ont permis le terrain pour poser une multitude de questions en suspens , y compris des changements conformationnels dans le GPCR et effecteur, GPCR-effectrices cinétiques d'interaction, et les ligands allostériques 12. Notre groupea été particulièrement intéressé par la création d'un biocapteur capable de détecter G conformations GPCR spécifiques de la protéine dans des conditions conduit agoniste. Ce biocapteur repose sur une technologie développée récemment nommée SPASM (systématique force modulation des protéines d'affinité) 13. SPASM implique tethering interagissant domaines protéiques en utilisant un ER / K lieur, qui contrôle leurs concentrations efficaces. Débordement l'éditeur de liens avec une paire de fluorophores FRET crée un outil qui peut signaler l'état de l'interaction entre les protéines 12. Auparavant 1 le module SPASM a été utilisé pour attacher le Ga C-terminale à un GPCR et de surveiller leurs interactions avec les fluorophores FRET, mCitrine (appelé dans ce protocole par sa variante communément connu, Jaune Fluorescent Protein (YFP), excitation / pic d'émission à 490/525 nm) et mCerulean (dénommé dans le présent protocole par sa variante communément appelé Cyan fluorescent Protein (PCP), excitation / pic d'émission 430/475 nm). A partir de N- à C-terminale, tson polypeptide unique codé génétiquement contient: une pleine longueur GPCR, FRET accepteur (mCitrine / YFP), 10 nm ER / K linker, donneur de FRET (mCerulean / CFP), et le peptide Ga C-terminale. Dans cette étude, les capteurs sont abrégés comme agent de liaison de GPCR-longueur Ga peptide. Tous les composants sont séparés par un non structurée (Gly-Ser-Gly) 4 segment de liaison qui permet une rotation libre de chaque domaine. La caractérisation détaillée de ces capteurs a déjà été réalisée en utilisant deux GPCR prototypiques: β 2 -AR et opsin 1.
Ce capteur est transfecté de manière transitoire dans des cellules HEK-293T et en temps réel des expériences cellulaires mesure des spectres de fluorescence en fonction du fluorimètre, de la paire de FRET en unités arbitraires de coups par seconde (CPS) en présence ou en absence de ligand. Ces mesures sont utilisées pour calculer un ratio de FRET entre les fluorophores (YFP max / CFP max). Un changement de FRET (ΔFRET) est ensuite calculée en soustrayant le ratio moyen de FRETdes échantillons non traités à partir du rapport de FRET d'échantillons de ligand traitée. ΔFRET peut être comparé à travers des constructions (β 2 -AR-10 nm-peptide par rapport ß Gas 2 -AR-10 nm-no peptide). Ici, nous détaillons le protocole d'exprimer ces capteurs dans des cellules vivantes HEK-293T, surveiller leur expression, et la configuration, l'exécution et l'analyse des cellules vivantes à base fluoromètre-FRET mesure pour non traité contre les conditions traitées par le médicament. Alors que ce protocole est spécifique pour le capteur de peptide β nm Gas 2 -Ar-10 traitées avec 100 uM d' isoprotérénol bitartrate, elle peut être optimisée pour les différentes paires de GPCR-Ga et des ligands.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Préparation de l'ADN
- capteur de design construit en utilisant un schéma de clonage modulaire. S'il vous plaît référence à la conception du capteur β 2 -AR détaillé précédemment 1.
- Préparer un ADN selon l' une commerciale protocole du kit miniprep et éluer dans une solution 2 mM de Tris-HCl, pH 8, à une concentration ≥ 750 ng / pl, A 260 / A 280 de 1/7 à 1/9, A 260 / A 230 de 2,0 à 2,29.
2. Culture cellulaire Préparation
- La culture des cellules HEK-293T-Flp-n cellules dans du DMEM contenant 4,5 g / L de D-glucose, supplémenté avec 10% de SVF (inactivé par la chaleur) (v / v), 1% de L-glutamine supplément, HEPES 20 mM, pH 7,5 à 37 ° C dans une atmosphère humidifiée à 5% de CO 2. Manipuler les cellules dans la hotte de sécurité biologique pour les étapes suivantes.
- Laisser les cellules se développent à une monocouche confluentes avant repiquage dans des boîtes à six puits. Temps pour atteindre la confluence dépend de la densité de placage initial. Utiliser des plaques quivenir à la confluence dans 1 - 2 jours de plaquage pour six puits de placage. Un plat confluentes tissu 10 cm culture traitée présente une densité cellulaire d'environ 4 x 10 6 cellules / ml. Voir la figure 1 pour l' image de la croissance de la culture cellulaire.
- Laver les cellules avec 10 ml de PBS, et trypsiniser avec 0,25% de trypsine (voir Discussion, paragraphe 2). Planche 8 x 10 5 cellules / puits dans 2 ml de milieu de culture de tissus traités six plats bien et laissez adhérer pendant 16 - 20 h.
3. Conditions Transfection
- Décaler transfections pour les constructions qui peuvent nécessiter des quantités différentes de temps pour atteindre une expression optimale (entre 20 - 36 h). Synchroniser les conditions pour un temps d'expérience unifiée. ont également un contrôle non transfectées ainsi à une densité cellulaire équivalente à utiliser pour le bruit de fond et de la diffusion soustraction lors de l'analyse.
- Amener les réactifs de transfection à la température ambiante: les médias sériques réduits, l'ADN, réactif de transfection.
- Dans unhotte de sécurité biologique combiner des réactifs dans un tube à centrifuger stérile dans l'ordre suivant: mélanger 2 pg d'ADN avec 100 pi réduit de médias de sérum. De Spike 6 pi de réactif de transfection dans les médias / ADN mix sans surface du mélange ou du côté du tube toucher. Mettre en place une réaction de transfection par puits. les conditions de transfection peuvent être optimisés (1 - 4 pg d'ADN, 3 - 6 ul de réactif de transfection) pour atteindre des niveaux d'expression compatibles. Voir le tableau 1 pour des rapports plus optimisés.
- Incuber mélange à la température ambiante dans la hotte de sécurité biologique pendant 15 - 30 min. Ne pas utiliser la réaction si on les laisse incuber pendant plus de 30 min.
- Ajouter réaction à des cellules d'une manière goutte à goutte à travers bien et secouez doucement six puits pour assurer un mélange complet. Ajouter une réaction par puits.
- Après 20 h d'expression, de surveiller la fluorescence en utilisant la culture de tissus microscope à fluorescence. Évaluer l'expression de la population avec 10X localisation objective et de protéines dans une cellule à 40X. observe pour l'expression de protéine à la membrane plasmique (PM). Si intériorisation substantielle est noté, surveiller la transfection jusqu'à expression significative est détectée au PM.
4. Préparation des réactifs et équipement
- Préparer 100 mM stocks de médicaments et conserver à -80 ° C: bitartrate isoprotérénol (100 mM dans dH 2 O contenant mM d' acide ascorbique 300). Faire de la glace / dans la chambre froide, et le flash-gel immédiatement. Aliquotes peuvent être fabriqués et utilisés jusqu'à un an.
- Préparer cellule tampon (~ 2 ml / condition) et stocker dans un bain d'eau C 37 °. Faire frais chaque jour. Tableau de référence 2 pour cellulaires constituants tampons.
- Préparer le tampon de drogue (10 ml) et stocker à température ambiante. Tableau de référence 2 pour les constituants tampons médicaments.
- Acid lavage des cuvettes en utilisant du HCl concentré. Neutraliser avec une base faible (1 M KOH), et laver soigneusement avec cuvettes dH 2 O.
- Préparer la station de travail autour de fluoromètre avec plusieursboîtes de 10, 200 et 1000 conseils ul de pipette, une minuterie réglée avec un compte à rebours de 10 min, une ligne de vide accessible avec des conseils pour le nettoyage de la cuvette, lingettes de tâches délicates, et gicler bouteille avec ultrapure H 2 O.
- Chauffer un bain d'eau externe pour fluorimètre et la chaleur bloc à 37 ° C.
- Allumez fluoromètre; définir le programme de collecte de fluorescence pour la collecte de la PCP à l'excitation 430 nm, bande passante 8 nm; plage d'émission de 450 nm - 600 nm, bande passante 4 nm. Pour la collecte YFP seulement comme le contrôle du capteur (voir Discussion) ensemble excitation à 490 nm, bande passante 8 nm, plage d'émission 500 - 600 nm, bande passante 4 nm. paramètres de collecte de la PCP seront utilisés pour acquérir un spectre de FRET dans cette expérience.
- Placer douze 1,5 ml microtubes dans le bloc thermique , comme illustré sur la figure 2 ci - dessous. Ces tubes sont des supports pour tubes aliquotes de cellules (tubes à centrifuger 500 pi.) Placer un petit morceau de tissu dans des supports 1 et 7 pour amortir les cuvettes placées ici.
Remarque: Utilisez des cuvettes séparées pour connaître l'état non traité et de l'état de la drogue pour éviter la contamination croisée.

Figure 2. Microcentrifugeuse Tube Set Up et position de référence dans la chaleur Bloc Cuve pour les échantillons non traités est en position 1. tubes aliquotes de cellules sont en positions 2 - 6. Cuve pour les échantillons traités par le médicament est en position 7; tubes aliquotes de cellules sont dans des positions 8 - 12. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Remplir les porteurs 2 - 6 et 8 - 12 ~ avec 750 ul d'eau pour créer un mini-bain de 37 ° C de l'eau.
- Placez dix 500 microtubes pi pour aliquotes de cellules dans des bains mini-eau (porte 2 - 6, 8 - 12). Chaque tube sera une répétition individuelle de la condition (5 untreated, 5 traité par le médicament).
- Surveiller les cellules d'expression (voir étape 3.6).
5. Expérience et collecte de données
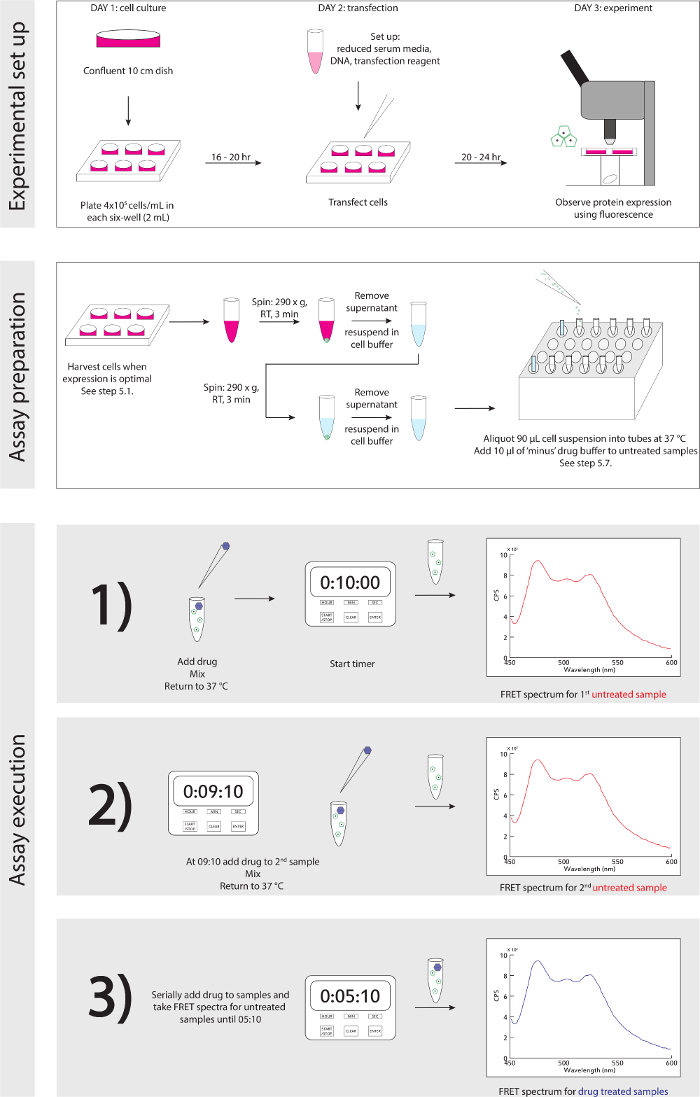
Figure 3. Schéma expérimental. Un guide étape par étape détaillé expérimental mis en place et de l' exécution. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Référence Figure 3 pour schéma expérimental. Lorsque les cellules sont prêtes à être récoltées, sur la base de l'expression de protéine détectée avec un microscope à fluorescence (voir Discussion, paragraphe 4): dans la hotte de sécurité biologique, retirez délicatement ~ 1 ml de milieu, remettre les cellules dans leur culture avec un P1,000 et transfert resuspension dans un tube de 1,5 ml.
Remarque: Évitez d'utiliser la trypsine comme il peut digérer l'extrémité N-terminale et /ou dans la poche du capteur GPCR liant. - Compter les cellules pour assurer la densité cellulaire appropriée en resuspension. Optimiser le volume de remise en suspension 4 x 10 6 cellules / ml.
- Spin cellules dans oscillante Centrifugeuse à la température ambiante, 290 g pendant 3 min. Retirer le surnageant après la centrifugation.
- Cellules DOUCEMENT resuspendre dans 1 ml cellule tampon (stocké à 37 ° C) et répétez l' étape 5.3. Au cours du deuxième tour, recueillir 100 mM stock de médicaments aliquote de -80 ° C. Faire dilution 1: 100 dans le tampon de médicaments pour 1 mM de travail et maintenir à température ambiante.
- Après la seconde centrifugation, éliminer le surnageant et remettre en suspension les cellules doucement dans 1 ml de tampon de cellules (4 x 10 6 cellules / ml). Mesurer la DO 600 de l'échantillon dans le spectrophotomètre en utilisant 1 ml de cellules et de 1 ml d' une cellule tampon comme un blanc. Distribuer les cellules dans une cuvette en plastique jetable et transfert à un tube à centrifuger immédiatement après spectrophotométrie.
- Pour une commande de cel non transfectéesl état du spectre, resuspendre délicatement les cellules non transfectées dans 1 ml cellule tampon avec P1,000 pipette, ajouter 90 ul de cellules à cuvette et acquérir le spectre FRET à excitation 430 nm, bande passante 8 nm, émission 450-600 nm, bande passante 4 nm. Collecter 3 - 5 spectres de répétition avec frais de 90 pi de cellules. Gardez stock de cellules à 37 ° C entre les spécifications, resuspendre doucement avec P1,000 entre chaque échantillon aliquote, et rincer avec cuvette ultrapure H 2 O entre les échantillons.
- Pour des conditions expérimentales aliquotes de 90 ul des cellules transfectées à chacun des tubes de 500 ul dans des supports 2 - 6, 8 - 12 dans le bloc thermique. Resuspendre doucement stock de cellules avec P1,000 pipette entre chaque aliquote.
- Après que les cellules sont aliquotées, ajouter 10 ul de tampon de médicaments aux tubes 2 - 6 pour des échantillons d'état non traitées.
- Commencez l'expérience en ajoutant 10 pi de solution de médicament 1 mM dans le tube 8, démarrer la minuterie compte à rebours de 10 min, et doucement le tube mélanger avec P200 pipette. Fermer le tube et le retour à 37° C bloc thermique.
- ramasser immédiatement tube 2, mélanger doucement avec P200 (utiliser une nouvelle pointe), ajouter 90 ul de suspension cellulaire à l'état non traité cuvette, et le placer dans fluoromètre.
- Acquérir spectre FRET à excitation 430 nm, bande passante 8 nm, émission 450-600 nm, bande passante 4 nm.
- A 9 min - 10 sec, spike tube 9 avec 10 pi de solution médicamenteuse 1 mM, mélanger délicatement avec un P200 (utiliser une nouvelle pointe), et le tube pour chauffer le bloc de retour.
- Répétez les étapes 05.10 à 05.11 avec le tube 3 et 5.12 avec le tube 10.
- Répétez les étapes 5,10 à 5,13 à des intervalles de 1 minute (8:10, 7:10, etc.) jusqu'à ce que les spectres sont collectées pour tous les échantillons de condition non traités, et le médicament a été ajouté à tous les échantillons de l' état des médicaments. Utilisez une nouvelle astuce pour chaque étape de la pipette pour éviter la contamination croisée.
- A 5 min - 10 sec, commencer à mélanger tube 8 (condition de la drogue) doucement avec P200 pipette, ajouter 90 ul de suspension cellulaire à cuvette séparée pour la drogue échantillon traité et dans fluoromètre.
- Acquérir Fspectre de RET (voir l'étape 5.11 pour les réglages).
- Répétez les étapes 05.15 à 05.16 à des intervalles de 1 minute (4:10, 3:10, etc.) pour encore état de drogue échantillons (tubes 9 - 12).
- Après la fin de l' expérience, enregistrer des fichiers de projet, laver à fond avec cuvettes ultrapure H 2 O, et repeupler tubes pour connaître l' état suivant. Prenez soin d'éviter la contamination croisée dans l'étape de lavage. Changer la pointe de la O bouteille H 2 ainsi que sur la ligne de vide entre les lavages.
Analyse 6. Données
- Sauvegardez et fichiers de données d'exportation dans la CPS format à utiliser pour l'analyse. programmes d'analyse sont disponibles pour téléchargement à partir du site publication Sivaramakrishnan Lab.
- Créer des fichiers de chemin d'accès pour le logiciel d'analyse qui comprennent les programmes d'analyse (v9, v15), les fichiers échantillons non transfectées (voir étape 5.6 pour la collecte du spectre de cellules non transfectées), fichier de données de sortie, et les valeurs séparées par des virgules fichiers (CSV) pour la saisie des données.
- Entrez les informations suivantesdans un fichier CSV (voir exemple dans le tableau 3) et désigner les conditions respectives pour chaque échantillon, y compris:
Nom du fichier - fichiers graphiques SPC individuels
Récepteur - désigné qui GPCR construction a été testée (par exemple, Β2)
Liant - qui désignent la variante de peptide de la construction a été testée (par exemple, S)
Agonist - désigner non traitée (N) ou traités par le médicament (D) conditions
De noms - le dossier de chemin dans lequel les fichiers SPC sont enregistrés, généralement organisés par date
OD - enregistrée densité optique de l'échantillon de spectrophotomètre - Entrez les noms de fichiers pour les échantillons non transfectées (étape 5.6) pour soustraire le tampon et le bruit de diffusion à partir d'échantillons.
- Entrez les conditions dans le programme d'analyse.
- Exécuter des programmes pour analyser des échantillons à l'intérieur des conditions individuelles (v9) et à travers des conditions (v15).
- Exclure les fichiers échantillons qui sont aberrantes apparentes dans l'ensemble de données, ou d'ajuster pour la soustraction en augmentant ou en diminuant la valeur de DO de individouble fichiers.
- Exporter des données vers le fichier de sortie pour l'accès à calculer FRET rapports (525 nm / 475 nm).
- Calculer ΔFRET en soustrayant le taux de FRET moyen pour connaître l'état non traité à partir des rapports de FRET individuels pour traités conditions (de drogue).
Access restricted. Please log in or start a trial to view this content.
Résultats
Un schéma généralisé de l'expérience mise en place et l' exécution est détaillée dans la figure 3.
Afin de détecter un changement de FRET dans la plage dynamique étroite du capteur, il est essentiel de respecter les nuances du système être respectées. La qualité cellulaire est impératif d'expression de la protéine ainsi que la cohérence dans l' échantillonnage. Figure 1 Caractéristiques des images de cellules cultivées en ...
Access restricted. Please log in or start a trial to view this content.
Discussion
La gamme dynamique étroite de mesures FRET dans ce système renforce la nécessité d'un contrôle de qualité sensible à chaque étape de ce protocole. Les étapes les plus importantes pour assurer une expérience réussie FRET sont 1) la culture cellulaire, 2) la transfection 3) d'expression de protéines et 4), en temps opportun, une coordination précise lors de l'exécution du test.
la santé cellulaire et la qualité d'entretien / de placage peuvent avoir un impact si...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun conflit d'intérêts.
Remerciements
RUM a été financée par l'American Heart Association Fellowship pré-doctoral (14PRE18560010). La recherche a été financée par le développement scientifique Grant American Heart Association (13SDG14270009) et le NIH (1DP2 CA186752-01 & 1-R01-GM-105646-01-A1) SS
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
Références
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon