Method Article
直接节段性肝内交付使用大鼠肝门部夹具模型方法
摘要
独特的大鼠肝门部钳模型,为研究药物分子在改善缺血再灌注损伤的影响发展。该模型包括通过门静脉的一个分支门供应到缺血性肝段直接插管,从而允许直接肝递送。
摘要
主要肝手术血流阻断,肝移植,必要一段时间的热缺血,并在一段再灌注导致缺血/再灌注(I / R)与无数的负面后果的伤害。在目的地为肝移植边缘器官潜在I / R损伤有助于电流供体短缺继发于降低的器官利用率。一个显著存在需要探讨,以介导其在移植对移植肾功能的影响肝I / R损伤。大鼠肝门部钳模型用于研究不同分子对肝I / R损伤的影响。根据不同的模型,这些分子已使用吸入,硬膜外输注,腹膜内注射,静脉内给药或注射到外围肠系膜上静脉递送。一只老鼠肝门部钳模式已被开发用于研究在改善I / R损伤药物分子的影响。该describED模型大鼠肝门部夹具包括通过门静脉的侧分支门户供给到缺血性肝段的直接插管,从而允许直接节段性肝递送。我们的方法是,以诱导局部缺血的左横向和中值裂片60分钟,在此期间所研究的物质被注入。在这种情况下,聚乙二醇化超氧化物歧化酶(PEG-SOD),自由基清除剂,被直接注入缺血段。这一系列的实验表明,PEG-SOD的输液对肝脏I / R损伤具有保护作用。这种方法的优点包括直接注射该分子与在全身性副作用分布和减少的体积随之减少缺血段。
引言
主要肝手术血流阻断,肝移植,必要一段时间的热缺血,并在一段再灌注导致缺血/再灌注(I / R)损伤1。 I / R损伤的肝脏的后果已被广泛1,2,3中详述。的我后果/ R损伤在文献中详述的包括:生成活性氧,炎症级联的引发,包括嗜中性粒细胞的活化,Kupffer细胞和内皮细胞,血红素加氧酶系统的活化和活化toll样受体,一个内皮素和一氧化氮,核因子κB的活化,和促进促炎细胞因子和粘附分子的合成1,2,3之间的不平衡。这些促炎事件可能升EAD凋亡,坏死,器官功能障碍和最终器官功能衰竭3。
I / R损伤注定肝移植器官可导致早期移植物损失和边际器官损伤3更容易促成当前的供体短缺。目前在2015年5进行了在美国4肝移植等待名单上的15226个潜在受益者,只有5,950肝脏移植手术。由于在器官可用性这种极端限制,研究探索需要以优化移植物的功能和器官利用肝I / R损伤。
用于研究肝I / R损伤动物模型包括大鼠肺门钳模型和大鼠肝移植模型。有很多种目前正在使用大鼠肺门钳模型。最常见的是在其中门静脉,肝动脉和胆管杜克拉供给左横向和中值瓣采用显微夹子6,7,8,9,10,11,12 30至60分钟6,7,10,13,14,然后从60分钟的期间再灌注的夹紧至24小时7,9,10,13,14是允许的。大鼠肝脏的左外侧和中位数裂片包括肝实质9的约70%。旨在研究缺血预处理一些协议包括门血管的间歇性夹紧或后肢之前缺血通过夹紧门血管9,13诱导较长的时间。也有在文献中描述了几种变型。第一种是夹持门静脉和肝动脉供给左横向和中值裂片,但不包括胆管15。第二变形例是通过分割16,17,18,19,20之前,夹持门静脉,肝动脉和胆管诱导全肝缺血。第三修改包括肺门血管30至60分钟8肝右叶夹紧。一个额外的修饰包括夹紧在一个后肢维管束以诱导损伤的肝脏13,21 。肺门夹紧过程的各种方法在图1A-D中示出。
大鼠肝肺门夹具模型已被用于研究不同的分子和化合物对肝I / R造成的影响。根据不同的模型中使用这些分子使用吸入11,硬膜外输注12,腹膜内注射17,18,21,22,静脉内给药10,14,15,19,23,24或注射已交付到外围肠系膜上静脉8 。
在本报告includ详细大鼠肝门部钳模型ES就可通过门静脉的侧分支门户提供给局部缺血段( 图2),其允许所研究的药理物质的直接节段性肝输送的直接插管。我们的方法是,以诱导局部缺血的左横向和中值裂片60分钟,在此期间所研究的物质的注入,在这种情况下,聚乙二醇化超氧化物歧化酶,自由基清除剂25,被直接注入缺血段。血液样品在诱导缺血前和在120分钟再灌注后服用。在这一点上,大鼠处死,样品从左侧和中间叶取出。此外,将样品从肝右叶取以用作内部对照。
有许多优点,以这种方式。首先,当所研究的药理物质可以直接注射到缺血段的体积ÒF分布是相比于注射的分布体积进入全身循环或腹膜腔相当低。此外,这种方法减少了,但并没有消除,全身副作用的可能性。
研究方案
根据机构动物护理和国家研究理事会指南的人文关怀和实验动物的使用(IACUC)的指导方针进行所有的程序,并经历了由美国俄亥俄州立大学IACUC委员会的批准。
1.初始设置
- 建立手术显微镜和手术室( 图3, 图4)。打开所有设备包括用于维持麻醉和监测生命体征。打开电单元和气候变暖垫。手术台附近输液泵的位置。
- 制定10毫升液体异氟烷在麻醉注射器吸入(分子量184.5),并将其放置在麻醉单元。
- 建立手术台附近的液氮的200mL容器中,并在那里另一血样将被处理的近离心机。
- 波什银行足球比赛的手术器械,4-0和7-0的编织丝缝合线,无菌棉签,4×4非织造海绵,5个毫升注射器,和手术台附近27个规格胰岛素注射器。
- 制备异氟醚腔室和确保足够的异氟烷在麻醉诱导递送系统灌输。
2.麻醉诱导
- 处理提上了以下的个人防护装备(PPE)大鼠前:口罩,手术手套和一次性礼服。
- 称量大鼠和记录重量。
注:SD大鼠应使用。 - 将大鼠在麻醉室,并开启异氟醚和氧气。使用异氟醚室诱导麻醉。
- 使用电动理发器,以允许清洁剂曝光( 图5)夹在动物的腹部毛发。
- 地方的additio异氟醚室动物背最终一分钟。执行脚趾捏来验证麻醉深度。
3.程序
- 与鼻锥动物的鼻子和固定与气候变暖垫限制或磁带四肢老鼠的位置。
- 使用麻醉递送系统,鼻锥和异氟醚麻醉在3.6%动物200和与动物体重大于250 g的250克4%称量继续麻醉。通过执行脚趾捏和皮肤捏确认麻醉深度。
- 使从耻骨中线腹部切口通过使用锋利的剪刀( 图6)皮肤剑突。
- 请从耻骨到剑突并进入腹部,注意不要损伤膀胱或肠道沿白线腹膜切口。由于肝脏也坚持腹膜向前靠近剑突,确保其发布在这个AR切开腹壁前EA。
- 使通过皮肤和横向切口在肝脏右叶下缘水平腹膜。
- 转动麻醉下降到1.6%动物200和和2对动物称重大于250 g的250克%称量。
- 缩回使用弯曲蚊式钳剑突。
- 地方肋牵开器从所述中线拉动肋尽可能远离可能的( 图7)。切镰状,膈胃韧带。翻转肝起来使用的润湿无菌棉签。
- 必要时切断附加韧带来访问的PORTA。用生理盐水弄湿的纱布( 图7)执行内脏转动。
- 取出的疏松结缔组织使用尖锐的或钝的解剖覆盖在门户脐。取出的疏松结缔组织覆盖在门静脉的长度。
- 使用镊子通过疏松的吨至推发行后,以左门静脉,动脉和胆管制作窗口,然后将4-0波茨缝合,但不收紧下来( 图8)。
- 清除掉疏松结缔组织覆后支随附右肾在近似水平的门静脉。这静脉将用于插管。
- 绘制0.5mL血液出下腔静脉(IVC)用胰岛素注射器( 图9)的。放置0.5毫升的血液在小瓶,离心机在135×g离心12分钟。尝试抽出血清。
- 如果一个不同的线不能红血细胞和血清之间可以理解,试图离心另外2 - 在135×g下3分钟。抽出血清并将其放置在小瓶中丙氨酸氨基转移酶(ALT)。卡扣通过直接将其置于液氮中冷冻该标本。
- 切7-0缝合静脉近的地方的两片将用于套管灰。将围绕这一思路的第一个7-0环路内侧远越好。扎该循环,并使用它使用弯曲蚊式钳( 图10)缩回。广场上,将用于插管的交叉口附近与门静脉和放置一个领带静脉第二循环7-0,但不肚带下来。
- 准备用5毫升的注射器用3mL试剂的输液泵。总理油管。
- 采用显微外科钳钳夹远端门静脉。
注:当静脉切开插管为这将减少出血。 - 切割在静脉0.5mm的孔在7-0停留缝合和其与使用小的显微剪刀门静脉交点之间。使用27-0导管将导管插入左侧门静脉系统( 图11, 图12)。插入导管过去左,右门静脉的分叉。
- 通过infus检查套管的位置荷兰国际集团生理盐水1毫升并观察肝脏灼的左侧和中位数裂片。手动确认导管过去是门静脉右支的起飞,但不超过门静脉喂养中叶的腾飞。
- 不在话下下来波茨缝合,并开始缺血时间。拧紧周围静脉7-0缝线和27-0导管举行的地方,并从远端门静脉取出钳。
- 开始使用输液泵聚乙二醇 - 超氧化物歧化酶(PEG-SOD,0.00067克/毫升)的输注。开始输液尽可能接近到的缺血时间开始。
4.监测
- 继续监控整个输液动物的生命体征。交付2毫升0.9%生理盐水或2毫升PEG-SOD的(0.00067克/毫升)溶解在0.9%生理盐水中历时15分钟。
5.再灌注
- 允许一个小时,从我一开始传递schemic时间。这是热缺血时间1小时。
- 取出波茨缝合。取下导管27-0。倒不在话下周围静脉缝合7-0。注意时间。这标志着再灌注的时间。
6.续取样
- 绘制0.5mL血液出IVC的在120分钟再灌注后。绘制血慢慢地避免溶解红细胞。慢慢地滴血液进入小瓶。保证从下腔静脉出血是每个抽血后控制。
- 如果继续有出血轻轻向下按压,用无菌棉签或小的1cm乘由丝网1厘米部分切断。
- 离心机中以135×g离心12分钟。如果没有实现充分的分离,尝试另外的2 - 在135×g下3分钟。
- 将一半的血清在小瓶为ALT以后处理。捕捉冻结这些标本。
7.安乐死
- 虽然老鼠仍然是麻醉下切开下腔静脉和superior韦纳·卡瓦(SVC)和监控,直到血液流动,呼吸和心脏搏动停止。
- 切开隔膜和通过在一个圆圈切开隔膜和切开残留在肝脏连接到腹膜腔附加结缔组织执行简短肝切除。取下腹腔肝。
- 就拿从肝脏的左和中位数叶四个样本和四个样品从肝脏右叶。样品应尽可能大,它们的大小将仅受可用肝组织量的限制。放置这些小,标记的小瓶中,并且在捕捉液氮冷冻。使用这些供以后处理组织三磷酸腺苷(ADP),丙二醛(MDA)和谷胱甘肽(GSH)。
8.后的实验分析
- 使用诊断试剂盒确定的谷胱甘肽(GSH),丙二醛(MDA)和丙氨酸转氨酶(ALT)肝组织中的活动和血清样品根据制造商的说明。
- 均质化的肝组织用裂解缓冲液,并使用Bradford测定法量化。分析由使用抗切割capase-3和肌动蛋白十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳和免疫印迹组织裂解物。量化与公开可用的软件进行蛋白质印迹。
结果
该实验用2组的n = 3只大鼠各自执行。三个大鼠肝脏注射用2mL生理盐水(NS)与输液泵历时15分钟。三个大鼠肝脏用2mL生理盐水(NS)与聚乙二醇化超氧化物歧化酶(PEG-SOD,0.00067克/毫升)与输液泵在15分钟内混合注入。如在上述方案中所述,取血样前肺门钳,并在120分钟再灌注后。另外,再灌注4肝组织样品的120分钟完成了从左侧和中间叶和四个肝脏样品取出后,从大鼠肝脏的右叶服用。
血清丙氨酸转氨酶(ALT),测定预肺门夹具和在控制120分钟再灌注后(NS)和实验(PEG-SOD)的动物。有控制的ALT水平之间的差异显著(NS)动物预肺门钳,并在120分钟再灌注后。有控制的ALT水平(NS)和实验动物(PEG-SOD)在120分钟( 图13A)之间的显著差异。组织丙二醛(MDA)是为控制(NS)和实验(PEG-SOD)的动物在肝脏中的右侧和左侧肺叶测量。组织MDA在右叶(非肺门钳)与对照注射(NS)和实验注射(PEG-SOD)表明无显著差异。左叶(后肺门钳和再灌注)组织MDA与对照注射(NS)大于右叶(非肺门钳)P <0.001显著不同。左叶(后肺门钳和再灌注)具有与对照注射(NS)与试验喷射(PEG-SOD)P <0.005( 图13B)显著不同层次组织MDA的。组织谷胱甘肽(GSH)进行了测定,在右叶(非肺门钳)与对照注射(NS)的组织谷胱甘肽第二实验注射(PEG-SOD)表明无显著差异。左叶(后肺门钳和再灌注)组织GSH与对照注射(NS)大于右叶(非肺门钳)显著不同,与对照注射(NS)P <0.05。左叶(后肺门钳和再灌注)具有显著不同水平与对照注射(NS)与试验喷射(PEG-SOD)P <0.005( 图13C)的组织谷胱甘肽。进行Western印迹比较控制动物的左,右叶,显示了提高裂解的caspase-3在肺门钳和再灌注( 图13D)后,左叶。进行第二次免疫印迹比较控制,并与PEG-SOD( 图13E)处理的动物的左侧瓣。这表明与PEG-SOD治疗动物的肝组织减少裂解的caspase-3。密度还进行demonstra婷认为肝组织裂解的caspase-3的水平在左侧相对于对照动物的( 图13F)的右叶被显著增加。在比较实验动物的左叶肝组织,用PEG-SOD输注,和对照动物的左叶肝组织,用生理盐水灌注,密度演示显著与PEG-SOD处理的动物相比,动物降低裂解的caspase-3与对照( 图13G)处理。
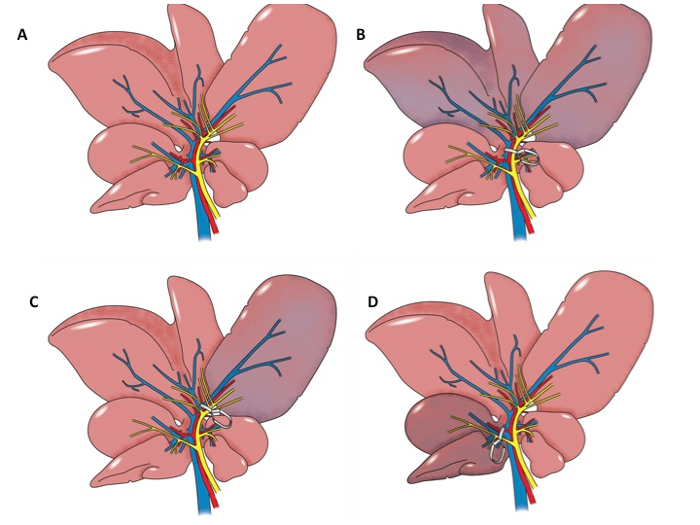
图1: 解剖插图。大鼠肝脏的解剖A.例证。 B.解剖图的大鼠肝脏。该门蒂到肝脏的左侧和中间叶被夹住。左和中位数叶是缺血性。 C.解剖图示中的大鼠肝的。该门蒂的左叶夹紧。左叶缺血。 D.解剖图的大鼠肝脏。该门蒂以右叶夹住并肝右叶是缺血性。
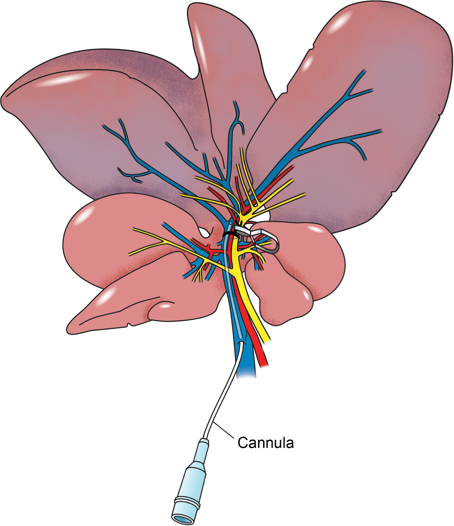
图2: 解剖插图。门静脉的大鼠肝脏的解剖图示通过侧分支静脉插管。门户椎弓根到肝脏的左,中位数裂片是通过缝合线包围和微血管钳已被用于收紧围绕维管束。左和中位数叶是缺血性。

图3: 仪器设置。该图表明日 Ë仪器设置。

图4: 手术室了。该图展示了手术室设置。 请点击此处查看该图的放大版本。
图5: 腹毛的剪裁。该图演示了腹毛的剪裁。 请点击此处查看该图的放大版本。
负载/ 54729 / 54729fig6.jpg" />
图6: 固定化和皮肤切口。该图显示大鼠和皮肤切口的固定。 请点击此处查看该图的放大版本。

图7: 肋骨牵安置和去脏。该图演示了肋骨牵放置和取出内脏。 请点击此处查看该图的放大版本。
图8: 将缝合换货。这个数字表明了缝合的位置。 请点击此处查看该图的放大版本。
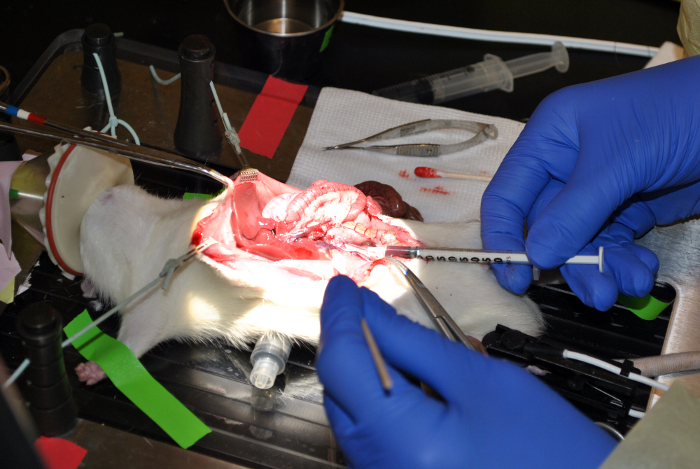
图9: 从下韦纳·卡瓦抽血。该图显示从下腔静脉抽血。 请点击此处查看该图的放大版本。

图10: 静脉分支结扎和收回。该图证明静脉分支结扎和收回。 ecsource.jove.com/files/ftp_upload/54729/54729fig10large.jpg"目标=‘_空白’>点击此处查看该图的放大版本。

图11: 插管的过程。该图证明插管的过程。 请点击此处查看该图的放大版本。
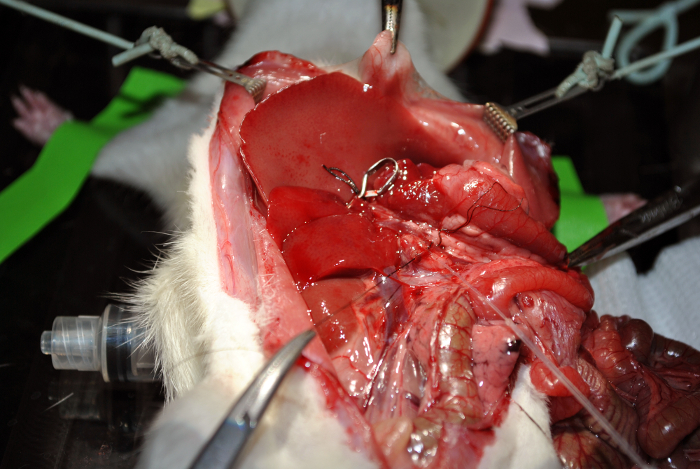
图12: 插管。这个数字说明了插管。 请点击此处查看该图的放大版本。
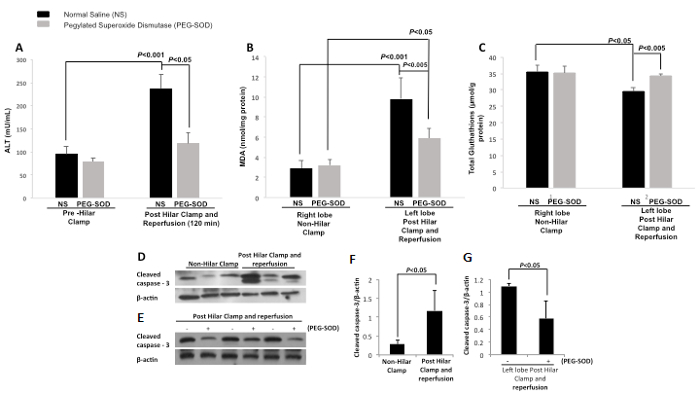
图13: 代表性的成果:PEG化的超氧化物歧化酶的直接节段性肝内交付使用大鼠肺门钳模型。 NS =生理盐水。 PEG-SOD =聚乙二醇化超氧化物歧化酶,ALT =谷丙转氨酶,MDA =丙二醛。 A.血清丙氨酸转氨酶(ALT,MU / mL)的比较前肺门钳和120分钟再灌注后之间。有控制(NS)预肺门夹具和控制(NS)在120分钟再灌注后(P <0.001)之间的差异显著。还有,在120分钟再灌注后(P <0.05)对照组(NS)和实验组(PEG-SOD)之间的显著差异。被使用的学生t检验。误差条表示标准偏差。在右叶(非肺门钳)B.组织丙二醛与对照注射(NS)的ð实验注射(PEG-SOD)表明无显著差异。左叶(后肺门钳和再灌注)组织丙二醛与对照注射(NS)大于右叶(非肺门钳)P <0.001显著不同。左叶(后肺门钳和再灌注)具有显著不同水平与对照注射(NS)与试验喷射(PEG-SOD)P <0.005组织丙二醛。被使用的学生t检验。误差条表示标准偏差。 C.在右叶(非肺门钳)组织谷胱甘肽与对照注射(NS)和实验注射(PEG-SOD)表明无显著差异。左叶(后肺门钳和再灌注)组织谷胱甘肽与对照注射(NS)大于右叶(非肺门钳)显著不同,与对照注射(NS)P <0.05。左叶(后肺门钳和再灌注)具有与对照注射液显著不同级别的组织谷胱甘肽的N(NS)与试验喷射(PEG-SOD)P <0.005。被使用的学生t检验。误差条表示标准偏差。控制动物的左叶(后肺门钳和再灌注)与右叶(非肺门钳)(生理盐水)的肝组织D.印迹表明增加裂解的caspase-3。 E. Western印迹示范用PEG-SOD在比较处理,以用对照(生理盐水)处理的动物的动物的肝组织中降低裂解的caspase-3。 F.肝组织裂解的caspase-3的水平在后肺门钳和再灌注动物(P <0.05)被显著增加。被使用的学生t检验。误差条表示标准偏差。 G.在比较实验动物的左叶肝组织(与PEG-SOD输注)和对照动物的左叶肝组织(用生理盐水灌注),有显著在降低裂解的caspase-3用PEG-SOD在比较处理,以用对照(生理盐水)处理的动物imals。被使用的学生t检验。误差条表示标准偏差。
讨论
这一系列的实验表明,PEG-SOD进入左,导致显著跌幅ALT的发布中位数叶,细胞膜的脂质过氧化(MDA)和谷胱甘肽的维护(GSH)的注射时,与对照组相比(生理盐水)。肝组织转氨酶包括丙氨酸转氨酶(ALT)建立肝细胞损伤的标记。当左叶被注射PEG-SOD中ALT的降低表明PEG-SOD的保护作用。增加组织MDA指示增加的脂质过氧化,并且被认为氧化应激和组织损伤的标志物。活性氧物质的过量产生导致制造MDA 26的增加。在组织MDA当PEG-SOD注入的显著减少动物的左侧和中间叶表明PEG-SOD的保护作用。这是与当前的理解是,PEG-SOD免受损伤细胞一致引起的部分还原的活性氧27。另外,在活性氧的存在下,谷胱甘肽二硫化物被还原成还原型谷胱甘肽(GSH)28。与PEG-SOD注入进一步的肝左和中位数叶中GSH维修加固PEG-SOD的保护作用。另外据证实存在增加的裂解的caspase-3,细胞凋亡的产物,在暴露于缺血再灌注损伤的组织。在当PEG-SOD治疗左叶中裂解的caspase-3的下降表明,PEG-SOD导致凋亡减少。
超氧化物歧化酶(SOD)是在活性氧物质的解毒的关键酶。所述酶催化两个超氧阴离子转化成过氧化氢和水。过氧化氢酶则过氧化氢转化为水和氧气,从而完成过程25。的半衰期天然SOD限制了它在实验模型中使用的共轭直到聚乙二醇 - 超氧化物歧化酶(PEG-SOD)的发展。 SOD与聚乙二醇缀合的6分钟增加其半衰期14个小时。 Nguyen 等。展示了其减轻脂质过氧化肝缺血的大鼠模型中的能力,使用全身递送29。
有多种此处详细介绍和一些先前已经在文献中描述的技术的潜在修改。根据不同的模型中使用的分子已被使用吸入11,硬膜外输注12,腹膜内注射17,18,21,22,静脉内给药10,14,15传递P>,19,23,24或注射到外围肠系膜上静脉8。
还有在这个协议的几个关键步骤。最重要的是门静脉插管。必须注意的是切静脉孔不会太大。该组织是非常有弹性和孔将扩大自身。我们建议通过切割孔,其为0.5mm与显微剪刀开始。插管可以通过孔使用仪器,其允许更大的灵活性比如果试图手工执行的过程的这个部分被馈送。此外,虽然最初进料套管,应当直接瞄准朝向左侧和右侧门静脉的分叉,以避免穿过静脉的后壁戳一个孔。当所述套管尖端到达分岔,它可以然后被馈入特定左静脉盟友。一旦插管被送入左门静脉,它提供两个左和中间凸角,它的位置可以被手动感觉就能静脉内确认。其位置也可以通过注入冷盐水的少量,看到对肝脏的供给段热烫效果证实。
在大鼠肝门部钳模型提供了证明肝脏缺血再灌注损伤可重复和稳定的平台。可变肺门夹具模型已被用于研究人员研究抗氧化剂和其他小分子6,7,8,9,10,11,12,13,14的保护作用。变化点包括血管是钳位版,其中段是由局部缺血,胆管是否被包括在内和再灌注6,7,8,9,10,11,12,13,14,15,16,17,18的期间的长度, 19,20,21。 此外,当此模型被用于研究分子的给药途径的给药的影响也异构8,10,11,"> 12,14,15,17,18,19,21,22,23,24。有几个优点对所描述的方法。首先,门户提供给局部缺血段的直接插管允许的直接节段性肝输送所研究的药理物质。这使得肝脏作为内部对照的其它叶的利用率。其次,节段性肝插管允许正在研究分布在分子的一个减小的体积,这种方法从而减少了全身性副作用的风险该物质直接喷射到感兴趣的肝段,肝段的直接插管允许物质交付预缺血内,缺血或缺血后。这允许在缺血再灌注损伤周期的任何分子的作用研究。随着缺血时间长度的增加,增加的伤害额外的机会来研究肝再生是可利用的水平。
也有这种做法的一些限制。首先是启动成本。购买手术显微镜的可能是不已经拥有一个实验室一个显著启动成本。这种技术可以是没有显微镜困难或不可能。二是学习曲线时间。虽然这个过程是比较简单,它确实需要一些做法,很可能是一个新手,需要的程序显著数成为一个专家。
总之,这种模式允许可重复的,简单,经济高效的平台来研究肝脏缺血再灌注损伤。尽管在这里描述的协议聚乙烯GLycol超氧化物歧化酶,自由基清除剂25,灌注,此模型可用于注入各种不同的药物物质,以评估其对I / R损伤肝脏的影响。
披露声明
所有作者报告说,他们没有披露。
致谢
我们要感谢丹尼斯·马蒂亞斯他说明工作。这项工作是由美国国立卫生研究院T32AI 106704-01A1和俄亥俄州立大学T·弗莱希基金器官移植,灌注,工程和再生支持。
材料
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley Rat | Harlan Sprague Dawley Inc. | 200- 250 grams | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Charcoal Canisters | Kent Scientific | SOMNO-2001-8 | |
| Isoflurane Molecular Weight 184.5 | Piramal Healthcare | ||
| Pressure-Lok Precision Analytical Syringe | Valco Instruments Co, Inc. | SOMNO-10ML | |
| Electrosurgical Unit | Macan | MV-7A | |
| Warming Pad | Braintree Scientific | HHP2 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Isoflurane chamber | Kent Scientific | SOMNO-0530LG | |
| SurgiVet | Isotec | CDS 9000 Tabletop | |
| Oxygen | Praxair | 98015 | |
| 27-0 Micro-Cannula | Braintree Scientific | MC-28 | |
| Rib retractors | Kent Scientific | INS600240 | |
| Polyethylene Glycol - Superoxide Dismutase (PEG-SOD) | Sigma Aldrich | S9549 SIGMA | |
| GenieTouch | Kent Scientific | ||
| Normal Saline | Baxter | NDC 0338-0048-04 | |
| 4 x 4 Non-Woven Sponges | Criterion | 104-2411 | |
| Sterile Q-Tips | Henry Schein Animal Health | 1009175 | |
| U-100 27 Gauge Insulin Syringe | Terumo | 22-272328 | |
| 5 mL Syringe | BD | REF 309603 | |
| 4-0 Braided Silk Suture | Deknatel, Inc. | 198737LP | |
| 7-0 Braided Silk Suture | Teleflex Medical | REF 103-S | |
| 1.8 mL Arcticle Cryogenic Tube | USA Scientific | 1418-7410 | |
| Microsurgical Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Scissors | Roboz | RS-5610 | |
| Large Scissors | S&T | SAA-15 | |
| Forceps - Large Angled | S&T | JFCL-7 | |
| Forceps - Small Angled | S&T | FRAS-15 RM-8 | |
| Clip Applier | ROBOZ | RS-5440 | |
| Scissors - non micro | FST 14958-11 | 14958-11 | |
| Forceps - Straight Tip | S&T | FRS-15 RM8TC | |
| Large Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-02 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-03 | |
| Other Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Mosquito Clamps | Generic | ||
| Analysis | |||
| Name | Company | Catalog Number | Comments |
| Alannine aminotransferase (ALT) assay | Biovision | K752-100 | |
| Malondialdehye (MDA) assay | Abcam | ab118970 | |
| Glutathione (GSH) assay | Cayman Chemical | 7030002 | |
| Antibodies - Cleaved Caspase-3 and Actin | Cell Signaling Tecnology | Antibody 9661 | |
| ImageJ Software | National Institutes of Health | ||
| RIPA Lysis and Extraction Buffer | Millipore | 10-188 |
参考文献
- Serracino-Inglott, F., Habib, N. A., Mathie, R. T. Hepatic ischemia-reperfusion injury. Am J Surg. 181, 160-166 (2001).
- Fondevila, C., Busuttil, R. W., Kupiec-Weglinski, J. W. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 74, 86-93 (2003).
- Kupiec-Weglinski, J. W., Busuttil, R. W. Ischemia and reperfusion injury in liver transplantation. Transplant Proc. 37, 1653-1656 (2005).
- OPTN. . Overall by Organ. Current US Waiting List. , (2016).
- OPTN. . Transplants in the US by Recipient ABO. , (2016).
- Tacchini, L., Radice, L., Pogliaghi, G., Bernelli-Zazzera, A. Differential activation of heat shock and nuclear factor kappaB transcription factors in postischemic reperfused rat liver. Hepatology. 26, 186-191 (1997).
- Palladini, G., et al. Lobe-specific heterogeneity and matrix metalloproteinase activation after ischemia/reperfusion injury in rat livers. Toxicol Pathol. 40, 722-730 (2012).
- Nakano, H., Kuzume, M., Namatame, K., Yamaguchi, M., Kumada, K. Efficacy of intraportal injection of anti-ICAM-1 monoclonal antibody against liver cell injury following warm ischemia in the rat. Am J Surg. 170, 64-66 (1995).
- Centurion, S. A., et al. Effects of ischemic liver preconditioning on hepatic ischemia/reperfusion injury in the rat. Transplant Proc. 39, 361-364 (2007).
- Kobayashi, H., et al. Role of endogenous nitric oxide in ischemia-reperfusion injury in rat liver. J Surg Res. 59, 772-779 (1995).
- Strifler, G., et al. Inhaled Methane Limits the Mitochondrial Electron Transport Chain Dysfunction during Experimental Liver Ischemia-Reperfusion Injury. PLoS One. 11, e0146363 (2016).
- Sarikus, Z., Bedirli, N., Yilmaz, G., Bagriacik, U., Bozkirli, F. The effects of epidural bupivacaine on ischemia/reperfusion-induced liver injury. Bratisl Lek Listy. 117, 41-46 (2016).
- Guimarães Filho, A. M., et al. Effect of remote ischemic preconditioning in the expression of IL-6 and IL-10 in a rat model of liver ischemia-reperfusion injury. Acta Cir Bras. 30, 452-460 (2015).
- Liu, Q. S., et al. Erythropoietin pretreatment exerts anti-inflammatory effects in hepatic ischemia/reperfusion-injured rats via suppression of the TLR2/NF-κB pathway. Transplant Proc. 47, 283-289 (2015).
- Montero, E. F., Quireze, C., d'Oliveira, D. M. Bile duct exclusion from selective vascular inflow occlusion in rat liver: role of ischemic preconditioning and N-acetylcysteine on hepatic reperfusion injury. Transplant Proc. 37, 425-427 (2005).
- Tártaro, R. D., et al. No protective function found in Wistar rats submitted to long ischemia time and reperfusion after intermittent clamping of the total hepatic pedicle. Transplant Proc. 47, 1038-1041 (2015).
- Yeh, D. Y., Yang, Y. C., Wang, J. J. Hepatic Warm Ischemia-Reperfusion-Induced Increase in Pulmonary Capillary Filtration Is Ameliorated by Administration of a Multidrug Resistance-Associated Protein 1 Inhibitor and Leukotriene D4 Antagonist (MK-571) Through Reducing Neutrophil Infiltration and Pulmonary Inflammation and Oxidative Stress in Rats. Transplant Proc. 47, 1087-1091 (2015).
- Kilicoglu, B., et al. Ultrastructural view of a promising anti TNF-α agent on hepatic ischaemia reperfusion injury. Bratisl Lek Listy. , 601-607 (2015).
- Jiménez Pérez, J. C., et al. Spironolactone Effect in Hepatic Ischemia/Reperfusion Injury in Wistar Rats. Oxid Med Cell Longev. , 3196431 (2016).
- Sano, N., et al. New drug delivery system for liver sinusoidal endothelial cells for ischemia-reperfusion injury. World J Gastroenterol. 21, 12778-12786 (2015).
- Chang, Y. K., Huang, S. C., Kao, M. C., Huang, C. J. Cepharanthine alleviates liver injury in a rodent model of limb ischemia-reperfusion. Acta Anaesthesiol Taiwan. , (2015).
- Lucas, M. L., Rhoden, C. R., Rhoden, E. L., Zettler, C. G., Mattos, A. A. Effects of L-arginine and L-NAME on ischemia-reperfusion in rat liver. Acta Cir Bras. 30, 345-352 (2015).
- Yeh, D. Y., Tung, S. P., Fu, Y. H., Yang, Y. C., Wang, J. J. Intravenous superoxide dismutase administration reduces contralateral lung injury induced by unilateral lung ischemia and reperfusion in rats through suppression of activity and protein expression of matrix metalloproteases. Transplant Proc. 47, 1083-1086 (2015).
- Yusen, R. D., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report-2015; Focus Theme: Early Graft Failure. J Heart Lung Transplant. 34, 1264-1277 (2015).
- Held, P. . An Introduction to Reactive Oxygen Species: Measurement of ROS in Cells. , 1-14 (2012).
- Gaweł, S., Wardas, M., Niedworok, E., Wardas, P. Malondialdehyde (MDA) as a lipid peroxidation marker. Wiad Lek. 57, 453-455 (2004).
- Beckman, J. S., et al. Superoxide dismutase and catalase conjugated to polyethylene glycol increases endothelial enzyme activity and oxidant resistance. J Biol Chem. 263, 6884-6892 (1988).
- Carlberg, I., Mannervik, B. Glutathione reductase. Methods Enzymol. 113, 484-490 (1985).
- Nguyen, W. D., Kim, D. H., Alam, H. B., Provido, H. S., Kirkpatrick, J. R. Polyethylene glycol-superoxide dismutase inhibits lipid peroxidation in hepatic ischemia/reperfusion injury. Crit Care. 3, 127-130 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。