Method Article
Метод прямых Сегментные Intra-печеночной доставка с помощью модели печени крысы Hilar зажима
В этой статье
Резюме
Уникальная печень крысы модель грудной зажим была разработана для изучения влияния фармакологических молекул в смягчении ишемии-реперфузии. Эта модель включает в себя прямую канюляцию поставки портальной к ишемическому сегменту печени через ветвь воротной вены, что позволяет прямую печеночную доставке.
Аннотация
Основная печеночная хирургия с приточной окклюзией, и трансплантацией печени, требует периода теплой ишемии, а также в период реперфузии, ведущий к ишемии / реперфузиям (I / R) травмам с бесчисленными негативными последствиями. Потенциал травма / Р в маргинальных органах, предназначенных для трансплантации печени способствует текущей нехватке доноров вторичной по отношению к снижению коэффициента использования органов. Значительная существует необходимость исследовать печеночный I / R травму для того, чтобы опосредовать его влияние на функции трансплантата при пересадке. Печени крысы внутригрудные модели зажима используются для изучения влияния различных молекул на повреждениях печени I / R. В зависимости от модели, эти молекулы были доставлены с использованием ингаляции, эпидуральной инфузии, внутрибрюшинную инъекцию, внутривенную инъекцию или введение в периферическую брыжеечной вены. Модель грудной зажим печени крысы была разработана для использования при изучении влияния фармакологических молекул в смягчении травмы I / R. describред модель для внутригрудной печени крысы зажима включает в себя прямую канюляцию поставки портальной к ишемическим печеночному сегменту через боковую ветвь воротной вены, что позволяет прямым сегментарной печеночную доставку. Наш подход, чтобы вызвать ишемию в левых боковой и срединной доле в течение 60 мин, в течение которых вещество при исследовании вливают. В этом случае, пегилированный-супероксиддисмутаза (СОД-ПЭГ), утилизатор свободных радикалов, вливают непосредственно в ишемического сегмента. Эта серия экспериментов показывает, что вливание ПЭГ-СОД защищает от повреждения печени I / R. Преимущества такого подхода включают в себя прямой впрыск молекулы в ишемизированный сегмент с последующим уменьшением объемом распределения и снижения системных побочных эффектов.
Введение
Основная печеночная хирургия с приточной окклюзией, и трансплантацией печени, требует периода теплой ишемии, а также в период реперфузии , ведущий к ишемии / реперфузиям (I / R) травмы 1. Последствия травмы I / R в печени широко 1, 2, 3 подробно. Последствия I / R травмы подробно описаны в литературе, включают: генерацию активных форм кислорода, инициирование воспалительного каскада, включа активацию нейтрофилов, клетки Купфера и эндотелиальных клеток, активации системы гемоксигеназы и активацию Toll-подобных рецепторов, в дисбаланс между эндотелина и оксида азота, активации ядерного фактора-кВ, и продвижение провоспалительного цитокина и молекулы адгезии синтеза 1, 2, 3. Эти провоспалительные события могут лEAD к апоптозу, некроз, дисфункции органов и возможного отказа органа 3.
I / R травма в органах , предназначенные для трансплантации печени может привести к ранней потере трансплантата и способствует текущей нехватке доноров , как маргинальные органы более восприимчивы к травмам 3. Есть в настоящее время 15,226 потенциальные получатели на листе ожидания трансплантации печени в Соединенных Штатах Америки 4 , и только 5950 операций по пересадке печени были выполнены в 2015 году 5. Из-за этого крайнее ограничение в доступности органов, исследование изучает травма печени / Р необходима для того, чтобы оптимизировать функции трансплантата и использование органов.
Животные модель, используемая для изучения печени I / R травм включает в себя модель грудной хомуты крыс и модель трансплантации печени крыс. Есть множество моделей крыс воротных зажимных используемый в настоящее время. Наиболее распространенным является тот, в котором воротной вены, печеночной артерии и желчных дюкт подачи левые боковые и срединные лопасти зажаты с помощью микрохирургических зажимы 6, 7, 8, 9, 10, 11, 12 в течение от 30 до 60 мин 6, 7, 10, 13, 14, а затем в течение реперфузии от 60 мин до 24 ч 7, 9, 10, 13, 14 допускается. Левые боковые и срединные лопасти печени крысы составляют около 70% от печеночной паренхимы 9. Некоторые протоколы, предназначенные для изучения ишемического переобусловливания включают прерывистое зажимание воротных сосудовили задние конечности до более длительного периода ишемии , вызванного зажима внутригрудных сосудов 9, 13. Есть также несколько модификаций, описанных в литературе. Первый зажать воротной вены и печеночной артерии , снабжающие левые боковые и срединные лопасти, но исключают желчный проток 15. Вторая модификация , чтобы вызвать полную печеночной ишемии путем зажима воротной вены, печеночной артерии и желчных протоков до их разделения 16, 17, 18, 19, 20. Третья модификация включает в себя зажим из воротных сосудов в правой доле от 30 до 60 мин 8. Дополнительная модификация включает зажимную сосудистый пучок в одной задней конечности для того , чтобы вызвать повреждение в печени 13, 21 . Различные подходы к внутригрудной процедуре зажима показаны на рисунке 1А-D.
Печени крысы внутригрудные модели зажима, были использованы для изучения влияния различных молекул и соединений на печеночном I / R. В зависимости от используемой модели эти молекулы были доставлены с помощью ингаляции 11, эпидуральной инфузии , 12, внутрибрюшинной инъекции 17, 18, 21, 22, внутривенное введение 10, 14, 15, 19, 23, 24 или инъекции в периферическую брыжеечной вены 8 ,
Модель для печени крыс прикорневых хомута подробно в настоящем докладе, ВКЛЮЧАЕТэс прямой канюляции на поставку портальной к ишемическому сегменту через боковую ветвь воротной вены (рисунок 2), что позволяет осуществлять прямые сегментарную печеночную доставку фармакологического исследуемого вещества. Наш подход , чтобы вызвать ишемию в левых боковой и срединной доле в течение 60 мин, в течение которых настой исследуемого вещества, в данном случае, пегилированный-супероксиддисмутаз, акцептор радикалов 25 свободно, вливают непосредственно в ишемический сегмент , Пробы крови берут перед индукцией ишемии и при 120 мин после реперфузии. На данный момент, крыса умерщвляют и отбирают образцы из левых и срединных лепестков. Кроме того, пробы отбирают из правой доли, чтобы служить в качестве внутреннего контроля.
Есть многочисленные преимущества этого подхода. В первую очередь, когда фармакологическое вещество, при исследовании может быть непосредственно введен в сегменте ишемического объем OРаспределение F является довольно низким по сравнению с объемом распределения инъекции в системный кровоток или брюшную полость. Кроме того, этот подход уменьшает, хотя и не исключает, возможность системных побочных эффектов.
протокол
Все процедуры были выполнены в соответствии с руководящими принципами институциональной помощи животных и руководство Национального исследовательского совета по гуманному уходу и использованию лабораторных животных (IACUC) и претерпели одобрение комитета Университета штат Огайо IACUC.
1. Начальная установка
- Настройка операционного микроскопа и операционный (рисунок 3, фигура 4). Включите все оборудование, в том числе для поддержания анестезии и мониторинга жизненно важных признаков. Включите электрохирургический блок и согревающую площадку. Установите инфузионный насос возле операционного стола.
- Составление 10 мл жидкого изофлурана для ингаляции (молекулярный вес 184,5) в анестезии шприца и поместить его в блок анестезии.
- Настройка 200 мл контейнер жидкого азота вблизи операционного стола, а другой вблизи центрифугу, где будут обработаны образцы крови.
- позицияition хирургических инструментов, 4-0 и 7-0 плетеные шелковая шовные, стерильные ватные тампоны, 4x4 нетканых губки, 5 мл шприцев и 27 калибра инсулин шприцев рядом с операционным столом.
- Подготовьте изофлуран камеры и убедитесь, что достаточно изофлюрана закапывают в системе анестезии индукции доставки.
2. вводного наркоза
- Перед началом работы с крысу положить на следующие средства индивидуальной защиты (СИЗ): хирургические маски, хирургические перчатки и одноразовую платье.
- Взвесьте крысы и записать вес.
Примечание: крысы Sprague Dawley следует использовать. - Поместите крысу в наркозе камере и включите изофлуран и кислород. Индуцируют анестезии с использованием изофлурана камеры.
- Клип брюшных волос животного с помощью электрических машинок для стрижки волос , чтобы обеспечить более чистое воздействие (рисунком 5).
- Поместите животное обратно в камере для изофлурановой с сложения иNAL одна минута. Выполните схождения щепотку, чтобы проверить глубину анестезии.
3. Процедура
- Поместите крысу с носом животного в носовом обтекателе и четырех конечностей обездвиженных с ограничениями или лентами на согревающей площадке.
- Продолжить анестезии с использованием системы доставки анестезии, носовой конус и изофлуран анестезии с 3,6% для животных весом от 200 до 250 г и 4% для животных весом более 250 г. Подтвердить глубину анестезии, выполняя носок щепотку и щепотку кожи.
- Делают разрез по средней линии живота от лобка до мечевидного через кожу с помощью острыми ножницами (рисунок 6).
- Сделайте надрез в брюшину вдоль белой линии от лобка до мечевидного и войти в живот Стараясь, чтобы не повредить мочевой пузырь или кишечник. Поскольку печень также прилипает к брюшине кпереди у мечевидного отростка, убедитесь, что он выпускает до рассечения брюшной стенки в этом арешт.
- Сделайте поперечный разрез через кожу и брюшину на уровне нижней границы правой доли печени.
- Включите анестезии до 1,6% для животных весом от 200 до 250 г и 2% для животных весом более 250 г.
- Отвод мечевидного отростка с помощью изогнутого зажима комаров.
- Место ребра ретракторы потянув ребра , как далеко друг от друга как можно дальше от средней линии (рисунок 7). Отрежьте серповидные, диафрагмальные и желудочные связки. Флип печень с использованием смачивают стерильные ватные тампоны.
- Вырезать дополнительные связки по мере необходимости, чтобы получить доступ к Порту. Выполните висцерального вращение с физиологическим смачивают марлю (рисунок 7).
- Удалите рыхлую соединительную ткань, перекрывающую портал рубчик, используя острую или тупую диссекцию. Удалите рыхлую соединительную ткань, перекрывающую длину воротной вены.
- Используйте пинцет, чтобы протолкнуть рыхлый соединительный твопрос позади левой воротной вены, артерии и желчных протоков , сделать окно и поместите 4-0 Поттс шовный , но не подпруга вниз (рисунок 8).
- Очистите от рыхлой соединительной ткани, покрывающей задней ветвь воротной вены, которая приходит в примерно на уровне правой почки. Эта вена будет использоваться для пункции.
- Draw 0,5 мл крови из нижней полой вены (НПВ) с шприц инсулина (рисунок 9). Поместите 0,5 мл крови в малом флаконе, центрифуги при 135 мкг в течение 12 мин. Попытка оттянуть сыворотки.
- Если отличие линия не может быть оценена между красными кровяными клетками и сыворотками, попытайтесь центрифугировать в течение еще 2 - 3 мин при 135 й г. Откачать сыворотку и место в ампулу для аланин-аминотрансферазы (АЛТ). Привязка заморозить этот образец, помещая его непосредственно в жидкий азот.
- Отрежьте два кусок 7-0 шва и место рядом с веной, которая будет использоваться для канюлиТион. Поместите первую 7-0 петли вокруг этой вены до медиальной, насколько это возможно. Tie этой петли и использовать его , чтобы убрать с помощью изогнутых комаров зажима (рисунка 10). Поместите вторую 7-0 петли на ключе, который будет использоваться для пункции вблизи ее пересечения с воротной веной и местом один галстука, но не подпруга вниз.
- Подготовка Инфузионный насос с помощью шприца 5 мл с 3 мл реагента. Заливка трубы.
- Зажим дистальной воротной вены с использованием микрохирургического зажима.
Примечание: Это уменьшит кровотечение, когда вены рассекают пункцию. - Вырезать 0,5 мм отверстия в вене между 7-0 пребыванием швом и его пересечением с воротной веной с использованием небольших микрохирургических ножниц. Используйте 27-0 катетер для левого иглу портальной венозной системы (Рисунок 11, Рисунок 12). Вставьте катетер мимо бифуркации левой и правой воротной вены.
- Проверьте размещение канюли по InfusING 1 мл физиологического раствора и следить за левую боковую и срединную долю печени на бланшируете. Вручную убедитесь, что катетер мимо взлета правой воротной вены, но не за взлетом воротной вены кормления медианы мочки.
- Cinch вниз шовного Поттс и время начала ишемии. Затянуть 7-0 шва вокруг вены и 27-0 катетера удерживать его на месте и снимите зажим с дистальной воротной вены.
- Начать настой полиэтиленгликоля-супероксиддисмутазы (СОД-PEG, 0,00067 г / мл) с помощью инфузионного насоса. Начать настой как можно ближе к началу ишемии.
4. Мониторинг
- Продолжайте следить за жизненно важные признаки животного на протяжении инфузии. Deliver 2 мл 0,9% физиологического раствора или 2 мл ПЭГ-SOD (0,00067 г / мл), растворенные в 0,9% физиологическом растворе в течение 15 мин.
5. реперфузии
- Разрешить один час, чтобы пройти от начала Ischemic время. Это 1-ч теплого времени ишемии.
- Удалить шовный Поттс. Удалите 27-0 катетер. Cinch вниз 7-0 шва вокруг вены. Обратите внимание на время. Это отмечает время реперфузии.
6. Продолжение выборки
- Draw 0,5 мл крови из нижней полой вены в 120 мин после реперфузии. Нарисуйте кровь медленно, чтобы избежать лизировать эритроциты. Медленно капать кровь в пробирку. Убедитесь в том, что кровотечение из нижней полой вены контролируется после каждого взятия крови.
- Если продолжаются кровотечение применять мягкое давление со стерильным ватным тампоном или небольшими 1 см на 1 см сечения вырезанного из марли.
- Центрифуга при 135 мкг в течение 12 мин. Если достаточное разделение не достигнуто, попытайтесь еще 2 - 3 мин при 135 х г.
- Поместите половину сыворотки во флаконе для последующей обработки АЛТ. Привязка заморозить эти образцы.
7. Эвтаназия
- В то время как крысы все еще находится под наркозом вырезать IVC и Superior Вена Кава (SVC) и не контролировать до кровотока, дыхания и сердечных сокращений прекращаются.
- Надрезать диафрагму и выполнить короткие гепатэктомии с помощью рассечения диафрагмы в круге и рассечении дополнительной соединительной ткани, которая остается подключение печени в брюшную полость. Удалить печень от брюшной полости.
- Возьмите четыре образца из левой и срединной доли печени и четыре образца из правой доли печени. Образцы должны быть настолько большими, насколько это возможно, и их размер будет ограничен только объемом доступной ткани печени. Поместите их в небольших, маркированных флаконах, и оснастки замораживание в жидком азоте. Используйте их для последующей обработки для ткани аденозинтрифосфата (АДФ), малонового диальдегида (МДА) и глютатиона (GSH).
8. Пост-эксперимент Анализ
- Определение глутатиона (GSH), малоновый диальдегид (МДА) и аланинаминотрансферазы (ALT) деятельность в ткани печени и образцы сыворотки с помощью диагностических наборовв соответствии с инструкциями изготовителя.
- Однородная ткань печени с буфером для лизиса и количественно с использованием анализа Брэдфорда. Анализ лизата ткани с помощью гель-электрофореза с додецилсульфатом натрия в полиакриламидном и иммуноблоттинга с использованием антител против расщепленного capase-3 и актина. Количественно вестерн-блоттинга, выполненные с общедоступного программного обеспечения.
Результаты
Этот эксперимент проводили с 2-х групп N = 3 крыс в каждой. Три крысы Печень вводили 2 мл физиологического раствора (NS) с инфузионного насоса в течение 15 мин. Три крысы Печень вводили 2 мл физиологического раствора (NS), смешанного с пегилированного-супероксиддисмутазы (СОД-PEG, 0,00067 г / мл) с инфузионного насоса в течение 15 мин. Как описано в приведенном выше протокола, были взяты образцы крови предварительно внутригрудный зажим и на 120-мин после реперфузии. Кроме того, после завершения 120-минутной реперфузии четырех образцов ткани печени были взяты из левого и срединных лепестков и четырех образцов печени были взяты из правой доли печени крысы.
Сыворотка аланинаминотрансферазы (АЛТ) измеряли предварительно внутригрудную зажим и на 120-мин после реперфузии в контроле (NS) и экспериментальной (ПЭГ-СОД) животных. Была значительная разница между уровнем АЛТ контроля (NS)животные предварительно внутригрудная зажим и на 120-мин после реперфузии. Была значительная разница между уровнем ALT контроля (NS) и экспериментальными животными (ПЭГ-SOD) при 120-мин (рис 13а). измеряли Tissue малонового (MDA) для контроля (NS) и экспериментальной (ПЭГ-СОД) животных в правой и левой долей печени. Tissue MDA в правой доле (не прикорневых зажим) с впрыском управления (NS) и экспериментальной инъекции (PEG-СОД) не демонстрируют существенной разницы. Левая лопасть (пост-внутригрудная зажим и реперфузия) ткань МД с впрыском управления (NS), значительно отличается от правой доли (не внутригрудная зажим) р <0,001. Левая лопасть (пост-внутригрудная зажим и реперфузии) имеет существенно различные уровни ткани MDA с впрыском управления (NS) по сравнению с экспериментальной инъекции (ПЭГ-СОД) р <0,005 (рис 13б). Ткань глутатион (GSH) измеряли и глутатион ткани в правой доли (не внутригрудной зажим) с впрыском управления (NS) ай экспериментальной инъекции (PEG-SOD) не демонстрируют существенной разницы. Левая лопасть (пост-внутригрудная зажим и реперфузия) ткань GSH с впрыском управления (NS), значительно отличаются от правой доли (не внутригрудная зажим) с впрыском управления (NS) р <0,05. Левая лопасть (пост-внутригрудная зажим и реперфузии) имеет существенно различные уровни ткани глутатиона с впрыском управления (NS) по сравнению с экспериментальной инъекции (ПЭГ-СОД) р <0,005 (рис 13C). Вестерн - блото было проведено сравнением правой и левой мочки контрольных животных и демонстрирует увеличилось расщепляются каспазы-3 в левой доле после внутригрудного зажима и реперфузий (рис 13d). Вторая вестерн - блот было проведено сравнение левых мочки животных , обработанных контролем и с ПЭГ-СОД (рис 13E). Это свидетельствует о уменьшилось расщепляется каспазы-3 в ткани печени животных, получавших ПЭГ-SOD. Денситометрию также была проведена ДЕМОНСТРАтин , что уровень расщепляется каспазы-3 в ткани печени значительно увеличивается в левой доле по сравнению с правой контрольных животных (рис 13F). При сравнении левой ткани лопасти печени экспериментальных животных, залитой ПЭГ-СОДАХ и левой ткань лопасти печени контрольных животных, заваренной обычном физиологическом раствор, денситометрия демонстрирует значительно снизилась расщепленные каспазы-3 у животных, обработанных ПЭГ-СОДЫ, по сравнению с животными обрабатывают с контролем (рис 13G).
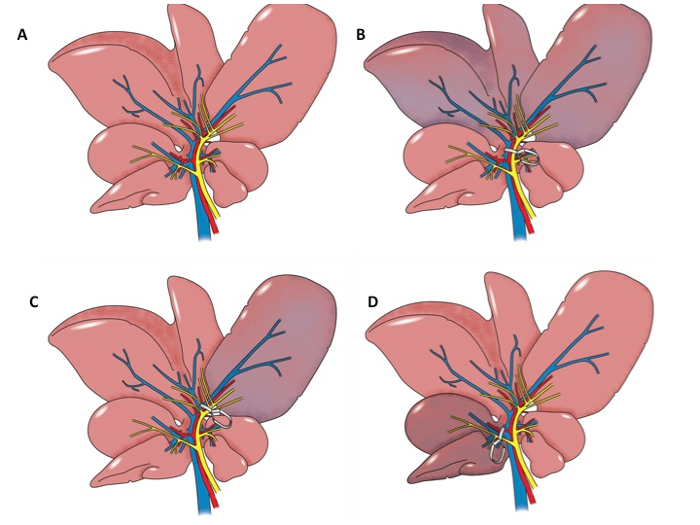
Рисунок 1: Анатомические иллюстрации. А. Анатомическая иллюстрация печени крыс. Б. Анатомическая иллюстрация печени крыс. Портал ножка с левой и срединной долей печени зажимается. Левые и средние доли ишемические. C. Анатомическийиллюстрация печени крыс. Портал ножку к левой доле зажимается. Левая лопасть ишемическая. Д. Анатомической иллюстрация печени крыс. Портал ножка в правой доле зажимаются и правая лопасть ишемическая.
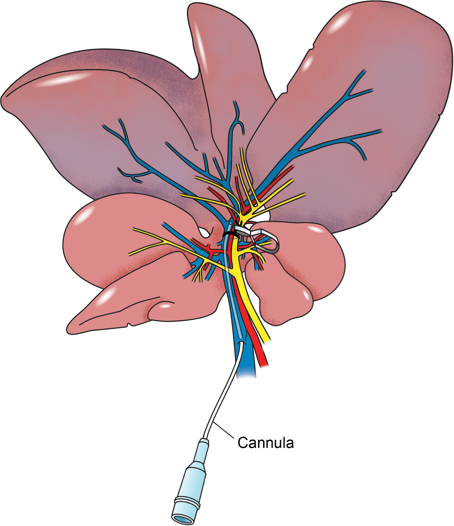
Рисунок 2: Анатомические иллюстрации. Анатомическая иллюстрация печени крыс с воротной веной через канюлю через боковую ветвь. Портал ножка с левой и срединной долей печени окружена швом и зажим микрососудов был использован, чтобы затянуть вокруг сосудистого пучка. Левые и средние доли ишемические.

Рисунок 3: Инструмент настройка. Эта цифра показывает, тыс е инструмент вверх установленный.

Рисунок 4: Operating Room Set-вверх. Эта цифра демонстрирует операционную настройку. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 5: Обрезка абдоминального волоса. Эта цифра демонстрирует срез брюшного волоса. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
нагрузка / 54729 / 54729fig6.jpg»/>
Рисунок 6: иммобилизация и Разрез кожи. Эта цифра демонстрирует иммобилизации крыс и разрез кожи. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 7: Ребро втягивающего Размещение и эвисцерация. Эта цифра демонстрирует грудное размещение втягивания и потрошение. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 8: Место Мент шовного. Эта цифра демонстрирует размещение шовного материала. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
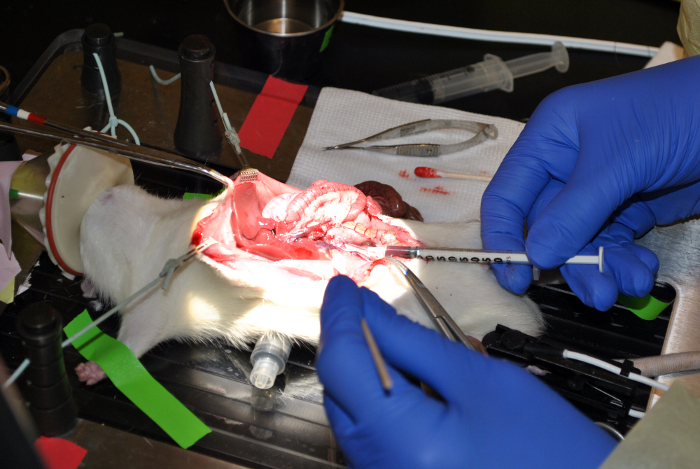
Рисунок 9: Кровь Розыгрыш от НПВ. Эта цифра демонстрирует дро крови из нижней Вена Кава. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 10: Vein Branch перевязывают и складные. Эта цифра демонстрирует вены ветви перевязывают и убирается. ecsource.jove.com/files/ftp_upload/54729/54729fig10large.jpg»целевых =„_blank“> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 11: Процесс канюли. Эта фигура демонстрирует процесс пункции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
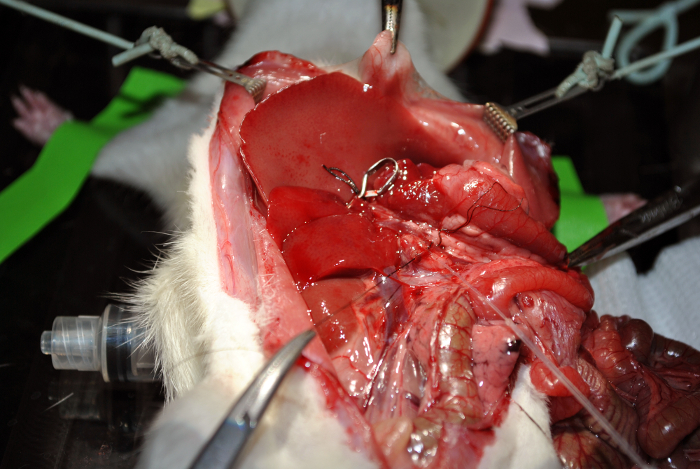
Рисунок 12: канюля. Эта цифра демонстрирует катетеризацию. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
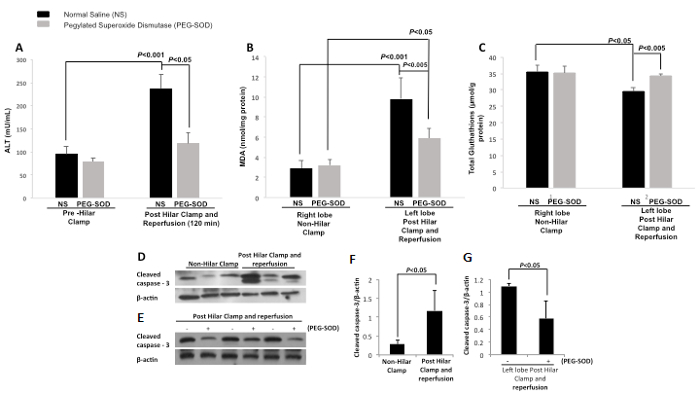
Рисунок 13: Представитель Результаты: Прямой Сегментные Внутрипеченочный Доставка пегилированных-супероксиддисмутазы Использования Rat грудной зажима Модели. NS = нормальный физиологический раствор. PEG-СОД = пегилированного-супероксиддисмутаза, ALT = аланинаминотрансферазы, MDA = малонового. А. Сыворотка аланинаминотрансферазы (АЛТ, мЕд / мл) по сравнению между предварительно внутригрудной зажимом и 120-мин после реперфузии. Существует значительная разница между контролем (NS) предварительно внутригрудным зажимом и контролем (NS) при 120-мин после реперфузии (р <0,001). Существует также значительная разница между контролем (NS) и экспериментальных групп (ПЭГ-SOD) при 120-мин после реперфузии (р <0,05). использовали T-тест студента. Столбики ошибок представляют стандартное отклонение. В. Тканевый малонового диальдегида в правой доле (не внутригрудной зажим) с впрыском управления (NS) апд экспериментальной инъекции (ПЭГ-СОД) не демонстрируют существенную разницу. Левая лопасть (пост-внутригрудная зажим и реперфузии) ткани малонового диальдегида с впрыском управления (NS) значительно отличается от правой доли (не внутригрудная зажим) р <0,001. Левая лопасть (пост-внутригрудная зажим и реперфузии) имеет существенно различные уровни ткани малонового с впрыском управления (NS) по сравнению с экспериментальной инъекции (ПЭГ-СОД) р <0,005. использовали T-тест студента. Столбики ошибок представляют стандартное отклонение. C. Тканевая глутатиона в правой доли (не прикорневых зажим) с впрыском управления (NS) и экспериментальной инъекции (PEG-СОД) не демонстрируют существенной разницы. Левая лопасть (пост-внутригрудная зажим и реперфузия) ткань глутатион с впрыском управления (NS) значительно отличается от правой доли (не внутригрудная зажим) с впрыском управления (NS) р <0,05. Левая лопасть (пост-внутригрудная зажим и реперфузии) имеет существенно различные уровни глутатиона ткани с контрольной injectioп (NS), по сравнению с экспериментальной инъекции (ПЭГ-СОД) р <0,005. использовали T-тест студента. Столбики ошибок представляют стандартное отклонение. Д. Вестерн - блот - продемонстрированная более расщепленный каспазы-3 в ткани печени левой доли (пост-внутригрудная зажима и реперфузии) по сравнению с правой доли (не внутригрудной зажим) контрольных животных (нормальный физиологический раствор). Е. Вестерн - блот - демонстрирующий уменьшился расщепленные каспазы-3 в ткани печени животных , получавших ПЭГ-СОДАХ , по сравнению с животными , которым вводили контроль (нормальный физиологический раствор). F. Уровень расщепленной каспазы-3 в ткани печени значительно увеличивается в пост-внутригрудных смыкания и реперфузионных животных (р <0,05). использовали T-тест студента. Столбики ошибок представляют стандартное отклонение. Г. При сравнении левой доле печени ткани экспериментальных животных (залитый ПЭГ-СОД) и левой доли печени ткани контрольных животных (залитый нормальный физиологический раствор), то значительно снижается расщепленный активность каспазы-3 вimals обработанные PEG-СОД, по сравнению с животными, которым вводили контроль (нормальный физиологический раствор). использовали T-тест студента. Столбики ошибок представляют стандартное отклонение.
Обсуждение
Эта серия экспериментов показали, что введение ПЭГ-СОД в левой и срединных лепестков привело к значительному снижению в выпуске ALT, перекисное окисление липидов клеточных мембран (MDA), и содержание глутатиона (GSH) по сравнению с контрольной группой (Нормальный физиологический раствор ). Печень трансаминаз ткани, включая аланинаминотрансферазы (АЛТ) установлены маркеры гепатоцеллюлярной травмы. Снижение АЛТ, когда левая лопасть вводят ПЭГ-СОД предполагает защитный эффект PEG-SOD. Увеличение ткани MDA указывает на усиление перекисного окисления липидов и считается маркером окислительного стресса и повреждения тканей. Перепроизводство активных форм кислорода приводит к увеличению производства MDA 26. Значительное сокращение ткани MDA в левой и средней долей животного при введении ПЭГ-СОД демонстрирует защитный эффект PEG-SOD. Это согласуется с нынешним пониманием того, что PEG-SOD защищает клетки от повреждений,вызвано частично восстановленных активных форм кислорода 27. Кроме того, в присутствии активных форм кислорода, дисульфида глутатиона сводится к глутатиона (GSH) 28. Содержание в GSH в левой и срединной доле печени, инъецированный ПЭГ-СОДАХ дополнительно усиливает защитный эффект PEG-SOD. Кроме того, показано, что существует повышенная расщепляется каспазы-3, продукт апоптоза в ткани подвергается воздействию травмы ишемии-реперфузии. Снижение расщепленной каспазы-3 в левой доле при лечении ПЭГ-СОД предполагает, что ПЭГ-СОД приводит к уменьшению апоптоза.
Супероксиддисмутазы (СОД) является критическим ферментом в детоксикации активных форм кислорода. Фермент катализирует превращение двух супероксиданионов в перекись водорода и воду. Фермент каталаза затем преобразует пероксид водорода на воду и кислород, завершение процесса 25. Полураспаданативный СОД не ограничивает его применение в экспериментальных моделях до развития конъюгированного полиэтиленгликоля-супероксиддисмутазы (PEG-SOD). Конъюгирование SOD к полиэтиленгликоль увеличивает его период полураспада от 6 мин до 14 ч. Нгуен и др. продемонстрировал свою способность смягчать перекисное окисление липидов в печени ишемии в модели крысы, с использованием системной доставки 29.
Есть целый ряд возможных модификаций техники, подробно здесь и некоторые из них ранее были описаны в литературе. В зависимости от используемой модели молекул были доставлены с использованием ингаляции 11, эпидуральной инфузии , 12, внутрибрюшинной инъекции 17, 18, 21, 22, внутривенное введение 10, 14, 15 , 19, 23, 24 или инъекции в периферическую вену верхней брыжеечной 8.
Есть несколько важных шагов в этом протоколе. Наиболее важным является катетеризация воротной вены. Необходимо соблюдать осторожность, чтобы отверстие вырезать в вене не слишком велико. Ткань очень эластична и дыра будет увеличить на своем собственном. Мы рекомендуем начать резание отверстия, которое составляет 0,5 мм с микрохирургической ножницами. Канюлю можно подавать через отверстие с помощью прибора, который позволяет повысить гибкость, чем если бы пытается выполнить эту часть процедуры вручную. Кроме того, в то время как первоначально кормления канюли, она должна быть направлена непосредственно к бифуркации левой и правой воротной вены, чтобы избежать тыкать отверстие через заднюю стенку вены. Когда кончик канюли достигает развилки, он затем может быть подан в левую вену определеннойсоюзник. После того, как канюля подается в левую воротной вену, которая снабжает левую и срединный лепестком, его положение может быть подтверждено вручную, чувствуя его внутри вены. Его положение также может быть подтверждено путем введения небольшого количества холодного солевого раствора и видя бланширование влияния на прилагаемых сегментах печени.
Внутригрудная печени зажим модель крысы обеспечивает воспроизводимую и стабильную платформу для демонстрации повреждения печени ишемических-реперфузионного. Переменные внутригрудные модели зажима, были использованы исследователями для изучения защитных эффектов антиоксидантов и других небольших молекул 6, 7, 8, 9, 10, 11, 12, 13, 14. Точки изменения включают в котором сосуды зажим е изд, какой сегмент выполнены ишемическая, независимо от того , включен или нет желчных протоков и длина периода реперфузии 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21. Кроме того, когда эта модель используется для изучения влияния введения молекулы от пути введения также гетерогенные 8, 10, 11,«> 12, 14, 15, 17, 18, 19, 21, 22, 23, 24. Есть несколько преимуществ описанного подхода. Во- первых, прямое канюляция поставку портального к ишемическим сегмента позволяет прямой сегментарного печеночной доставки фармакологическое вещество на стадии изучения. Это позволяет использование другой доли печени в качестве внутреннего контроля. Во-вторыхов, сегментарная печеночная канюляция позволяет уменьшенный объем распределения для молекулы изучаемого. Этот подход, таким образом, снижает риск возникновения системных побочных эффектов, как вещество вводятся непосредственно в сегмент печени, представляющего интереса. Прямая канюляция печеночного сегмента позволяет вещества должны быть доставлена предварительно ишемия, Интр-ишемия или после ишемии. Это позволяет для изучения эффекта молекулы в любой точке цикла ишемии-реперфузии травмы. С увеличением продолжительности ишемии и повышенного уровня травматизма дополнительную возможность для изучения регенерации печени будут доступны.
Есть также некоторые ограничения этого подхода. Первый запуск стоимость. Приобретение операционного микроскопа может быть значительным запуском стоимостью лаборатории, которая уже не обладает одним. Этот метод может быть затруднено или невозможно без микроскопа. Второе время обучения кривой. Хотя эта процедура относительно проста она требует некоторой практики, и вполне вероятно, что новичок потребует значительного количества процедур, чтобы стать экспертом.
Таким образом, эта модель позволяет воспроизводимым, простой и экономически эффективной платформой для изучения печеночной травмы ишемии-реперфузии. Хотя в протоколе, описанных здесь полиэтилен Г.Л.ycol-супероксиддисмутаза, акцептор радикалов 25 бесплатно, вливают, эта модель может быть использована для влить множество различных фармакологических веществ , для того , чтобы оценить их воздействие на травмы I / R в печени.
Раскрытие информации
Все авторы сообщают, что у них нет раскрытия.
Благодарности
Мы хотели бы отметить Деннис Матиас за его иллюстративную работу. Эта работа была поддержана NIH T32AI 106704-01A1 и Флеш фонд T. для трансплантации органов, перфузии, инженерии и регенерации в Университете штата Огайо.
Материалы
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley Rat | Harlan Sprague Dawley Inc. | 200- 250 grams | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Charcoal Canisters | Kent Scientific | SOMNO-2001-8 | |
| Isoflurane Molecular Weight 184.5 | Piramal Healthcare | ||
| Pressure-Lok Precision Analytical Syringe | Valco Instruments Co, Inc. | SOMNO-10ML | |
| Electrosurgical Unit | Macan | MV-7A | |
| Warming Pad | Braintree Scientific | HHP2 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Isoflurane chamber | Kent Scientific | SOMNO-0530LG | |
| SurgiVet | Isotec | CDS 9000 Tabletop | |
| Oxygen | Praxair | 98015 | |
| 27-0 Micro-Cannula | Braintree Scientific | MC-28 | |
| Rib retractors | Kent Scientific | INS600240 | |
| Polyethylene Glycol - Superoxide Dismutase (PEG-SOD) | Sigma Aldrich | S9549 SIGMA | |
| GenieTouch | Kent Scientific | ||
| Normal Saline | Baxter | NDC 0338-0048-04 | |
| 4 x 4 Non-Woven Sponges | Criterion | 104-2411 | |
| Sterile Q-Tips | Henry Schein Animal Health | 1009175 | |
| U-100 27 Gauge Insulin Syringe | Terumo | 22-272328 | |
| 5 mL Syringe | BD | REF 309603 | |
| 4-0 Braided Silk Suture | Deknatel, Inc. | 198737LP | |
| 7-0 Braided Silk Suture | Teleflex Medical | REF 103-S | |
| 1.8 mL Arcticle Cryogenic Tube | USA Scientific | 1418-7410 | |
| Microsurgical Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Scissors | Roboz | RS-5610 | |
| Large Scissors | S&T | SAA-15 | |
| Forceps - Large Angled | S&T | JFCL-7 | |
| Forceps - Small Angled | S&T | FRAS-15 RM-8 | |
| Clip Applier | ROBOZ | RS-5440 | |
| Scissors - non micro | FST 14958-11 | 14958-11 | |
| Forceps - Straight Tip | S&T | FRS-15 RM8TC | |
| Large Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-02 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-03 | |
| Other Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Mosquito Clamps | Generic | ||
| Analysis | |||
| Name | Company | Catalog Number | Comments |
| Alannine aminotransferase (ALT) assay | Biovision | K752-100 | |
| Malondialdehye (MDA) assay | Abcam | ab118970 | |
| Glutathione (GSH) assay | Cayman Chemical | 7030002 | |
| Antibodies - Cleaved Caspase-3 and Actin | Cell Signaling Tecnology | Antibody 9661 | |
| ImageJ Software | National Institutes of Health | ||
| RIPA Lysis and Extraction Buffer | Millipore | 10-188 |
Ссылки
- Serracino-Inglott, F., Habib, N. A., Mathie, R. T. Hepatic ischemia-reperfusion injury. Am J Surg. 181, 160-166 (2001).
- Fondevila, C., Busuttil, R. W., Kupiec-Weglinski, J. W. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 74, 86-93 (2003).
- Kupiec-Weglinski, J. W., Busuttil, R. W. Ischemia and reperfusion injury in liver transplantation. Transplant Proc. 37, 1653-1656 (2005).
- OPTN. . Overall by Organ. Current US Waiting List. , (2016).
- OPTN. . Transplants in the US by Recipient ABO. , (2016).
- Tacchini, L., Radice, L., Pogliaghi, G., Bernelli-Zazzera, A. Differential activation of heat shock and nuclear factor kappaB transcription factors in postischemic reperfused rat liver. Hepatology. 26, 186-191 (1997).
- Palladini, G., et al. Lobe-specific heterogeneity and matrix metalloproteinase activation after ischemia/reperfusion injury in rat livers. Toxicol Pathol. 40, 722-730 (2012).
- Nakano, H., Kuzume, M., Namatame, K., Yamaguchi, M., Kumada, K. Efficacy of intraportal injection of anti-ICAM-1 monoclonal antibody against liver cell injury following warm ischemia in the rat. Am J Surg. 170, 64-66 (1995).
- Centurion, S. A., et al. Effects of ischemic liver preconditioning on hepatic ischemia/reperfusion injury in the rat. Transplant Proc. 39, 361-364 (2007).
- Kobayashi, H., et al. Role of endogenous nitric oxide in ischemia-reperfusion injury in rat liver. J Surg Res. 59, 772-779 (1995).
- Strifler, G., et al. Inhaled Methane Limits the Mitochondrial Electron Transport Chain Dysfunction during Experimental Liver Ischemia-Reperfusion Injury. PLoS One. 11, e0146363 (2016).
- Sarikus, Z., Bedirli, N., Yilmaz, G., Bagriacik, U., Bozkirli, F. The effects of epidural bupivacaine on ischemia/reperfusion-induced liver injury. Bratisl Lek Listy. 117, 41-46 (2016).
- Guimarães Filho, A. M., et al. Effect of remote ischemic preconditioning in the expression of IL-6 and IL-10 in a rat model of liver ischemia-reperfusion injury. Acta Cir Bras. 30, 452-460 (2015).
- Liu, Q. S., et al. Erythropoietin pretreatment exerts anti-inflammatory effects in hepatic ischemia/reperfusion-injured rats via suppression of the TLR2/NF-κB pathway. Transplant Proc. 47, 283-289 (2015).
- Montero, E. F., Quireze, C., d'Oliveira, D. M. Bile duct exclusion from selective vascular inflow occlusion in rat liver: role of ischemic preconditioning and N-acetylcysteine on hepatic reperfusion injury. Transplant Proc. 37, 425-427 (2005).
- Tártaro, R. D., et al. No protective function found in Wistar rats submitted to long ischemia time and reperfusion after intermittent clamping of the total hepatic pedicle. Transplant Proc. 47, 1038-1041 (2015).
- Yeh, D. Y., Yang, Y. C., Wang, J. J. Hepatic Warm Ischemia-Reperfusion-Induced Increase in Pulmonary Capillary Filtration Is Ameliorated by Administration of a Multidrug Resistance-Associated Protein 1 Inhibitor and Leukotriene D4 Antagonist (MK-571) Through Reducing Neutrophil Infiltration and Pulmonary Inflammation and Oxidative Stress in Rats. Transplant Proc. 47, 1087-1091 (2015).
- Kilicoglu, B., et al. Ultrastructural view of a promising anti TNF-α agent on hepatic ischaemia reperfusion injury. Bratisl Lek Listy. , 601-607 (2015).
- Jiménez Pérez, J. C., et al. Spironolactone Effect in Hepatic Ischemia/Reperfusion Injury in Wistar Rats. Oxid Med Cell Longev. , 3196431 (2016).
- Sano, N., et al. New drug delivery system for liver sinusoidal endothelial cells for ischemia-reperfusion injury. World J Gastroenterol. 21, 12778-12786 (2015).
- Chang, Y. K., Huang, S. C., Kao, M. C., Huang, C. J. Cepharanthine alleviates liver injury in a rodent model of limb ischemia-reperfusion. Acta Anaesthesiol Taiwan. , (2015).
- Lucas, M. L., Rhoden, C. R., Rhoden, E. L., Zettler, C. G., Mattos, A. A. Effects of L-arginine and L-NAME on ischemia-reperfusion in rat liver. Acta Cir Bras. 30, 345-352 (2015).
- Yeh, D. Y., Tung, S. P., Fu, Y. H., Yang, Y. C., Wang, J. J. Intravenous superoxide dismutase administration reduces contralateral lung injury induced by unilateral lung ischemia and reperfusion in rats through suppression of activity and protein expression of matrix metalloproteases. Transplant Proc. 47, 1083-1086 (2015).
- Yusen, R. D., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report-2015; Focus Theme: Early Graft Failure. J Heart Lung Transplant. 34, 1264-1277 (2015).
- Held, P. . An Introduction to Reactive Oxygen Species: Measurement of ROS in Cells. , 1-14 (2012).
- Gaweł, S., Wardas, M., Niedworok, E., Wardas, P. Malondialdehyde (MDA) as a lipid peroxidation marker. Wiad Lek. 57, 453-455 (2004).
- Beckman, J. S., et al. Superoxide dismutase and catalase conjugated to polyethylene glycol increases endothelial enzyme activity and oxidant resistance. J Biol Chem. 263, 6884-6892 (1988).
- Carlberg, I., Mannervik, B. Glutathione reductase. Methods Enzymol. 113, 484-490 (1985).
- Nguyen, W. D., Kim, D. H., Alam, H. B., Provido, H. S., Kirkpatrick, J. R. Polyethylene glycol-superoxide dismutase inhibits lipid peroxidation in hepatic ischemia/reperfusion injury. Crit Care. 3, 127-130 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены