Method Article
Método de la entrega directa segmentaria intra-hepática utilizando un modelo de hígado de rata hiliar abrazadera
En este artículo
Resumen
Un modelo de abrazadera hiliar hígado de rata única fue desarrollado para estudiar el impacto de moléculas farmacológicas en la mejora de la lesión por isquemia-reperfusión. Este modelo incluye la canulación directa del suministro de portal al segmento de hígado isquémico a través de una rama de la vena porta, lo que permite la entrega hepática directa.
Resumen
cirugía hepática Major con oclusión de entrada, y el trasplante de hígado, requieren un período de isquemia caliente, y un periodo de reperfusión conduce a la isquemia / reperfusión (I / R) lesión con consecuencias negativas innumerables. lesión I / R potencial en órganos marginales destinados a trasplante de hígado contribuye a la escasez de donantes de corriente secundaria a una tasa de utilización de órganos disminuido. Existe una necesidad significativa para explorar lesión hepática de I / R con el fin de mediar en su impacto en la función del injerto en el trasplante. modelos de abrazadera hiliares de hígado de rata se utilizan para investigar el impacto de diferentes moléculas en la lesión I / R hepática. Dependiendo del modelo, estas moléculas han sido entregados de usar la inhalación, la infusión epidural, inyección intraperitoneal, la administración intravenosa o la inyección en la vena mesentérica superior periférica. Un modelo de abrazadera hiliar hígado de rata se ha desarrollado para su uso en el estudio del impacto de las moléculas farmacológicas en la mejora de I / R lesión. el describmodelo ed para la abrazadera hiliar hígado de rata incluye la canulación directa del suministro de portal al segmento hepática isquémica a través de una rama lateral de la vena porta, lo que permite la entrega hepática segmentaria directa. Nuestro enfoque es inducir isquemia en los lóbulos laterales y la mediana se dejaron durante 60 min, tiempo durante el cual se infunde la sustancia en estudio. En este caso, pegilado-superóxido dismutasa (PEG-SOD), un eliminador de radicales libres, se infunde directamente en el segmento isquémico. Esta serie de experimentos demuestra que la infusión de PEG-SOD es protectora contra la lesión I / R hepática. Las ventajas de este enfoque incluyen la inyección directa de la molécula en el segmento isquémica con la consiguiente disminución en el volumen de distribución y reducción de los efectos secundarios sistémicos.
Introducción
Cirugía hepática Major con oclusión de entrada, y el trasplante de hígado, requieren un período de isquemia caliente, y un periodo de reperfusión conduce a la isquemia / reperfusión (I / R) lesión 1. Las consecuencias de la lesión I / R en el hígado se han detallado ampliamente 1, 2, 3. Consecuencias de la lesión I / R se detalla en la literatura incluyen: generación de especies reactivas de oxígeno, la iniciación de la cascada inflamatoria, incluyendo la activación de los neutrófilos, las células de Kupffer, y células endoteliales, la activación del sistema de hemo oxigenasa y la activación de receptores de tipo Toll, una desequilibrio entre la endotelina y el óxido nítrico, la activación del factor nuclear-kB, y la promoción de citocinas proinflamatorias y la síntesis de 1, 2, 3 molécula de adhesión. Estos eventos proinflamatorias puede lead a la apoptosis, necrosis, la disfunción de órganos y la insuficiencia de órganos eventual 3.
I / R lesión de órganos destinados a trasplante de hígado puede conducir a la pérdida del injerto temprano y contribuye a la escasez de donantes actual como órganos marginales son más susceptibles a las lesiones 3. Actualmente hay 15.226 beneficiarios potenciales en la lista de espera para un trasplante de hígado en los Estados Unidos y 4 sólo 5.950 trasplantes de hígado se realizaron en 2015 5. Debido a esta limitación extrema en la disponibilidad de órganos, la investigación a explorar se necesita lesión I / R hepática con el fin de optimizar la función del injerto y la utilización de órganos.
Los modelos animales utilizados para estudiar la lesión hepática I / R incluyen rata modelos de abrazadera hiliar y modelos de trasplante de hígado de rata. Hay una variedad de modelos de abrazadera hiliares rata actualmente en uso. El más común es aquella en la que la vena portal, arteria hepática y biliar duct suministro de los lóbulos laterales y la mediana de la izquierda se sujetan utilizando clips de microcirugía 6, 7, 8, 9, 10, 11, 12 durante 30 a 60 min 6, 7, 10, 13, 14, y después de un periodo de reperfusión de 60 min a 24 h 7, 9, 10, 13, se permite 14. Los lóbulos laterales y la mediana izquierdo del hígado de rata comprenden de aproximadamente 70% del parénquima hepático 9. Algunos protocolos diseñados para estudiar el precondicionamiento isquémico incluyen sujeción intermitente de los vasos hiliareso el de las extremidades posteriores antes de un período más largo de la isquemia inducida por apriete los vasos hiliares 9, 13. Hay también varias modificaciones descritas en la literatura. La primera es para sujetar la vena porta y arteria hepática suministro de los lóbulos laterales y la mediana izquierda, pero excluir el conducto biliar 15. Una segunda modificación es el de inducir isquemia hepática total de por apriete del conducto vena portal, arteria hepática y biliar antes de su división 16, 17, 18, 19, 20. Una tercera modificación incluye la sujeción de los vasos hiliares al lóbulo derecho durante 30 a 60 min 8. Una modificación adicional implica la sujeción del haz vascular en una extremidad posterior con el fin de inducir lesiones en el hígado 13, 21 . Varios enfoques para el procedimiento abrazadera hiliares se ilustran en la Figura 1A-D.
modelos de abrazadera hiliares de hígado de rata se han utilizado para estudiar el impacto de diferentes moléculas y compuestos en hepática de I / R. Dependiendo del modelo utilizado estas moléculas han sido entregados usar la inhalación de 11, la infusión epidural 12, la inyección intraperitoneal 17, 18, 21, 22, la administración intravenosa 10, 14, 15, 19, 23, 24 o inyección en la vena periférica mesentérica superior 8 .
El modelo para la abrazadera hiliar hígado de rata se detalla en este informe includit canulación directa del suministro de portal al segmento isquémico a través de una rama lateral de la vena porta (Figura 2), lo que permite segmental directa entrega hepática de la sustancia farmacológica en estudio. Nuestro enfoque es inducir isquemia en los lóbulos laterales y la mediana se dejaron durante 60 min, tiempo durante el cual una infusión de la sustancia en estudio, en este caso, la superóxido pegilado-dismutasa, un eliminador de radicales libres 25, se infunde directamente en el segmento isquémico . Las muestras de sangre se toman antes de la inducción de la isquemia y a 120 minutos después de la reperfusión. En este punto, la rata se sacrifica y se toman muestras de los lóbulos izquierdo y la mediana. Adicionalmente, se toman muestras del lóbulo derecho de servir como un control interno.
Hay numerosas ventajas de este enfoque. Primero y ante todo, cuando la sustancia farmacológica en estudio puede ser inyectado directamente en el segmento isquémico el volumen odistribución f es bastante bajo en comparación con el volumen de distribución de la inyección en la circulación sistémica o la cavidad peritoneal. Además, este enfoque reduce, aunque no elimina, la posibilidad de efectos secundarios sistémicos.
Protocolo
Todos los procedimientos se realizaron de acuerdo con las directrices del Cuidado de Animales institucional y el Manual del Consejo Superior de Investigaciones Científicas para el cuidado humano y Uso de Animales de Laboratorio (IACUC) y ha sido objeto de aprobación por el comité de la Universidad del Estado de Ohio IACUC.
1. Configuración inicial
- Puesta en marcha el microscopio quirúrgico y la sala de operaciones (Figura 3, Figura 4). Encienda todo el equipo incluido el de mantener la anestesia y monitorización de constantes vitales. Encienda la unidad y el calentamiento de la almohadilla de electrocirugía. Coloque la bomba de infusión cerca de la mesa de operaciones.
- Elaborar 10 ml de isoflurano líquido para inhalación (peso molecular 184,5) en la jeringa de anestesia y colocarla en la unidad de la anestesia.
- Establecer un ml recipiente 200 de nitrógeno líquido cerca de la mesa de operaciones y otro cerca de la centrífuga donde se procesarán las muestras de sangre.
- PosITION los instrumentos quirúrgicos, 4-0 y 7-0 de sutura trenzado de seda, hisopos de algodón estériles, esponjas 4x4 no tejida, 5 jeringas ml, y 27 jeringas de calibre de insulina cerca de la mesa de operaciones.
- Preparar la cámara de isoflurano y asegúrese de que el isoflurano suficiente se instila en el sistema de suministro de inducción de la anestesia.
2. La inducción de la anestesia
- Antes de manipular la rata poner en el siguiente equipo de protección personal (EPP): máscara quirúrgica, guantes quirúrgicos, y bata desechable.
- Pesar la rata y registrar el peso.
NOTA: ratas Sprague Dawley se deben utilizar. - Coloque la rata en la cámara de anestesia y encienda el isoflurano y el oxígeno. Inducir la anestesia usando la cámara de isoflurano.
- Pinza de pelo abdominal del animal usando una cortadora de cabello eléctrica para permitir la exposición limpiador (Figura 5).
- Coloque la parte posterior de los animales en la cámara de isoflurano para una additional un minuto. Realizar una pizca dedo del pie para verificar la profundidad de la anestesia.
3. Procedimiento
- Coloque la rata con la nariz del animal en el cono de la nariz y cuatro extremidades inmovilizadas con restricciones o cinta adhesiva en la almohadilla de calentamiento.
- Continuar la anestesia utilizando el sistema de administración de anestesia, cono de la nariz e isoflurano con la anestesia en el 3,6% para los animales que pesaban entre 200 y 250 g y 4% para los animales con un peso superior a 250 g. Confirmar profundidad de la anestesia mediante la realización de una pizca dedo del pie y una pizca de la piel.
- Haga una incisión abdominal en la línea media del pubis a xifoides a través de la piel usando unas tijeras afiladas (Figura 6).
- Hacer una incisión en el peritoneo a lo largo de la línea alba del pubis hasta xifoides y entrar en el abdomen cuidando de no dañar la vejiga o el intestino. Como el hígado también se pega a la peritoneo anterior, cerca de la apófisis xifoides, garantizar que se libera antes de la incisión de la pared abdominal en este area.
- Hacer una incisión transversal a través de la piel y el peritoneo en el nivel del borde inferior del lóbulo derecho del hígado.
- Girar la anestesia hasta 1,6% para los animales que pesaban entre 200 y 250 g y 2% para los animales con un peso superior a 250 g.
- Retraer el proceso xifoides utilizando una pinza mosquito curvada.
- Retractores lugar de costilla que tiran de las costillas tan alejados como sea posible de la línea media (Figura 7). Cortar el falciforme, frénico y los ligamentos gástricos. Da la vuelta al hígado utilizando hisopos de algodón estériles humedecidas.
- Cortar los ligamentos adicionales si es necesario para acceder al porta. Realizar rotación visceral con solución salina gasa humedecida (Figura 7).
- Eliminar el tejido conectivo laxo que cubre el hilio portal con disección aguda o roma. Quitar el tejido conectivo laxo que cubre la longitud de la vena portal.
- El uso de fórceps para empujar a través de la suelta t conectivocuestión posterior al conducto vena porta izquierda, la arteria y la bilis hacer una ventana y coloque 4-0 Potts sutura pero no cincha hacia abajo (Figura 8).
- Despejar el tejido conectivo laxo que cubre la rama posterior a la vena porta que se presenta en aproximadamente el nivel del riñón derecho. Esta vena se utilizan para la canalización.
- Dibuje 0,5 ml de sangre de la vena cava inferior (IVC) con una jeringa de insulina (Figura 9). Coloque los 0,5 ml de sangre en un pequeño vial, centrifugar a 135 xg durante 12 min. Intentar para extraer el suero.
- Si una línea distinta no se puede apreciar entre las células rojas de la sangre y el suero, trata de centrifugar durante 2 adicional - 3 min a 135 x g. Trasvasar suero y lugar en un vial para la alanina-aminotransferasa (ALT). Snap congelar este espécimen colocándolo directamente en nitrógeno líquido.
- Cortar dos piezas de 7-0 sutura y lugar cerca de la vena que se utilizarán para la cánulación. Coloque el primer bucle alrededor de 7-0 este sentido en la medida de lo posible medial. Ate este bucle y lo utilizan para retraer el uso de una pinza mosquito curvada (Figura 10). Colocar un segundo bucle de 7-0 en la vena que será utilizado para la canalización cerca de su intersección con la vena porta y coloque un lazo, pero no cincha hacia abajo.
- Preparar la bomba de infusión con una jeringa de 5 ml con 3 ml de reactivo. El primer tubo.
- Abrazadera vena portal distal mediante una abrazadera de microcirugía.
NOTA: Esto reducirá el sangrado cuando la vena se realiza una incisión para la canalización. - Corte un agujero de 0,5 mm en la vena en entre la sutura 7-0 estancia y su intersección con la vena portal usando pequeñas tijeras de microcirugía. Utilice 27-0 catéter para canular el sistema venoso portal izquierda (Figura 11, Figura 12). Insertar el catéter más allá de la bifurcación de la vena porta izquierda y derecha.
- Compruebe la colocación de la cánula por infusing 1 ml de solución salina normal y el reloj para los lóbulos laterales y la mediana izquierdo del hígado a palidecer. confirmar manualmente que el catéter está más allá de la toma de fuerza del portal de la derecha de la vena, pero no más allá del despegue de la vena porta que alimenta el lóbulo medio.
- Cincha por la sutura Potts y hora de inicio de la isquemia. Apretar 7-0 sutura alrededor de la vena y 27-0 catéter para mantenerlo en su lugar y quitar la pinza de la vena portal distal.
- Comience la infusión de polietileno glicol superóxido-dismutasa (PEG-SOD, 0,00067 g / ml) usando la bomba de infusión. Iniciar la infusión lo más cerca posible al inicio del tiempo de isquemia.
4. Seguimiento
- Seguirá de cerca los signos vitales del animal a lo largo de la infusión. Entregar 2 ml de solución salina normal al 0,9% o 2 ml de PEG-SOD (0,00067 g / ml) disuelto en solución salina normal al 0,9% durante un período de 15 min.
5. La reperfusión
- Permitir una hora para pasar desde el comienzo de la ischemic tiempo. Esto es 1-h de tiempo de isquemia caliente.
- Retire la sutura Potts. Retirar el catéter 27-0. Cincha por la sutura 7-0 alrededor de la vena. Tenga en cuenta el tiempo. Esto marca el momento de la reperfusión.
6. Continuación Muestreo
- Dibuje 0,5 ml de sangre de la vena cava inferior a 120 min post-reperfusión. Dibujar la sangre lentamente para evitar la lisis de los glóbulos rojos. gotear lentamente la sangre en un vial. Asegúrese de que el sangrado de la IVC se controla después de cada extracción de sangre.
- Si no se continúa el sangrado aplicar una presión suave con un bastoncillo de algodón estéril o una pequeña de 1 cm por 1 cm sección de corte de gasa.
- Centrifugar a 135 xg durante 12 min. Si no se logra una separación suficiente, trate de un 2 adicional - 3 min a 135 x g.
- Coloque media del suero en un vial para su posterior procesamiento para ALT. Snap congelar estos especímenes.
7. La eutanasia
- Mientras que la rata es todavía bajo anestesia cortar la IVC y superior de la vena cava (SVC) y el monitor hasta que el flujo de sangre, la respiración y los latidos del corazón cese.
- Incisión en el diafragma y realizar una breve hepatectomía mediante la incisión de la membrana en un círculo y cortar tejido conectivo adicional que queda conectar el hígado a la cavidad peritoneal. Retire el hígado a partir de la cavidad peritoneal.
- Tomar cuatro muestras de los lóbulos izquierdo y medianas del hígado y cuatro muestras del lóbulo derecho del hígado. Las muestras deben ser tan grandes como sea posible y su tamaño será limitado sólo por la cantidad de tejido hepático disponible. Coloque éstos en viales pequeños, etiquetados, y complemento de congelación en nitrógeno líquido. Utilice éstos para su posterior procesamiento para el trifosfato de adenosina tejido (ADP), el malondialdehído (MDA) y glutatión (GSH).
8. Post-experimento de análisis
- Determinar el glutatión (GSH), el malondialdehído (MDA) y alanina aminotransferasa (ALT) actividades en el tejido hepático y muestras de suero utilizando kits de diagnósticode acuerdo con las instrucciones del fabricante.
- Homogeneizar el tejido hepático con tampón de lisis y cuantificar usando un ensayo de Bradford. Analizar lisado de tejido por electroforesis en gel de poliacrilamida con dodecilsulfato de sodio y de inmunotransferencia usando anticuerpos contra Capase-3 escindida y la actina. Cuantificar las transferencias Western realizadas con el software a disposición del público.
Resultados
Este experimento se realizó con 2 grupos de n = 3 ratas cada uno. Tres hígados de rata fueron inyectados con 2 mL de solución salina normal (NS) con la bomba de infusión durante un período de 15 min. Tres hígados de rata fueron inyectados con 2 mL de solución salina normal (NS) mezclado con la superóxido dismutasa pegilada-(PEG-SOD, 0,00067 g / ml) con la bomba de infusión durante un período de 15 min. Como se describe en el protocolo anterior, las muestras de sangre fueron tomadas abrazadera pre-hiliar y al 120-min post-reperfusión. Además, después de la finalización de 120-min de reperfusión cuatro muestras de tejido hepático se tomaron de la izquierda y los lóbulos mediana y cuatro muestras de hígado fueron tomadas del lóbulo derecho del hígado de rata.
Serum Alanina aminotransferasa (ALT) se midió abrazadera pre-hiliar y al 120-min post-reperfusión en control (NS) y experimental (PEG-SOD) animales. Hubo una diferencia significativa entre el nivel de ALT de control (NS)animales de fijación pre-hiliar y en 120 minutos después de la reperfusión. Hubo una diferencia significativa entre el nivel de ALT de control (NS) y animales experimentales (PEG-SOD) en 120-min (Figura 13A). malonaldehído Tissue (MDA) se midió para el control (NS) y experimental (PEG-SOD) los animales en ambos lóbulos derecho e izquierdo del hígado. Tissue MDA en el lóbulo (pinza no hiliar) derecho con la inyección de control (NS) y la inyección experimental (PEG-SOD) demostrar ninguna diferencia significativa. lóbulo izquierdo (pinza y reperfusión post-hiliar) tejido MDA con la inyección de control (NS) es significativamente diferente de lóbulo derecho (pinza no hiliar) p <0,001. Lóbulo izquierdo (pinza post-hiliar y reperfusión) tiene niveles significativamente diferentes de tejido MDA con inyección de control (NS) versus inyección experimental (PEG-SOD) p <0,005 (Figura 13B). glutatión tisular (GSH) se midió y glutatión tejido en lóbulo derecho (pinza no hiliar) con inyección de control (NS) unand inyección experimental (PEG-SOD) demostrar ninguna diferencia significativa. lóbulo izquierdo (pinza y reperfusión post-hiliar) tejido GSH con la inyección de control (NS) es significativamente diferente de lóbulo derecho (pinza no hiliar) con inyección de control (NS) p <0,05. Lóbulo izquierdo (pinza post-hiliar y reperfusión) tiene significativamente diferentes niveles de glutatión tejido con la inyección de control (NS) versus inyección experimental (PEG-SOD) p <0,005 (Figura 13C). Western blot se realizó la comparación de lóbulo derecho e izquierdo de los animales de control y demuestra el aumento de exfoliados caspasa-3 en el lóbulo izquierdo después de abrazadera hiliar y la reperfusión (Figura 13D). Una segunda transferencia de Western se realizó la comparación de los lóbulos izquierdos de los animales tratados con el control y con PEG-SOD (Figura 13E). Esto demuestra disminuyó exfoliados caspasa-3 en el tejido hepático de los animales tratados con PEG-SOD. Densitometría También se realizó demostrating que el nivel de la caspasa-3 escinde en el tejido hepático es significativamente mayor en la izquierda contra lóbulo derecho de los animales de control (Figura 13F). Al comparar el tejido izquierda hígado lóbulo de animales de experimentación, infundido con PEG-SOD, y el tejido hepático lóbulo izquierdo de los animales de control, infundido con solución salina normal, densitometría demuestra disminuyó significativamente exfoliados caspasa-3 en los animales tratados con PEG-SOD en comparación con los animales tratados con control (Figura 13G).
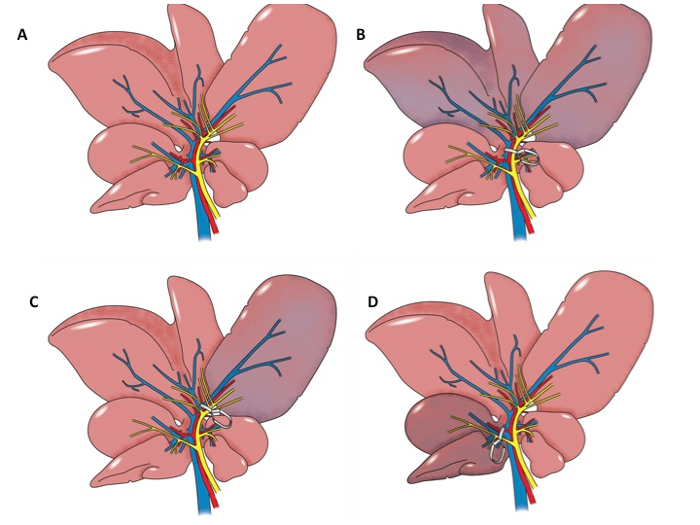
Figura 1: Anatomical ilustraciones. A. Ilustración anatómica del hígado de rata. Ilustración B. anatómica del hígado de rata. El pedículo portal a los lóbulos izquierdos y la mediana del hígado se sujeta. Los lóbulos izquierdo y medianos son isquémico. C. anatómicoilustración del hígado de rata. El pedículo portal al lóbulo izquierdo se sujeta. El lóbulo izquierdo es isquémica. Ilustración D. anatómica del hígado de rata. El pedículo portal al lóbulo derecho se sujeta y el lóbulo derecho es isquémico.
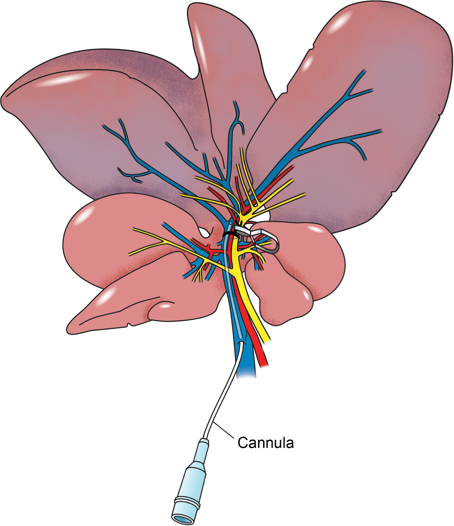
Figura 2: Anatomical ilustraciones. Ilustración anatómica del hígado de rata con la vena porta una cánula a través de una rama lateral. El pedículo portal a los lóbulos izquierdos y la mediana del hígado está rodeado por una sutura y una pinza de microvasos se ha utilizado para apretar alrededor del haz vascular. Los lóbulos izquierdo y medianos son isquémico.

Figura 3: configuración del instrumento. Esta figura demuestra º puesta en marcha e instrumento.

Figura 4: sala de operaciones en marcha. Esta figura demuestra la sala de operaciones puesta a punto. Haga clic aquí para ver una versión más grande de esta figura.
Figura 5: Recorte de abdominal de pelo. Esta figura demuestra el recorte del vello abdominal. Haga clic aquí para ver una versión más grande de esta figura.
carga / 54729 / 54729fig6.jpg"/>
Figura 6: La inmovilización y la incisión de la piel. Esta figura demuestra la inmovilización de la rata y la incisión de la piel. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Costilla Retractor Colocación y evisceración. Esta figura demuestra la colocación retractor de costilla y evisceración. Haga clic aquí para ver una versión más grande de esta figura.
Figura 8: Place ción de sutura. Esta figura demuestra la colocación de la sutura. Haga clic aquí para ver una versión más grande de esta figura.
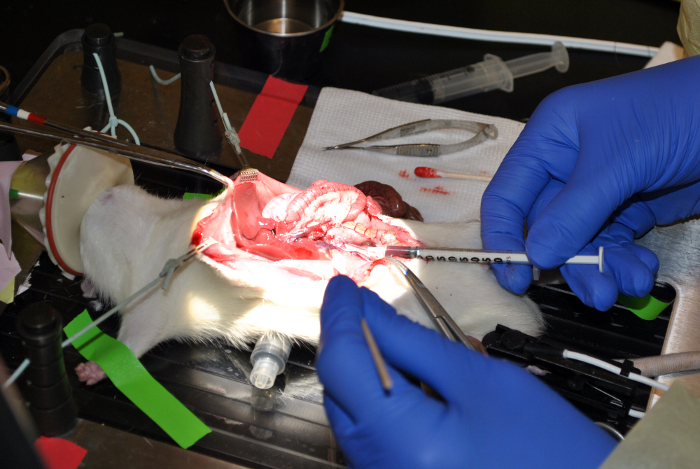
Figura 9: extraer la sangre de la Vena Cava inferior. Esta figura demuestra la extracción de sangre de la vena cava inferior. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: rama venosa ligan y retraída. Esta figura demuestra rama venosa ligan y se retrae. ecsource.jove.com/files/ftp_upload/54729/54729fig10large.jpg" target = '_ blank'> Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Proceso de canulación. Esta figura demuestra el proceso de la canulación. Haga clic aquí para ver una versión más grande de esta figura.
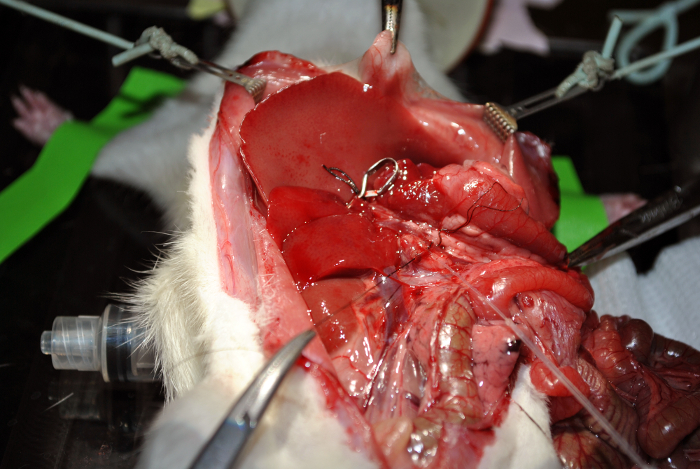
Figura 12: La canulación. Esta cifra demuestra la canulación. Haga clic aquí para ver una versión más grande de esta figura.
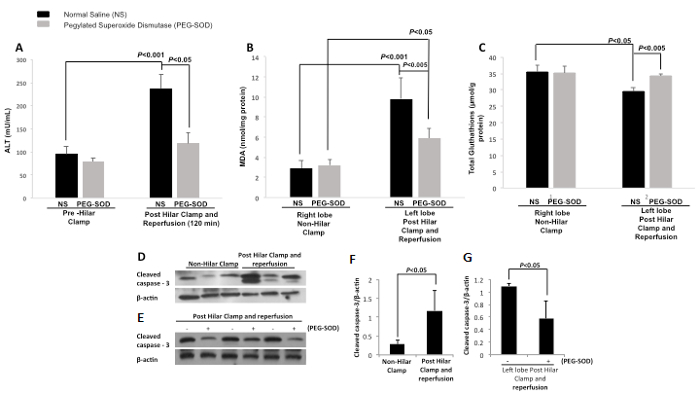
Figura 13: Los resultados representativos: Directo segmentaria intrahepática Entrega de pegilado-superóxido dismutasa con una abrazadera de modelo de rata hiliar. NS = solución salina normal. PEG-SOD = pegilado-superóxido dismutasa, ALT = alanina aminotransferasa, MDA = malondialdehído. A. Suero Alanina aminotransferasa (ALT, mU / mL) en comparación entre la pinza pre-hiliar y 120 minutos después de la reperfusión. Hay una diferencia significativa entre el control (NS) de sujeción pre-hiliar y control (NS) en 120-min post-reperfusión (p <0,001). También hay una diferencia significativa entre el control (NS) y los grupos experimentales (PEG-SOD) en post-reperfusión de 120 min (p <0,05). Se utilizó la prueba T de Student. Las barras de error representan la desviación estándar. B. malondialdehído Tissue en lóbulo derecho (pinza no hiliar) con inyección de control un (NS)d inyección experimental (PEG-SOD) demostrar ninguna diferencia significativa. lóbulo izquierdo (pinza post-hiliar y reperfusión) malondialdehído tejido con la inyección de control (NS) es significativamente diferente de lóbulo derecho (pinza no hiliar) p <0,001. lóbulo izquierdo (pinza post-hiliar y reperfusión) tiene significativamente diferentes niveles de malonaldehído tejido con la inyección de control (NS) versus inyección experimental (PEG-SOD) p <0,005. Se utilizó la prueba T de Student. Las barras de error representan la desviación estándar. C. glutatión tisular en lóbulo derecho (pinza no hiliar) con inyección de control (NS) y la inyección experimental (PEG-SOD) demostrar ninguna diferencia significativa. lóbulo izquierdo (pinza post-hiliar y reperfusión) glutatión tejido con la inyección de control (NS) es significativamente diferente de lóbulo derecho (pinza no hiliar) con inyección de control (NS) p <0,05. lóbulo izquierdo (pinza post-hiliar y reperfusión) tiene significativamente diferentes niveles de glutatión tejido con injectio de controln (NS) versus inyección experimental (PEG-SOD) p <0,005. Se utilizó la prueba T de Student. Las barras de error representan la desviación estándar. D. transferencia Western que demuestra aumentó exfoliados caspasa-3 en el tejido hepático del lóbulo izquierdo (pinza post-hiliar y reperfusión) versus el lóbulo derecho (pinza no hiliar) de los animales de control (solución salina normal). E. Western blot que demuestra disminuyó exfoliados caspasa-3 en el tejido hepático de los animales tratados con PEG-SOD en comparación con los animales tratados con control (solución salina normal). F. Nivel de la caspasa-3 escinde en el tejido hepático es significativamente mayor en la abrazadera y de reperfusión los animales post-hiliares (p <0,05). Se utilizó la prueba T de Student. Las barras de error representan la desviación estándar. G. En la comparación de tejido izquierda hígado lóbulo de animales de experimentación (infundido con PEG-SOD) y se dejó tejido hepático lóbulo de animales de control (infundido con solución salina normal), no se reduce significativamente exfoliados caspasa-3 en unaanimalesque tratados con PEG-SOD en comparación con los animales tratados con control (solución salina normal). Se utilizó la prueba T de Student. Las barras de error representan la desviación estándar.
Discusión
Esta serie de experimentos demostró que la inyección de PEG-SOD en la izquierda y los lóbulos mediana conducido a disminuciones significativas en la liberación de ALT, la peroxidación lipídica de las membranas celulares (MDA), y el mantenimiento de glutatión (GSH) en comparación con los controles (solución salina normal ). transaminasas tejido del hígado incluyendo Alanina aminotransferasa (ALT) son marcadores de lesión hepatocelular establecidos. La disminución de ALT cuando el lóbulo izquierdo se inyecta con PEG-SOD sugiere un efecto protector de PEG-SOD. El aumento de tejido MDA indica aumento de la peroxidación de lípidos y se considera un marcador de estrés oxidativo y lesión tisular. La sobreproducción de especies reactivas de oxígeno provoca un aumento en la producción de MDA 26. La reducción significativa en el tejido MDA en los lóbulos izquierdo y la mediana del animal cuando se inyecta con PEG-SOD demuestra un efecto protector de PEG-SOD. Esto es consistente con el conocimiento actual que PEG-SOD protege las células del dañocausada por parcialmente reducidos especies reactivas de oxígeno 27. Adicionalmente, en la presencia de especies reactivas de oxígeno, disulfuro de glutatión se reduce a glutatión (GSH) 28. El mantenimiento en GSH en los lóbulos izquierdo y la mediana del hígado inyectado con PEG-SOD refuerza aún más el efecto protector de PEG-SOD. Además se demuestra que hay un aumento de exfoliados caspasa-3, un producto de la apoptosis, en el tejido expuesto a la lesión por isquemia-reperfusión. La disminución de la caspasa-3 escinde en el lóbulo izquierdo cuando son tratados con PEG-SOD sugiere que PEG-SOD conduce a una disminución en la apoptosis.
La superóxido dismutasa (SOD) es una enzima crítica en la desintoxicación de especies reactivas del oxígeno. La enzima cataliza la conversión de dos aniones superóxido en peróxido de hidrógeno y agua. La enzima catalasa luego convierte peróxido de hidrógeno en agua y oxígeno, completando el proceso 25. La vida media deSOD nativa limitado su uso en modelos experimentales hasta el desarrollo de polietileno superóxido conjugado glicol-dismutasa (PEG-SOD). Conjugación de SOD a polietilenglicol aumenta su vida media de 6 min a 14 h. Nguyen et al. demostrado su capacidad para mitigar la peroxidación de lípidos en la isquemia hepática en un modelo de rata, usando administración sistémica 29.
Hay una variedad de posibles modificaciones de la técnica se detallan aquí y algunos se han descrito previamente en la literatura. Dependiendo de las moléculas modelo utilizado han sido entregados usar la inhalación de 11, la infusión epidural 12, la inyección intraperitoneal 17, 18, 21, 22, la administración intravenosa 10, 14, 15 , 19, 23, 24 o inyección en la vena mesentérica superior periférica 8.
Hay varios pasos críticos en este protocolo. El más importante es la canulación de la vena porta. Se debe tener cuidado de que el agujero cortado en la vena no es demasiado grande. El tejido es muy elástica y el agujero se agrandará por su propia cuenta. Se recomienda comenzar cortando un agujero que es de 0,5 mm con las tijeras de microcirugía. La cánula puede ser alimentado a través del orificio utilizando un instrumento, que permite una mayor agilidad que si intentar realizar esta parte del procedimiento mediante la mano. Además, aunque inicialmente la alimentación de la cánula, debe ser dirigida directamente hacia la bifurcación de las venas porta izquierda y derecha para evitar hacer un agujero a través de la pared posterior de la vena. Cuando la punta de la cánula llega a la bifurcación, puede entonces ser alimentada en la vena izquierda específicaaliado. Una vez que la cánula se introduce en la vena porta izquierda, que abastece tanto a la izquierda y la mediana de lóbulos, su posición se puede confirmar manualmente por sentirlo dentro de la vena. Su posición también puede ser confirmada mediante la inyección de una pequeña cantidad de solución salina fría y ver el efecto de blanqueado en los segmentos suministrados del hígado.
El modelo de abrazadera hiliar hígado en la rata proporciona una plataforma reproducible y estable para la demostración de la lesión isquémica-reperfusión hepática. Modelos de abrazadera hiliares variables se han utilizado por los investigadores para estudiar los efectos protectores de anti-oxidantes y otras moléculas pequeñas 6, 7, 8, 9, 10, 11, 12, 13, 14. Puntos de variación incluyen la que los vasos son abrazadera ed, que segmentos se efectúan isquémico, sea o no el conducto biliar está incluido y la longitud del periodo de reperfusión 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21. Además, cuando este modelo se utiliza para estudiar el impacto de la administración de una molécula de la ruta de administración también es heterogénea 8, 10, 11,"> 12, 14, 15, 17, 18, 19, 21, 22, 23, 24. Hay varias ventajas para el enfoque descrito. En primer lugar, la canulación directa del suministro de portal al segmento isquémico permite segmental entrega hepática directa de la sustancia farmacológica en estudio. Esto permite la utilización de los otros lóbulos de los hígados como un control interno. en segundo lugar, la canulación hepática segmentaria permite un volumen reducido de distribución de la molécula en estudio. Este enfoque reduce así el riesgo de efectos secundarios sistémicos como la sustancia se inyecta directamente en el segmento de hígado de interés. canulación directa del segmento hepática permite la sustancia a suministrar pre-isquemia, Intra-isquemia o post-isquemia. Esto permite que para el estudio del efecto de la molécula en cualquier punto en el ciclo de la lesión por isquemia-reperfusión. Con el aumento de la longitud de tiempo de isquemia y el aumento de nivel de la lesión oportunidad adicional para estudiar la regeneración del hígado estaría disponible.
También hay algunas limitaciones de este enfoque. El primero es el costo de puesta en marcha. La compra de un microscopio quirúrgico podría ser un costo significativo de puesta en marcha de un laboratorio que no posea ya una. Esta técnica puede ser difícil o imposible sin un microscopio. El segundo tiempo está aprendiendo curva. Aunque este procedimiento es relativamente simple que requiere un poco de práctica y es probable que un novato requerirá un número significativo de procedimientos para convertirse en un experto.
En resumen, este modelo permite una plataforma reproducible, sencillo y rentable para estudiar la lesión por isquemia-reperfusión hepática. Aunque en el protocolo descrito aquí gl polietilenosuperóxido ycol-dismutasa, un eliminador de radicales libres 25, se infundió, este modelo podría ser utilizado para infundir una variedad de diferentes sustancias farmacológicas con el fin de evaluar su impacto en I / R lesión en el hígado.
Divulgaciones
Todos los autores informan que no tener ningún conflicto.
Agradecimientos
Nos gustaría reconocer Dennis Mathias por su trabajo ilustrativo. Este trabajo fue apoyado por el NIH T32AI 106704-01A1 y el Fondo T. Flesch para el trasplante de órganos, la perfusión, Ingeniería y Regeneración de la Universidad Estatal de Ohio.
Materiales
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley Rat | Harlan Sprague Dawley Inc. | 200- 250 grams | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Charcoal Canisters | Kent Scientific | SOMNO-2001-8 | |
| Isoflurane Molecular Weight 184.5 | Piramal Healthcare | ||
| Pressure-Lok Precision Analytical Syringe | Valco Instruments Co, Inc. | SOMNO-10ML | |
| Electrosurgical Unit | Macan | MV-7A | |
| Warming Pad | Braintree Scientific | HHP2 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Isoflurane chamber | Kent Scientific | SOMNO-0530LG | |
| SurgiVet | Isotec | CDS 9000 Tabletop | |
| Oxygen | Praxair | 98015 | |
| 27-0 Micro-Cannula | Braintree Scientific | MC-28 | |
| Rib retractors | Kent Scientific | INS600240 | |
| Polyethylene Glycol - Superoxide Dismutase (PEG-SOD) | Sigma Aldrich | S9549 SIGMA | |
| GenieTouch | Kent Scientific | ||
| Normal Saline | Baxter | NDC 0338-0048-04 | |
| 4 x 4 Non-Woven Sponges | Criterion | 104-2411 | |
| Sterile Q-Tips | Henry Schein Animal Health | 1009175 | |
| U-100 27 Gauge Insulin Syringe | Terumo | 22-272328 | |
| 5 mL Syringe | BD | REF 309603 | |
| 4-0 Braided Silk Suture | Deknatel, Inc. | 198737LP | |
| 7-0 Braided Silk Suture | Teleflex Medical | REF 103-S | |
| 1.8 mL Arcticle Cryogenic Tube | USA Scientific | 1418-7410 | |
| Microsurgical Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Scissors | Roboz | RS-5610 | |
| Large Scissors | S&T | SAA-15 | |
| Forceps - Large Angled | S&T | JFCL-7 | |
| Forceps - Small Angled | S&T | FRAS-15 RM-8 | |
| Clip Applier | ROBOZ | RS-5440 | |
| Scissors - non micro | FST 14958-11 | 14958-11 | |
| Forceps - Straight Tip | S&T | FRS-15 RM8TC | |
| Large Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-02 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-03 | |
| Other Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Mosquito Clamps | Generic | ||
| Analysis | |||
| Name | Company | Catalog Number | Comments |
| Alannine aminotransferase (ALT) assay | Biovision | K752-100 | |
| Malondialdehye (MDA) assay | Abcam | ab118970 | |
| Glutathione (GSH) assay | Cayman Chemical | 7030002 | |
| Antibodies - Cleaved Caspase-3 and Actin | Cell Signaling Tecnology | Antibody 9661 | |
| ImageJ Software | National Institutes of Health | ||
| RIPA Lysis and Extraction Buffer | Millipore | 10-188 |
Referencias
- Serracino-Inglott, F., Habib, N. A., Mathie, R. T. Hepatic ischemia-reperfusion injury. Am J Surg. 181, 160-166 (2001).
- Fondevila, C., Busuttil, R. W., Kupiec-Weglinski, J. W. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 74, 86-93 (2003).
- Kupiec-Weglinski, J. W., Busuttil, R. W. Ischemia and reperfusion injury in liver transplantation. Transplant Proc. 37, 1653-1656 (2005).
- OPTN. . Overall by Organ. Current US Waiting List. , (2016).
- OPTN. . Transplants in the US by Recipient ABO. , (2016).
- Tacchini, L., Radice, L., Pogliaghi, G., Bernelli-Zazzera, A. Differential activation of heat shock and nuclear factor kappaB transcription factors in postischemic reperfused rat liver. Hepatology. 26, 186-191 (1997).
- Palladini, G., et al. Lobe-specific heterogeneity and matrix metalloproteinase activation after ischemia/reperfusion injury in rat livers. Toxicol Pathol. 40, 722-730 (2012).
- Nakano, H., Kuzume, M., Namatame, K., Yamaguchi, M., Kumada, K. Efficacy of intraportal injection of anti-ICAM-1 monoclonal antibody against liver cell injury following warm ischemia in the rat. Am J Surg. 170, 64-66 (1995).
- Centurion, S. A., et al. Effects of ischemic liver preconditioning on hepatic ischemia/reperfusion injury in the rat. Transplant Proc. 39, 361-364 (2007).
- Kobayashi, H., et al. Role of endogenous nitric oxide in ischemia-reperfusion injury in rat liver. J Surg Res. 59, 772-779 (1995).
- Strifler, G., et al. Inhaled Methane Limits the Mitochondrial Electron Transport Chain Dysfunction during Experimental Liver Ischemia-Reperfusion Injury. PLoS One. 11, e0146363 (2016).
- Sarikus, Z., Bedirli, N., Yilmaz, G., Bagriacik, U., Bozkirli, F. The effects of epidural bupivacaine on ischemia/reperfusion-induced liver injury. Bratisl Lek Listy. 117, 41-46 (2016).
- Guimarães Filho, A. M., et al. Effect of remote ischemic preconditioning in the expression of IL-6 and IL-10 in a rat model of liver ischemia-reperfusion injury. Acta Cir Bras. 30, 452-460 (2015).
- Liu, Q. S., et al. Erythropoietin pretreatment exerts anti-inflammatory effects in hepatic ischemia/reperfusion-injured rats via suppression of the TLR2/NF-κB pathway. Transplant Proc. 47, 283-289 (2015).
- Montero, E. F., Quireze, C., d'Oliveira, D. M. Bile duct exclusion from selective vascular inflow occlusion in rat liver: role of ischemic preconditioning and N-acetylcysteine on hepatic reperfusion injury. Transplant Proc. 37, 425-427 (2005).
- Tártaro, R. D., et al. No protective function found in Wistar rats submitted to long ischemia time and reperfusion after intermittent clamping of the total hepatic pedicle. Transplant Proc. 47, 1038-1041 (2015).
- Yeh, D. Y., Yang, Y. C., Wang, J. J. Hepatic Warm Ischemia-Reperfusion-Induced Increase in Pulmonary Capillary Filtration Is Ameliorated by Administration of a Multidrug Resistance-Associated Protein 1 Inhibitor and Leukotriene D4 Antagonist (MK-571) Through Reducing Neutrophil Infiltration and Pulmonary Inflammation and Oxidative Stress in Rats. Transplant Proc. 47, 1087-1091 (2015).
- Kilicoglu, B., et al. Ultrastructural view of a promising anti TNF-α agent on hepatic ischaemia reperfusion injury. Bratisl Lek Listy. , 601-607 (2015).
- Jiménez Pérez, J. C., et al. Spironolactone Effect in Hepatic Ischemia/Reperfusion Injury in Wistar Rats. Oxid Med Cell Longev. , 3196431 (2016).
- Sano, N., et al. New drug delivery system for liver sinusoidal endothelial cells for ischemia-reperfusion injury. World J Gastroenterol. 21, 12778-12786 (2015).
- Chang, Y. K., Huang, S. C., Kao, M. C., Huang, C. J. Cepharanthine alleviates liver injury in a rodent model of limb ischemia-reperfusion. Acta Anaesthesiol Taiwan. , (2015).
- Lucas, M. L., Rhoden, C. R., Rhoden, E. L., Zettler, C. G., Mattos, A. A. Effects of L-arginine and L-NAME on ischemia-reperfusion in rat liver. Acta Cir Bras. 30, 345-352 (2015).
- Yeh, D. Y., Tung, S. P., Fu, Y. H., Yang, Y. C., Wang, J. J. Intravenous superoxide dismutase administration reduces contralateral lung injury induced by unilateral lung ischemia and reperfusion in rats through suppression of activity and protein expression of matrix metalloproteases. Transplant Proc. 47, 1083-1086 (2015).
- Yusen, R. D., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report-2015; Focus Theme: Early Graft Failure. J Heart Lung Transplant. 34, 1264-1277 (2015).
- Held, P. . An Introduction to Reactive Oxygen Species: Measurement of ROS in Cells. , 1-14 (2012).
- Gaweł, S., Wardas, M., Niedworok, E., Wardas, P. Malondialdehyde (MDA) as a lipid peroxidation marker. Wiad Lek. 57, 453-455 (2004).
- Beckman, J. S., et al. Superoxide dismutase and catalase conjugated to polyethylene glycol increases endothelial enzyme activity and oxidant resistance. J Biol Chem. 263, 6884-6892 (1988).
- Carlberg, I., Mannervik, B. Glutathione reductase. Methods Enzymol. 113, 484-490 (1985).
- Nguyen, W. D., Kim, D. H., Alam, H. B., Provido, H. S., Kirkpatrick, J. R. Polyethylene glycol-superoxide dismutase inhibits lipid peroxidation in hepatic ischemia/reperfusion injury. Crit Care. 3, 127-130 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados