Method Article
Méthode de Direct segmentaire livraison intra-hépatique L'utilisation d'un modèle hilaire de foie de rat Clamp
Dans cet article
Résumé
Un modèle de pince hilaire de foie de rat unique a été développé pour étudier l'impact des molécules pharmacologiques dans l'amélioration ischémie-reperfusion. Ce modèle comprend la canulation directe de la fourniture de portail au segment hépatique ischémique via une branche de la veine porte, permettant une livraison directe hépatique.
Résumé
Major chirurgie hépatique avec occlusion d'entrée et une transplantation hépatique, nécessite une période d'ischémie chaude, et une période de reperfusion conduisant à une ischémie / reperfusion (I / R) des blessures avec des conséquences négatives multiples. Potentiel blessure I / R dans les organes marginaux destinés à la transplantation du foie contribue à la pénurie de donneurs courant secondaire à un taux d'utilisation d'organes a diminué. Un besoin important existe pour explorer des blessures I / R hépatique afin de médier son impact sur la fonction du greffon dans la transplantation. foie de rat modèles de serrage hile sont utilisés pour étudier l'impact des différentes molécules sur les blessures I / R hépatique. Selon le modèle, ces molécules ont été livrées en utilisant l'inhalation, la perfusion péridurale, injection intra-péritonéale, l'administration ou l'injection intraveineuse dans la veine mésentérique supérieure périphérique. Un foie de rat modèle de pince hilaire a été développé pour être utilisé dans l'étude de l'impact des molécules pharmacologiques dans l'amélioration des blessures I / R. le described modèle de pince hilaire de foie de rat comprend canulation directe de la fourniture de portail au segment hépatique ischémique par l'intermédiaire d'une branche latérale de la veine porte, permettant une livraison hépatique segmentaire direct. Notre approche est d'induire une ischémie dans les lobes latéraux et médians gauche pendant 60 minutes, au cours de laquelle la substance à l'étude est infusé. Dans ce cas, pégylée-superoxyde dismutase (SOD PEG-), un capteur de radicaux libres, est perfusée directement dans le segment ischémique. Cette série d'expériences démontre que la perfusion de PEG-SOD est de protection contre les blessures I / R hépatique. Les avantages de cette approche comprennent l'injection directe de la molécule dans le segment ischémique avec une diminution conséquente du volume de distribution et à la réduction des effets secondaires systémiques.
Introduction
Major chirurgie hépatique avec occlusion d'entrée et une transplantation hépatique, nécessite une période d'ischémie chaude, et une période de reperfusion conduisant à une ischémie / reperfusion (I / R) 1 blessure. Les conséquences de blessures I / R dans le foie ont été détaillées largement 1, 2, 3. Les conséquences de I / blessure R détaillée dans la littérature comprennent: la génération d'espèces réactives de l'oxygène, l'initiation de la cascade inflammatoire, y compris l'activation des neutrophiles, des cellules de Kupffer et les cellules endotheliales, l'activation du système d'hème oxygénase et de l'activation des récepteurs de type Toll, un déséquilibre entre l' endothéline et de l' oxyde nitrique, l' activation du facteur nucléaire-kB, et la promotion des cytokines pro - inflammatoires et des molécules d'adhésion synthèse 1, 2, 3. Ces événements peuvent l proinflammatoiresead à l' apoptose, la nécrose, la dysfonction d'organes et de défaillance d' un organe éventuel 3.
I / R blessures dans les organes destinés à une transplantation hépatique peut conduire à la perte précoce de la greffe et contribue à la pénurie actuelle des donateurs comme des organes marginaux sont plus sensibles aux blessures 3. Il y a actuellement 15,226 bénéficiaires potentiels sur la liste d' attente pour une transplantation du foie aux États-Unis 4 et seulement 5950 transplantations hépatiques ont été réalisées en 2015 5. En raison de cette limitation extrême disponibilité des organes, la recherche exploration des blessures I / R hépatique est nécessaire afin d'optimiser la fonction du greffon et de l'utilisation d'organes.
Les modèles animaux utilisés pour étudier les blessures I / R hépatique comprennent des modèles de serrage de rat hilaire et modèles de transplantation de foie de rat. Il existe une variété de modèles de serrage de hile de rat actuellement en cours d'utilisation. Le plus courant est celui dans lequel la veine porte, l'artère hépatique et biliaire duct à fournir les lobes latéraux et médians de gauche sont serrées au moyen de clips de microchirurgie 6, 7, 8, 9, 10, 11, 12 pendant 30 à 60 min 6, 7, 10, 13, 14, puis une période de reperfusion de 60 min à 24 h 7, 9, 10, 13, 14 est autorisé. Les lobes latéraux et médian gauche du foie de rat représentent environ 70% du parenchyme hépatique 9. Certains protocoles destinés à l'étude préconditionnement ischémique comprennent serrage intermittente des vaisseaux hilairesou le membre postérieur avant une période d'ischémie induite par serrage plus les vaisseaux hilaires 9, 13. Il y a aussi plusieurs modifications décrites dans la littérature. La première consiste à serrer la veine porte et l' artère hépatique fournir les lobes latéraux et médian gauche, mais exclure la voie biliaire 15. Une deuxième modification est d'induire une ischémie hépatique totale par serrage de la veine porte, l' artère hépatique et des voies biliaires avant leur division 16, 17, 18, 19, 20. Une troisième modification comprend le serrage des pédicule au lobe droit pendant 30 à 60 min 8. Une modification supplémentaire consiste à serrer le faisceau vasculaire dans une patte postérieure afin d'induire une lésion du foie 13, 21 . Diverses approches de la procédure de serrage hilaire sont illustrés sur la figure 1A-D.
foie de rat modèles de serrage hile ont été utilisées pour étudier l'impact des molécules et des composés différents sur I / R hépatique. Selon le modèle utilisé ces molécules ont été livrés à l' aide inhalation 11, infusion péridurale 12, injection intraperitoneale 17, 18, 21, 22, l' administration intraveineuse de 10, 14, 15, 19, 23, 24 ou par injection dans la veine périphérique mésentérique supérieure 8 .
Le modèle de pince hilaire de foie de rat décrit dans ce rapport includes canulation directe de la fourniture de portail au segment ischémique par l' intermédiaire d' une branche latérale de la veine porte (figure 2), ce qui permet une livraison hépatique segmentaire directe de la substance pharmacologique à l'étude. Notre approche est d'induire une ischémie dans les lobes latéraux et médians gauche pendant 60 min, temps pendant lequel une infusion de la substance à l'étude, dans ce cas, dismutase pégylée-dismutase, un piégeur de radicaux libres 25, est perfusée directement dans le segment ischémique . Des échantillons de sang sont prélevés avant l'induction de l'ischémie et à 120 min après la reperfusion. A ce stade, le rat est sacrifié et des échantillons sont prélevés à partir des lobes gauche et médiane. En outre, des échantillons sont prélevés à partir du lobe droit de servir de contrôle interne.
Il existe de nombreux avantages à cette approche. Tout d'abord, quand on peut injecter directement la substance pharmacologique à l'étude dans le segment ischémique o le volumeRépartition de f est très faible en comparaison avec le volume de distribution de l'injection dans la circulation systémique ou la cavité péritonéale. De plus, cette approche réduit, mais ne supprime pas la possibilité d'effets secondaires systémiques.
Protocole
Toutes les procédures ont été effectuées conformément aux directives du Institutional Animal Care et le Guide du Conseil national de recherches pour l'humanisation des soins et l'utilisation des animaux de laboratoire (IACUC) et a fait l'objet d'approbation par le comité Ohio State University IACUC.
1. Mise en place initiale
- Mise en place du microscope chirurgical et de la salle d'opération (figure 3, figure 4). Allumez tous les équipements y compris pour le maintien de l'anesthésie et la surveillance des signes vitaux. Allumez l'appareil et électrochirurgie pad réchauffement. Placez la pompe à perfusion près de la table d'opération.
- Dresser 10 ml d'isoflurane liquide pour inhalation (poids moléculaire 184,5) dans la seringue d'anesthésie et le placer dans l'unité d'anesthésie.
- Mise en place d'un récipient de 200 ml d'azote liquide à proximité de la table d'opération et un autre près de la centrifugeuse où des échantillons de sang seront traités.
- Position les instruments chirurgicaux, 4-0 et 7-0 suture en soie tressé, des tampons de coton stérile, 4x4 éponges non-tissés, des seringues de 5 ml, et 27 seringues à insuline de calibre à proximité de la table d'opération.
- Préparer la chambre isoflurane et veiller à ce que l'isoflurane suffisante est instillé dans le système de distribution de l'induction de l'anesthésie.
2. L'induction de l'anesthésie
- Avant de manipuler le rat mis sur l'équipement de protection individuelle (EPI) suivant: masque chirurgical, gants chirurgicaux et blouse à usage unique.
- Peser le rat et enregistrer le poids.
REMARQUE: Des rats Sprague Dawley doivent être utilisés. - Placez le rat dans la chambre d'anesthésie et allumez l'isoflurane et l'oxygène. Induire une anesthésie à l'aide de la chambre isoflurane.
- Pincer les cheveux abdominale de l'animal à l' aide d' une tondeuse à cheveux électrique pour permettre une exposition plus propre (Figure 5).
- Placez le dos des animaux dans la chambre isoflurane pour un supplénal une minute. Effectuer une pincée de pointe afin de vérifier la profondeur de l'anesthésie.
3. procédure
- Positionner le rat avec le nez de l'animal dans le cône de nez et les quatre extrémités immobilisées avec des dispositifs de retenue ou de ruban adhésif sur le coussin chauffant.
- Continuer l'anesthésie en utilisant le système de délivrance d'anesthésie, cône de nez et de l'isoflurane avec une anesthésie à 3,6% pour les animaux d'un poids compris entre 200 et 250 g et 4% pour les animaux d'un poids supérieur à 250 g. Confirmer la profondeur de l'anesthésie en effectuant une pincée d'orteil et une pincée de peau.
- Faire une incision abdominale médiane du pubis à xiphoïde à travers la peau en utilisant des ciseaux tranchants (figure 6).
- Faire une incision dans le péritoine le long de la linea alba de pubienne à Xiphoid et pénétrer dans l'abdomen en prenant soin de ne pas endommager la vessie ou de l'intestin. Comme le foie colle également au péritoine en avant à proximité de la pointe du sternum, en sorte qu'il libère avant l'incision de la paroi abdominale dans cette arch.
- Faire une incision transversale à travers la peau et le péritoine au niveau de la frontière inférieure du lobe droit du foie.
- Mettez l'anesthésie à 1,6% pour les animaux d'un poids compris entre 200 et 250 g et 2% pour les animaux d'un poids supérieur à 250 g.
- Rétracter la pointe du sternum au moyen d'un collier de moustique courbe.
- Placer nervure écarteurs tirant les nervures aussi loin que possible de la ligne médiane (figure 7). Couper le falciforme, phrénique et ligaments gastriques. Retournez le foie à l'aide de cotons-tiges stériles humidifiées.
- Couper les ligaments supplémentaires si nécessaire pour accéder à la porte. Effectuer une rotation viscérale avec de la gaze humecté d' une solution saline (figure 7).
- Retirez le tissu conjonctif lâche recouvrant le hile portail à l'aide bistouri ou émoussée. Retirez le tissu conjonctif lâche recouvrant la longueur de la veine porte.
- Utilisez une pince pour pousser à travers le conjonctif lâche tquestion postérieure à la veine porte gauche, artère et conduit la bile faisant une fenêtre et placez 4-0 suture Potts , mais ne pas cinch vers le bas (figure 8).
- Dégagez le tissu conjonctif lâche recouvrant la branche postérieure à la veine porte qui arrive à peu près au niveau du rein droit. Cette veine sera utilisée pour canulation.
- Dessiner 0,5 ml de sang de la veine cave inférieure (VCI) avec une seringue d'insuline (figure 9). Placer les 0,5 ml de sang dans un petit flacon, centrifuger à 135 g pendant 12 min. Tenter de prélever du sérum.
- Si une ligne distincte ne peut pas être appréciée entre les globules rouges et du sérum, essayer de centrifuger pendant encore 2 - 3 min à 135 x g. Prélever le sérum et le placer dans un flacon pour l'alanine-aminotransférase (ALT). geler encliquetage cet échantillon en le plaçant directement dans l'azote liquide.
- Coupez deux morceaux de 7-0 suture et lieu près de la veine qui seront utilisés pour la canuletion. Placez la première boucle 7-0 autour de cette veine jusqu'à médial que possible. Attachez cette boucle et l' utiliser pour se rétracter à l' aide d' une pince de moustique courbe (figure 10). Placez une deuxième boucle 7-0 sur la veine qui sera utilisée pour canulation près de son intersection avec la veine porte et placez un lien, mais ne pas cinch vers le bas.
- Préparer la pompe de perfusion avec une seringue de 5 ml avec 3 ml de réactif. Amorcer le tube.
- Pince veine porte distale à l'aide d'une pince microchirurgicale.
NOTE: Cela permettra de réduire les saignements lorsque la veine est incisé pour canulation. - Coupez un trou de 0,5 mm dans la veine entre la suture séjour et 7-0 son intersection avec la veine porte à l'aide de petits ciseaux de microchirurgie. Utilisation cathéter 27-0 à cathétériser la veine porte gauche (Figure 11, Figure 12). Insérez le cathéter après la bifurcation des veines portail gauche et à droite.
- Vérifiez le positionnement de la canule par infusing 1 ml de solution saline normale et surveiller les lobes médians et latéraux gauche du foie à blanchir. confirmer manuellement que le cathéter est passé le décollage de la veine porte droite, mais pas au-delà du décollage de la veine porte alimentant le lobe médian.
- Cinch sur la suture Potts et commencer à temps d'ischémie. Serrer 7-0 suture autour veine et cathéter 27-0 pour le maintenir en place et retirer la pince de la veine porte distale.
- Commencer l'injection de polyéthylène glycol-superoxyde dismutase (SOD PEG-, 0,00067 g / ml) en utilisant la pompe à perfusion. Démarrez la perfusion le plus près possible du début du temps ischémique.
4. Suivi
- Continuer à surveiller les signes vitaux tout au long de la perfusion de l'animal. L'administration de 2 ml de 0,9% de solution saline normale ou de 2 ml de PEG-SOD (0,00067 g / ml) dissous dans une solution saline normale à 0,9% sur une période de 15 min.
5. revascularisation
- Prévoyez une heure pour passer du début de l'itemps schemic. Ceci est 1 h de temps d'ischémie chaude.
- Retirez la suture Potts. Retirer le cathéter 27-0. Cinch sur la suture 7-0 autour de la veine. Notez le temps. Cela marque le moment de la reperfusion.
6. L'échantillonnage Suite
- Dessiner 0,5 ml de sang de la veine cave inférieure à 120 min après la reperfusion. Dessiner le sang lentement pour éviter la lyse des globules rouges. goutte à goutte lentement le sang dans un flacon. Assurez-vous que le saignement de la veine cave inférieure est contrôlé après chaque prélèvement de sang.
- Si on continue à saigner appliquer une légère pression avec un coton-tige stérile ou un petit 1 cm par 1 cm section coupe de la gaze.
- Centrifuger à 135 g pendant 12 min. Si une séparation suffisante est pas atteint, essayer un supplément de 2 - 3 min à 135 x g.
- Placez la moitié du sérum dans un flacon pour un traitement ultérieur pour ALT. Snap geler ces spécimens.
7. euthanasie
- Bien que le rat est encore sous anesthésie coupe la veine cave inférieure et superior veine cave (SVC) et de surveiller jusqu'à ce que la circulation sanguine, la respiration et cessez de battement de coeur.
- Inciser la membrane et effectuer une brève hépatectomie en incisant la membrane dans un cercle et inciser le tissu conjonctif supplémentaire qui reste reliant le foie à la cavité péritonéale. Retirer le foie de la cavité peritoneale.
- Prenez quatre échantillons des lobes gauche et médiane du foie et quatre échantillons du lobe droit du foie. Les échantillons doivent être aussi grand que possible et leur taille ne sera limitée que par la quantité de tissu hépatique disponible. Placez-les dans de petits flacons étiquetés, et enclenchez gel dans l'azote liquide. Utilisez-les pour un traitement ultérieur pour l'adénosine triphosphate tissulaire (ADP), malondialdéhyde (MDA) et le glutathion (GSH).
8. Analyse post-expérience
- Déterminer le glutathion (GSH), le malondialdéhyde (MDA) et de l'alanine aminotransférase activités (ALT) dans le tissu du foie et des échantillons de sérum en utilisant des kits de diagnosticselon les instructions du fabricant.
- Homogénéiser le tissu hépatique avec du tampon de lyse et de quantifier en utilisant un dosage de Bradford. Analyse lysat de tissu par électrophorèse sur gel de polyacrylamide-dodécylsulfate de sodium et immunoblot en utilisant des anticorps contre Capase-3 et de l'actine clivée. Quantifier Western blots réalisée avec le logiciel public.
Résultats
Cette expérience a été réalisée avec 2 groupes de n = 3 rats chacun. Trois foies de rats ont reçu une injection avec 2 ml de solution saline normale (NS) avec la pompe de perfusion sur une période de 15 min. Trois foies de rats ont reçu une injection avec 2 ml de solution saline normale (NS) mélangé avec pégylé-superoxyde dismutase (SOD PEG-, 0,00067 g / ml) avec la pompe de perfusion sur une période de 15 min. Comme décrit dans le protocole ci-dessus, des échantillons de sang ont été prélevés pince de pré-hilaire et au post-reperfusion de 120 min. En outre, après achèvement de 120 min de reperfusion quatre échantillons de tissus du foie ont été prélevés sur les lobes gauche et médiane et quatre échantillons de foie ont été prélevés dans le lobe droit du foie de rat.
Sérum alanine aminotransférase (ALT) a été mesurée pince de pré-hilaire et au post-reperfusion de 120 min dans la commande (NS) et les animaux expérimentaux (PEG-SOD). Il y avait une différence significative entre le niveau d'ALT de contrôle (NS)animaux de serrage pré-hilaire et au post-reperfusion 120 min. Il y avait une différence significative entre le niveau de contrôle ALT (NS) et les animaux de laboratoire (PEG-SOD) à 120 min (Figure 13). malonaldéhyde tissulaire (MDA) a été mesurée pour la commande (NS) et les animaux expérimentaux (PEG-SOD) dans les deux lobes droit et gauche du foie. Tissue MDA dans le lobe droit (pince non-hilaire) avec injection de commande (NS) et l'injection expérimentale (PEG-SOD) montrent pas de différence significative. lobe gauche (pince post-hilaire et reperfusion) MDA tissu avec injection de commande (NS) est significativement différent de celui du lobe droit (pince non-hilaire) p <0,001. Lobe gauche (pince post-hilaire et reperfusion) a significativement différents niveaux de MDA tissu avec injection de commande (NS) par rapport à l' injection expérimentale (PEG-SOD) p <0,005 (Figure 13B). glutathion tissulaire (GSH) a été mesurée et le glutathion tissulaire dans le lobe droit (pince non-hilaire) avec injection de commande (NS) unnd injection expérimentale (PEG-SOD) démontrent aucune différence significative. lobe gauche (pince post-hilaire et reperfusion) GSH tissu avec injection de commande (NS) est significativement différent de celui du lobe droit (pince non-hilaire) avec injection de commande (NS) p <0,05. Lobe gauche (pince post-hilaire et reperfusion) a significativement différents niveaux de glutathion tissulaire avec injection de commande (NS) par rapport à l' injection expérimentale (PEG-SOD) p <0,005 (Figure 13C). Western Blot a été réalisée comparant lobe droit et gauche des animaux témoins et démontre une augmentation clivée dans le lobe gauche caspase-3 après pince hilaire et reperfusion (figure 13D). Un second western blot a été réalisée en comparant les lobes gauche des animaux traités avec le contrôle et avec le PEG-SOD (Figure 13E). Cela démontre une diminution de la caspase-3 clivée dans le tissu hépatique des animaux traités par PEG-SOD. Densitométrie a également été réalisé démonstrationsTing que le niveau de la caspase-3 dans les tissus du foie clivée est significativement augmentée par rapport à la gauche lobe droit des animaux témoins (Figure 13F). En comparant le tissu hépatique du lobe gauche des animaux de laboratoire, infusé avec PEG-SOD, et les tissus du foie lobe gauche des animaux témoins, infusé avec normale Saline, densitométrie démontre une diminution significative de la caspase-3 clivée chez les animaux traités par PEG-SOD par rapport aux animaux traité avec le contrôle (figure 13G).
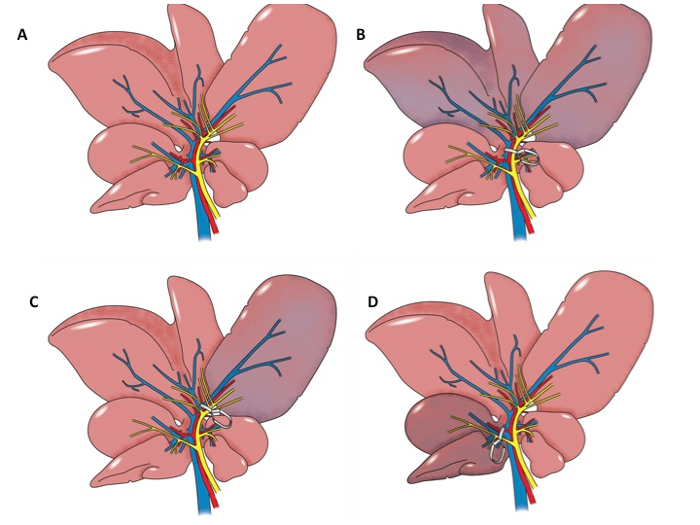
Figure 1: Illustrations Anatomique. A. illustration anatomique du foie de rat. B. Anatomical illustration du foie de rat. Le pédicule portail aux lobes gauche et médiane du foie est serré. Les lobes gauche et médiane sont ischémique. C. Anatomicalillustration du foie de rat. Le pédicule portail au lobe gauche est serré. Le lobe gauche est ischémique. D. Anatomical illustration du foie de rat. Le pédicule portail au lobe droit est serré et le lobe droit est ischémique.
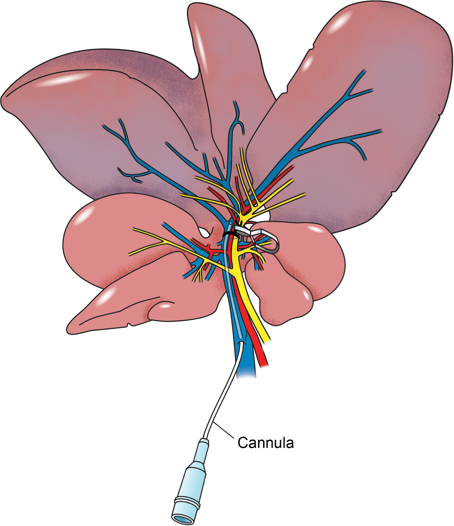
Figure 2: Illustrations Anatomique. illustration anatomique du foie de rat avec portail veine canulée par une branche latérale. Le pédicule du portail pour les lobes gauche et médiane du foie est entourée d'un fil de suture et une pince de microvaisseaux a été utilisé pour serrer autour du faisceau vasculaire. Les lobes gauche et médiane sont ischémique.

Figure 3: Instrument Set-up. Ce chiffre témoigne e instrument électronique mis en place.

Figure 4: Salle d' opération Set-up. Ce chiffre démontre la salle d'opération mise en place. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Figure 5: parage des cheveux abdominale. Ce chiffre démontre la coupure des cheveux abdominale. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
charge / 54729 / 54729fig6.jpg »/>
Figure 6: Immobilisation et peau Incision. Ce chiffre démontre l'immobilisation du rat et l'incision cutanée. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7: Rib Rétracteur Placement et éviscération. Ce chiffre démontre la mise en place de l'écarteur thoracique et éviscération. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Figure 8: Lieu ment de Suture. Ce chiffre démontre la mise en place de la suture. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
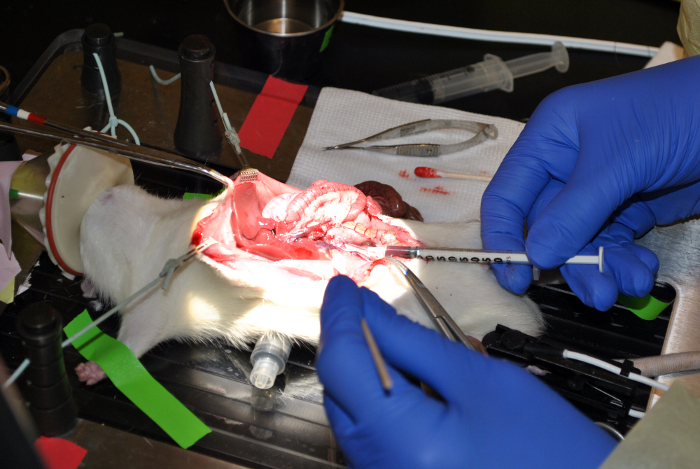
Figure 9: prise de sang de la veine cave inférieure. Ce chiffre démontre la prise de sang de la veine cave inférieure. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 10: Direction Vein ligaturées et rétractés. Ce chiffre démontre la veine branche nouée et rétractée. ecsource.jove.com/files/ftp_upload/54729/54729fig10large.jpg » target = « _ blank »> S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 11: Processus de canulation. Ce chiffre illustre le processus de canulation. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
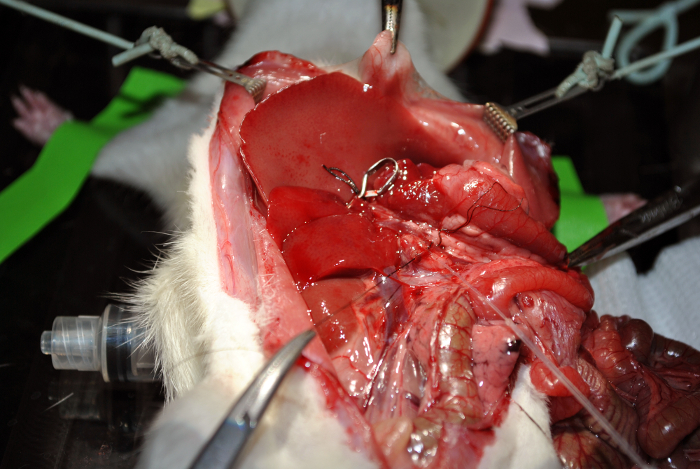
Figure 12: Canulation. Ce chiffre démontre la canulation. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
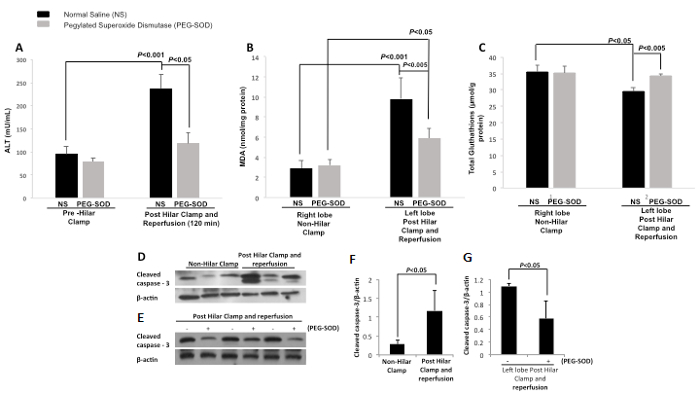
Figure 13: Les résultats représentatifs: Direct segmentaire intrahépatique Livraison de pégylé-superoxyde dismutase L' utilisation d' un modèle de rat hilaire Clamp. NS = solution saline normale. PEG-SOD = pégylé-superoxyde dismutase, ALT = alanine aminotransférase, MDA = malondialdéhyde. A. Serum alanine aminotransférase (ALT, mU / mL) par rapport entre la pince de pré-hilaire et post-reperfusion de 120 min. Il y a une différence significative entre le contrôle (NS) pince de pré-hilaire et de commande (NS) au niveau post-reperfusion de 120 min (p <0,001). Il existe également une différence significative entre le contrôle (NS) et les groupes expérimentaux (PEG-SOD) à post-reperfusion de 120 min (p <0,05). a été utilisé T test d'un étudiant. Les barres d'erreur représentent l'écart type. B. malondialdéhyde tissulaire dans le lobe droit (pince non-hilaire) avec injection de commande (NS) und injection expérimentale (PEG-SOD) montrent pas de différence significative. est significativement différent de celui du lobe droit (pince non-hilaire) p <0,001 lobe gauche (pince post-hilaire et reperfusion) de malondialdéhyde tissulaire avec injection de commande (NS). p <0,005 lobe gauche (pince post-hilaire et reperfusion) a significativement différents niveaux de tissu malonaldéhyde avec injection de commande (NS) par rapport à l'injection expérimentale (PEG-SOD). a été utilisé T test d'un étudiant. Les barres d'erreur représentent l'écart type. C. de glutathion tissulaire dans le lobe droit (pince non-hilaire) avec injection de commande (NS) et l' injection expérimentale (PEG-SOD) montrent pas de différence significative. est significativement différent de celui du lobe droit (pince non-hilaire) avec injection de commande (NS) p <0,05 lobe gauche (pince post-hilaire et reperfusion) glutathion tissulaire avec injection de commande (NS). lobe gauche (pince post-hilaire et reperfusion) a des niveaux sensiblement différents de glutathion tissulaire avec contrôle injection (NS) par rapport à l'injection expérimentale (PEG-SOD) p <0,005. a été utilisé T test d'un étudiant. Les barres d'erreur représentent l'écart type. D. Western Blot a augmenté la démonstration caspase-3 clivée dans le tissu hépatique du lobe gauche (pince post-hilaire et reperfusion) par rapport au lobe droit (pince non-hilaire) des animaux témoins (solution saline normale). E. Western blot démontrant une diminution de la caspase-3 dans les tissus du foie clivée des animaux traités avec le PEG-SOD par rapport aux animaux traités avec le témoin (solution saline normale). F. Niveau de caspase-3 dans les tissus du foie clivée est significativement augmentée dans serrage post-hilaire et les animaux reperfusion (p <0,05). a été utilisé T test d'un étudiant. Les barres d'erreur représentent l'écart type. G. En comparant les tissus de foie de lobe gauche des animaux de laboratoire (infusé avec du PEG-SOD) et de tissus de foie de lobe gauche des animaux témoins (infusé avec du sérum physiologique), il y a une diminution significative de la caspase-3 clivée dans unimals traités par PEG-SOD par rapport aux animaux traités avec le contrôle (sérum physiologique normal). a été utilisé T test d'un étudiant. Les barres d'erreur représentent l'écart type.
Discussion
Cette série d'expériences a montré que l'injection de PEG-SOD dans les lobes gauche et médian conduit à une diminution significative de la libération de ALT, peroxydation lipidique des membranes cellulaires (MDA), et le maintien de glutathion (GSH) par rapport aux témoins (Saline normale ). tissus hépatiques transaminases notamment l'alanine aminotransférase (ALT) sont fixés des marqueurs de lésion hépatocellulaire. La diminution de l'ALT lorsque le lobe gauche est injecté avec du PEG-SOD suggère un effet protecteur du PEG-SOD. L'augmentation des tissus MDA indique une augmentation peroxydation des lipides et est considérée comme un marqueur du stress oxydatif et une lésion tissulaire. La surproduction d'espèces réactives de l' oxygène provoque une augmentation de la production de MDA 26. La réduction significative des tissus MDA dans les lobes gauche et médiane de l'animal lorsqu'il est injecté avec PEG-SOD montre un effet protecteur de PEG-SOD. Ceci est cohérent avec la compréhension actuelle que le PEG-SOD protège les cellules contre les dommagescausée par une réduction partielle des espèces réactives de l' oxygène 27. De plus, en présence d'espèces réactives de l' oxygène, du disulfure de glutathion réduit au glutathion (GSH) 28. Le maintien en GSH dans les lobes gauche et médiane du foie injecté avec du PEG-SOD renforce encore l'effet protecteur du PEG-SOD. En outre, il est démontré que il y a une augmentation de la caspase-3 clivée, un produit de l'apoptose, dans des tissus exposés à une lésion d'ischémie-reperfusion. La diminution de la caspase-3 clivée dans le lobe gauche lorsqu'il est traité avec du PEG-SOD suggère que le PEG-SOD conduit à une diminution de l'apoptose.
La superoxyde dismutase (SOD) est une enzyme essentielle dans la détoxication d'espèces réactives de l'oxygène. L'enzyme catalyse la conversion de deux anions superoxyde en peroxyde d'hydrogène et de l'eau. L'enzyme catalase convertit ensuite le peroxyde d'hydrogène en eau et oxygène, 25 l' achèvement du processus. La demi-vie deSOD native a limité son utilisation dans des modèles expérimentaux jusqu'à ce que le développement de glycol-superoxyde dismutase conjugué polyéthylène (PEG-SOD). Conjugaison de SOD de polyethylene glycol augmente sa demi-vie de 6 min à 14 h. Nguyen et al. démontré sa capacité à réduire la peroxydation des lipides dans l' ischémie hépatique chez un modèle de rat, en utilisant une délivrance systémique 29.
Il existe une variété de modifications possibles de la technique détaillée ici et certains ont déjà été décrits dans la littérature. Selon le modèle utilisé molécules ont été livrés à l' aide inhalation 11, infusion péridurale 12, injection intraperitoneale 17, 18, 21, 22, l' administration intraveineuse de 10, 14, 15 , 19, 23, 24 ou par injection dans la veine mésentérique supérieure périphérique 8.
Il y a plusieurs étapes critiques dans ce protocole. Le plus important est la canulation de la veine porte. Il faut veiller à ce que le trou découpé dans la veine est pas trop grand. Le tissu est très élastique et le trou agrandira lui-même. Nous vous recommandons de commencer par couper un trou qui est de 0,5 mm avec les ciseaux de microchirurgie. La canule peut être introduite à travers le trou à l'aide d'un instrument, ce qui permet une plus grande souplesse que si la tentative d'exécution de cette partie de la procédure à la main. En outre, tout en alimentant d'abord la canule, il devrait viser directement vers la bifurcation des veines portail gauche et à droite pour éviter piquer un trou dans le mur arrière de la veine. Lorsque la pointe de la canule atteint la bifurcation, il peut alors être introduit dans la veine spécifique gaucheallié. Une fois que la canule est introduite dans la veine porte gauche, qui fournit à la fois les lobes gauche et médiane, sa position peut être confirmée manuellement par le sentiment à l'intérieur de la veine. Sa position peut également être confirmée par l'injection d'une petite quantité de solution saline froide et de voir l'effet sur les segments blanchissement fournis du foie.
Le modèle de pince hilaire du foie chez le rat fournit une plate-forme reproductible et stable pour démontrer une lésion ischémique-reperfusion hépatique. Modèles de serrage hile variables ont été utilisées par les chercheurs d'étudier les effets protecteurs des anti-oxydants et d' autres petites molécules 6, 7, 8, 9, 10, 11, 12, 13, 14. Les points de variation comprennent quels sont les navires de serrage ed, lequel segment sont fabriqués ischémique, si oui ou non le canal biliaire est inclus et la durée de la période de reperfusion 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21. En outre, lorsque ce modèle est utilisé pour étudier les effets de l' administration d'une molécule de la voie d'administration est également hétérogène 8, 10, 11,« > 12, 14, 15, 17, 18, 19, 21, 22, 23, 24. Il y a plusieurs avantages à l'approche décrite. En premier lieu , la canulation directe de la fourniture de portail au segment ischémique permet une livraison hépatique segmentaire directe de la substance pharmacologique à l'étude. Cela permet l'utilisation des autres lobes des foies comme un contrôle interne. en second lieu, canulation hépatique segmentaire permet un volume de distribution réduit pour la molécule étudiée. Cette approche réduit ainsi le risque d'effets secondaires systémiques la substance est injectée directement dans le segment de foie d'intérêt. canulation directe du segment hépatique permet la substance à délivrer de pré-ischémie, Intra-ischémie ou post-ischémie. Cela permet une étude de l'effet de la molécule à tout moment du cycle de lésions d'ischémie-reperfusion. Avec augmentation de la durée ischémique et le niveau accru de blessures occasion supplémentaire pour étudier la régénération du foie serait disponible.
Il y a aussi quelques limites de cette approche. Le premier est le coût de démarrage. L'achat d'un microscope chirurgical pourrait être un coût de démarrage significatif pour un laboratoire qui ne possède pas déjà un. Cette technique peut être difficile, voire impossible, sans microscope. Le second est le temps d'apprentissage de la courbe. Bien que cette procédure est relativement simple, il nécessite une certaine pratique et il est probable qu'un novice exigera un grand nombre de procédures pour devenir un expert.
En résumé, ce modèle permet une plate-forme reproductible, simple et économique pour étudier les lésions d'ischémie-reperfusion hépatique. Bien que dans le protocole décrit ici polyéthylène gldismutase superoxyde-ycol, un capteur de radicaux libres 25, a été infusé, ce modèle pourrait être utilisé pour insuffler une variété de différentes substances pharmacologiques afin d'évaluer leur impact sur les blessures I / R dans le foie.
Déclarations de divulgation
Tous les auteurs déclarent qu'ils ont aucune divulgation.
Remerciements
Nous tenons à remercier Dennis Mathias pour son travail d'illustration. Ce travail a été soutenu par le NIH T32AI 106704-01A1 et le Fonds T. Flesch pour la transplantation d'organes, Perfusion, d'ingénierie et de régénération à l'Ohio State University.
matériels
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley Rat | Harlan Sprague Dawley Inc. | 200- 250 grams | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Charcoal Canisters | Kent Scientific | SOMNO-2001-8 | |
| Isoflurane Molecular Weight 184.5 | Piramal Healthcare | ||
| Pressure-Lok Precision Analytical Syringe | Valco Instruments Co, Inc. | SOMNO-10ML | |
| Electrosurgical Unit | Macan | MV-7A | |
| Warming Pad | Braintree Scientific | HHP2 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Isoflurane chamber | Kent Scientific | SOMNO-0530LG | |
| SurgiVet | Isotec | CDS 9000 Tabletop | |
| Oxygen | Praxair | 98015 | |
| 27-0 Micro-Cannula | Braintree Scientific | MC-28 | |
| Rib retractors | Kent Scientific | INS600240 | |
| Polyethylene Glycol - Superoxide Dismutase (PEG-SOD) | Sigma Aldrich | S9549 SIGMA | |
| GenieTouch | Kent Scientific | ||
| Normal Saline | Baxter | NDC 0338-0048-04 | |
| 4 x 4 Non-Woven Sponges | Criterion | 104-2411 | |
| Sterile Q-Tips | Henry Schein Animal Health | 1009175 | |
| U-100 27 Gauge Insulin Syringe | Terumo | 22-272328 | |
| 5 mL Syringe | BD | REF 309603 | |
| 4-0 Braided Silk Suture | Deknatel, Inc. | 198737LP | |
| 7-0 Braided Silk Suture | Teleflex Medical | REF 103-S | |
| 1.8 mL Arcticle Cryogenic Tube | USA Scientific | 1418-7410 | |
| Microsurgical Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Scissors | Roboz | RS-5610 | |
| Large Scissors | S&T | SAA-15 | |
| Forceps - Large Angled | S&T | JFCL-7 | |
| Forceps - Small Angled | S&T | FRAS-15 RM-8 | |
| Clip Applier | ROBOZ | RS-5440 | |
| Scissors - non micro | FST 14958-11 | 14958-11 | |
| Forceps - Straight Tip | S&T | FRS-15 RM8TC | |
| Large Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-02 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-03 | |
| Other Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Mosquito Clamps | Generic | ||
| Analysis | |||
| Name | Company | Catalog Number | Comments |
| Alannine aminotransferase (ALT) assay | Biovision | K752-100 | |
| Malondialdehye (MDA) assay | Abcam | ab118970 | |
| Glutathione (GSH) assay | Cayman Chemical | 7030002 | |
| Antibodies - Cleaved Caspase-3 and Actin | Cell Signaling Tecnology | Antibody 9661 | |
| ImageJ Software | National Institutes of Health | ||
| RIPA Lysis and Extraction Buffer | Millipore | 10-188 |
Références
- Serracino-Inglott, F., Habib, N. A., Mathie, R. T. Hepatic ischemia-reperfusion injury. Am J Surg. 181, 160-166 (2001).
- Fondevila, C., Busuttil, R. W., Kupiec-Weglinski, J. W. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 74, 86-93 (2003).
- Kupiec-Weglinski, J. W., Busuttil, R. W. Ischemia and reperfusion injury in liver transplantation. Transplant Proc. 37, 1653-1656 (2005).
- OPTN. . Overall by Organ. Current US Waiting List. , (2016).
- OPTN. . Transplants in the US by Recipient ABO. , (2016).
- Tacchini, L., Radice, L., Pogliaghi, G., Bernelli-Zazzera, A. Differential activation of heat shock and nuclear factor kappaB transcription factors in postischemic reperfused rat liver. Hepatology. 26, 186-191 (1997).
- Palladini, G., et al. Lobe-specific heterogeneity and matrix metalloproteinase activation after ischemia/reperfusion injury in rat livers. Toxicol Pathol. 40, 722-730 (2012).
- Nakano, H., Kuzume, M., Namatame, K., Yamaguchi, M., Kumada, K. Efficacy of intraportal injection of anti-ICAM-1 monoclonal antibody against liver cell injury following warm ischemia in the rat. Am J Surg. 170, 64-66 (1995).
- Centurion, S. A., et al. Effects of ischemic liver preconditioning on hepatic ischemia/reperfusion injury in the rat. Transplant Proc. 39, 361-364 (2007).
- Kobayashi, H., et al. Role of endogenous nitric oxide in ischemia-reperfusion injury in rat liver. J Surg Res. 59, 772-779 (1995).
- Strifler, G., et al. Inhaled Methane Limits the Mitochondrial Electron Transport Chain Dysfunction during Experimental Liver Ischemia-Reperfusion Injury. PLoS One. 11, e0146363 (2016).
- Sarikus, Z., Bedirli, N., Yilmaz, G., Bagriacik, U., Bozkirli, F. The effects of epidural bupivacaine on ischemia/reperfusion-induced liver injury. Bratisl Lek Listy. 117, 41-46 (2016).
- Guimarães Filho, A. M., et al. Effect of remote ischemic preconditioning in the expression of IL-6 and IL-10 in a rat model of liver ischemia-reperfusion injury. Acta Cir Bras. 30, 452-460 (2015).
- Liu, Q. S., et al. Erythropoietin pretreatment exerts anti-inflammatory effects in hepatic ischemia/reperfusion-injured rats via suppression of the TLR2/NF-κB pathway. Transplant Proc. 47, 283-289 (2015).
- Montero, E. F., Quireze, C., d'Oliveira, D. M. Bile duct exclusion from selective vascular inflow occlusion in rat liver: role of ischemic preconditioning and N-acetylcysteine on hepatic reperfusion injury. Transplant Proc. 37, 425-427 (2005).
- Tártaro, R. D., et al. No protective function found in Wistar rats submitted to long ischemia time and reperfusion after intermittent clamping of the total hepatic pedicle. Transplant Proc. 47, 1038-1041 (2015).
- Yeh, D. Y., Yang, Y. C., Wang, J. J. Hepatic Warm Ischemia-Reperfusion-Induced Increase in Pulmonary Capillary Filtration Is Ameliorated by Administration of a Multidrug Resistance-Associated Protein 1 Inhibitor and Leukotriene D4 Antagonist (MK-571) Through Reducing Neutrophil Infiltration and Pulmonary Inflammation and Oxidative Stress in Rats. Transplant Proc. 47, 1087-1091 (2015).
- Kilicoglu, B., et al. Ultrastructural view of a promising anti TNF-α agent on hepatic ischaemia reperfusion injury. Bratisl Lek Listy. , 601-607 (2015).
- Jiménez Pérez, J. C., et al. Spironolactone Effect in Hepatic Ischemia/Reperfusion Injury in Wistar Rats. Oxid Med Cell Longev. , 3196431 (2016).
- Sano, N., et al. New drug delivery system for liver sinusoidal endothelial cells for ischemia-reperfusion injury. World J Gastroenterol. 21, 12778-12786 (2015).
- Chang, Y. K., Huang, S. C., Kao, M. C., Huang, C. J. Cepharanthine alleviates liver injury in a rodent model of limb ischemia-reperfusion. Acta Anaesthesiol Taiwan. , (2015).
- Lucas, M. L., Rhoden, C. R., Rhoden, E. L., Zettler, C. G., Mattos, A. A. Effects of L-arginine and L-NAME on ischemia-reperfusion in rat liver. Acta Cir Bras. 30, 345-352 (2015).
- Yeh, D. Y., Tung, S. P., Fu, Y. H., Yang, Y. C., Wang, J. J. Intravenous superoxide dismutase administration reduces contralateral lung injury induced by unilateral lung ischemia and reperfusion in rats through suppression of activity and protein expression of matrix metalloproteases. Transplant Proc. 47, 1083-1086 (2015).
- Yusen, R. D., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report-2015; Focus Theme: Early Graft Failure. J Heart Lung Transplant. 34, 1264-1277 (2015).
- Held, P. . An Introduction to Reactive Oxygen Species: Measurement of ROS in Cells. , 1-14 (2012).
- Gaweł, S., Wardas, M., Niedworok, E., Wardas, P. Malondialdehyde (MDA) as a lipid peroxidation marker. Wiad Lek. 57, 453-455 (2004).
- Beckman, J. S., et al. Superoxide dismutase and catalase conjugated to polyethylene glycol increases endothelial enzyme activity and oxidant resistance. J Biol Chem. 263, 6884-6892 (1988).
- Carlberg, I., Mannervik, B. Glutathione reductase. Methods Enzymol. 113, 484-490 (1985).
- Nguyen, W. D., Kim, D. H., Alam, H. B., Provido, H. S., Kirkpatrick, J. R. Polyethylene glycol-superoxide dismutase inhibits lipid peroxidation in hepatic ischemia/reperfusion injury. Crit Care. 3, 127-130 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon