Method Article
Método de entrega directa segmentos intra-hepática Usando um modelo de rato Liver Hilar Grampo
Neste Artigo
Resumo
Um modelo de braçadeira hilar fígado de rato original foi desenvolvido para estudar o impacto das moléculas farmacológicas no melhoramento da lesão por isquemia-reperfusão. Este modelo inclui canulação direta da oferta de portal para o segmento fígado isquêmico através de um ramo da veia portal, permitindo a entrega hepática direta.
Resumo
cirurgia major hepática com oclusão influxo, e o transplante de fígado, necessitam de um período de isquemia quente, e um período de reperfusão que conduz à lesão com consequências negativas miríade de isquemia / reperfusão (I / R). lesão potencial de I / R em órgãos marginais destinados a transplante de fígado contribui para a falta de doadores corrente secundária a uma taxa de utilização órgão diminuído. Existe uma necessidade significativa para explorar hepática lesão de I / R, a fim de mediar o seu impacto na função do enxerto em transplante. De fígado de rato modelos braçadeira hilares são usados para investigar o impacto de diferentes moléculas na lesão de I / R hepática. Dependendo do modelo, estas moléculas foram entregues usando inalação, a infusão epidural, injecção intraperitoneal, administração intravenosa ou injecção na veia mesentérica superior periférica. Um modelo hilar braçadeira de fígado de rato foi desenvolvido para uso em estudar o impacto das moléculas farmacológicas em melhorar lesão de I / R. o described modelo para a braçadeira hilar fígado de rato inclui a canulação directa do fornecimento portal para o segmento hepática isquémica através de um ramal lateral da veia porta, permitindo a entrega hepática segmentar directa. A nossa abordagem é para induzir isquemia nos lóbulos laterais e medianas esquerda durante 60 min, tempo durante o qual a substância em estudo é infundida. Neste caso, peguilado-superóxido dismutase (SOD-PEG), um captador de radicais livres, é infundido directamente no segmento isquémica. Esta série de experiências demonstram que a infusão de PEG-SOD é protectora contra a lesão de I / R hepática. As vantagens desta abordagem incluem a injecção directa da molécula no segmento isquémico, com a consequente diminuição do volume de distribuição e redução em efeitos secundários sistémicos.
Introdução
Cirurgia major hepática com oclusão influxo, e o transplante de fígado, necessitam de um período de isquemia quente, e um período de reperfusão que conduz à lesão um isquemia / reperfusão (I / R). As consequências do dano de I / R em fígado foram detalhados extensivamente 1, 2, 3. Consequências da I / lesão R descritos na literatura incluem: geração de espécies reactivas de oxigénio, a iniciação da cascata inflamatória, incluindo a activação de neutrófilos, células de Kupffer e células endoteliais, a activação do sistema de heme-oxigenase e a activação dos receptores do tipo Toll, uma desequilíbrio entre endotelina e óxido nítrico, a activação do factor nuclear-kB, e promoção da citocina pró-inflamatória e síntese 1, 2, 3 molécula de adesão. Estes eventos pró-inflamatórios may lead a apoptose, necrose, disfunção de órgãos e eventual falha do órgão 3.
I / R lesão em órgãos destinados a transplantação do fígado pode levar à perda precoce do enxerto e contribui para a falta de doadores corrente como órgãos marginais são mais susceptíveis a lesão 3. Atualmente 15,226 potenciais destinatários na lista de espera para transplante de fígado nos Estados Unidos 4 e apenas 5.950 transplantes de fígado foram realizados em 2015 5. Devido a esta limitação extrema na disponibilidade de órgãos, pesquisa a explorar lesão de I / R hepática é necessária a fim de optimizar o funcionamento do enxerto e a utilização de órgãos.
Os modelos animais utilizados para estudar a lesão hepática I / R incluem modelos de rato hilar braçadeira e modelos de transplante de fígado de rato. Há uma variedade de modelos de fixação hilares rato atualmente em uso. O mais comum é aquele em que a veia porta, artéria hepática e bile duct fornecendo os lóbulos laterais e mediano esquerdo são presos usando grampos de microcirurgia 6, 7, 8, 9, 10, 11, 12, durante 30 a 60 minutos, 6, 7, 10, 13, 14, e em seguida um período de reperfusão de 60 min a 24 h, 7, 9, 10, 13, 14 é permitido. Os lóbulos laterais e medianas esquerdo do fígado de rato compreendem cerca de 70% do parênquima hepático 9. Alguns protocolos concebidos para estudar o pré-condicionamento isquémico incluem aperto intermitente dos vasos hilaresou a corça-membro antes de um longo período de isquémia induzida por aperto dos vasos hilares 9, 13. Existem também várias modificações descritas na literatura. O primeiro é para prender a veia porta e artéria hepática fornecendo os lobos lateral esquerdo e mediano, mas excluem o ducto biliar 15. Uma segunda modificação é para induzir isquemia hepática total por aperto a conduta da veia porta, artéria hepática e biliar, antes da sua divisão 16, 17, 18, 19, 20. Uma terceira modificação inclui aperto dos vasos hilares para o lóbulo direito durante 30 a 60 min 8. Uma modificação adicional envolve o aperto feixe vascular em um membro traseiro, a fim de induzir a lesão no fígado 13, 21 . Várias abordagens para o procedimento de braçadeira hilar são ilustrados na Figura 1A-D.
De fígado de rato modelos braçadeira hilares têm sido utilizados para estudar o impacto de diferentes moléculas e compostos em hepática de I / R. Dependendo do modelo utilizado estas moléculas tenham sido entregues usando inalação 11, a infusão epidural 12, injecção intraperitoneal 17, 18, 21, 22, a administração intravenosa 10, 14, 15, 19, 23, 24 ou injecção no mesentérica superior periférica da veia 8 .
O modelo de fígado de rato braçadeira hilar detalhado neste relatório inclues canulação directa do fornecimento portal para o segmento isquémica através de um ramal lateral da veia porta (Figura 2), que permite a entrega directa segmentar hepática da substância farmacológica em estudo. A nossa abordagem é para induzir isquemia nos lóbulos laterais e medianas esquerda durante 60 min, tempo durante o qual uma infusão da substância em estudo, neste caso, a superóxido peguilado-dismutase, um captador de radicais livres 25, é infundido directamente no segmento isquémica . As amostras de sangue são tomadas antes da indução da isquemia e a 120 minutos após a reperfusão. Neste ponto, o rato é sacrificado e as amostras são colhidas dos lobos esquerdo e medianos. Além disso, as amostras são colhidas a partir do lobo direito para servir como um controlo interno.
Existem inúmeras vantagens para esta abordagem. Em primeiro lugar e acima de tudo, quando a substância farmacológica sob estudo pode ser directamente injectado no segmento isquémico o volume ódistribuição f é bastante baixa em comparação com o volume de distribuição da injecção na circulação sistémica ou na cavidade peritoneal. Além disso, esta abordagem reduz, embora não elimina, a possibilidade de efeitos colaterais sistêmicos.
Protocolo
Todos os procedimentos foram realizados de acordo com as diretrizes do Animal Care Institucional e Guia do Conselho Nacional de Pesquisa para o cuidado humano e Uso de Animais de Laboratório (IACUC) e foi submetido a aprovação pela comissão de Ohio State University IACUC.
1. configuração inicial
- Defina-se o microscópio cirúrgico e a sala de operações (Figura 3, Figura 4). Ligue todos os equipamentos, incluindo que, para manter a anestesia e monitoramento de sinais vitais. Ligue o electrosurgical pad unidade e aquecimento. Posicione a bomba de infusão perto da mesa de operações.
- Desenha-se 10 ml de líquido para inalação de isoflurano (peso molecular 184,5) na seringa anestesia e colocá-la na unidade de anestesia.
- Defina-se um recipiente de 200 ml de azoto líquido perto da mesa de operações e outra perto da centrífuga onde as amostras de sangue vai ser processado.
- Position os instrumentos cirúrgicos, 4-0 e 7-0 sutura de seda trançada, cotonetes de algodão estéril, esponjas 4x4 não-tecidos, 5 mL seringas, seringas e 27 calibre de insulina perto da mesa de operações.
- Preparar a câmara de isoflurano e assegurar que o isoflurano suficiente é instilada no sistema de libertação da indução da anestesia.
2. Indução de Anestesia
- Antes de manusear o rato colocado no seguinte equipamento de protecção individual (EPI): máscara cirúrgica, luvas cirúrgicas, e bata descartável.
- Pesar o rato e registrar o peso.
NOTA: ratos Sprague Dawley deve ser usado. - Coloque o rato na câmara de anestesia e ligar o isoflurano e o oxigênio. Induzir a anestesia utilizando a câmara de isoflurano.
- Grampo de cabelo abdominal do animal usando um cortador de cabelo elétrico para permitir a exposição mais limpa (Figura 5).
- Coloque a parte de trás de animais na câmara de isoflurano para um additional de um minuto. Realizar uma pitada dedo do pé para verificar a profundidade da anestesia.
3. Procedimento
- Posicione o rato com o nariz do animal no cone do nariz e quatro extremidades imobilizadas com restrições ou fita sobre a almofada de aquecimento.
- Continue a anestesia utilizando o sistema de entrega de anestesia, cone de nariz e isoflurano com anestesia de 3,6% para os animais pesando entre 200 e 250 g e 4% para animais com peso superior a 250 g. Confirmar profundidade da anestesia através da realização de uma pitada dedo do pé e uma pitada de pele.
- Faça uma incisão abdominal na linha média do púbis até xifóide através da pele usando uma tesoura afiada (Figura 6).
- Faça uma incisão no peritônio ao longo da linha alba do púbis até xifóide e digite o cuidar abdômen para não danificar a bexiga ou intestino. Como o fígado também adere ao peritônio anteriormente perto do apêndice xifóide, garantir que ele libera antes da incisão na parede abdominal neste area.
- Faça uma incisão transversal através da pele e do peritônio ao nível da borda inferior do lóbulo direito do fígado.
- Transformar o anestesia para baixo a 1,6% para os animais pesando entre 200 e 250 g e 2% para animais com peso superior a 250 g.
- Retrair o processo xifóide usando uma braçadeira mosquito curvo.
- Afastadores lugar de nervura que puxam as nervuras tão longe quanto possível a partir da linha média (Figura 7). Cortar o falciforme, frénico e ligamentos gástricas. Virar o fígado usando umedecidos cotonetes estéreis.
- Corte ligamentos adicionais conforme necessário para obter acesso à porta. Executar a rotação visceral com solução salina humedecido gaze (Figura 7).
- Remover o tecido conjuntivo frouxo que recobre o hilo portal utilizando dissecção cortante ou contundente. Remover o tecido conjuntivo frouxo que recobre o comprimento da veia portal.
- Use uma pinça para empurrar através do conjuntivo frouxo tedição posterior ao ducto veia porta esquerda, artéria e bile tornando uma janela e coloque 4-0 Potts sutura, mas não apertar para baixo (Figura 8).
- Limpar fora o tecido conjuntivo frouxo que cobre o ramo posterior à veia portal que vem em aproximadamente ao nível do rim direito. Esta veia será usado para canulação.
- Desenhar 0,5 mL de sangue para fora da vena cava inferior (IVC) com uma seringa de insulina (Figura 9). Colocar os 0,5 mL de sangue em um pequeno frasco, centrifugar a 135 xg durante 12 min. Tentativa para retirar soro.
- Se uma linha distinta não pode ser apreciado entre as células vermelhas do sangue e soro, tentar centrifugar durante um adicional de 2 - 3 minutos, a 135 x g. Colhem-se soro e colocar num frasco de alanina-aminotransferase (ALT). Encaixe congelar esta amostra, colocando-o directamente em azoto líquido.
- Corte dois pedaços de 7-0 sutura e lugar perto da veia que serão utilizados para a cânulação. Coloque a primeira 7-0 laço em torno dessa veia, tanto medial quanto possível. Amarrar este ciclo e usá-lo para retrair usando uma braçadeira mosquito curva (Figura 10). Coloque um segundo 7-0 laço na veia que será usado para canulação perto de sua interseção com a veia porta e coloque uma gravata, mas não apertar para baixo.
- Preparar a bomba de perfusão com uma seringa de 5 ml com 3 ml de reagente. Primeiro o tubo.
- Grampo veia porta distal utilizando uma braçadeira de microcirurgia.
NOTA: Isto irá reduzir o sangramento quando a veia está incisão para canulação. - Cortar um orifício com 0,5 mm de veia entre o fio de sutura 7-0 e estadia sua intersecção com a veia portal usando uma tesoura pequena microcirúrgicos. Usar 27-0 cateter para canular o sistema venoso portal esquerda (Figura 11, Figura 12). Insira o cateter após a bifurcação das veias porta esquerda e direita.
- Verifique a colocação da cânula por infusing 1 mL de solução salina normal e para assistir os lóbulos laterais e medianas esquerdo do fígado para branquear. manualmente confirmar que cateter é passado o take-off da veia porta direita, mas não além do take-off da veia portal alimentando o lobo médio.
- Cinch para baixo a sutura Potts e começar a tempo de isquemia. Apertar 7-0 sutura em volta da veia e 27-0 cateter para o manter no lugar e remover o grampo a partir da veia porta distal.
- Iniciar a infusão de polietileno glicol superóxido-dismutase (SOD-PEG, 0,00067 g / ml) usando a bomba de infusão. Comece a infusão tão perto quanto possível do início do tempo de isquemia.
4. Acompanhamento
- Continue a monitorar os sinais vitais do animal ao longo da infusão. Entregar 2 mL de 0,9% solução salina normal ou 2 mL de PEG-SOD (0,00067 g / ml) dissolvido em 0,9% de solução salina normal durante um período de 15 min.
5. A reperfusão
- Permitir uma hora para passar desde o início do itempo isquêmico. Este é 1-h de tempo de isquemia quente.
- Retire a sutura Potts. Remover o cateter 27-0. Cinch para baixo o 7-0 sutura em torno da veia. Observe o tempo. Isto marca o tempo de reperfusão.
6. Amostragem Continuação
- Desenhar 0,5 mL de sangue para fora da veia cava inferior a 120 min após a reperfusão. Tirar o sangue lentamente para evitar a lise de células vermelhas do sangue. Lentamente escorrer o sangue para um tubo de ensaio. Certifique-se de que o sangramento do IVC é controlada depois de cada colheita de sangue.
- Se não é continuada sangramento aplicar uma ligeira pressão com uma mecha de algodão estéril ou uma pequena 1 cm 1 cm secção de corte de gaze.
- Centrifugar a 135 xg durante 12 min. Se a separação suficiente não for atingida, tentar um adicional de 2 - 3 minutos a 135 x g.
- Coloque metade do soro em um frasco para processamento posterior para ALT. Encaixe congelar estas amostras.
7. A eutanásia
- Enquanto o rato continua a ser cortado sob anestesia e o VCI superior vena cava (SVC) e monitorar até que o fluxo de sangue, respiração e batimento cardíaco cessar.
- Incisão no diafragma e realizar uma breve hepatectomia por incisão o diafragma num círculo e incisão do tecido conjuntivo adicional que permanece ligar o fígado para a cavidade peritoneal. Remover o fígado a partir da cavidade peritoneal.
- Tome quatro amostras dos lobos esquerdo e medianos do fígado e quatro amostras do lóbulo direito do fígado. As amostras devem ser tão grandes quanto possível e a sua dimensão será limitado apenas pela quantidade de tecido do fígado disponível. Colocar estes em pequenos frascos, marcados, e encaixe de congelamento em azoto líquido. Usá-los para processamento posterior para o trifosfato de adenosina tecido (ADP), o malondialdeído (MDA) e glutationa (GSH).
8. Pós-experimento Análise
- Determinar a glutationa (GSH), o malondialdeído (MDA) e alanina aminotransferase (ALT) actividades em tecido do fígado e as amostras de soro utilizando kits de diagnósticode acordo com as instruções do fabricante.
- Homogeneizar o tecido hepático com tampão de lise e quantificar utilizando um ensaio de Bradford. Analisar lisado de tecido por electroforese em gel de sulfato de dodecilo-poliacrilamida de sódio e imunotransferência utilizando anticorpos contra Capase-3 clivado e actina. Quantificar Western blot realizados com software disponível ao público.
Resultados
Esta experiência foi realizada com 2 grupos de n = 3 ratos cada. Três fígados de ratos foram injectados com 2 ml de solução salina normal (NS) com a bomba de infusão ao longo de um período de 15 min. Três fígados de ratos foram injectados com 2 ml de solução salina normal (NS) misturado com peguilado-superóxido dismutase (SOD-PEG, 0,00067 g / ml) com a bomba de infusão ao longo de um período de 15 min. Tal como descrito no protocolo acima, as amostras de sangue foram tomadas de aperto pré-hilar e em 120 min após a reperfusão. Além disso, após a conclusão de 120 min de reperfusão, quatro amostras de tecido de fígado foram tomadas a partir da esquerda e lóbulos medianas e quatro amostras de fígado foram tomadas a partir do lobo direito do fígado de rato.
Alanina aminotransferase (ALT) foi medida braçadeira pré-hilar e em 120 minutos pós-reperfusão no controle (NS) e experimental (PEG-SOD) animais. Houve uma diferença significativa entre o nível de ALT de controlo (NS)animais de braçadeira pré-hilar e em 120 min após a reperfusão. Houve uma diferença significativa entre os níveis de ALT de controlo (SN) e os animais experimentais (PEG-SOD) em 120 minutos (Figura 13A). malonaldeído tecido (MDA) foi medido para o controle (NS) e experimental (PEG-SOD) animais em ambos os lobos direito e esquerdo do fígado. Tecido MDA no lóbulo (braçadeira não-hilar) direita com injecção de controlo (NS) e injecção experimental (PEG-SOD) demonstrar nenhuma diferença significativa. lobo esquerdo (pós-hilar braçadeira e reperfusão) tecido MDA com injecção de controlo (SN) é significativamente diferente do que o lóbulo direito (braçadeira não-hilar) p <0,001. Lobo esquerdo (grampo de pós-reperfusão e hilar) tem significativamente diferentes níveis de tecido MDA com injecção de controlo (NS) versus injecção experimental (PEG-SOD) p <0,005 (Figura 13B). Tecido de glutationa (GSH) e glutationa foi medida no tecido do lóbulo direito (braçadeira não-hilar) com injecção de controlo (SN) de umand injecção experimental (PEG-SOD) demonstrar nenhuma diferença significativa. lobo esquerdo (pós-hilar braçadeira e reperfusão) tecido GSH com injecção de controlo (SN) é significativamente diferente do que o lóbulo direito (braçadeira não-hilar) com injecção de controlo (NS) p <0,05. Lobo esquerdo (grampo de pós-reperfusão e hilar) tem significativamente diferentes níveis de glutationa nos tecidos com injecção de controlo (NS) versus injecção experimental (PEG-SOD) p <0,005 (Figura 13C). Western blot foi realizada comparando lóbulo direito e esquerdo de animais de controlo e demonstra o aumento caspase-3 clivada no lobo esquerdo após braçadeira hilar e reperfus (Figura 13D). Uma segunda transfercia de Western foi realizada comparando-se os lobos esquerdo dos animais tratados com o controlo e com o PEG-SOD (Figura 13E). Isto demonstra a diminuição da caspase-3 no tecido hepático de animais tratados com PEG-SOD. Densitometria também foi realizada demonstraTing que o nível de caspase-3 clivada em tecido do fígado é significativamente aumentada na esquerda versus lóbulo direito dos animais de controlo (Figura 13F). Ao comparar o tecido esquerda fígado lóbulo de animais experimentais, infundidos com PEG-SOD, e o tecido do fígado lóbulo esquerdo de animais de controlo, infundidos com solução salina normal, densitometria demonstra diminuiu significativamente a caspase-3 clivada em animais tratados com PEG-SOD, em comparação com animais tratados com controlo (Figura 13G).
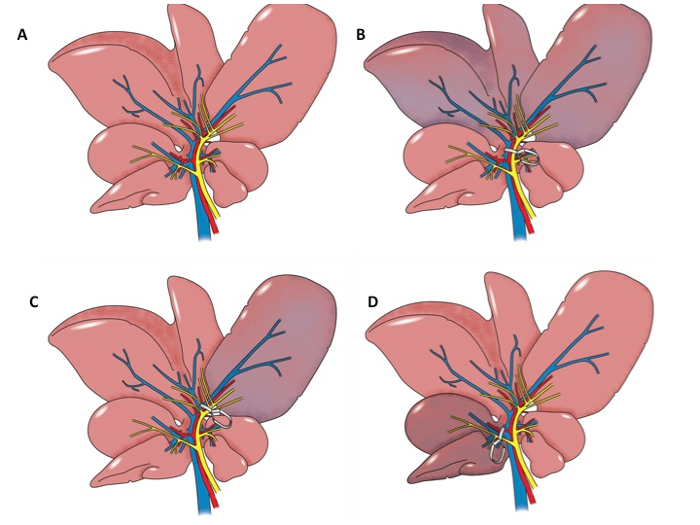
Figura 1: Anatomical Ilustrações. Ilustração anatômica A. do fígado de rato. Ilustração B. anatômico do fígado de rato. O pedículo portal para os lobos esquerdo e medianos do fígado é preso. Os lobos esquerdo e mediana são isquêmicos. C. AnatomicalIlustração do fígado de rato. O pedículo portal para o lobo esquerdo é preso. O lobo esquerdo é isquémica. D. ilustração Anatómico do fígado de rato. O pedículo portal para o lobo direito é preso e o lóbulo direito é isquêmica.
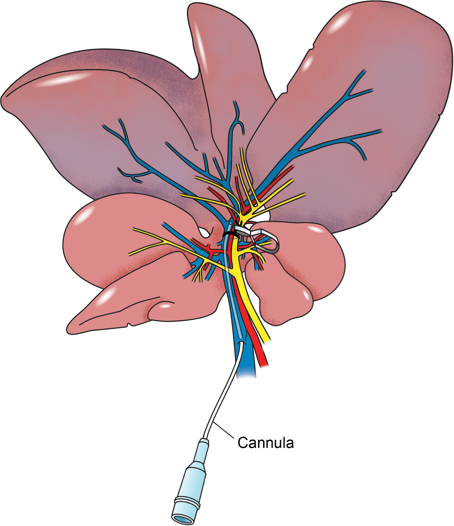
Figura 2: Anatomical Ilustrações. Ilustração anatômica do fígado de rato com portal veia canulada através de um ramo lateral. O pedículo portal para os lobos esquerdo e medianos do fígado é cercada por uma sutura e uma braçadeira de microvasos foi usado para apertar ao redor do feixe vascular. Os lobos esquerdo e mediana são isquêmicos.

Figura 3: Instrumento Set-up. Esta figura demonstra th e instrumento de set-up.

Figura 4: Operating Room Set-up. Esta figura demonstra a sala de operação set-up. Por favor clique aqui para ver uma versão maior desta figura.
Figura 5: Corte de cabelo abdominal. Esta figura demonstra o corte do cabelo abdominal. Por favor clique aqui para ver uma versão maior desta figura.
carga / 54729 / 54729fig6.jpg"/>
Figura 6: A imobilização e incisão da pele. Esta figura demonstra a imobilização do rato e a incisão na pele. Por favor clique aqui para ver uma versão maior desta figura.

Figura 7: Rib afastador de posicionamento e evisceração. Esta figura demonstra a colocação afastador de costela e evisceração. Por favor clique aqui para ver uma versão maior desta figura.
Figura 8: Local mento de sutura. Esta figura demonstra a colocação da sutura. Por favor clique aqui para ver uma versão maior desta figura.
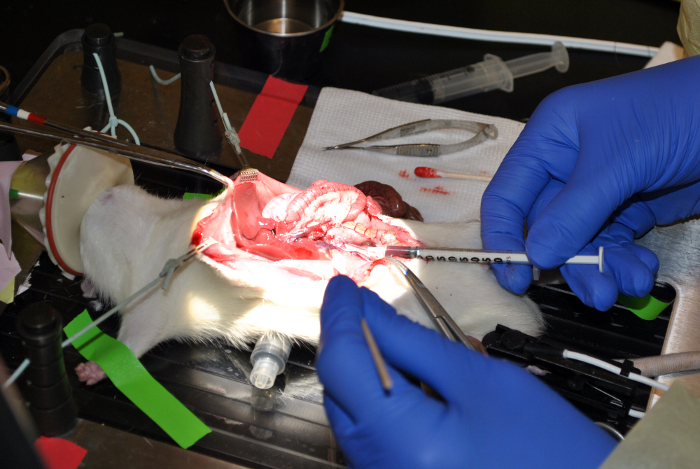
Figura 9: tirar sangue da veia cava inferior. Esta figura demonstra coleta de sangue da veia cava inferior. Por favor clique aqui para ver uma versão maior desta figura.

Figura 10: Veia ramo amarrado e retraída. Esta figura demonstra veia ramo amarrado e retraída. ecsource.jove.com/files/ftp_upload/54729/54729fig10large.jpg" target = '_ blank'> Clique aqui para ver uma versão maior desta figura.

Figura 11: Processo de canulação. Esta figura demonstra o processo de canulação. Por favor clique aqui para ver uma versão maior desta figura.
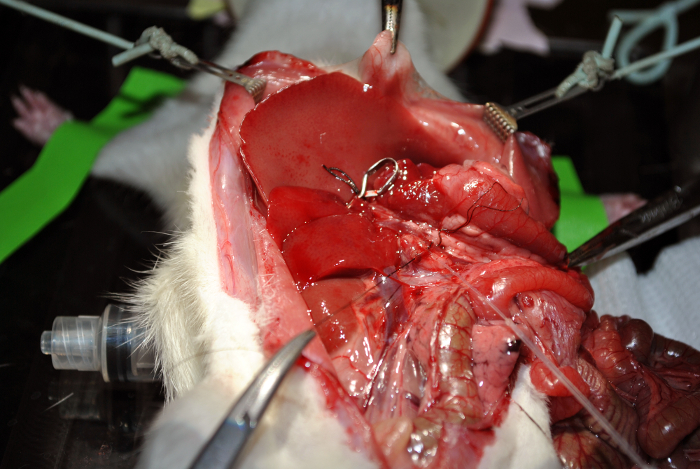
Figura 12: A canulação. Esta figura demonstra a canulação. Por favor clique aqui para ver uma versão maior desta figura.
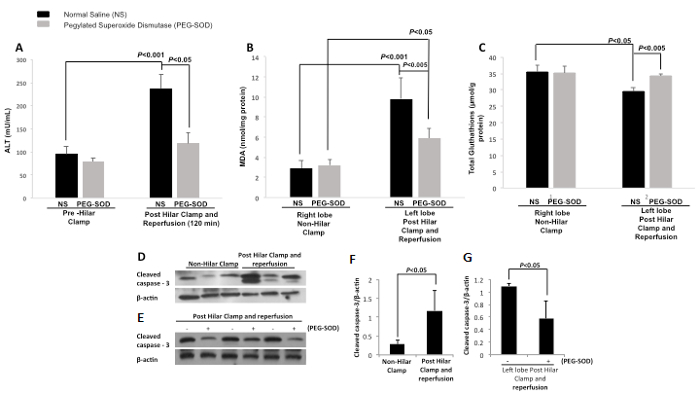
Figura 13: Resultados representativos: direto segmentos intra-hepática Entrega de peguilado-superóxido dismutase Usando uma braçadeira modelo de rato Hilar. NS = soro fisiológico normal. PEG-SOD = peguilado-superóxido dismutase, ALT = aminotransferase alanina, MDA = malondialdeído. A. alanina aminotransferase (ALT, mU / ml) em comparação entre braçadeira pré-hilar e 120 min após a reperfusão. Há uma diferença significativa entre o controlo (SN) de aperto pré-hilar e de controlo (SN) em 120 min após a reperfusão (p <0,001). Há também uma diferença significativa entre o controlo (SN) e os grupos experimentais (PEG-SOD) em 120 min após a reperfusão (p <0,05). Foi utilizado um teste t de estudante. As barras de erro representam o desvio padrão. B. Tissue malondialdeído no lobo direito (braçadeira não-hilar) com injecção de controlo (SN) de umainjecção experimental d (PEG-SOD) demonstrar nenhuma diferença significativa. lobo esquerdo (grampo de pós-reperfusão e hilar) malondialdeído tecidos com injecção de controlo (SN) é significativamente diferente do que o lóbulo direito (braçadeira não-hilar) p <0,001. lobo esquerdo (grampo de pós-reperfusão e hilar) tem significativamente diferentes níveis de malonaldeído tecidos com injecção de controlo (NS) versus injecção experimental (PEG-SOD) p <0,005. Foi utilizado um teste t de estudante. As barras de erro representam o desvio padrão. C. glutationa nos tecidos no lobo direito (braçadeira não-hilar) com injecção de controlo (NS) e injecção experimental (PEG-SOD) demonstrar nenhuma diferença significativa. lobo esquerdo (grampo de pós-reperfusão e hilar) glutationa tecidos com injecção de controlo (SN) é significativamente diferente do que o lóbulo direito (braçadeira não-hilar) com injecção de controlo (NS) p <0,05. lobo esquerdo (grampo de pós-reperfusão e hilar) tem significativamente diferentes níveis de glutationa tecido com injectio controlen (NS) versus injecção experimental (PEG-SOD) p <0,005. Foi utilizado um teste t de estudante. As barras de erro representam o desvio padrão. D. Western Blot demonstrando a aumento da caspase-3 clivada no tecido do fígado do lobo esquerdo (grampo de pós-reperfusão e hilar) versus o lóbulo direito (braçadeira não-hilar) dos animais de controlo (solução salina normal). E. de transferência de Western demonstrando diminuição da caspase-3 clivada no tecido hepático de animais tratados com PEG-SOD, em comparação com os animais tratados com o controlo (solução salina normal). F. Nível de caspase-3 clivada no tecido hepático é aumentada de forma significativa na braçadeira e reperfusão animais pós-hilares (p <0,05). Foi utilizado um teste t de estudante. As barras de erro representam o desvio padrão. G. Em comparação tecido esquerda fígado lóbulo de animais experimentais (infundidas com PEG-SOD) e tecido lobo esquerdo do fígado de animais de controlo (infundido com soro fisiológico), há uma redução significativa da caspase-3 clivada numaimals tratados com PEG-SOD, em comparação com os animais tratados com o controlo (solução salina normal). Foi utilizado um teste t de estudante. As barras de erro representam o desvio padrão.
Discussão
Esta série de experiências demonstraram que a injecção de PEG-SOD para a esquerda e lóbulos medianos conduziram a decréscimos significativos na libertação de ALT, a peroxidação lipídica das membranas celulares (MDA), e manutenção de glutationa (GSH), quando comparado com os controlos (solução salina normal ). Transaminases hepáticas tecido incluindo alanina aminotransferase (ALT) são marcadores de lesão hepatocelular estabelecida. A diminuição na ALT quando o lobo esquerdo é injectado com PEG-SOD sugere um efeito protector do PEG-SOD. tecido aumentou MDA indica aumento da peroxidação de lípidos e é considerado um marcador de estresse oxidativo e lesão de tecidos. A superprodução de espécies reactivas de oxigénio provoca um aumento da produção de MDA de 26. A redução significativa no tecido MDA nos lobos esquerdo e médio do animal quando injectados com PEG-SOD demonstra um efeito protector do PEG-SOD. Isto é consistente com o entendimento atual que PEG-SOD protege as células dos danoscausada por espécies reactivas de oxigénio parcialmente reduzido 27. Além disso, na presença de espécies de oxigénio reactivas, dissulfureto de glutationa reduzida é a glutationa (GSH) 28. A manutenção em GSH nos lobos esquerdo e medianos da fígado injectados com PEG-SOD reforça ainda mais o efeito protector do PEG-SOD. Além disso demonstra-se que há um aumento da caspase-3, um produto de apoptose, em tecido exposto a lesão de isquemia-reperfusão. A diminuição da caspase-3 clivada no lobo esquerdo quando tratados com PEG-SOD sugere que o PEG-SOD leva a uma diminuição na apoptose.
superóxido dismutase (SOD) é uma enzima crítica na desintoxicação de espécies reactivas de oxigénio. A enzima catalisa a conversão de dois aniões superóxido em peróxido de hidrogénio e água. A enzima catalase, em seguida, converte o peróxido de hidrogénio em água e oxigénio, completando o processo 25. A meia-vida deSOD nativa limita a sua utilização em modelos experimentais até que o desenvolvimento de polietileno glicol superóxido-dismutase conjugado (PEG-SOD). A conjugação da SOD com polietilenoglicol aumenta o seu tempo de meia-vida de 6 min a 14 h. Nguyen et ai. demonstrou a sua capacidade para atenuar a peroxidação lipídica em isquemia hepática num modelo de rato, usando a entrega sistémica 29.
Há uma variedade de potenciais modificações da técnica detalhado aqui e alguns foram previamente descritos na literatura. Dependendo das moléculas modelo usado foram entregues usando inalação 11, a infusão epidural 12, injecção intraperitoneal 17, 18, 21, 22, a administração intravenosa 10, 14, 15 , 19, 23, 24 ou injecção na veia mesentérica superior periférica 8.
Existem vários passos críticos neste protocolo. O mais importante é a punção da veia portal. Cuidados devem ser tomados para que o buraco cortado na veia não é muito grande. O tecido é muito elástica e o buraco vai aumentar por conta própria. É recomendável iniciar o corte por um furo que é de 0,5 mm, com uma tesoura de microcirurgia. A cânula pode ser alimentado através do orifício usando um instrumento, o qual permite uma maior agilidade de se tentar efectuar esta porção do processo com a mão. Além disso, enquanto inicialmente alimentando a cânula, deve ser apontado diretamente para a bifurcação das veias porta esquerda e direita para evitar picar um buraco através da parede de trás da veia. Quando a ponta da cânula atinge a bifurcação, que pode então ser alimentado para dentro da veia esquerda específicoaliado. Uma vez que a cânula é introduzida na veia porta esquerda, que fornece tanto a esquerda e lobos medianos, a sua posição pode ser confirmada manualmente, sentindo-lo dentro da veia. A sua posição pode também ser confirmada através da injecção de uma pequena quantidade de solução salina fria e ver o efeito de branqueamento sobre os segmentos fornecidos do fígado.
O modelo de braçadeira hilar do fígado no rato fornece uma plataforma reprodutível e estável para demonstrando lesão isquémica e reperfusão hepáticas. Modelos braçadeira hilares variáveis têm sido utilizados pelos investigadores a estudar os efeitos protectores dos anti-oxidantes e outras pequenas moléculas de 6, 7, 8, 9, 10, 11, 12, 13, 14. Os pontos de variação incluem qual os vasos são braçadeira ed, que segmento são feitos isquémica, se ou não o ducto biliar está incluído e o comprimento do período de reperfusão de 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21. Além disso, quando este modelo é usado para estudar o impacto da administração de uma molécula da via de administração também é heterogéneo, 8, 10, 11,"> 12, 14, 15, 17, 18, 19, 21, 22, 23, 24. Existem várias vantagens para a abordagem descrita. Em primeiro lugar, a canulação directa do fornecimento portal para o segmento isquémica permite a entrega hepática segmentar directa de a substância farmacológica em estudo. Isto permite a utilização de outros lobos dos fígados como um controlo interno. em segundo lugar, a canulação hepática segmentar permite para um volume reduzido de distribuição para a molécula a ser estudado. Esta abordagem, assim, reduz o risco de efeitos colaterais sistémicos, a substância é injectada directamente para o fígado segmento de interesse. canulação directa do segmento hepático permite para a substância a ser entregue pré-isquemia, Intra-isquemia ou pós-isquemia. Isto permite para o estudo do efeito da molécula em qualquer ponto no ciclo a lesão de isquemia-reperfusão. Com o aumento da duração do tempo de isquemia e aumento do nível de lesão oportunidade adicional para estudar a regeneração hepática estaria disponível.
Há também algumas limitações desta abordagem. O primeiro é o custo start-up. A compra de um microscópio cirúrgico poderia ser um custo significativo start-up para um laboratório que já não possua um. Esta técnica pode ser difícil ou impossível sem um microscópio. O segundo é aprender tempo curva. Embora este procedimento é relativamente simples que requer alguma prática e é provável que um novato vai exigir um número significativo de procedimentos para se tornar um especialista.
Em resumo, este modelo permite uma plataforma reprodutível, simples e de baixo custo para estudar a lesão de isquemia-reperfusão hepática. Embora no protocolo aqui descrito polietileno glsuperóxido-dismutase ycol, um captador de radicais livres 25, foi infundido, este modelo pode ser usado para infundir uma variedade de diferentes substâncias farmacológicas, a fim de avaliar o seu impacto sobre a lesão de I / R no fígado.
Divulgações
Todos os autores relatam que eles não têm divulgações.
Agradecimentos
Nós gostaríamos de agradecer Dennis Mathias por seu trabalho ilustrativo. Este trabalho foi financiado pelo NIH T32AI 106704-01A1 eo Fundo T. Flesch de Transplante de Órgãos, Perfusão, Engenharia e Regeneração no The Ohio State University.
Materiais
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley Rat | Harlan Sprague Dawley Inc. | 200- 250 grams | |
| Surgical Microscope | Leica | M500-N w/ OHS | |
| Charcoal Canisters | Kent Scientific | SOMNO-2001-8 | |
| Isoflurane Molecular Weight 184.5 | Piramal Healthcare | ||
| Pressure-Lok Precision Analytical Syringe | Valco Instruments Co, Inc. | SOMNO-10ML | |
| Electrosurgical Unit | Macan | MV-7A | |
| Warming Pad | Braintree Scientific | HHP2 | |
| SomnoSuite Small Animal Anesthesia System | Kent Scientific | SS-MVG-Module | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Isoflurane chamber | Kent Scientific | SOMNO-0530LG | |
| SurgiVet | Isotec | CDS 9000 Tabletop | |
| Oxygen | Praxair | 98015 | |
| 27-0 Micro-Cannula | Braintree Scientific | MC-28 | |
| Rib retractors | Kent Scientific | INS600240 | |
| Polyethylene Glycol - Superoxide Dismutase (PEG-SOD) | Sigma Aldrich | S9549 SIGMA | |
| GenieTouch | Kent Scientific | ||
| Normal Saline | Baxter | NDC 0338-0048-04 | |
| 4 x 4 Non-Woven Sponges | Criterion | 104-2411 | |
| Sterile Q-Tips | Henry Schein Animal Health | 1009175 | |
| U-100 27 Gauge Insulin Syringe | Terumo | 22-272328 | |
| 5 mL Syringe | BD | REF 309603 | |
| 4-0 Braided Silk Suture | Deknatel, Inc. | 198737LP | |
| 7-0 Braided Silk Suture | Teleflex Medical | REF 103-S | |
| 1.8 mL Arcticle Cryogenic Tube | USA Scientific | 1418-7410 | |
| Microsurgical Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Scissors | Roboz | RS-5610 | |
| Large Scissors | S&T | SAA-15 | |
| Forceps - Large Angled | S&T | JFCL-7 | |
| Forceps - Small Angled | S&T | FRAS-15 RM-8 | |
| Clip Applier | ROBOZ | RS-5440 | |
| Scissors - non micro | FST 14958-11 | 14958-11 | |
| Forceps - Straight Tip | S&T | FRS-15 RM8TC | |
| Large Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-01 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-02 | |
| Small Microsurgical Clip | Fine Scientific Tools | 18055-03 | |
| Other Instruments | |||
| Name | Company | Catalog Number | Comments |
| Small Mosquito Clamps | Generic | ||
| Analysis | |||
| Name | Company | Catalog Number | Comments |
| Alannine aminotransferase (ALT) assay | Biovision | K752-100 | |
| Malondialdehye (MDA) assay | Abcam | ab118970 | |
| Glutathione (GSH) assay | Cayman Chemical | 7030002 | |
| Antibodies - Cleaved Caspase-3 and Actin | Cell Signaling Tecnology | Antibody 9661 | |
| ImageJ Software | National Institutes of Health | ||
| RIPA Lysis and Extraction Buffer | Millipore | 10-188 |
Referências
- Serracino-Inglott, F., Habib, N. A., Mathie, R. T. Hepatic ischemia-reperfusion injury. Am J Surg. 181, 160-166 (2001).
- Fondevila, C., Busuttil, R. W., Kupiec-Weglinski, J. W. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 74, 86-93 (2003).
- Kupiec-Weglinski, J. W., Busuttil, R. W. Ischemia and reperfusion injury in liver transplantation. Transplant Proc. 37, 1653-1656 (2005).
- OPTN. . Overall by Organ. Current US Waiting List. , (2016).
- OPTN. . Transplants in the US by Recipient ABO. , (2016).
- Tacchini, L., Radice, L., Pogliaghi, G., Bernelli-Zazzera, A. Differential activation of heat shock and nuclear factor kappaB transcription factors in postischemic reperfused rat liver. Hepatology. 26, 186-191 (1997).
- Palladini, G., et al. Lobe-specific heterogeneity and matrix metalloproteinase activation after ischemia/reperfusion injury in rat livers. Toxicol Pathol. 40, 722-730 (2012).
- Nakano, H., Kuzume, M., Namatame, K., Yamaguchi, M., Kumada, K. Efficacy of intraportal injection of anti-ICAM-1 monoclonal antibody against liver cell injury following warm ischemia in the rat. Am J Surg. 170, 64-66 (1995).
- Centurion, S. A., et al. Effects of ischemic liver preconditioning on hepatic ischemia/reperfusion injury in the rat. Transplant Proc. 39, 361-364 (2007).
- Kobayashi, H., et al. Role of endogenous nitric oxide in ischemia-reperfusion injury in rat liver. J Surg Res. 59, 772-779 (1995).
- Strifler, G., et al. Inhaled Methane Limits the Mitochondrial Electron Transport Chain Dysfunction during Experimental Liver Ischemia-Reperfusion Injury. PLoS One. 11, e0146363 (2016).
- Sarikus, Z., Bedirli, N., Yilmaz, G., Bagriacik, U., Bozkirli, F. The effects of epidural bupivacaine on ischemia/reperfusion-induced liver injury. Bratisl Lek Listy. 117, 41-46 (2016).
- Guimarães Filho, A. M., et al. Effect of remote ischemic preconditioning in the expression of IL-6 and IL-10 in a rat model of liver ischemia-reperfusion injury. Acta Cir Bras. 30, 452-460 (2015).
- Liu, Q. S., et al. Erythropoietin pretreatment exerts anti-inflammatory effects in hepatic ischemia/reperfusion-injured rats via suppression of the TLR2/NF-κB pathway. Transplant Proc. 47, 283-289 (2015).
- Montero, E. F., Quireze, C., d'Oliveira, D. M. Bile duct exclusion from selective vascular inflow occlusion in rat liver: role of ischemic preconditioning and N-acetylcysteine on hepatic reperfusion injury. Transplant Proc. 37, 425-427 (2005).
- Tártaro, R. D., et al. No protective function found in Wistar rats submitted to long ischemia time and reperfusion after intermittent clamping of the total hepatic pedicle. Transplant Proc. 47, 1038-1041 (2015).
- Yeh, D. Y., Yang, Y. C., Wang, J. J. Hepatic Warm Ischemia-Reperfusion-Induced Increase in Pulmonary Capillary Filtration Is Ameliorated by Administration of a Multidrug Resistance-Associated Protein 1 Inhibitor and Leukotriene D4 Antagonist (MK-571) Through Reducing Neutrophil Infiltration and Pulmonary Inflammation and Oxidative Stress in Rats. Transplant Proc. 47, 1087-1091 (2015).
- Kilicoglu, B., et al. Ultrastructural view of a promising anti TNF-α agent on hepatic ischaemia reperfusion injury. Bratisl Lek Listy. , 601-607 (2015).
- Jiménez Pérez, J. C., et al. Spironolactone Effect in Hepatic Ischemia/Reperfusion Injury in Wistar Rats. Oxid Med Cell Longev. , 3196431 (2016).
- Sano, N., et al. New drug delivery system for liver sinusoidal endothelial cells for ischemia-reperfusion injury. World J Gastroenterol. 21, 12778-12786 (2015).
- Chang, Y. K., Huang, S. C., Kao, M. C., Huang, C. J. Cepharanthine alleviates liver injury in a rodent model of limb ischemia-reperfusion. Acta Anaesthesiol Taiwan. , (2015).
- Lucas, M. L., Rhoden, C. R., Rhoden, E. L., Zettler, C. G., Mattos, A. A. Effects of L-arginine and L-NAME on ischemia-reperfusion in rat liver. Acta Cir Bras. 30, 345-352 (2015).
- Yeh, D. Y., Tung, S. P., Fu, Y. H., Yang, Y. C., Wang, J. J. Intravenous superoxide dismutase administration reduces contralateral lung injury induced by unilateral lung ischemia and reperfusion in rats through suppression of activity and protein expression of matrix metalloproteases. Transplant Proc. 47, 1083-1086 (2015).
- Yusen, R. D., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report-2015; Focus Theme: Early Graft Failure. J Heart Lung Transplant. 34, 1264-1277 (2015).
- Held, P. . An Introduction to Reactive Oxygen Species: Measurement of ROS in Cells. , 1-14 (2012).
- Gaweł, S., Wardas, M., Niedworok, E., Wardas, P. Malondialdehyde (MDA) as a lipid peroxidation marker. Wiad Lek. 57, 453-455 (2004).
- Beckman, J. S., et al. Superoxide dismutase and catalase conjugated to polyethylene glycol increases endothelial enzyme activity and oxidant resistance. J Biol Chem. 263, 6884-6892 (1988).
- Carlberg, I., Mannervik, B. Glutathione reductase. Methods Enzymol. 113, 484-490 (1985).
- Nguyen, W. D., Kim, D. H., Alam, H. B., Provido, H. S., Kirkpatrick, J. R. Polyethylene glycol-superoxide dismutase inhibits lipid peroxidation in hepatic ischemia/reperfusion injury. Crit Care. 3, 127-130 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados