需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
该Faix方法:生物油羰基官能团通过电位滴定法测定
摘要
Here we present a potentiometric titration technique for accurately quantifying carbonyl compounds in pyrolysis bio-oils.
摘要
是已知的存在于生物油的羰基化合物是负责在贮存和升级过程中生物油属性更改。具体地,羰基引起粘度生物油的储存期间的增加(通常被称为"老化")。因此,羰基含量以前已用作跟踪生物油的老化和缩合反应具有比粘度测量的变异较少的方法。此外,羰基还负责在生物油升级进程积炭。鉴于生物油羰基的重要性,它们的量化精确的分析方法可用于生物油社区非常重要的。长期以来被用于羰基含量在热解生物油的确定基于羰基肟化电位滴定方法。这里,我们提出的,其导致较少的反应时间的传统羰肟化的方法的改进,更小的样本大小,更高的精度,并且更ACC尿酸测定羰基。而传统的羰基肟化方法发生在室温下,这里提出的Faix方法时发生在升高的温度为80℃。
引言
而热解生物油是由大量的各种化合物和化学官能团,羰基的定量是特别重要的。羰基是公知的两个存储器1和处理2期间负责生物油的不稳定性。这里介绍的滴定法是一种简单的技术,它能够可靠地量化生物油的总羰基含量。只有醛和酮官能团使用这种方法量化;羧酸和内酯基团没有定量。
为生物油的分析,通过滴定羰基的量化历来使用尼古拉德斯3的方法来实现的。这种方法已在生物油文献4,5,6,7被广泛使用。这是一个简单的过程,其中羰基被转化为相应的肟( 见图1)。释出的盐酸用吡啶到平衡强行完成反应。吡啶的共轭酸滴定用NaOH(碱滴定剂)的已知量。使用氢氧化钠的当量数是按化学计量当量存在于生物油羰的摩尔数。
所述尼古拉德斯方法,但是,有一些限制。它可以要求反应时间超过48小时,达到完成。这严重限制了样品通量。它利用吡啶,其是有毒的。的1〜2克样品重量是必需的。使用样品重量是依赖于羟胺盐酸的存在量和样品的羰基含量。如果所使用的样品重量的初始估计是不正确的,滴定必须重复。
Faix 等。 8开发已被修改h的方法ERE解决方法尼古拉德斯的问题。该反应在80℃进行2小时,从而增加样品通量。吡啶已被替换为三乙醇胺,它是一种毒性较小的化学物质。样本大小可以减小到100至150毫克。三乙醇胺消耗释放的盐酸,驱动反应完成和未消耗的三乙醇胺是直接滴定。羟胺的第二个滴定是不必要的。这些滴定方法的比较表明,尼古拉德斯方法显著低估生物油9的羰基含量。
此处所描述的方法已经从原来的方法8修改成更适用于热解生物油的分析。这种方法对原材料热解生物油的分析开发的,但它已被成功地应用到其它类型的生物衍生的油,包括加氢处理的生物油。阿迪tionally,这种方法已被用于同时监测老化和升级过程中羰基含量的变化。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:请阅读开始之前所有相关的材料安全数据表(MSDS)。酒精是易燃品。所有相关化学品处理程序应遵循,以及所有适用的废一次性和处理程序。
1.试剂解决方案
- 制备羟胺盐酸盐溶液(溶液A):添加7.7克羟胺盐酸盐和50毫升去离子水至250毫升容量瓶中。当所有固体溶解,稀释用乙醇来标记。这导致在80%(体积/体积)乙醇中的0.55微米盐酸羟胺溶液。
- 制备三乙醇胺溶液(溶液B):加入17.4毫升的三乙醇胺到250毫升容量瓶中。添加10mL水,然后稀释到用乙醇标志。如果水的加入被跳过也可以使用95%的乙醇。这导致了0.48三乙醇胺的溶液在96%(体积/体积)乙醇
- 制备盐酸解。无论是购买0.1N的溶液或用10毫升浓准备HCl和1升的水。
2.生物油采样和处理
- 确保油样中抽取样品之前在室温下。 (通过剧烈振荡至少1分钟的混合,并目视检查样品以确保它是均匀的,有些生物油可能需要更长的振荡时间)充分均匀化生物油,得到有代表性的样品。
- 为生物油样品中,使用生物油为100至150毫克。
- 尽量减少暴露到氧气和热量,以防止在分析前样品降解。
3.分析程序
- 碱溶液的标准化
- 干燥的 Na 2 CO 3中在105℃的烘箱主标准过夜以确保一干燥样品。允许的 Na 2 CO 3称重前冷却到室温。
- 称重100至150毫克碳酸钠滴定容器,记录实际重量,加入搅拌棒和补充足够的水分,以覆盖pH电极灯泡和结。
- 将样品转移至滴定容器中,用乙醇和水分别洗涤反应瓶多次比例使乙醇/水的最终的80%溶液。使用自动滴定到终点的酸溶液滴定。记录端点。端点被定义为滴定曲线上的拐点。
- 重复该过程两次获得三分。
- 使用该平均值作为该酸溶液的正常性。
- 滴定空白的制备
- 对于空白答:加入0.5毫升二甲基亚砜(DMSO),以5毫升小瓶旋转叶片。
- 加入2毫升盐酸羟胺溶液(溶液A)。
- 加入2毫升三乙醇胺溶液(溶液B)。
- 盖紧瓶盖,置于预热(80℃)热器块或水浴,搅拌2小时。
- 使用自动滴定到终点记录端点酸溶液中,并滴定。
- 为空白B:如果无机酸被怀疑存在于样本中,添加0.5mL的DMSO中,5毫升小瓶使用旋叶片。
- 加入2毫升三乙醇胺溶液(溶液B)。
- 帽密封和搅拌在80℃进行2小时。
- 将样品转移至滴定容器中,用乙醇和水分别洗涤反应瓶多次比例使乙醇/水的最终的80%溶液。使用自动滴定到终点的酸溶液滴定。记录端点。
- 重复过程三次以获得三点。
- 使用公知的羰基的方法的验证
- 称取约100毫克4-(苄氧基)苯甲醛(4-BBA)到5毫升的小瓶,记录实际重量,增加一个旋转叶片。
- 添加0.5毫升DMSO中。
- 溶解在2mL盐酸羟胺溶液(溶液A)的样品。
- 加入2毫升三乙醇胺溶液(溶液B)。
- 关闭盖紧锅盖,搅拌在80℃2小时。
- 将样品转移至滴定容器中,用乙醇和水分别洗涤反应瓶多次比例使乙醇/水的最终的80%溶液。使用自动滴定到终点的酸溶液滴定。记录端点。
- 重复该过程三次,得到三点。
- 生物油的分析使用方法
- 权衡接近100毫克生物油至5ml小瓶中,记录实际重量并添加旋叶片。
- 添加0.5毫升DMSO中。
- 溶解在2mL盐酸羟胺溶液(溶液A)的样品。
- 加入2毫升三乙醇胺溶液(溶液B)。
- 关闭盖紧锅盖,搅拌在80℃2小时。
- 转让日Ë样品滴定容器中,在比例用乙醇和水分别洗涤反应小瓶几次,使乙醇/水的最终的80%溶液。使用自动滴定到终点的酸溶液滴定。记录端点。
- 重复该过程三次,得到三点。
- 坯料C:如果无机酸被怀疑存在于样本,称量接近100毫克生物油的成5毫升小瓶中,记录重量和添加旋叶片。
- 添加0.5毫升DMSO中。
- 加入2毫升三乙醇胺溶液(溶液B)。
- 帽密封和搅拌在80℃进行2小时。
- 将样品转移至滴定容器中,用乙醇和水分别洗涤反应瓶多次比例使乙醇/水的最终的80%溶液。使用自动滴定到终点的酸溶液滴定。记录端点。
- 重复过程三次以获得三点。
4.计算
- 碱溶液的标准化
- 计算使用下面的公式的酸溶液(摩尔/升)的浓度。干碳酸钠以克的重量为w 1,纯度被写入为分数( 即 ,99%是0.99),和端点处于毫升。
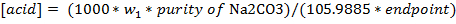
- 计算使用下面的公式的酸溶液(摩尔/升)的浓度。干碳酸钠以克的重量为w 1,纯度被写入为分数( 即 ,99%是0.99),和端点处于毫升。
- 使用公知的羰基的方法的验证
- 使用下列公式计算4BBA(摩尔/升)的样品中的浓度。该4BBA的以克的重量W 2,该4BBA纯度被写入为分数( 即 ,99%是0.99),酸溶液(摩尔/升)的浓度为[酸],三乙醇胺/羟胺•盐酸空白端点EP BA(三坯的平均值,以mL),并且端点是EP(以mL)。
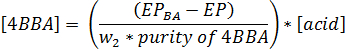
- 使用下列公式计算4BBA(摩尔/升)的样品中的浓度。该4BBA的以克的重量W 2,该4BBA纯度被写入为分数( 即 ,99%是0.99),酸溶液(摩尔/升)的浓度为[酸],三乙醇胺/羟胺•盐酸空白端点EP BA(三坯的平均值,以mL),并且端点是EP(以mL)。
- 生物油的分析
- 计算使用以下等式在生物油羰[CO](毫摩尔/克生物油)的浓度。生物油的以克的重量为w 3,所述酸溶液(摩尔/升)的浓度为[酸],三乙醇胺/羟胺•盐酸空白端点EP BA(三个坯料以mL的平均值) ,和端点是EP(以毫升)。

- 计算使用以下等式在生物油羰[CO](毫摩尔/克生物油)的浓度。生物油的以克的重量为w 3,所述酸溶液(摩尔/升)的浓度为[酸],三乙醇胺/羟胺•盐酸空白端点EP BA(三个坯料以mL的平均值) ,和端点是EP(以毫升)。
- 纠正酸
注:无机酸或有机酸与pKa值<2的存在会引起人为的低羰基值由于与三乙醇胺的酸的反应。- 如对此有怀疑,执行的部分3.2.6和3.4.8中详述的空白。生物油的样品中以克的重量是W 3,EP是样品的端点和EP,BA是三乙醇胺/羟胺空。 EP BB是空白B的终点,EP BC是空白C中使用的油空白C和重量(克)终点为W BC:
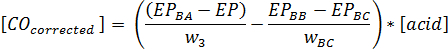
为主要包含乙酸生物油的样品,这是不必要的步骤。
- 如对此有怀疑,执行的部分3.2.6和3.4.8中详述的空白。生物油的样品中以克的重量是W 3,EP是样品的端点和EP,BA是三乙醇胺/羟胺空。 EP BB是空白B的终点,EP BC是空白C中使用的油空白C和重量(克)终点为W BC:
Access restricted. Please log in or start a trial to view this content.
结果
一个典型的滴定曲线由一个单一端点的, 如图2。为原料的生物油样品,和一个空白滴定典型滴定,被示出。作为终点在于在滴定曲线的拐点;端点可以通过绘制滴定曲线的一阶导数(在右侧轴上,DPH / DV所示,在图2中)容易地识别。许多自动滴定系统具有计算滴定曲线,它有时被称为端点识别条件(ERC)的衍生物的软件。
Access restricted. Please log in or start a trial to view this content.
讨论
代表滴定曲线示于图2。一个空白滴定,以及用于热解油样品滴定,被示出。此外,该滴定曲线(DPH / DV)的一次导数中示出,这允许容易识别滴定终点。关于图2中的插图表显示为热解油和空白滴定式三份的数据,以平均值和标准偏差。 (以mL)中所示的端点值在第4节用于计算所述热解油样中的总羰基含量(毫摩尔/克)。对于图2中所示的热解油滴定,生物油...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者什么都没有透露。
致谢
这项工作是由能源合同号DE-AC36-08GO28308美国能源部与美国国家可再生能源实验室的支持。通过能源效率的美国能源部办公室和可再生能源生物能源技术办公室提供资金。美国政府保留和发布,通过接受的文章发表,承认美国政府保留了非排他性的,缴足,不可撤销的,全球性的许可发布或转载本文的发表形式,或允许其他人这样做,对于美国政府的目的。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Analytical balance | accurate to 0.1 mg | ||
| dry block heater with magnetic stirrer, or hot water bath with magnetic stirrer | |||
| Automatic titrator | We used a Metrohm Titrando 809 automatic titrator, though other equivalent systems are acceptable | ||
| Deionized water | |||
| Ethanol (reagent grade) | CAS # 64-17-5 | ||
| Hydroxylamine hydrochloride | CAS # 5470-11-1 | ||
| Triethanolamine | CAS #102-71-6 | ||
| Hydrochloric acid (37%) | CAS # 7647-01-0 | ||
| Sodium Carbonate (primary standard) | SigmaAldrich | 223484 | |
| 4-(benzyloxy)benzaldehyde | CAS # 4397-53-9 | ||
| Dimethyl sulfoxide | CAS # 67-68-5 | ||
| 5 mL glass Reacti-vials with solid lid and teflon spinvane | Thermoscientific | TS-13223 | |
| 200 mL volumetric flask | |||
| Volumetric or mechanical pipettes |
参考文献
- Oasmaa, A., Kuoppala, E., Solantausta, Y. Fast pyrolysis of forestry residue. 2. physicochemical composition of product liquid. Energy Fuels. 17 (2), 433-443 (2003).
- Olarte, M., et al. Stabilization of Softwood-Derived Pyrolysis Oils for Continuous Bio-oil Hydroprocessing. Top. Catal. 59 (1), 55-64 (2016).
- Nicolaides, G. The chemical characterization of pyrolytic oils. , Dept. of Chemical Engineering., University of Waterloo. Waterloo, Ontario, Canada. MASc Thesis (1984).
- Oasmaa, A., Korhonen, J., Kuoppala, E. An approach for stability measurement of wood-based fast pyrolysis bio-oils. Energy Fuels. 25 (7), 3307-3313 (2011).
- Chen, C. L. Methods in Lignin Chemistry. Lin, S. Y., Dence, C. W. , Springer-Verlag. Berlin, Heidelberg, New York. 446-457 (1992).
- Scholze, B., Hanser, C., Meier, D. Characterization of the water-insoluble fraction from fast pyrolysis liquids (pyrolytic lignin) Part II. GPC, carbonyl groups, and 13C-NMR. J. Anal. Appl. Pyrolysis. 58-59, 387-400 (2001).
- Bayerbach, R., Meier, D. Characterization of the water-insoluble fraction from fast pyrolysis liquids (pyrolytic lignin). Part IV: Structure elucidation of oligomeric molecules. J. Anal. Appl. Pyrolysis. 85 (1-2), 98-107 (2009).
- Faix, O., Andersons, B., Zakis, G. Determination of Carbonyl Groups of Six Round Robin Lignins. Holzforschung. 52, 268-272 (1998).
- Black, S., Ferrell, J. Determination of Carbonyl Groups in Pyrolysis Bio-oils Using Potentiometric Titration: Review and Comparison of Methods. Energy Fuels. 30 (2), 1071-1077 (2016).
- Ferrell, J., et al. Standardization of Chemical Analytical Techniques for Pyrolysis Bio-oil: History, Challenges, and Current Status of Methods. Biofuels, Bioprod. Biorefin. 10, 496-507 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。