Method Article
分层膜片钳技术在学习诱导可塑性分析中的应用
摘要
切片膜片钳技术是一种有效的方法, 分析学习诱导变化的内在属性和可塑性的兴奋或抑制突触。
摘要
片式膜片钳技术是研究特定脑区学习诱发神经可塑性的有力工具。为了分析运动学习诱发的可塑性, 我们训练了大鼠使用加速转子杆任务。老鼠以30秒的间隔执行任务10次, 时间为1或2天。与第一次试验相比, 训练日的表现明显改善。然后, 我们在未经训练和训练的大鼠中, 准备了初级运动皮层 (M1) 的急性脑切片。电流钳分析显示休眠膜电位、穗阈值、afterhyperpolarization 和膜电阻在 II. 层锥体神经元中的动态变化。目前的注射诱导了2天训练的老鼠比未经训练的控制更多的峰值。
为了分析情境学习诱发的可塑性, 我们训练大鼠使用抑制性回避 (IA) 任务。在一个盒子的黑暗面经历了足部震动后, 老鼠学会了躲避它, 呆在明亮的一侧。我们准备了急性海马切片从未经训练的, IA 培训, 不成对, 和 walk-through 鼠。电压钳分析被用来连续记录微型兴奋和抑制突触后电流 (mEPSCs 和 mIPSCs) 从同一 CA1 神经元。在每个 CA1 神经元中, 我们发现了不同的平均 mEPSC 和 mIPSC 振幅, 提示每个神经元在兴奋和抑制突触时有不同的突触后强度。此外, 与未经训练的控制, IA 训练大鼠有较高的 mEPSC 和 mIPSC 振幅, 具有广泛的多样性。这些结果表明, 情境学习创造了突触后的多样性在兴奋和抑制突触在每个 CA1 神经元。
AMPA 或 GABAA受体似乎调解突触后的电流, 因为浴治疗与 CNQX 或荷包阻断 mEPSC 或 mIPSC 事件, 分别。这项技术可以用来研究不同类型的学习在其他地区, 如感觉皮质和杏仁核。
引言
膜片钳技术, 由内尔和 Sakmann 开发, 已被广泛应用于电生理学实验1。整个细胞膜片钳技术2可用于记录细胞内电流或电压使用的 gigaohm 密封的细胞膜。电流钳技术使我们能够分析不同的膜性能, 如休息电位, 电阻, 和电容3。电压钳技术使我们可以分析学习诱导突触可塑性在兴奋和抑制突触。
主要的运动皮层 (M1) 是一个中心地区, 是关键的, 使熟练的志愿运动。先前的电生理学研究表明, 在熟练的运动训练后的第二层/III. 型兴奋性突触中, 长期增增 (分层) 状可塑性的发展4。此外,在体内成像研究进一步证明了 M1 树突棘的重塑后, 一个熟练的到达任务5,6。然而, 学习诱发的突触和内在可塑性并没有在 M1 神经元中表现出来。
我们最近报道, 转子杆任务促进了谷氨酸和 gaba 突触的动态变化, 并改变了 M1 层 II/III 神经元的内在可塑性7。在这里, 我们使用切片膜片钳技术来研究学习诱导的可塑性。这项技术也可以用来研究其他类型的经验依赖的可塑性在其他脑区。例如, 感觉输入到桶皮层可以加强 AMPA 受体介导的兴奋性输入到第二层/III 型神经元8, 和暗示恐惧调理加强兴奋投入到侧杏仁核神经元, 这是必需的恐惧记忆9。此外, 情境学习在兴奋和抑制突触输入海马 CA1 神经元方面产生多样性10,11。
研究方案
所有动物的住房和外科手术都符合山口大学医学院动物实验的指导原则, 并得到山口机构动物保育和使用委员会的批准。大学.
1. 动物
- 使用4至5周龄的雄性大鼠 (产后28到31天).
- 将老鼠放在单独的塑料笼子里 (40 厘米和 #215; 25 厘米和 #215; 25 厘米), 在一个 1-小时的光/暗循环下保持恒温 (23 和 #176; c 和 #177; 12 和 #176; c)。给老鼠 ad 随意 访问水和食物.
2。转子杆测试
- 研究电机技能学习, 主题每鼠 到转子杆测试 (杆直径7厘米; 车道宽度8.9 厘米; 下降高度26.7 厘米) 为1或2连续天 ( 图 1A 在田 et al., 2016类 = "xref" > 7 )。在一个安静, 温度控制的房间 (23 和 #177; 1 和 #176; C) 执行任务。在测试前请勿打扰或处理老鼠.
- 将转子杆设置为加速模式, 从4轮/分钟到40轮/分钟 (8 和 #960;/分钟到80和 #960;/分钟) 在5分钟内线性增加.
- 把老鼠放在静止的旋转杆上。确认所有的四肢都在杆上.
- 测量从旋转杆跌落的滞后时间以评估马达性能.
- 允许每只老鼠10次尝试 (试验), 间隔30秒.
- 如果老鼠从旋转的杆子上掉下来, 在10-20 秒间隔后再把它放在标尺上. 在最后的试验结束后, 用过量的戊巴比妥 (400 毫克/千克) 30 分钟牺牲鼠。在自家的笼子里注射同样剂量的麻醉药来控制老鼠.
3。抑制性回避测试
- 调查上下文学习, 主题大鼠到抑制回避 (IA) 测试 ( 图 1D 在 Mitsushima et al., 2011, 2013 10 , 11 ) 避免在实验当天发生的任何偶发性体验, 例如与他人接触、保持笼子的变化或清洗。在一个安静, 温度控制的房间 (23 和 #177; 1 和 #176; C) 执行任务.
注: IA 训练装置为双腔亚克力盒 (长33厘米; 宽58厘米; 高33厘米)。它有一个点燃安全的一面和一个黑暗的震荡侧, 被一个陷阱门 ( 图 1D ) 隔开. - 将老鼠放在照明箱的安全 (点亮) 一侧。轻轻地把老鼠处理, 不受压力.
- 等待短时间 (10 到二十年代) 使老鼠适应环境.
- 打开滑动门, 允许老鼠按意愿进入黑盒子.
- 在老鼠进入盒子的新的黑暗面之前测量潜伏期。第一次试验的潜伏期代表了老鼠和 #39 在训练前的表现.
- 进入黑暗面后, 关上车门, 用电钢棒将电脚冲击 (2 秒, 1.6 毫安), 设置在盒子的地板上。允许 walk-through 鼠探索训练器械1分钟而不被电击。在一个发亮的休克笼内的房子不配对的大鼠几天, 突然给休克没有情节的经验。在任何组中轻轻地处理而不受压力.
- 将每只老鼠放在十年代的黑盒子里, 然后再把它归还给家里的笼子.
- 在足部休克后30分钟, 再把老鼠放到盒子的亮边。测量延迟进入黑暗面.
- 将鼠返回到主笼子.
- 在休克后60分钟, 以过量戊巴比妥 (400 毫克/千克) 为大鼠牺牲。轻轻地把老鼠的手, 注射麻醉腹腔。在未经训练的控制大鼠中, 在没有上述经验的情况下, 在自家的笼子里注射麻醉.
4。夹层缓冲
- 溶解0.195 克 NaH 2 PO 4 2H 2 O 的晶体, 0.188 克氯化钾, 0.074 g CaCl 2 , 1.423 g 氯化镁 2 -6H 2 O, 和 12.579 g 氯化胆碱在超纯水中 (900 毫升到950毫升).见表 1.
- 溶解2.340 克抗坏血酸、0.342 克丙酮酸钠盐、2.100 克 NaHCO 3 和4.500 克葡萄糖的晶体.
- 加水可达1000毫升。渗透的范围将在 290 mOsm/升和 300 mOsm/l 调整渗透通过添加超纯水, 如果它是在范围.
- 气泡的解决方案与 5% CO 2 /95% O 2 气体混合物在 ice-cold 温度为5分钟使用前.
5。人工脑脊液 (aCSF)
- 在超纯水 (4 毫升到2毫升) 中溶解0.186 克氯化钾、6.700 克氯化钠和 0.156 g NaH 2 PO 900 -2H 950 O 的晶体。见表 2.
- 气泡与气体混合物5分钟
- 溶解1.800 克葡萄糖和 2.184 g NaHCO 的晶体 3 , 然后添加 4 ml 氯化镁 2 和 4 ml CaCl 2 从 1 M 库存解决方案.
- 加水可达1000毫升。渗透的范围将在 290 mOsm/升和 295 mOsm/l 调整渗透通过添加超纯水, 如果它是在范围.
- 使用前用气体混合气泡.
6。胞内解决方案
- 用于当前钳形记录 (表 3), 溶解0.0746 克氯化钾, 6.089 克葡萄糖酸, 0.476 克 HEPES, 0.0456 g EGTA, 和500和 #181; L 氯化镁 2 从 1 M 库存解决方案在180毫升超纯水 (调整 pH 值到7.2 与 KOH)。
- 添加0.4408 克 na 2 -ATP, 0.0418 g na 3 GTP, 和 0.510 g na-磷酸。加水到200毫升, 并调整 pH 值到7.35 与 KOH.
- 通过添加超纯水将渗透调整到大约 290 mOsm/升.
- 存储为1毫升等分在冰箱 (-30 和 #176; C).
- 电压钳记录 (表 4), 溶解 5.244 g CsMeSO 3 , 0.672 g 中海, 0.476 g HEPES, 0.0456 g EGTA, 500 和 #181; L 氯化镁 2 从1米的库存解决方案180毫升超纯水。用 CsOH 调节 pH 值至7.2。对于 mEPSP 和 mIPSP 录音, 使用修改浓度5.814 克 CsMeSO 3 和0.252 克中海集运来调整 GABA A 受体应答的反转电位 11 。
- 添加0.4408 克 na 2 -ATP, 0.0418 g na 3 GTP, 和 0.510 g na-磷酸。加水到200毫升, 并调整 pH 值到7.35 与 CsOH.
- 通过添加超纯水将渗透调整到大约 290 mOsm/升.
- 存储为1毫升等分在冰箱 (-30 和 #176; C).
7。切片准备
- 在牺牲之前, 冷却所有带碎冰的解剖工具 ( 图 2A )。在粉碎的冰容器中加入约500毫升的冷水, 增加接触面面积。此过程以前被描述为 10 , 11 , 12 。 注: 这里的工具有: 大剪刀、虹膜剪刀、刮刀、微铲、镊子、镊子、不锈钢200毫升烧杯、用于大脑修整的刀片、120毫升心脏灌注注射器, 用气体混合物处理,硅胶管 (20 厘米) 连接到一个扁平的18口径针, 一个不锈钢的大脑解剖阶段 (厚度 = 3 毫米, & #981; = 12 厘米), 和一个安装阶段的 vibratome (和 #981; = 5 厘米).
- 在完成行为范式后, 麻醉30分钟, 通过过量戊巴比妥 (400 毫克/千克体重) 将其处死。快速执行切片准备, 以确保切片尽可能健康 10 , 11 , 12 。大脑机行动协议符合我们大学的所有兽医标准.
- 填充120毫升注射器与 ice-cold 解剖缓冲 (表 1) 冒泡与 5% CO 2 /95% O 2 气体混合物。在灌注之前要除去气泡.
- 在暴露心脏后, 将针插入左心室的后部.
- 使用注射器手动进行 transcardial 灌注。大鼠需要更多的解剖缓冲液进行灌注。淹没大脑与 ice-cold 解剖缓冲5分钟. 在浸没过程中连续冒泡缓冲区.
- 用刀片修剪大脑的后侧, 其角度与目标皮层区域的树突方向平行。由于大脑是站在解剖阶段与切割端底部, 初始角度确定所有后续脑切片的角度。此步骤 至关重要 ( 图 2B )。不正确的角度可能会穿透目标锥体神经元.
注意: 这里的工具是: 用于大脑修剪的刀片, 一张滤纸 (和 #981 = 10 厘米), 一个不锈钢的大脑解剖阶段 (厚度 = 3 毫米, 和 #981; = 12 厘米), 刮刀, 强力, 滴管, 和安装阶段的 vibratome (和 #981; = 5 厘米). - 用 vibratome 切割350和 #181; m 厚的冠状脑切片。用 5% CO 2 /95% O 2 气体混合物 ( 图 2C ) 填充 ice-cold 缓冲区冒泡的解剖室。在脑切片中连续气泡缓冲.
- 使用虹膜剪刀修剪目标区域的外围.
- 在室温下轻轻清洗修剪过的切片, aCSF 冒泡, 5% CO 2 /95% O 2 (表 2).
- 保持接口腔中的修剪切片, 直到执行录制 ( 图 2D 和 E )。在腔室中孵育1小时可以改善细胞的状况, 但如果切片的孵育时间超过10个小时, 则表型会发生变化。关闭箱盖, 将气体和小液滴 aCSF.
8。全细胞膜片钳
注意: 整个单元记录需要一个放大器和一个低通滤波器, 它被设置为5赫的截止频率。信号被数字化并且被存放在个人计算机。存储的数据是离线分析的 ( 图 3A ).
- 使用水平拉出器创建玻璃电极。用一个普通的聚乙烯1毫升注射器连接到一个精致的玻璃管和 0.22 #181; m 过滤器, 用一个合适的溶液 (表3和 4) 填充电极.
- 在与电池接触之前, 保持正压, 并将吸管电流调整为零.
- 在形成 gigaohm 密封后, 应用负压来破裂细胞膜 (整个单元配置在 图 3F ) 中.
9。当前钳位分析
- 细胞膜的特性
- 填充膜片记录管与细胞内解决方案的电流钳记录 (表 3)。吸管的阻力在4米和 #937 之间; 7 米和 #937; 在 aCSF.
- 膜片破裂后, 在 V 钳模式下按住-60 mV 的膜电压。然后, 切换 #34; 沐浴与 #34; 模式与 #34; 细胞与 #34; 膜测试模式使用软件来测量细胞膜电容、电阻和时间常数等固有的细胞特性.
- 当前注入研究
- 记录了内部单元属性后, 将模式从 V 形钳位切换到跟踪 (i = 0)/钳位正常的电流注入。请注意, 不应更正液结电位 10 .
- 将电流注入到单元格中300毫秒. 改变电流的强度逐步从和 #8722; 100 pa 到 +550 pa 与 50 pa 增量。计算当前注入引起的峰值 (动作电位) 的个数.
- 测量引起动作电位所需的最小电压 (这是阈值电压).
- 计算 afterhyperpolarization 振幅作为峰值起始电压和在 afterhyperpolarization 期间达到的最低电压之间的差异 7 .
10。电压钳分析
- AMPA/nmda 比率
注: AMPA/nmda 比值是一种常规的方法来评估突触后的可塑性谷氨酸兴奋性突触 7 , 8 , 9 , 10 , 11 . 但是, 请注意, 两个组件的伴随增加可能不会更改比率 13 。- 灌注将具有生理解决方案的记录室与气体混合物一起冒泡, 并保持22和 #176 的温度; c 到25和 #176; 添加 0.1 mM picrotoxin 以阻止 GABA A 介导的响应, 并添加4和 #181; M 2-氯以稳定诱发神经反应 14 .
- 用细胞内溶液填充电压钳记录的补丁记录管 (表 4)。检查 aCSF 中的记录吸管的电阻。电阻介于4米和 #937 之间; 7 米和 #937;.
- 用于记录 M1 中的 II/III 层锥体神经元, 放置双极性钨刺激电极200和 #181; m 到300和 #181; m 向要记录的单元的侧面, 在前肢表示的区域下方的脑膜表面 (2 毫米侧向中线) 15 , 16 , 17 .
- 对于记录在 CA1 锥体神经元, 将刺激电极200和 #181; m 到300和 #181; m 侧向 (谢弗侧枝纤维) 或内侧 (temporoammonic 通路) 的细胞将被记录 ( 图 3B ).
- 将刺激强度提高到突触反应和 #62; 10 pA
- 计算 AMPA/NMDA 比为峰值电流的比值和 #8722; 60 mv 到目前测量在 +40 mv 在150毫秒后, 刺激开始。注意, 50 到100的痕迹应该平均计算比率.
- 微型突触后的当前记录
注意: 微型兴奋性突触后电流 (mEPSCs) 被认为是对应于前释放一个单一泡谷氨酸 18.相比之下, 微型抑制突触后电流 (mIPSCs) 被认为是对应的反应引起的前释放单泡 GABA 18 。mEPSCs 和 mIPSCs 振幅的增加反映了突触后的传输增强, 而事件频率的增加则反映了功能突触的数量增加或前释放概率 11 .- 用修改后的胞内溶液 (表 4) 填充贴片记录吸管, 以调整 GABA A 受体介导的电流到-60 mV 的反转电位.
- 添加0.5 和 #181; 我的河豚毒素到浴缸, 以阻止自发动作电位.
- 按住-60 毫伏到 r 的电压ecord 5 分钟的 mEPSC 事件
- 将保留电位更改为 0 mV, 以记录 mIPSC 事件5分钟。由于 M1 神经元显示 AMPA 受体介导的电流的反转电位略高, M1 神经元的 mIPSCs 记录在 +15 mV, 0.1 毫米 APV.
- 等待几分钟以使电流稳定.
- 将 mIPSC 事件记录为5分钟
- 使用软件检测小型事件, 并使用 10 pA 以上的事件进行分析。计算5分钟的 mEPSCs 或 mIPSCs 事件的次数, 以确定频率。平均振幅的事件得到平均值的幅度.
- 确认是否使用10和 #181; m CNQX 或与10和 #181; m 荷包 methiodide 分别阻止 mEPSCs 和 mIPSCs 事件.
- 配对脉冲分析
注: 前可塑性可以用配对脉冲分析法进行分析。配对脉冲速率的增加表明前谷氨酸或 GABA 释放概率的降低 7 , 10 , 11 。- 分析兴奋性突触, 添加 0.1 mM picrotoxin 并记录-60 mV 的反应。虽然我们增加了4和 #181; M 2-氯到浴缸, 我们需要记住, 药物影响前释放概率 14 .
- 分析抑制突触, 增加0.1 毫米 APV 和4和 #181; M 2-氯到浴缸, 并记录在 0 mV 的反应。在 M1 神经元中, 记录 +15 mV 的反应.
- 应用配对脉冲, inter-stimulus 间隔为100毫秒或200毫秒
- 记录每个持有电位的50-100 连续跟踪值和平均值.
- 计算配对脉冲比为第二峰值与突触后电流的第一峰值的比值.
结果
正如我们最近描述的7, 转子杆训练 (图 1A) 导致了 M1 层 II/III 锥体神经元内在可塑性的动态变化。测量的潜伏期, 直到老鼠从旋转杆下降, 使我们能够估计的技能学习性能的大鼠。较长的延迟表示更好的马达性能。在训练的1天, 老鼠改进了他们的转子杆表现直到试验结束。在2天, 老鼠在平均会话分数 (图 1B) 中获得了近乎渐进的水平。与第一次试用时的滞后时间相比,事后分析在训练日的最后试验 (图 1C) 中显示了显著的改进。
图 4A显示了电流钳分析的一个例子, 其中神经元特性在运动技能学习后发生了变化。需要注射 400 pa 和 500 pa 电流, 以诱发非训练组和1天训练的大鼠的动作电位。相比之下, 仅注射 150 pA 电流就足以在2天训练的老鼠中诱发动作电位。当前强度与动作电位数之间的关系如图 4B所示。只有 50 pA 电流足以诱发2天训练的老鼠的峰值;相比之下, 1 天训练的老鼠比未训练的老鼠对 350 pA 和更高的电流反应较少动作电位。此外,图 4C显示1天训练的大鼠表现出较低的休眠电位、较高的穗阈值和更深的 afterhyperpolarization, 而2天训练的老鼠表现出更高的休眠电位 (图 4C) 和膜电阻 (图 4D)。
正如我们先前所描述的11, IA 训练 (图 1D) 在海马 CA1 神经元的兴奋和抑制突触中诱发突触后的可塑性。通过测量光盒中的潜伏期, 我们可以估计出大鼠的情境学习表现。图 1E显示 IA 任务的结果。在配对电击后, 老鼠学会避开盒子的暗面, 呆在点亮的一侧, 这通常是他们不喜欢的。因此, 避免黑暗面的倾向意味着获取上下文记忆。
图 5显示了一个电压钳分析的例子, 其中微型突触后电流在上下文学习之后发生了戏剧性的变化。为了研究学习诱导的可塑性, 自发 AMPA 介导的 mEPSCs 和 GABAA介导的 mIPSCs 是连续记录在0.5 µM 河豚毒素 (图 5A和B) 的存在。如 two-dimensional 图所示 (图形 5C), 每个 CA1 神经元对 mEPSCs 和 mIPSCs 均有不同的平均振幅。虽然振幅低, 并显示在未经训练的, 不成对, 和 walk-through 大鼠的分布范围狭窄, 这些都是不同的 IA 训练大鼠 (表 5)。方差分析后的事后结果表明, 在 IA 训练的大鼠 (图 5E) 中, mEPSC 和 mIPSC 的平均振幅显著增加, 这表明 CA1 神经元中的学习诱发后突触可塑性。
此外, 每个 CA1 神经元呈现不同的 mEPSC 和 mIPSC 频率 (图 5D)。虽然频率低, 并显示了一个狭窄的分布范围内未经训练, 不成对, 和 walk-through 大鼠, 这些都是不同的 IA 训练大鼠 (表 6)。方差分析后的事后结果显示, 在 IA 训练的大鼠中, mEPSC 和 mIPSC 事件的频率显著增加 (图 5F)。对这些结果有两种可能的解释。第一, 语境学习增加了神经元功能突触的数量。二是语境学习增加了谷氨酸和 GABA 的前释放几率。
为了进一步检查前的可塑性, 我们还进行了配对脉冲刺激, 如先前所报告的10,11。
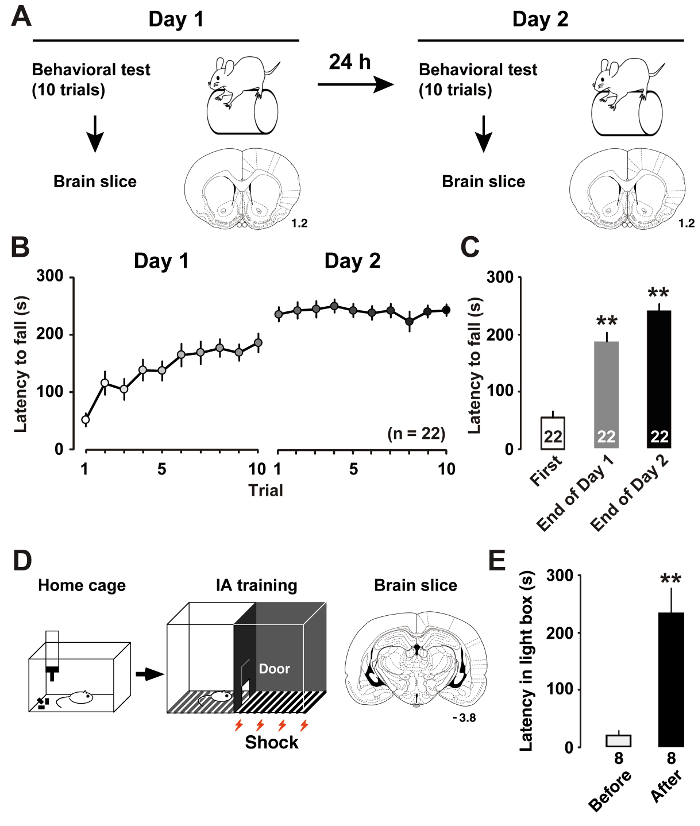
图 1: 训练后学习性能.
A: 实验设计显示了转子杆训练和冠状脑切片。B: 从加速转子杆筒中跌落的平均滞后时间。C: 在训练日1和 27的第一个和最后的试验中, 平均滞后时间将从标尺上脱落。**P和 #60; 0.01 vs.第一次试用。D: 抑制性回避 (IA) 任务和冠状脑切片的图式。E: 在 IA 训练之前和之后进入黑盒的平均滞后时间11。**P和 #60; 0.01 vs.在 IA 培训之前。由冠状部分的数字表明 bregma 在毫米前面的距离。动物的数量显示在酒吧的底部。误差线表示 SEM.请单击此处查看此图的较大版本.
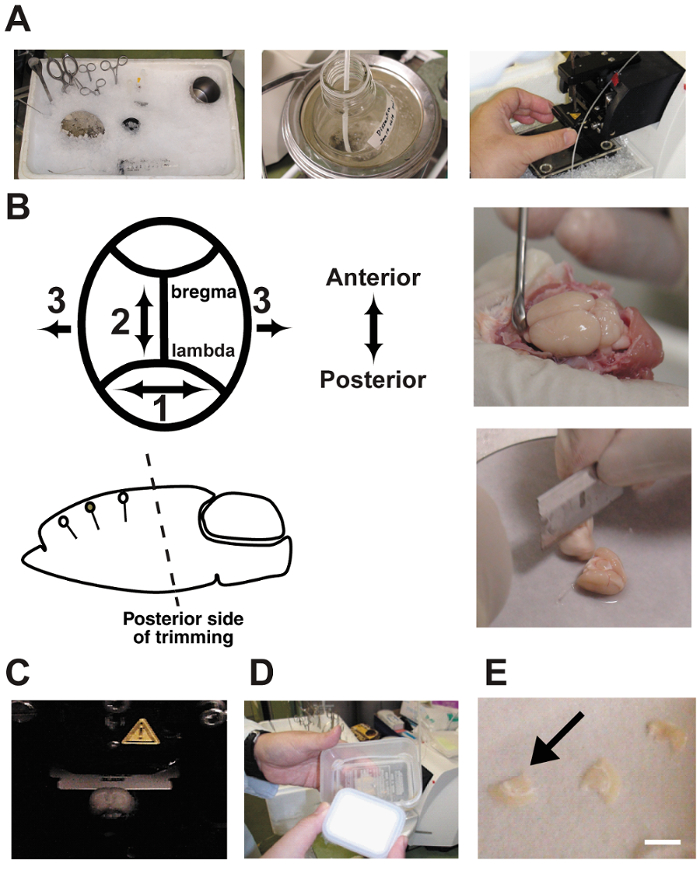
图 2: 切片过程.
A: 照片显示急性脑切片的制备。解剖工具被冷却在粉碎冰在使用之前。B: 大脑解剖和修剪。注意, 后侧修剪的角度必须与树突方向平行。C: 在 vibratome 室中将大脑切片。大脑是沐浴在解剖缓冲区和不断冒泡与 5% CO2/95% O2气体混合物。D: 由两个塑料食品容器和硅胶管组成的接口室。腔内充满了人工脑脊液, 并随着气体混合物不断起泡。E: 将脑切片放在室内的湿滤纸上。条形图 = 5 mm请单击此处查看此图形的较大版本.
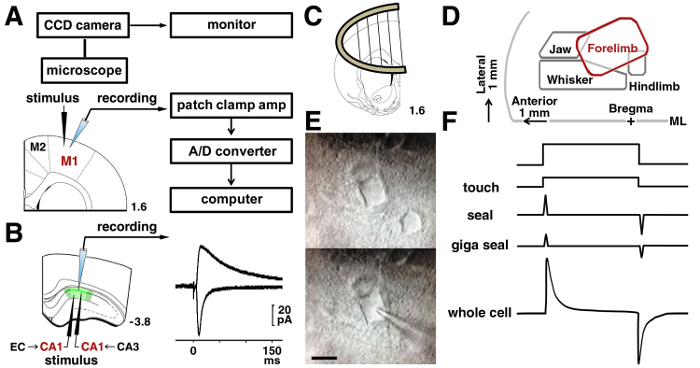
图 3: 膜片钳程序.
a: 用于记录神经元电信号的膜片钳系统。刺激和记录电极在二/III 层神经元的位置显示在大鼠运动皮层。B: 为了分析 CA1 锥体神经元的谢弗突触, 在地层 radiatum 处放置一个刺激电极。为了分析 temporoammonic 突触, 在地层 moleculare 放置一个刺激电极。示 AMPA 和 NMDA 受体介导的兴奋性突触后电流在同一 CA1 神经元的代表性痕迹。C: 在记录室中使用切片定位点来稳定切片。D: 根据已发表的论文15、16、17, 在马达皮层中的表示映射。ML = 中线。E:IR-DIC 显微的 M1 层 II/III 神经元之前, (上部) 和在录制期间 (较低)。Bar = 10 µm. F: 在触点 (顶部) 和膜破裂 (底部) 前的吸管电流发生变化。请单击此处查看此图的较大版本.
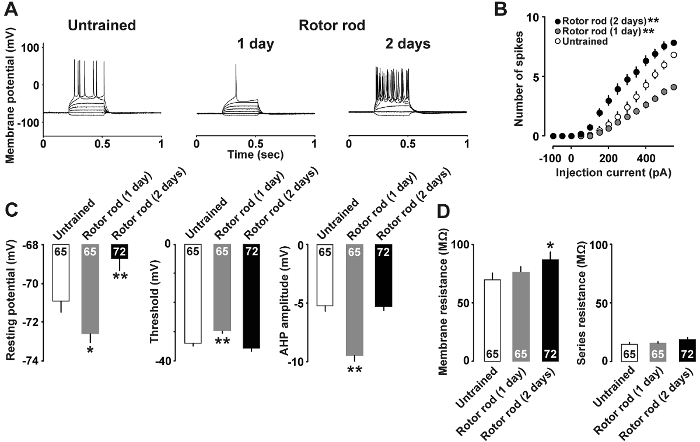
图 4: 当前钳位分析的代表性结果7 .
A: 有代表性的痕迹的动作电位记录后诱导与当前注射。B: 平均电流输入 (pA) 与动作电位输出 (从未训练的 (开放式酒吧)、1天训练 (灰条) 和2天训练的大鼠 (填充棒) 的脑切片之间的关系。C: 休眠电位, 阈值和 afterhyperpolarization 的第二层/III 型神经元。D: 神经元的膜电阻和串联电阻。我们每组使用 9-10 只老鼠。每个条形图中显示的单元格数。误差线表示 SEM. *p和 #60; 0.05, **p和 #60; 0.01与未经训练。请单击此处查看此图的较大版本.
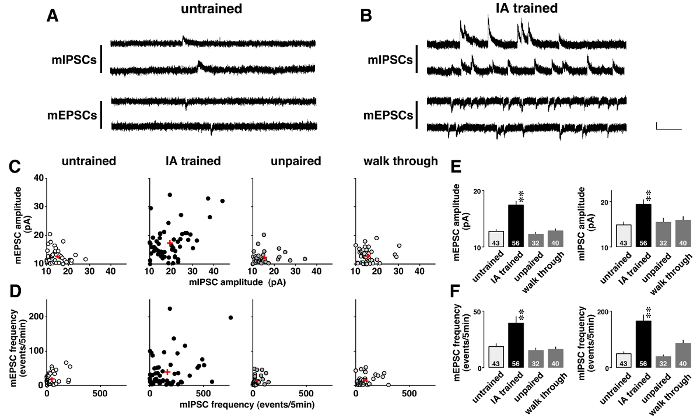
图 5: 电压钳分析的代表性结果11 .
典型的微量兴奋性和抑制性突触后电流 (mEPSCs 和 mIPSCs) 在未经训练的 (A) 和抑制性躲避 (IA) 培养的大鼠 (B)。在河豚毒素 (0.5 µM) 的存在下, 在同一 CA1 锥体神经元上依次测量了-60 mv 和 mIPSCs 0 mv 的 mEPSCs。竖条 = 20 pA, 水平条 = 200 毫秒. C: 在未经训练的、IA 训练的、不成对的和 walk-through 的大鼠中, 平均 I (I) PSC 振幅的二维图形。D: 4 组中的 I (I) PSC 频率的二维图形。注意, 每个 CA1 神经元表现出不同的平均我 (I) PSC 振幅和频率。IA 训练不仅加强了平均振幅(E), 而且增加了我 (I) PSC 事件(F) 的频率。我们每组使用 4-6 只老鼠。单元格的数目显示在条形图的底部。红色加号 (C、D) 和带有竖线 (E、F) 的条形图表示平均± SEM. **P和 #60; 0.01与未经训练的老鼠。请单击此处查看此图的较大版本.
| 夹层缓冲 (共 1L) | ||
| NaH2PO4 · 2H2O | 0.195 克 | 1.25 摩尔/升 |
| 氯化钾 | 0.188 克 | 2.5 摩尔/升 |
| CaCl2 | 0.074 克 | 0.5 摩尔/升 |
| 氯化镁2 · 6H2O | 1.423 克 | 7.0 摩尔/升 |
| 氯化胆碱 | 12.579 克 | 90摩尔/升 |
| 抗坏血酸 | 2.340 克 | 11.6 摩尔/升 |
| 丙酮酸 | 0.342 克 | 3.1 摩尔/升 |
| NaHCO3 | 2.100 克 | 25摩尔/升 |
| 葡萄糖 | 4.500 克 | 25摩尔/升 |
表 1:解剖缓冲区的配方
| 人工脑脊液 (共 1L) | ||
| 氯化钾 | 0.186 克 | 2.5 摩尔/升 |
| nacl | 6.700 克 | 114.6 摩尔/升 |
| NaH2PO4 · 2H2O | 0.156 克 | 1摩尔/升 |
| 葡萄糖 | 1.800 克 | 10摩尔/升 |
| NaHCO3 | 2.184 克 | 26摩尔/升 |
| 1M 氯化镁2 | 4毫升 | 4摩尔/升 |
| 1M CaCl2 | 4毫升 | 4摩尔/升 |
表 2:人工脑脊液处方 (CSF)
| 电流钳的胞内溶液 (共200毫升) | ||
| 氯化钾 | 0.0746 克 | 5摩尔/升 |
| 葡萄糖酸钾 | 6.089 克 | 130摩尔/升 |
| HEPES | 0.476 克 | 10摩尔/升 |
| egta | 0.0456 克 | 0.6 摩尔/升 |
| 1M 氯化镁2 | 500µL | 2.5 摩尔/升 |
| Na2 ATP | 0.4408 克 | 4摩尔/升 |
| Na3 GTP | 0.0418 克 | 0.4 摩尔/升 |
| Na 磷酸 | 0.510 克 | 10摩尔/升 |
表 3:当前钳位记录的胞内解决方案的配方
| 电压钳的胞内解决方案 (共200毫升) | ||||
| CsMeSO3 | 5 | |||
表 4:用于电压钳记录的胞内解决方案的配方
| 参数 | 训练 | IA 培训 | 对 | 走过 | |
| mEPSC 振幅 | 方差 | 5。8 | 32。1 | 4。7 | 5。9 |
| 标准偏差 | 2。4 | 5。7 | 2。2 | 2。4 | |
| 变异系数 | 0.189 | 0.326 | 0.177 | 0.190 | |
| mIPSC 振幅 | 方差 | 17。1 | 56。7 | 31。8 | 20。7 |
| 标准偏差 | 4。1 | 7。5 | 5。6 | 4。5 | |
| 变异系数 | 0.279 | 0.387 | 0.367 | 0.286 |
表 5: 抑制性避障 (IA) 培养的小鼠微型兴奋性和抑制性突触后电流 (mEPSC 和 mIPSC) 振幅的多样性
| 参数 | 训练 | IA 培训 | 对 | 走过 | |
| mEPSC 频率 | 方差 | 278 | 2195 | 188 | 195 |
| 标准偏差 | 17 | 47 | 14 | 14 | |
| 变异系数 | 0.902 | 1.198 | 0.893 | 0.874 | |
| mIPSC 频率 | 方差 | 3282 | 27212 | 1385 | 5135 |
| 标准偏差 | 57 | 165 | 37 | 72 | |
| 变异系数 | 1.195 | 1.006 | 0.955 | 0.836 |
表 6: 抑制性躲避 (IA) 培养的小鼠的微型兴奋性和抑制性突触后电流 (mEPSC 和 mIPSC) 频率的多样性
讨论
片式膜片钳技术的主要局限性是切片准备中的记录, 这可能无法反映在体内发生的情况。虽然体内的电流钳分析更可靠, 但从技术上来说, 从有意识的动物那里获得足够的数据是很困难的。由于每个锥体神经元具有不同的细胞性质, 需要足够数量的细胞来正确分析神经元在训练后的差异。此外, 电压钳分析需要持续的药物治疗与 CNQX, APV, 或荷包, 以确定后突触反应的性质。为了分析单泡谷氨酸或 GABA 诱发的微小反应, 需要对河豚毒素进行连续处理, 以阻断自发动作电位。虽然最近开发的光子成像技术是强大的分析形态学变化的兴奋性突触19, 需要一个组合膜片钳技术来分析的功能, 突触在体内。目前很难分析抑制突触的形态学变化, 因为大多数抑制突触不会形成棘。在这个时候, 切片膜片钳将是最适合的技术来分析细胞性质或功能的兴奋/抑制突触的训练动物。
使用电流钳分析 (图 4), 我们最近报告了运动学习诱导的内在可塑性的第二层/III 型神经元。具体地说, 1 天训练的大鼠表现出的休眠膜电位明显下降, 穗阈值增加。经过2天训练的大鼠, 休眠膜电位明显增加, 导致兴奋性增加。这些结果提示, 训练大鼠 M1 层 II/III. 型神经元的内在可塑性有动态变化。另外的电压钳分析显示在1天训练的大鼠中, 配对脉冲比的增加, 这表明在前 GABA 释放概率中有一个短暂的下降7。因此, 抑制在二/III 层突触中的 GABA 可能触发由此产生的 M1 的学习诱导可塑性。为了支持这一点, M1 的切片制备需要使用 GABAa受体阻滞剂来诱导20。
微型突触后电位的分析是一种强有力的方法, 以检测突触可塑性的 IA 训练动物。单 CA1 神经元的 mEPSCs 和 mIPSCs 的序贯记录可以分析每个神经元的突触兴奋/抑制强度。由于一个单一的我 (i) psc 的反应是归因于一个单一的泡谷氨酸或 GABA, 增加在我 (i) psc 振幅建议后突触强化。使用我 (I) PSC 分析, 我们发现每个 CA1 神经元的兴奋/抑制输入强度的个体差异 (图 5C)。IA 训练明显促进了突触强度的多样性, 但其他组未观察到这一点 (表 5)。
学习诱导的突触多样性可以从数学上进行分析。通过计算每个点的外观概率, 利用克劳德 e. 香农21的信息论, 可以将每个神经元的数据转换为 self-entropy (位)。一个点以高出现可能性 (在平均水平附近) 表明低 self-entropy, 而一个点以非常罕见的可能性 (一个偏离点) 表明高 self-entropy。与未训练的大鼠相比, 在 IA 训练的大鼠中, 每个神经元的 self-entropy 明显增加, 但不是未配对或 walk-through 大鼠22。这一分析表明, 在语境学习之后, intra-CA1 信息的增加。
切片膜片钳技术也可用于在侧杏仁核9和感觉经验研究在桶皮层8的线索恐惧条件反射研究。此外, 这种技术可以用于其他各种技术的进一步调查。例如, 病毒介导的绿色荧光蛋白 (GFP) 标记基因传递技术可以与膜片钳技术相结合, 来分析特定分子的功能。此外, 还可以使用逆行示踪剂的局灶显微注射来可视化特定区域的具体神经元。然后, 利用电流钳技术, 可以在可视化神经元23中分析细胞特异特性。此外, 结合双光子激光扫描显微镜与双光子激光 uncaging 的谷氨酸已被用来证明脊柱特异性生长和 "反应在小鼠皮层层 II/III 锥体神经元19。因此, 通过将它与新的化学物质、基因传递和照片操作技术相结合, 改进了切片膜片钳技术。
披露声明
作者声明没有利益冲突。我们确认, 我们已经阅读了《日刊》关于道德出版物所涉问题的立场, 我们申明本报告符合这些准则。资助者在研究设计、数据收集或分析、发布决定或原稿的准备方面没有作用。
致谢
我们要感谢 Dr. 的 Dr. Thiri 旷野和 Mrs. h. Tsurutani 的技术援助。该项目得到了补助金为青年科学家 (香港和林宏), 科学研究 B (博士), 科学研究 C (博士) 和创新领域 (博士), 从教育部, 文化, 体育, 科学和科学研究部的支持,日本的技术。
材料
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
参考文献
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。