Method Article
조각 패치 클램프 기술 학습 유도 소성을 분석 하기 위한
요약
조각 패치 클램프 기술 기본 속성 및 흥분 성의 또는 억제 시 냅 스의가 소성 학습 유도 된 변화를 분석 하기 위한 효과적인 방법입니다.
초록
조각 패치 클램프 기술 조사 특정 두뇌 지역에서 신경가 소성 학습 유도 위한 강력한 도구입니다. 모터-학습 유도 소성을 분석, 우리가 쥐 가속된 회전자 로드 작업을 사용 하 여 훈련. 쥐 1 개 또는 2 일에 대 한 10 번에서 30 s 간격으로 작업을 수행. 성능 첫 시험에 비해 훈련 일에 크게 개선 되었다. 우리는 다음 일반인 및 훈련 된 쥐에 기본 모터 피 질 (M1)의 급성 뇌 조각을 준비. 전류 클램프 분석 레이어 II/III 피라미드 뉴런에 막 잠재력, 스파이크 임계값, afterhyperpolarization, 고 막 저항 휴식에서 동적인 변화를 보였다. 현재 분사 유도 일반인된 컨트롤에 보다 2 일 훈련 된 쥐에 있는 많은 더 많은 스파이크.
상황별 학습 유도 소성을 분석, 우리가 쥐 금지 회피 (IA) 작업을 사용 하 여 훈련. 상자의 어두운 면에 발 충격을 경험한 후 쥐가 그것을 피하기 위해, 조명된 쪽에서 배웠습니다. 우리는 일반인, IA 훈련, 짝이 없는, 급성 hippocampal 슬라이스 및 실습 쥐 준비. 전압 클램프 분석 미니어처 흥분 성의 및 금지 postsynaptic 전류 (mEPSCs 및 mIPSCs) 동일한 CA1 신경에서 순차적으로 기록 하는 데 사용 되었다. 우리는 각 신경의 흥분 성의 억제 시 냅 스에서 다른 postsynaptic 강점 했다 제안 각 CA1 신경에서 다른 말은 mEPSC 및 mIPSC 진폭을 발견. 또한, IA 훈련 쥐 높은 mEPSC 및 mIPSC 진폭, 광범위 한 다양성을 했다 일반인 컨트롤과 비교. 이 결과 제안 상황별 학습 각 CA1 신경에서 흥분 성의 억제 시 냅 스에 postsynaptic 다양성을 만듭니다.
AMPA 또는 GABAA 수용 체 postsynaptic 전류 CNQX 목욕 치료 이후 중재 하 듯 또는 bicuculline 각각 mEPSC 또는 mIPSC 이벤트를 차단 합니다. 이 기술은 공부 감각 피 질, 편도 등의 다른 지역에서 배우기의 다른 종류를 사용할 수 있습니다.
서문
정치학자 그리고 Sakmann에 의해 개발 된 패치 클램프 기술 electrophysiological 실험1에 대 한 널리 사용 되었습니다. 전체 셀 패치 클램프 기술2 전류 세포내 또는 세포 막의 gigaohm 물개를 사용 하 여 전압을 기록 하는 데 사용할 수 있습니다. 전류 클램프 기술 잠재력, 저항 및 커패시턴스3휴식 같은 막 속성에 차이 분석할 수 있습니다. 전압 클램프 기술 흥분 성의 억제 시 냅 스에서 시 냅 스가 소성 학습 유도 분석할 수 있습니다.
기본 모터 피 질 (M1)은 숙련 된 자발적인 움직임을 만들기 위한 중요 한 중앙 지역 이다. 이전 electrophysiological 연구 시연 장기 potentiation (LTP)의 개발-같은 레이어 II/III 흥분 성의 synapses 숙련 된 모터 훈련4후에 소성. 또한, vivo에서 이미징 연구에 더 숙련 된 도달 작업5,6후 M1 모 수석 등뼈의 개장 시연. 그러나, 학습 유도 시 냅 스 하 고 본질적인 소성 되지 M1 뉴런에 표시 되었습니다.
우리는 최근로 터 로드 작업 승진 glutamatergic 동적 변화 및 GABAergic synapses 고 M1 층 II/III 신경7에 본질적인 소성 변경 했다. 여기 우리 학습 유도 소성 조사 조각 패치 클램프 기술 사용. 이 기술은 또한 다른 두뇌 지구에서 경험 종속 소성의 다른 종류를 조사 하기 위해 사용할 수 있습니다. 예를 들어 총 신 피 질에 감각 입력 AMPA 수용 체-중재 흥분 성의 입력을 레이어 II/III 신경8, 강화 수 있습니다 하 고 문장을된 두려움 컨디셔닝 강화 측면 편도 뉴런에 흥분 성의 입력이 필요 메모리9공포. 또한, 상황별 학습 hippocampal CA1 신경10,11에 흥분 성의 억제 시 냅 스 입력 측면에서 다양성을 만듭니다.
프로토콜
모든 동물 주택 외 과적 동물 실험의 야마구치 대학의과 대학에 대 한 지침에 따라 했다와 기관 동물 관리 및 사용 시 위원회에 의해 승인 되었다 대학.
1. 동물
- 4에 5-주-오래 된 남성 Sprague-Dawley 쥐 (나이의 출생 후 28 ~ 31 일)를 사용 하 여.
- 12 h 명암 주기에서 일정 한 온도 (23 ° C ± 1 ° C)에서 유지 개별 플라스틱 케이지 (40 ㎝ × 25 ㎝ × 25 ㎝)에 쥐를 집. 게 쥐 광고 libitum 액세스 물과 음식.
2. 로 터 로드 테스트
- 모터 기술 학습, 회전자 막대 시험에 각 쥐 주제 조사
- (막대 직경 7 cm, 차선 폭 8.9 cm;가 높이 26.7 cm) 1 개 또는 2 일 연속 ( 그림 1A 2016 국방 외에 < sup 클래스 = "외부 참조" > 7). 조용 하 고, 온도 제어 룸 (23 ± 1 ° C)에서 작업을 수행 합니다. 방해 하지 않거나 처리는 테스트 전에 쥐
- 4 회전/분 5 분에 40 회전/min (8 π/분 80 π/min)에서 선형으로 증가 하는 가속 모드로 회전자 막대 설정
- 휴식 회전 막대에 쥐를 넣어. 막대에 모든 사지 되는지 확인.
- 모터 성능을 평가 하기 위해 회전 막대에서가을 대기 시간을 측정.
- 허용 각 쥐 30의 간격으로 10 시도 (재판).
- 쥐 회전 막대에서 떨어지면, 설정 막대에 10-20의 간격 후 다시.
- 최종 재판 후 30 분 pentobarbital (400 mg/kg)의 과다와 쥐 희생. 자신의 집 새 마 취의 동일한 복용량 일반인된 제어 쥐를 주입.
3. 금지 회피 시험
- 조사 상황별 학습 주제 쥐 금지 회피 (IA) 테스트 ( 그림 1D에 Mitsushima 그 외 여러분, 2011, 2013 10 , 11) 피와 같은 실험의 날에 어떤 에피소드 경험 사람들과, 케이지 변경 또는 청소 문의. 조용 하 고, 온도 제어 룸 (23 ± 1 ° C)에서 작업을 수행.
참고: IA 교육 기구는 2 연 발 아크릴 상자 (길이 33cm, 폭 58cm, 높이 33 cm). 그것은 조명 안전 측면과 트랩 도어 ( 그림 1D)으로 구분 된 어두운 충격 측. - 조명된 상자의 안전 (조명된) 사이드에 쥐를 배치합니다. 스트레스 없이 부드럽게 쥐 처리.
- 대기 짧은 시간 (10 ~ 20 s) 환경에 쥐를 적응.
- 자유로이 어두운 상자 입력 쥐 수 있도록 슬라이딩 도어를 엽니다.
- 쥐 소설 어둠 상자를 입력 하기 전에 대기 시간 (s)를 측정 합니다. 첫 번째 재판의 대기 시간을 나타냅니다는 쥐 ' 훈련 전에 s 성능.
- 어둠으로 입장, 후 문을 닫고 스크램블된 전기 발 충격을 적용 (2 s, 1.6 mA) 설정 상자의 바닥에 전기 강철 막대를 통해. 실습 쥐 충격된 되지 않고 1 분 동안 훈련 장치를 탐험 하실 수 있습니다. 대 한 몇 가지 조명된 충격 장에 집 짝이 없는 쥐 일 갑자기 줄 에피소드 경험 없이 충격. 어떤 그룹에서 스트레스 없이 부드럽게 처리.
- 10 어둠 상자에 각 쥐를 계속 집 케이지를 반환 하기 전에 s.
- 에서 30 분 발 충격 후 다시 조명 상자에 쥐를 놓습니다. 어두운 면을 입력 대기 시간 측정.
- 홈 케이지를 쥐 반환.
- 에서 60 분, 충격 후 pentobarbital (400 mg/kg)의 과다로 쥐를 희생. 쥐를 부드럽게 처리 하 고 intraperitoneally 마 취 주사. 훈련 되지 않는 통제 쥐에 있는 위에서 설명한 경험 없이 자신의 집 새에 마 취 주사.
4. 해 부 버퍼
- 0.195 g NaH 2가 4-2 H 2 O, 0.188 g KCl, 0.074 g CaCl 2, 1.423 g MgCl 2-6 H 2 O, 12.579 g 콜린 염화 초순 (950 mL 900 mL)의 결정을 분해 . 표 1을 참조 하십시오.
- 2.340 g 아 스 코르 빈 산, 0.342 g pyruvic 산 나트륨 소금, 2.100 g NaHCO 3 및 4.500 g 포도 당 결정을 분해.
- 추가 최대 1000 mL 물. Osmolality의 범위 사이 있을 것입니다 290 mOsm/L 및 300 mOsm/l. 조정 osmolality 초순, 추가 하 여 범위 라면.
- 5% CO 2 솔루션 거품 / 95% O 2 가스 사용 하기 전에 5 분 동안 차가운 온도에서 혼합.
5. 인공 뇌 척수 (실제)
- 0.186 g 6.700 g NaCl, KCl과 0.156 g NaH 2 포의 해산 결정 4-2 H 2 O 초순 (950 mL 900 mL)에. 표 2를 참조 하십시오.
- 5 분에 대 한 가스 혼합물으로 거품
- 1.800 g 포도 당 및 2.184 g NaHCO 3의 결정을 분해 한 다음 4 mL MgCl 2와 4 mL CaCl 2 1 M에서 재고 솔루션 추가.
- 추가 최대 1000 mL 물. Osmolality의 범위 사이 있을 것입니다 290 mOsm/L 및 295 mOsm/l. 조정 osmolality 초순, 추가 하 여 범위 라면.
- 거품 사용 하기 가스 혼합물 전에와.
6. 세포내 솔루션
- 전류 클램프 녹음 (표 3), 0.0746 g KCl 해산, 대 한 6.089 g K-구 루 콘, 0.476 g HEPES, 0.0456 g EGTA, 500 µ L MgCl 2 1 M에서 주식 180 mL 초순에 솔루션 (pH 7.2 코와를 조정).
- 0.4408 g 나 2-ATP, 0.0418 g 나 3-GTP와 0.510 g Na-phosphocreatine
- 추가. 200 mL에 물을 추가 하 고 코와 함께 7.35에 pH 조정.
- 초순 추가 하 여 약 290 mOsm/l osmolality 조정.
- 1 mL aliquots 냉동 실 (-30 ° C)에 게.
- 전압 클램프 녹음 (표 4), 5.244 g CsMeSO 3, 0.672 g CsCl, 해산 대 0.476 g HEPES, 0.0456 g EGTA, 500 µ L MgCl 2 1 M에서 주식 180 mL 초순에 솔루션. 7.2 CsOH와에 pH를 조정 합니다. MEPSP 및 mIPSP 녹음, 수정된 농도 5.814 g CsMeSO 3와 0.252 g CsCl의 GABA A 수용 체 응답 11의 역 분개 잠재력을 조정 하려면 사용 합니다.
- 0.4408 g 나 2-ATP, 0.0418 g 나 3-GTP와 0.510 g Na-phosphocreatine
- 추가. 200 mL에 물을 추가 하 고 조정 CsOH 함께 7.35에 pH.
- 초순 추가 하 여 약 290 mOsm/l osmolality 조정.
- 1 mL aliquots 냉동 실 (-30 ° C)에 게.
7. 준비를 슬라이스
희생, 쿨 다운 ( 그림 2A) 얼음으로 모든 해 부 도구를- 이전. 접촉 표면 영역을 증가 얼음 용기에 냉 수의 약 500 mL를 추가 합니다. 이 절차를 설명 했다 이전 10 , , 11 12.
참고: 도구는 여기 있다: 큰가 위, 아이리스가 위, 주걱, 마이크로 주걱, 집게, 핀셋, 스테인리스 200 mL 비 커, 트리밍, 가스 혼합물으로 치료 해 부 버퍼 가득 120 mL 심장 관류 주사기 뇌에 대 한 블레이드는 일반된 18 게이지 바늘, 스테인리스 뇌 해 부 단계에 연결 된 실리콘 튜브 (20 cm) (두께 3 m m, ϕ = = 12 cm), 및 설치 단계는 vibratome에 대 한 (ϕ = 5 cm). - 는 Pentobarbital (400 mg/kg 체중)의 과다와 함께 그것을 마비 하 여 행동 패러다임을 완료 한 후 30 분 쥐를 희생. 빠르게 되도록 조각 가능한 10 , , 11 12로 건강 슬라이스 준비를 수행 합니다. 두뇌 extr동작 프로토콜 우리 대학에 대 한 모든 수의 기준에 부합.
- 차가운 해 부 버퍼 (표 1) 120 mL 주사기 5% CO 2 부풀어 채우기 / 95% O 2 가스 혼합물. 관류 전에 모든 기포를 제거.
- 마음, 노출 후 좌 심 실의 후부 부분에 바늘을 삽입.
- 수행 transcardial 관류 주사기를 사용 하 여 수동으로 하는 두뇌의. 큰 쥐 관류에 대 한 더 많은 해 부 버퍼를 필요로합니다. 5 분 거품 버퍼에 대 한 차가운 해 부 버퍼와 두뇌는 침수 동안 지속적으로 잠수함.
- 트림 블레이드를 사용 하 여 대상 피 질 영역의 수지상 방향 각도 동시에 두뇌의 후부 측면. 때문에 두뇌는 컷된 끝 아래쪽으로 해 부 무대에 서 서, 초기 각도를 모든 후속 뇌 조각의 각도를 결정 합니다. 이 단계는 매우 중요 하다 ( 그림 2B). 잘못 된 각도 대상 피라미드 뉴런을 통해 잘라 수 있습니다.
참고: 여기에 도구는: 두뇌 트리밍에 대 한 블레이드, 필터 종이 (ϕ = 10 cm), 스테인리스 뇌 해 부 무대 (두께 3 m m, ϕ = = 12 cm), 주걱는 superglue, 스 포 이트, 및 설치 단계는 vibratome에 대 한 (ϕ = 5 cm). - 는 350 µ m는 vibratome를 사용 하 여 두꺼운 코로나 뇌 조각 잘라. 얼음 처럼 차가운 버퍼와 해 부 챔버 5% CO 2 부풀어 채우기 / 95% O 2 가스 혼합물 ( 그림 2C). 뇌 조각 동안 지속적으로 버퍼를 거품.
- 아이리스가 위를 사용 하 여 대상 영역의 주변 트림.
- 세척 실제 실 온에서 부드럽게 손질된 조각 부풀어 5% CO 2 / 95% O 2 (표 2). 녹음 때까지 인터페이스 챔버를
- 유지는 손질된 조각 ( 그림 2D 및 E)를 수행 합니다. 1 h는 챔버에 대 한 보육은 셀의 상태를 개선 하지만 고기 조각 이상 10 시간 동안 알을 품는 경우 변경. 묶을 가스 챔버의 뚜껑을 닫고 실제의 작은 액체 방울.
8. 전체 셀 패치 클램프
참고: 전체 셀 녹음 필요 앰프와 저역 통과 필터를 5 kHz의 컷오프 주파수로 설정 되어. 신호는 디지털화 하 고 PC에 저장. 저장 된 데이터는 분석 오프 라인 ( 그림 3A).
- . 적합 한 솔루션 (표 3 및 4) 전극 채우기 좋은 유리 튜브와 0.22 μ m 필터에 연결 된 일반 폴 리 에틸렌 1 mL 주사기를 사용 하 여.
- 셀과 접촉, 이전 긍정적인 압력을 유지 하 고 전류 0를 피펫으로 조정.
- Gigaohm 물개를 형성 후 세포 막 ( 그림 3 층에 전체 셀 구성) 파열 부정적인 압력 적용.
9. 전류 클램프 분석
- 세포 막의
- 속성 입력 전류 클램프 녹음 (표 3)에 대 한 세포내 솔루션 펫을 기록 하는 패치. 4 m ω 및 7 m ω는 실제 사이 피 펫의 저항입니다.
- 막 파열 후-60에서 막 전압을 잡고 mV V-클램프 모드에서. 다음,에서 전환 " 목욕 " 모드를 " 셀 " 막 커패시턴스, 저항 및 시간 상수 등 기본 셀 속성을 측정 하는 소프트웨어를 사용 하 여 막 테스트에서 모드.
- 현재 주입 연구
- 기본 셀 속성을 기록한 후 트랙에 V-클램프에서 모드 전환 (나 = 0) 현재 분사에 대 한 /I-CLAMP 정상. 액체 접합 잠재력 여야 수정된 10.
- 300 부인에 대 한 현재 셀에 넣기에서 stepwise 전류의 강도 변경할 − 50 pA 증가와 +550 pA 100 pA. 스파이크 (활동 전위) 현재 주사 하 여 elicited 개수.
- (이) 활동 전위를 유도 하는 데 필요한 최소 전압 측정.
- Afterhyperpolarization 진폭 스파이크 개시에서 전압과 최저 전압 afterhyperpolarization 7 동안 달성 간의 차이 계산.
10. 전압 클램프 분석
- 는 AMPA/NMDA 비율
참고: The AMPA/NMDA 비율은 glutamatergic 흥분 성의 시 냅 스 7 , 8에 postsynaptic 소성을 평가 하는 기존의 방법 , 9 , 10 , 그러나 11., 두 구성 요소에 있는 수 반하는 증가 비율 13을 변경 하지 될 수 있습니다 주의.- Perfuse 생리 적인 솔루션으로 녹음 실 가스 혼합물으로 부풀어 및 GABA A-응답을 중재 하 고 4 µ M 2를 추가-차단 솔루션에 25 ° C. 추가 0.1 m m picrotoxin에 22 ° C에 온도 유지 chloroadenosine 안정 갖는 신경 응답 14.
- 입력 전압 클램프에 대 한 세포내 솔루션 펫 녹음 패치 녹음 (표 4). 에 실제 기록 피 펫의 저항을 확인 하십시오. 4 m ω 및 7 m ω 사이 성이.
- M 1에서 레이어 II/III 피라미드 뉴런에 녹음 장소 바이 폴라 텅스텐 전극 200 µ m forelimb 표현의 영역에서 pial 표면 아래 기록에 있는 셀에 300 µ m 측면에 자극 (2 mm 옆에는 중간 선) 15 , , 16 17.
- CA1 피라미드 신경에 기록를 위해 300 µ m 측면 (Schaffer 부수적인 섬유)을 자극 전극 200 µ m 또는 중간 (temporoammonic 통로) 됩니다 셀에 기록 ( 그림 3B).
- 시냅틱 응답까지 자극 강도 증가 > 10 실바
- AMPA/NMDA 비율 계산에서 측정 된 피크 전류 비율 − 60 현재 mV 측정 + 40 mV 150에 자극 발병 후 밀리초. 비율을 계산 50 ~ 100 트레이스를 평균 한다 참고.
- 미니어처 postsynaptic 현재 녹음
참고: 미니어처 흥분 성의 postsynaptic 전류 (mEPSCs) 조미료의 단일 기의 연 접 릴리스에 의해 elicited 응답에 해당 하 고 생각 된다 18 . 반면, 소형 금지 postsynaptic 전류 (mIPSCs) 해당 GABA 18의 단일 기의 연 접 릴리스에 의해 elicited 응답 하 생각 된다. MEPSCs 및 mIPSCs의 진폭에 있는 증가 반영 postsynaptic 전송 강화, 증가 하면서 주파수 기능 시 냅 스 연 접 릴리스 확률의 수에 있는 증가 반영 하는 이벤트에 11 .- -60에 수정 된 세포내 솔루션 (표 4) 조정의 GABA A 수용 체-중재 전류 반전 잠재력을 패치 기록 피 펫을 채우기 mV.
- 자발적인 활동 전위를 막기 위하여 목욕에 추가 0.5 µ M 테트로도톡신.
- 보류-60에서 전압 mV r ~ecord 5 분에 대 한 mEPSC 이벤트
- 변경 0으로 잠재적인 지주 mV 5 분에 대 한 기록 mIPSC 이벤트 ~. M 1 뉴런의 mIPSCs + 15에 기록 됩니다 때문에 m 1 뉴런 약간 높은 반전 AMPA 수용 체-중재 전류에 대 한 잠재적인 표시, 0.1 m m APV mV.
- 전류 안정화를 위한 몇 분 동안 기다려.
- 5 분에 대 한 mIPSC 이벤트 기록
- 는 소프트웨어를 사용 하 여 미니어처 이벤트를 감지 하 고 10 pA 위의 이벤트를 사용 하 여 분석에 대 한. 주파수를 결정 하기 위해 5 분 동안 mEPSCs 또는 mIPSCs 이벤트의 수를 계산 합니다. 평균 평균 진폭을 얻기 위해 이벤트의 진폭.
- 목욕 치료 10 µ M CNQX 또는 10 µ M bicuculline methiodide mEPSCs 및 mIPSCs 이벤트를 각각 차단 여부 확인.
- 쌍 펄스 분석
참고: 연 접가 소성 결합 펄스 분석을 사용 하 여 분석 될 수 있다. 짝 주파수 증가 제안 연 접 조미료에 감소 또는 GABA 해제 확률 7 , , 10 11.- 흥분 성의 시 냅 스를 분석 하 고, 0.1 m m picrotoxin를 추가 하 고-60에 대 한 응답을 기록 하는
- mV. 비록 우리가 목욕에 4 µ M 2-chloroadenosine를 추가, 우리는 약 연 접 릴리스 확률 14에 영향을 염두에 두어야 필요.
- 억제 시 냅 스를 분석 하는 목욕을 0.1 mM APV 4 µ M 2-chloroadenosine를 추가 하 고 0 응답 기록 mV. M1 뉴런에 + 15에 응답 기록 mV.
- 100 ms 또는 200 양 간 자극 간격 쌍된 펄스를 적용
- 각 잠재적인 들고에서 50-100 순차적 추적을 기록 하 고 평균 값.
- Postsynaptic 현재 첫 번째 피크에 대 한 두 번째 피크의 비로 짝된 펄스 비율 계산.
결과
우리가 설명 했 듯이 최근7, 회전자 봉 훈련 (그림 1A) m 1 층 II/III 피라미드 뉴런의 본질적인 소성에서 동적인 변화를 유도 한다. 대기 시간을 측정 하는 쥐 회전 막대에서가까지 쥐의 숙련 된 학습 성능을 측정 하 수 있습니다. 긴 대기 시간 더 나은 모터 성능을 나타냅니다. 교육의 날 1, 쥐 재판이 끝날 때까지 그들의 회전자 로드 성능 향상. 평균된 세션에서 하루 2, 쥐 달성 거의 점근 수준에 점수 (그림 1B). 첫 번째 재판에서 대기 시간와 비교 게시물-특별 분석 훈련 일 (그림 1C)에 최종 재판에서 상당한 개선을 보여주었다.
그림 4A 전류 클램프 분석 모터 기술 학습 후 신경 속성 변경의 예가 나와 있습니다. 400 pA 및 pA 전류 500의 각각 활동 전위 일반인된 그룹 및 1 일 훈련 된 쥐를 유도 하기 위해 필요 했다. 반면,만 150 파 전류 주입 2 일 훈련 된 쥐에 있는 활동 전위를 유도 하기에 충분 했다. 활동 전위의 수와 현재 강도 간의 관계는 그림 4B에 표시 됩니다. 작은 50 pA 현재 2 일 훈련된 쥐;에 스파이크를 유도 하기에 충분 했다 반면, 1 일 훈련된 쥐 350 pA와 더 높은 전류를 쌓지 않은 쥐 보다 적은 활동 전위와 반응. 또한, 그림 4C 는 1 일 훈련된 쥐 보였다 낮은 휴식 잠재력, 반면 2 일 훈련된 쥐 보여준 높은 휴식 잠재력 (그림 4C)와 막 저항 (높은 임계값, 그리고 깊은 afterhyperpolarization, 스파이크 그림 4D)입니다.
앞에서 설명한 우리11, IA 훈련 (그림 1D) hippocampal CA1 신경의 흥분 성의 억제 시 냅 스에 postsynaptic 소성을 유도 한다. 라이트 박스에서 대기 시간을 측정 하 여 쥐의 상황별 학습 성능을 예상 수 있습니다. 그림 1E IA 작업의 결과 보여 줍니다. 쌍을 이루는 전기 충격 후 쥐 상자의 어두운 면을 방지 하 고 그들은 일반적으로 선호 하지 조명된 측면에서 배워야만. 어둠을 피하기 위해 경향이 따라서 문맥상 기억의 인수를 나타냅니다.
그림 5 는 미니어처 postsynaptic 전류 극적으로 상황별 학습 후 변경 된 전압 클램프 분석의 예가 나와 있습니다. 조사 학습 유도 소성, 자발적인 AMPA 중재 mEPSCs 및 GABAA-중재 mIPSCs 0.5 µ M 테트로도톡신 (그림 5A 와 B)의 순차적으로 기록 되었다. 2 차원 플롯 (그림 5C)에 표시 된 대로 각 CA1 신경 mEPSCs 및 mIPSCs에 대 한 다른 말은 진폭을 했다. 진폭 낮은 좁은 범위에 보였다 했지만 일반인, 홀, 도보 쥐 그 IA 훈련 쥐 (표 5)에 다양 한 했다. 다음 post hoc 분석 ANOVA 보였다 mEPSC의 평균 진폭에 있는 상당한 증가 및 mIPSC IA 훈련 쥐 (그림 5E) CA1 신경 세포에 postsynaptic 소성 학습 유도 제안.
또한, 각 CA1 신경 다른 mEPSC와 mIPSC 주파수 (그림 5D) 전시. 주파수 낮은 좁은 범위에 보였다 했지만 일반인, 홀, 도보 쥐 그 IA 훈련 쥐 (표 6)에 다양 한 했다. 다음 post hoc 분석 ANOVA IA 훈련 쥐 (그림 5 층)에서 mEPSC 및 mIPSC 이벤트의 주파수에서 상당한 증가 보였다. 이러한 결과의 2 개의 가능한 해석이 있다. 첫 번째는 상황별 학습 기능 시 냅 스는 신경 세포의 수를 증가 했다. 다른 상황별 학습 조미료와 GABA의 연 접 릴리스 확률 증가입니다.
추가 검사 연 접가 소성, 우리 또한 실시 짝 펄스 stimulations, 이전10,11보고.
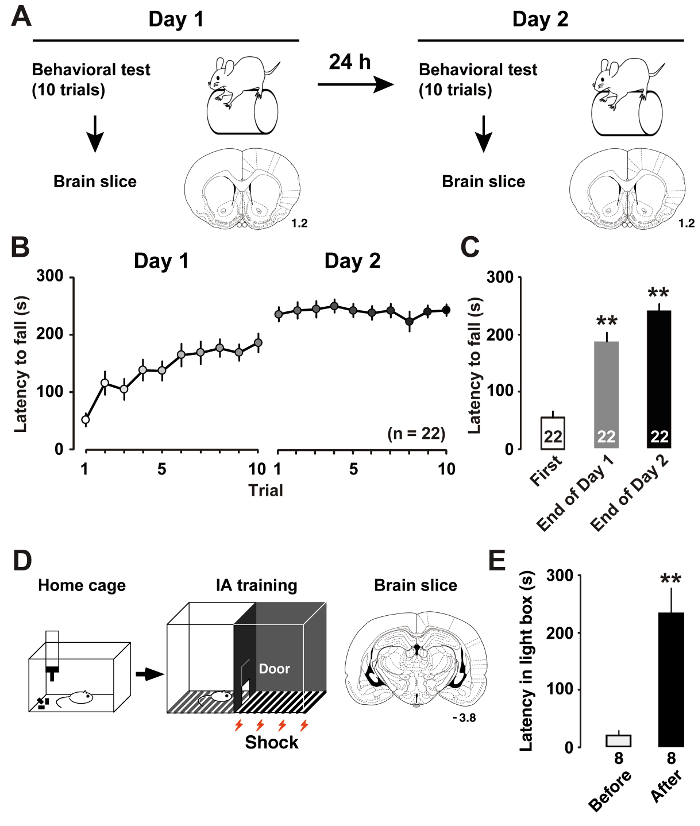
그림 1 : 학습 훈련 후.
A: 실험 설계 회전자 봉 교육 및 코로나 뇌 조각을 보여줍니다. B: 가속 회전자 봉 총 신에서가을 대기 하는 평균 시간. C: 평균 대기 시간 막대의 첫 번째 훈련 1-2 일7에 최종 재판에가을. P< 0.01 대 첫 재판. D: 금지 회피 (IA) 작업 및 코로나 뇌 조각의 스키마. E: IA 훈련11전후 어두운 상자를 입력 대기 하는 평균 시간. P< 0.01 대 IA 훈련 하기 전에. 코로나 섹션으로 숫자 m m에서 bregma에 앞쪽 거리를 나타냅니다. 동물의 수는 막대의 아래쪽에 표시 됩니다. 오차 막대 표시 SEM. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
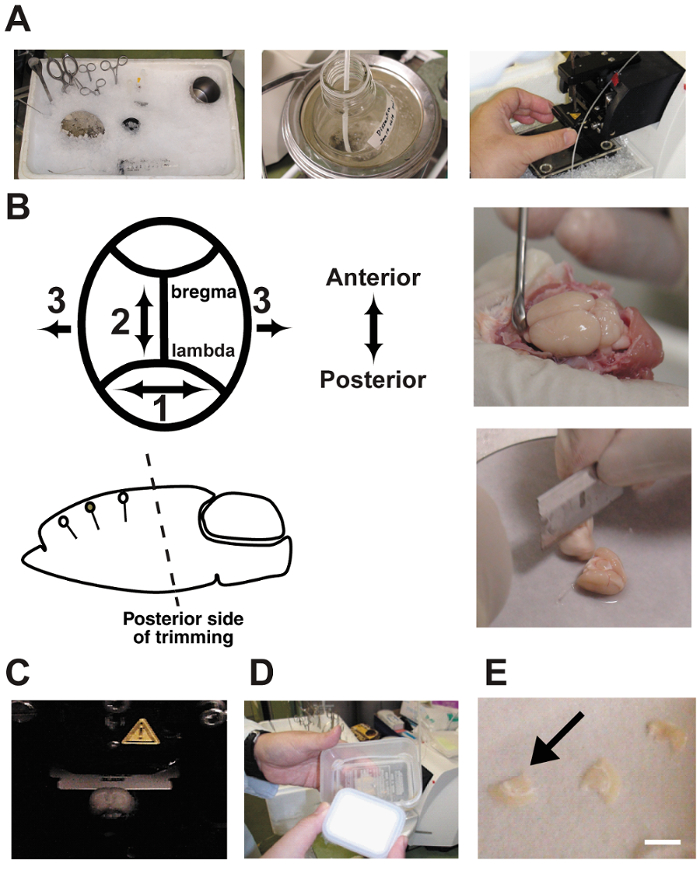
그림 2 : 슬라이스 절차.
A: 사진 보여 급성 뇌 조각 준비. 해 부 도구는 사용 하기 전에 얼음에 냉각 했다. B: 뇌의 해 부와 트리밍. 참고 수지상 방향으로 동시에 후부 측면에서 트리밍의 각도 지향 합니다. C: vibratome 챔버에 두뇌를 슬라이스. 뇌 해 부 버퍼에 목욕 하 고 지속적으로 5% CO2/95% O2 가스 혼합물으로 부풀어. D: 인터페이스 챔버를 두 개의 플라스틱 식품 용기 및 실리콘 튜브의 만든. 챔버 인공 CSF로 가득 했 고 가스 혼합물으로 지속적으로 부풀어. E: 뇌 조각 챔버에서 필터 종이에 배치 했다.바 = 5 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
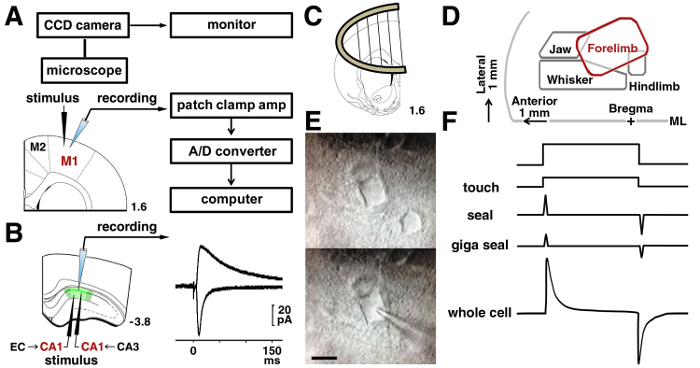
그림 3 : 패치 클램프 절차.
A: 신경에서 전기적 신호를 기록 하는 데 사용 하는 패치 클램프 시스템. 자극 하 고 레이어 II/III 뉴런에서 녹음 하는 전극의 위치는 쥐 모터 피 질에 표시 됩니다. B: CA1 피라미드 뉴런의 Schaffer 시 냅 스를 분석 하는 자극 전극 지층 radiatum에 배치 했다. Temporoammonic 시 냅 스를 분석 하는 자극 전극 지층 moleculare에 배치 했다. 대표 흔적 갖는 AMPA와 NMDA 수용 체-중재 흥분 성의 postsynaptic 전류 같은 CA1 신경에 표시 됩니다. C: 슬라이스 앵커 녹음 실에서 슬라이스를 안정화 하는 데 사용 되었다. D: 게시 된 논문15,,1617에 따라 모터 피 질에서 표현 지도. ML = 중간. E: M 1의 IR DIC 현미경 레이어 전에 II/III 신경 (위) 및 (낮은) 기록 하는 동안. 바 = 10 µ m. F: 터치 (상단) 전에 고 막 파열 (하단)에서 현재 피 펫에 변화. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
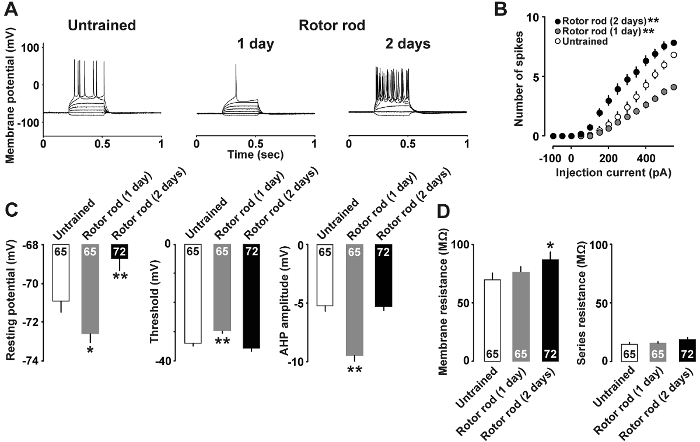
그림 4 : 전류 클램프 분석7 의 대표적인 결과 .
A: 활동 전위의 대표적인 흔적 현재 주사와 유도 후 기록. B: 말은 현재 입력 (pA) 뇌 조각에 활동 전위 출력 (스파이크의 수) 대 일반인된 (오픈 바), 1 일 훈련된 (회색 막대), 그리고 2 일 훈련된 쥐 (채워진된 바) 간의 관계. C: 휴식 잠재력, 임계값 및 레이어 II/III 뉴런의 afterhyperpolarization. D: 막 저항 및 신경 세포의 직렬 저항. 우리는 각 그룹에 9-10 쥐를 사용합니다. 셀의 수는 각 막대 내에서 표시 됩니다. 오차 막대 표시는 SEM. *P< 0.05, * *P< 0.01 대 일반인. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
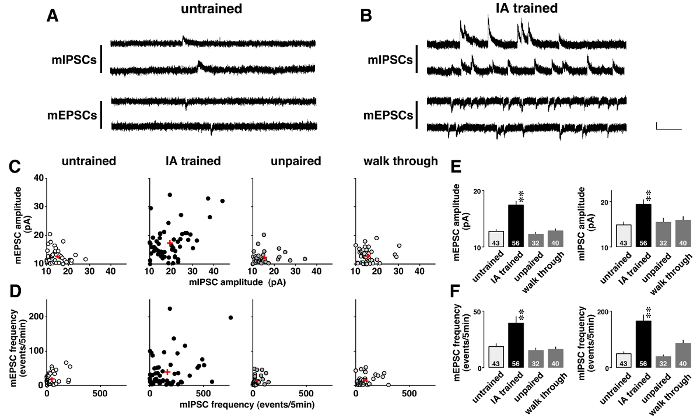
그림 5 : 전압 클램프 분석11 의 대표적인 결과 .
미니어처 흥분 성의 및 금지 postsynaptic 전류 (mEPSCs 및 mIPSCs) 일반인된 (A)와 억제 회피 (IA)의 대표적인 흔적-쥐 (B) 훈련. -60 mV, mV 테트로도톡신 (0.5 µ M)의 존재는 같은 CA1 피라미드 뉴런에서 순차적으로 측정 하는 0에서 mIPSCs에 mEPSCs. 세로줄 20 pA, 가로 바 = = 200 밀리초. C: 2 차원 플롯의 의미 나 (I) PSC 진폭에 일반인, IA-훈련, 홀, 및 도보 쥐. D: 나 (I) PSC의 2 차원 플롯 4 그룹에 주파수. 참고 각 CA1 신경 다른 전시 나 (I) PSC 진폭 및 주파수를 의미 합니다. IA 교육 뿐만 아니라 평균 진폭을 강화 했다 (E) 또한 증가 나 (I)의 주파수 PSC 이벤트 (F). 우리는 각 그룹에 4-6 쥐를 사용합니다. 셀의 수는 막대의 아래쪽에 표시 됩니다. 빨간색 더하기 기호 (C, D)과 수직 라인 (E, F)와 바 나타냅니다 평균 ± SEM. * *P< 0.01 대 일반인 쥐. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 해 부 버퍼 (총 1 L) | ||
| NaH2포4 • 2 H2O | 0.195 g | 1.25 m m o l/L |
| KCl | 0.188 g | 2.5 m m o l/L |
| CaCl2 | 0.074 g | 0.5 m m o l/L |
| MgCl2 • 6 H2O | 1.423 g | 7.0 mmol/L |
| 콜린 염화 물 | 12.579 g | 90 mmol/L |
| 의약품 | 2.340 g | 11.6 m m o l/L |
| Pyruvic 산 | 0.342 g | 3.1 mmol/L |
| NaHCO3 | 2.100 g | 25 mmol/L |
| 포도 당 | 4.500 g | 25 mmol/L |
표 1: 해 부 버퍼에 대 한 제조 법
| 인공 CSF (총 1 L) | ||
| KCl | 0.186 g | 2.5 m m o l/L |
| NaCl | 6.700 g | 114.6 mmol/L |
| NaH PO42•2H2O | 0.156 g | 1 mmol/L |
| 포도 당 | 1.800 g | 10 mmol/L |
| NaHCO3 | 2.184 g | 26 mmol/L |
| 1 M MgCl2 | 4 mL | 4 mmol/L |
| 1 M CaCl2 | 4 mL | 4 mmol/L |
표 2: 인공 뇌 척추 액체 (CSF)에 대 한 제조 법
| 전류 클램프 (총 200 mL)에 대 한 세포내 솔루션 | ||
| KCl | 0.0746 g | 5 mmol/L |
| K-글 루 콘 산 | 6.089 g | 130 m m o l/L |
| HEPES | 0.476 g | 10 mmol/L |
| EGTA | 0.0456 g | 0.6 m m o l/L |
| 1 M MgCl2 | 500 Μ L | 2.5 m m o l/L |
| 나2 ATP | 0.4408 g | 4 mmol/L |
| 나3 GTP | 0.0418 g | 0.4 mmol/L |
| Na phosphocreatine | 0.510 g | 10 mmol/L |
표 3: 전류 클램프에 대 한 세포내 솔루션에 대 한 제조 법 기록
| 전압 클램프 (총 200 mL)에 대 한 세포내 솔루션 | ||||
| CsMeSO3 | 5 | |||
표 4: 전압 클램프에 대 한 세포내 솔루션에 대 한 제조 법 기록
| 매개 변수 | 일반인 | IA 훈련 | 짝이 없는 | 안내 | |
| mEPSC 진폭 | 분산 | 5.8 | 32.1 | 4.7 | 5.9 |
| 표준 편차 | 2.4 | 5.7 | 2.2 | 2.4 | |
| 변동 계수 | 0.189 | 0.326 | 0.177 | 0.190 | |
| mIPSC 진폭 | 분산 | 17.1 | 56.7 | 31.8 | 20.7 |
| 표준 편차 | 4.1 | 7.5 | 5.6 | 4.5 | |
| 변동 계수 | 0.279 | 0.387 | 0.367 | 0.286 |
표 5: 미니어처 흥분 성의 금지 postsynaptic 현재 (mEPSC 및 mIPSC) 진폭 억제 회피 (IA)에서 다양성-쥐를 훈련
| 매개 변수 | 일반인 | IA 훈련 | 짝이 없는 | 안내 | |
| mEPSC 주파수 | 분산 | 278 | 2195 | 188 | 195 |
| 표준 편차 | 17 | 47 | 14 | 14 | |
| 변동 계수 | 0.902 | 1.198 | 0.893 | 0.874 | |
| mIPSC 주파수 | 분산 | 3282 | 27212 | 1385 | 5135 |
| 표준 편차 | 57 | 165 | 37 | 72 | |
| 변동 계수 | 1.195 | 1.006 | 0.955 | 0.836 |
표 6: 미니어처 흥분 성의 금지 postsynaptic 현재 (mEPSC 및 mIPSC) 주파수 억제 회피 (IA)의 다양성-쥐를 훈련
토론
조각 패치 클램프 방법의 주요 한계에 비보를 어떻게 반영 되지 않을 수 있습니다 슬라이스 준비에서 기록 이다. 전류 클램프 분석 vivo에서 더 안정적 이지만, 그것은 기술적으로 의식이 있는 동물에서 충분 한 데이터를 얻는 도전 이다. 각 피라미드 뉴런의 속성이 다른 세포 때문 세포의 충분 한 숫자는 제대로 훈련 후 신경에 차이 분석 하 필요 하다. 또한, 전압 클램프 분석 postsynaptic 응답의 성격을 결정 하는 CNQX, APV, 또는 bicuculline 지속적인 약물 치료를 필요 합니다. 조미료 또는 GABA의 단일 소포에 의해 유도 된 미니어처 응답 분석, 테트로도톡신 연속 치료 자발적인 활동 전위를 차단 필요 합니다. 비록 최근 개발 된 다중 광자 이미징 기술을 흥분 성의 시 냅 스19에서 형태학 상 변화를 분석 하기 위한 강력한, 결합 된 패치 클램프 기술 vivo에서시 냅 스의 기능 분석 필요 합니다. 그것은 현재 가장 억제 시 냅 스는 등뼈를 형성 하지 않습니다 이후 억제 시 냅 스에서 형태학 상 변화를 분석 하는 매우 어렵습니다. 이 시점에서 조각 패치 클램프 셀 속성 또는 훈련된 동물에 흥분 성의 억제 시 냅 스의 기능 분석에 가장 적합 한 기술 될 것 이다.
전류 클램프 분석 (그림 4)를 사용 하 여, 우리는 최근 레이어 II/III 뉴런에 모터 학습 유도 내장 소성을 했다. 특히, 1 일 훈련된 쥐 스파이크 임계값에 막 잠재력 및 증가 휴식에 상당한 감소를 보여주었다. 2 일 훈련된 쥐 휴식 막 잠재력 증가 흥분 시킨 중요 한 증가 보였다. 이 결과 제안 하는 거기 훈련 된 쥐에 M1 층 II/III 뉴런의 본질적인 소성에서 동적인 변화를 했다. 추가 전압 클램프 분석 공개 1 일 훈련된 쥐, 연 접 GABA 릴리스 확률7에 일시적인 감소 했다 제안에 쌍 펄스 비율에 증가 했다. 그것은 따라서 가능한 II/III synapses 계층에서 GABA에서 그 disinhibition m 1에서 결과 학습 유도 소성 시킬 수도. 이 지원 m 1의 슬라이스 준비 LTP20유도 GABAA 수용 체 차단제와 목욕 치료를 필요 합니다.
미니어처 postsynaptic 잠재력의 분석 IA 훈련 동물에 시 냅 스가 소성을 검출 하는 강력한 방법입니다. 기록 mEPSCs 및 mIPSCs에에서 순차 CA1 신경 각 개별 뉴런의 흥분 성의 억제 시 냅 스의 분석을 수 있습니다. 단일 이후 나 (I) PSC 응답은 조미료 또는 GABA, 증가 한 소포에 기인 나 (I) PSC 진폭 postsynaptic 강화 제안. 나 (I) PSC 분석을 사용 하 여, 우리는 각 CA1 신경 (그림 5C)에 흥분 성의 억제 입력의 강도에서 개별 차이 발견. IA 교육 명확 하 게 시 냅 스 강도, 다양성을 승진만이 아니라 다른 그룹 (표 5)에서 관찰 되었다.
시 냅 스 다양성 학습 유도 수학적으로 분석할 수 있습니다. 각 포인트의 출현 확률을 계산 하 여 각 뉴런에서 데이터 자체-엔트로피 (비트) Claude E. Shannon21의 정보 이론을 사용 하 여 변환할 수 있습니다. 매우 드문 확률 (이탈된 포인트) 점을 나타냅니다 높은 자기-엔트로피 (평균 수준)의 주위에 모양 높은 확률으로 포인트 낮은 자기-엔트로피, 나타냅니다. 익숙하지 않은 쥐에 비해 신경 당 자체 엔트로피 IA 훈련 된 쥐에 명확 하 게 증가 했지만 하지 짝이 없는 또는 도보 쥐22. 이 분석 내부 CA1 정보 상황별 학습 후에 증가 했다 나왔다.
조각 패치 클램프 기술 문장을 두려움 컨디셔닝 측면 편도9 연구 및 신 피 질8에서 감각 경험 연구에 사용할 수 있습니다. 또한,이 기술은 추가 조사에 대 한 다양 한 다른 기술을 사용할 수 있습니다. 예를 들어, 바이러스 중재 녹색 형광 단백질 (GFP)-태그 유전자 전달 기술을 특정 분자의 기능을 분석 하는 패치 클램프 기술 결합 될 수 있다. 또한, 특정 신경 특정 영역을 그 프로젝트를 시각화 하는 역행 추적 프로그램의 초점 microinjection은 사용할 수 있습니다. 그런 다음 전류 클램프 기술을 사용 하 여, 휴대 전용 속성 분석할 수 있습니다 시각된 신경23에. 또한, 조미료의 2 광자 레이저 uncaging와 결합 2 광자 레이저 스캔 현미경 척추 관련 성장과 마우스 피 질에서 EPSC 응답 레이어 II/III 피라미드 뉴런19보여 주기 위해 사용 되었습니다. 따라서, 조각 패치 클램프 기술 소설 화학, 유전자 전달와 사진 조작 기술을 결합 하 여 향상 되는.
공개
저자는 관심 없음 충돌 선언합니다. 우리는 우리가 윤리적 게시에 관련 된 문제에 저널의 위치를 읽고 우리 긍정이 보고서는 그 지침과 일치 확인 합니다. Funders 연구 설계, 데이터 수집 또는 분석, 게시, 결정 또는 원고 준비에 전혀 역할을 했다.
감사의 말
우리는 박사 발-민-Thein-Oo, 박사 한-Thiri-Zin, 부인 H. Tsurutani 그들의 기술 지원에 감사 하 고 싶습니다. 이 프로젝트는 젊은 과학자 (홍콩 및와에 스), 과학 연구 B (D.M.), 과학 연구 C (D.M.), 그리고 과학적인 연구에 혁신적인 지역 (D.M.), 교육, 문화, 스포츠, 과학에서 대 한 보조금에 의해 지원 되었다 고 일본의 기술입니다.
자료
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
참고문헌
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유