Method Article
Slice-Patch-Clamp-Technik für die Analyse von Learning-induzierte Plastizität
In diesem Artikel
Zusammenfassung
Die Slice-Patch-Clamp-Technik ist eine wirksame Methode zur Analyse von lernen-induzierte Veränderungen der inhärenten Eigenschaften und Plastizität der erregenden oder hemmenden Synapsen.
Zusammenfassung
Die Slice-Patch-Clamp-Technik ist ein leistungsfähiges Werkzeug für die Untersuchung von lernen-induzierte neuronale Plastizität in bestimmten Gehirnregionen. Um Motor-Learning induzierte Plastizität zu analysieren, haben wir Ratten mit Hilfe einer beschleunigten Rotor Stab Aufgabe geschult. Ratten durchgeführt die Aufgabe 10 Mal im Abstand von 30-s für 1 oder 2 Tage. Leistung wurde an den Trainingstagen im Vergleich zu der ersten Studie deutlich verbessert. Dann haben wir akuten Hirnschnitten von den primären motorischen Kortex (M1) in ungeschulten und ausgebildete Ratten vorbereitet. Strom-Clamp-Analyse zeigten dynamischen Veränderungen im ruhenden Membranpotential, Spike Threshold, Afterhyperpolarization und Membran Widerstand in Layer II/III pyramidale Neuronen. Stromeinspeisung induzierte viele weitere Spitzen in der 2-Tages ausgebildete Ratten als ungeübte Kontrollen.
Um kontextbezogene-Learning induzierte Plastizität zu analysieren, haben wir Ratten mit Hilfe einer hemmenden Vermeidung (IA) Aufgabe geschult. Nach der Erfahrung Fuß-Schock in die dunkle Seite der Schachtel, lernte die Ratten zu vermeiden, bleiben in der beleuchteten Seite. Wir bereiteten akute hippocampal Scheiben von ungeschulten, IA trainiert, ungepaarte und begehbare Ratten. Voltage-Clamp-Analyse wurde verwendet, um nacheinander Miniatur exzitatorischen und inhibitorischen postsynaptischen Ströme (mEPSCs und mIPSCs) von der gleichen CA1-Neuron aufzuzeichnen. Wir fanden verschiedene mittlere mEPSC und mIPSC Amplituden in jedes Neuron CA1 darauf hindeutet, dass jedes Neuron unterschiedliche postsynaptischen stärken an seinen erregenden und hemmenden Synapsen hatten. Darüber hinaus hatte IA ausgebildete Ratten verglichen mit ungeschulten Kontrollen, höhere mEPSC und mIPSC Amplituden mit Vielfalt. Diese Ergebnisse vorgeschlagen, dass kontextuellen Lernens in erregenden und hemmenden Synapsen auf jedes Neuron CA1 postsynaptischen Vielfalt schafft.
AMPA oder GABA-A -Rezeptoren schien die postsynaptischen Ströme seit Bad Behandlung mit CNQX zu vermitteln oder Bicuculline blockiert bzw. die mEPSC oder mIPSC Ereignisse. Diese Technik kann verwendet werden, um verschiedene Arten des Lernens in anderen Regionen, wie dem sensorischen Cortex und die Amygdala zu studieren.
Einleitung
Die Patch-Clamp-Technik, entwickelt von Neher und Sakmann, hat seit Elektrophysiologische Experimente1verbreitet. Die ganze Zelle Patch Clamp Technik2 kann zur intrazellulären Strom oder Spannung mit Gigaohm Siegel der Zellmembran aufnehmen. Die Strom-Clamp-Technik ermöglicht es uns, Unterschiede in den Eigenschaften der Membran wie ruhen Potential, Widerstand und Kapazität3zu analysieren. Die Voltage-Clamp-Technik ermöglicht es uns, lernen-induzierte synaptische Plastizität an erregenden und hemmenden Synapsen zu analysieren.
Der primäre motorische Kortex (M1) ist eine zentrale Region, die für qualifizierte Freiwillige Bewegungen von entscheidender Bedeutung ist. Elektrophysiologische Studien zeigte die Entwicklung der Langzeitpotenzierung (LTP)-wie Plastizität in Layer II/III exzitatorischen nach qualifizierten motor Training4 Synapsen. Darüber hinaus demonstriert in Vivo Bildgebungsstudien weiter der Umbau des M1 dendritischen Dornen nach einem qualifizierten reichende Aufgabe5,6. Lernen-induzierte synaptischen und intrinsischer Plastizität hat sich jedoch nicht in M1 Neuronen gezeigt.
Wir berichteten kürzlich, dass eine Rotor Stab Aufgabe dynamische Veränderungen der glutamatergen gefördert und GABAergen Synapsen und verändert die intrinsische Plastizität in M1 Layer II/III-Neuronen-7. Hier haben wir die Slice-Patch-Clamp-Technik um zu lernen-induzierte Plastizität zu untersuchen. Diese Technik kann auch verwendet werden, um andere Arten von Erfahrung-abhängigen Plastizität in anderen Gehirnregionen zu untersuchen. Z. B. sensorischer Input in die Fass-Rinde kann AMPA-Rezeptor-vermittelten exzitatorischen Input in Layer II/III Neuronen8stärken und wartenden Angst Klimaanlage stärkt die erregenden Eingänge auf der lateralen Amygdala Neuronen, die ist erforderlich für fürchten Sie Speicher9. Darüber hinaus schafft kontextuellen Lernens Vielfalt in Bezug auf die erregenden und hemmenden Synapsen Eingang in hippocampalen CA1 Neuronen10,11.
Protokoll
alle Tierhaltung und chirurgische Eingriffe wurden entsprechend den Richtlinien für Tier Experimente von Yamaguchi University School of Medicine und wurden von den institutionellen Animal Care und Nutzung Ausschuss der Yamaguchi genehmigt Universität.
1. Tiere
- verwenden Sie 4 bis 5 Wochen alten männliche Sprague-Dawley Ratten (postnatale 28 bis 31 Tage alt).
- Haus unter einem 12-h-hell/dunkel-Zyklus die Ratten im einzelnen Kunststoffkäfige (40 cm × 25 cm × 25 cm) auf eine konstante Temperatur (23 ° C ± 1 ° C) gehalten. Ratten Ad Libitum Zugang zu Wasser und Nahrung zu geben.
2. Rotor-Stab-Test
- , motorische Fähigkeiten erlernen, die Rotor-Stab-Test unterziehen jede Ratte zu untersuchen (Stabdurchmesser 7 cm; Spurbreite 8,9 cm; Fallhöhe 26,7 cm) für 1 oder 2 aufeinander folgenden Tagen ( Abbildung 1A in Kida Et Al., 2016 < sup Klasse = "Xref" > 7). Führen Sie die Aufgabe, in einem ruhigen, klimatisierten Raum (23 ± 1 ° C). Nicht stören oder Ratten vor dem Test zu behandeln
- Festlegen den Rotor Stab Beschleunigungsmodus, die linear von 4 Umdrehungen/min bis 40 Umdrehungen/min (8 π/min bis 80 π/min) in 5 min. erhöht
- Setzen die Ratte auf dem ruhenden rotierenden Stab. Bestätigen, dass alle Glieder auf dem Stab sind.
- Messen die Latenz vom rotierenden Stab auszuwertende Motorleistung fallen.
- Erlauben jede Ratte 10 Versuche (Studien) mit 30-s-Takt.
- Wenn die Ratte vom rotierenden Stab fällt, setzen Sie ihn auf den Stab wieder nach 10-20 s Pause.
- Opfern die Ratte mit einer Überdosis von Pentobarbital (400 mg/kg) 30 min nach dem letzten Versuch. Injizieren ungeschulten Kontrolle Ratten mit der gleichen Dosis der Anästhesie in ihrer Heimat Käfigen.
3. Hemmenden Vermeidung Test
- , kontextbezogenen Lernens untersuchen Thema Ratten zu einem hemmenden Vermeidung (IA)-Test ( Abbildung 1 in Mitsushima Et Al., 2011, 2013 10 , 11) vermeiden Sie Kontakt mit anderen, Käfig Änderungen oder Reinigung keine episodischen Erfahrungen am Tag des Experiments wie. Führen Sie die Aufgabe in einem ruhigen, klimatisierten Raum (23 ± 1 ° C).
Hinweis: Der IA-Training-Apparat ist ein zwei-Kammern-Acryl-Box (Länge 33 cm; breite 58 cm; Höhe 33 cm). Es verfügt über einen beleuchteten sicheren Seite und eine dunkle Schock-Seite, die durch eine Falltür ( Abbildung 1) voneinander getrennt sind. - Legen Sie die Ratte in der sicheren (beleuchteten) Seite der beleuchteten Box. Die Ratte sanft ohne Stress zu behandeln.
- Warten Sie kurze Zeit (10 bis 20 s), die Ratte an die Umgebung gewöhnen.
- Öffnen Sie die Schiebetür um die Ratte, die dunkle Box nach Belieben zu ermöglichen.
- Messen die Latenz (s), bevor die Ratte die neuartige dunkle Seite der Box betritt. Die Latenz des ersten Versuchs stellt die Ratte ' s Leistung vor dem Training.
- Nach Eintritt in die dunkle Seite, schließen Sie die Tür und wenden Sie einen verschlüsselte elektrische Fuß Schock (2 s, 1,6 mA) über elektrische Stahlstangen, die in den Boden des Kastens gesetzt. Lassen Sie begehbare Ratten, die TrainergerГ für 1 min ohne schockiert zu erkunden. Haus ungepaarte Ratten in einem beleuchteten Schock-Käfig für mehrere geben Tage und plötzlich die Schock ohne episodische Erlebnisse. Handhaben Sie vorsichtig ohne Stress in allen Gruppen.
- Halten Sie jede Ratte in den dunklen Kasten für 10 s vor der Rückgabe an die Heimat Käfig.
- Bei 30 min nach dem Fuß Schock wieder Platz die Ratte in die beleuchtete Seite des Feldes. Messen Sie die Wartezeit um die dunkle Seite zu gelangen.
- Die Ratte zu Hause Käfig zurück.
- Bei 60 min nach dem Schock, Opfern die Ratte mit einer Überdosis von Pentobarbital (400 mg/kg). Die Ratte schonend zu behandeln und die Narkose intraperitoneale Injektion. Bei ungeübten Kontrolle Ratten, injizieren die Narkose in ihrer Heimat Käfigen ohne die oben beschriebene Erfahrung.
4. Dissektion Puffer
- Kristalle von 0,195 g NaH 2 PO 4-2 H 2 O, 0,188 g KCl 0,074 g CaCl 2, 1,423 g MgCl 2-6 H 2 O und 12,579 g Cholinchlorid Reinstwasser (900 mL, 950 mL) auflösen . Siehe Tabelle 1.
- Lösen sich die Kristalle von 4,500 g Glukose, 2,340 g Ascorbinsäure, 0,342 g Brenztraubensäure Säure Natriumsalz und 2,100 g Nahco3 3.
- Add Wasser bis 1000 mL. Das Spektrum der Osmolalität werden zwischen 290 mOsm/L und 300 mOsm/L. Adjust Osmolalität durch Zugabe von hochreinem Wasser, wenn es über den Bereich ist.
- Bubble-die Lösung mit 5 % CO 2 / 95 % O 2 Gasgemisch bei eiskalten Temperaturen für 5 min vor Gebrauch.
5. Künstliche Liquor cerebrospinalis (ACFS)
- lösen sich Kristalle von 0,186 g KCl, 6,700 g NaCl, und 0,156 g NaH 2 PO 4-2 H 2 O Reinstwasser (900 mL, 950 mL). Siehe Tabelle 2.
- Blase mit dem Gasgemisch für 5 min.
- Lösen sich die Kristalle von 1,800 g Glukose und 2,184 g Nahco3 3 und fügen Sie dann 4 mL MgCl 2 und 4 mL CaCl 2 von 1 M auf Lager Lösungen.
- Add Wasser bis 1000 mL. Das Spektrum der Osmolalität werden zwischen 290 mOsm/L und 295 mOsm/L. Adjust Osmolalität durch Zugabe von hochreinem Wasser, wenn es über den Bereich ist.
- Blase mit Gas Mischung vor dem Gebrauch.
6. Intrazelluläre Lösungen
- für Strom-Clamp Aufnahmen (Tabelle 3), lösen Sie 0,0746 g KCl, 6,089 g K-Gluconat, 0,476 g HEPES, 0,0456 g EGTA und 500 µL MgCl 2 von 1 M auf Lager in Reinstwasser 180 mL Lösung (pH-Wert auf 7.2 mit KOH anpassen).
- 0,4408 g Na 2 - ATP, 0,0418 g Na 3 - GTP und 0,510 g Na-Phosphokreatin hinzufügen. 200 mL Wasser hinzu und passen Sie den pH-Wert auf 7,35 mit KOH.
- Einstellen Die Osmolalität auf rund 290 mOsm/L durch Zugabe von Reinstwasser.
- Store als 1-mL-aliquoten in den Gefrierschrank (-30 ° C).
- Für Voltage-Clamp-Aufnahmen (Tabelle 4), lösen Sie 5,244 g CsMeSO 3, 0,672 g CsCl, 0,476 g HEPES, 0,0456 g EGTA und 500 µL MgCl 2 von 1 M auf Lager Lösungen in 180 mL Reinstwasser. Stellen Sie den pH-Wert auf 7.2 mit CsOH. Verwenden Sie für mEPSP und mIPSP-Aufnahmen veränderte Konzentration von 5,814 g CsMeSO 3 und 0,252 g CsCl um die Umkehrung Potenzial der GABA-A Rezeptor Antwort 11 anzupassen.
- 0,4408 g Na 2 - ATP, 0,0418 g Na 3 - GTP und 0,510 g Na-Phosphokreatin hinzufügen. 200 mL Wasser hinzu und passen Sie den pH-Wert auf 7,35 mit CsOH.
- Einstellen Die Osmolalität auf rund 290 mOsm/L durch Zugabe von Reinstwasser.
- Store als 1-mL-aliquoten in den Gefrierschrank (-30 ° C).
7. Vorbereitung in Scheiben schneiden
- Prior zu opfern, Cool-Down alle Dissektion Werkzeuge mit crushed Ice ( Abbildung 2A). Fügen Sie ca. 500 mL kaltem Wasser in den crushed-Ice-Container um die Kontaktfläche zu erhöhen. Dieses Vorgehen war zuvor 10 , 11 , 12.
Hinweis: Die Werkzeuge sind: große Schere, Iris-Schere, Spatel, ein Mikro Spatel, Zange, Pinzette, ein Edelstahl-200-mL-Becherglas, eine Klinge für Gehirn trimmen, eine kardiale Perfusion 120-mL-Spritze mit Dissektion Puffer behandelt das Gasgemisch gefüllt ein Silikonschlauch (20 cm) verbunden mit einer abgeflachten 18-Gauge-Nadel, eine rostfreie Gehirn Dissektion Bühne (Dicke = 3 mm, ϕ = 12 cm), und eine Montage-Bühne für die Vibratome (ϕ = 5 cm). - Opfern die Ratte 30 min nach Abschluss der behavioralen Paradigmas durch betäuben sie mit einer Überdosis von Pentobarbital (400 mg/kg Körpergewicht). Führen Sie die Slice-Vorbereitung schnell um sicherzustellen, dass die Scheiben so gesund wie möglich 10 , 11 , 12 sind. Die Gehirn-extrAktion-Protokoll erfüllt alle tierärztlichen Standards für unsere Universität.
- Füllen Sie eine 120-mL-Spritze mit eiskalten Dissektion Puffer (Tabelle 1) sprudelte mit 5 % CO 2 / 95 % O 2 Gasgemisch. Entfernen Sie eventuell vorhandene Luftbläschen vor Perfusion.
- Nach Freilegung der Herzen, stechen Sie die Nadel in den hinteren Teil des linken Ventrikels.
- Perform Transcardial Durchblutung des Gehirns manuell mit der Spritze. Größere Ratten erfordern mehr Dissektion Puffer für Perfusion. Tauchen Sie das Gehirn mit eiskalten Dissektion Puffer für 5 min. Blase den Puffer kontinuierlich während der Überflutung.
- Trimmen die hintere Seite des Gehirns auf einen Winkel Parallel zu der dendritischen Ausrichtung der kortikalen Zielregion mit einer Klinge. Da das Gehirn ist auf der Dissektion Bühne mit abgeschnittenen Ende unten stehen, bestimmt der Anfangswinkel den Winkel des alle nachfolgenden Gehirnscheiben. Dieser Schritt ist von entscheidender Bedeutung ( Abb. 2 b). Ein falscher Winkel kann das Ziel pyramidale Neuronen durchschneiden.
Hinweis: Die Werkzeuge sind: eine Klinge zum Gehirn trimmen, ein Filterpapier (ϕ = 10 cm), Edelstahl Gehirn Dissektion Bühne (Dicke = 3 mm, ϕ = 12 cm), ein Spatel, ein Sekundenkleber, eine Pipette und eine Montage-Bühne für die Vibratome (ϕ = 5 cm). - Schnitt 350 µm dicken koronalen Gehirnscheiben mit einem Vibratome. Füllung die Dissektion Kammer mit eiskalten Puffer mit 5 % CO 2 sprudelte / 95 % O 2 Gasgemisch ( Abbildung 2). Blase den Puffer ständig während der Gehirn-Scheibe.
- Die Peripherie des Zielbereichs mit Iris-Schere trimmen.
- Waschen die getrimmten Scheiben schonend bei Raumtemperatur ACFS mit 5 % CO 2 / 95 sprudelte % O 2 (Tabelle 2).
- Pflegen die getrimmte Scheiben in einer Schnittstelle-Kammer, bis die Aufzeichnung durchgeführt ( Abb. 2D und E). Inkubation für 1 h in der Kammer verbessert den Zustand der Zellen, sondern die Phänotypen ändern, wenn die Scheiben für mehr als 10 Stunden inkubiert werden. Schließen Sie den Deckel der Kammer zu umschließen die Gase und die kleine Flüssigkeit sinkt der ACFS.
8. Ganze Zelle Patch Clamp
Hinweis: Whole-Cell Aufnahmen benötigen einen Verstärker und einen Tiefpass-Filter, die auf einem cutoff-Frequenz von 5 kHz eingestellt ist. Die Signale werden digitalisiert und auf einem PC gespeichert. Die gespeicherten Daten werden analysiert, offline ( Abb. 3A).
- Erstellen Glaselektroden mit einem horizontalen Abzieher. Füllen Sie die Elektroden mit einer geeigneten Lösung (Tabellen 3 und 4) mit einer regelmäßigen Polyethylen 1-mL-Spritze an einer feinen Glasröhre und 0,22 µm Filter befestigt.
- Vor dem Kontakt mit der Zelle, positive Druck aufrechterhalten und die Pipette aktuelle auf Null einstellen.
- Nach der Bildung einer Gigaohm Dichtung, gelten Unterdruck zum Bruch der Zellmembran (ganz-Zell Konfiguration in Abbildung 3F).
9. Strom-Clamp Analyse
- Eigenschaften der Zellmembran
- füllen den Patch Aufnahme Pipetten mit der intrazellulären Lösung für Strom-Clamp Aufnahmen (Tabelle 3). Der Widerstand der Pipette ist zwischen 4 MΩ und 7 MΩ in der ACFS.
- Nachdem die Membran Brüche, halten Sie die Spannung der Membran bei-60 mV im V-CLAMP-Modus. Schalten von " Bad " Modus zu " Zelle " Modus in den Membran-Test mit Software zur Messung der intrinsischen Zelleneigenschaften wie Membran Kapazität, Widerstand und Zeitkonstante.
- Aktuelle Injektion Studie
- nach der Aufnahme der intrinsischen Zelleigenschaften, schalten Sie den Modus von V-CLAMP, TRACK (ich = 0) /I-CLAMP NORMAL für die Stromeinspeisung. Beachten Sie, dass das flüssige Verzweigung Potenzial sollte nicht korrigierten 10.
- Spritzen in die Zelle für 300 Ms. aktuelle ändern die Intensität des Stromes schrittweise aus − 100 pA PA +550 mit 50 pA erhöht. Die Anzahl der Spitzen (Aktionspotentiale) hervorgerufen durch die aktuelle Injektionen.
- Messen die minimale Spannung benötigt, um ein Aktionspotential auslösen (Dies ist die Schwellenspannung).
- Berechnen die Afterhyperpolarization Amplitude als die Differenz zwischen der Spannung bei der Initiierung von Spike und die niedrigste Spannung erreicht während Afterhyperpolarization 7.
10. Voltage-Clamp-Analyse
- The AMPA/NMDA-Verhältnis
Hinweis: der AMPA/NMDA-Verhältnis ist konventionell auszuwertende postsynaptischen Plastizität bei glutamatergen exzitatorischen Synapsen 7 , 8 , 9 , 10 , 11. beachten Sie jedoch, dass damit einhergehende Anstieg der beiden Komponenten nicht das Verhältnis 13 ändern können.- Perfuse die Aufnahme Kammer mit physiologischer Lösung mit dem Gasgemisch sprudelte und behalten Sie die Temperatur bei 22 ° C bis 25 ° c hinzufügen 0,1 mM Picrotoxin zur Lösung der GABA-A - vermittelte Reaktion und fügen Sie 4 µM 2 - block Chloroadenosine zur Stabilisierung der evozierten neuronale Antwort 14.
- Füllen den Patch Pipetten mit der intrazellulären Lösung für Spannung-Zange Aufnahme Aufnahmen (Tabelle 4). Überprüfen Sie den Widerstand der Aufnahme Pipette in der ACFS. Der Widerstand ist zwischen 4 MΩ und 7 MΩ.
- Für die Aufnahme in Layer II/III pyramidale Neuronen in der M1, legen Sie eine bipolare Wolfram Elektrode 200 µm bis 300 µm seitlich in die Zellen aufgenommen werden, unter der pial Oberfläche im Bereich der Vordergliedmaße Darstellung anregend (2 mm seitlich an der Mittellinie) 15 , 16 , 17.
- Für die Aufnahme in einem pyramidenförmigen CA1-Neuron, legen Sie die anregende Elektrode 200 µm bis 300 µm Lateral (Schaffer Sicherheiten Faser) oder Medial (Temporoammonic Weg) auf die Zellen, die aufgezeichnet ( Abb. 3 b).
- Erhöhen die Reizintensität bis die synaptischen Antwort > 10 PA
- Berechnung der AMPA/NMDA-Verhältnis gemessen das Verhältnis von den Spitzenstrom in − 60 mV bis der Strom gemessen bei + 40 mV bei 150 ms nach dem Stimulus einsetzen. Beachten Sie, dass 50 bis 100 Spuren gemittelt werden sollte, um das Verhältnis zu berechnen.
- Miniatur postsynaptischen aktuelle Aufnahmen
Hinweis: Miniatur exzitatorischen postsynaptischen Ströme (mEPSCs) werden gedacht, um die Reaktionen hervorgerufen durch die präsynaptischen Freisetzung eines einzigen Vesikels von Glutamat entsprechen 18 . Im Gegensatz dazu sind Miniatur inhibitorischen postsynaptischen Ströme (mIPSCs) gedacht, um die Reaktionen hervorgerufen durch die präsynaptischen Freisetzung eines einzigen Vesikels GABA 18 entsprechen. Anstieg der Amplituden der mEPSCs und mIPSCs reflektiert postsynaptischen Übertragung Stärkung während erhöht bei Frequenz steigt die Zahl der funktionalen Synapsen oder die präsynaptischen Freisetzung Wahrscheinlichkeit reflektieren 11 .- Füllen Sie die Patch-Aufnahme-Pipette mit modifizierten intrazellulären Lösung (Tabelle 4) um die Umkehrung Potenzial der GABA-A Rezeptor-vermittelte aktuellen anzupassen,-60 mV.
- Add 0,5 µM Tetrodotoxin zum Bad, spontan Aktionspotentiale blockieren.
- Halten die Spannung bei-60 mV bis rECORD mEPSC Veranstaltungen für 5 min.
- Änderung im Betrieb möglichen auf 0 mV bis Rekord mIPSC Veranstaltungen für 5 Minuten. Da M1 Neuronen etwas höheren Umkehrung Potenzial für AMPA-Rezeptor-vermittelten Strömungen zeigen, die mIPSCs von M1 Neuronen werden aufgezeichnet, bei + 15 mV mit 0,1 mM APV.
- Warten Sie einige Minuten, bis der Strom zu stabilisieren.
- Protokollieren Sie die mIPSC-Ereignisse für 5 min.
- Die Miniatur-Ereignisse mit Hilfe der Software zu erkennen und Ereignisse über 10 pA für die Analyse verwenden. Die Anzahl der mEPSCs oder mIPSCs Veranstaltungen für 5 min um die Frequenz zu bestimmen. Durchschnitt der Amplituden der Ereignisse um die durchschnittliche Amplitude zu erhalten.
- Bestätigen, ob Bad Behandlung mit 10 µM CNQX oder 10 µM Bicuculline Methiodide der Ereignisse mEPSCs und mIPSCs bzw. blockiert.
- Paired-Pulse Analyse
Hinweis: präsynaptischen Plastizität gepaart-Puls-Analyse analysiert werden kann. Eine Erhöhung der gepaart Puls schlägt einen Rückgang der präsynaptischen Glutamat oder GABA release Wahrscheinlichkeit 7 , 10 , 11.- Exzitatorische Synapsen zu analysieren, 0,1 mM Picrotoxin hinzufügen und notieren die Antwort bei-60 mV. Obwohl wir das Bad 4 µM 2-Chloroadenosine hinzugefügt haben, müssen wir daran denken, dass das Medikament wirkt sich auf die präsynaptischen Freisetzung Wahrscheinlichkeit 14.
- Hemmende Synapsen, analysieren das Bad 0,1 mM APV und 4 µM 2-Chloroadenosine hinzu und notieren Sie die Antwort bei 0 mV. In M1 Neuronen aufnehmen die Antwort bei + 15 mV.
- Anwenden von gekoppelten Impulse mit einem inter-Stimulus-Intervall von 100 ms oder 200 ms.
- 50-100 sequentielle Spuren im jeweils möglichen aufzeichnen und die Durchschnittswerte.
- Berechnen die gepaarten Puls-Verhältnis als das Verhältnis des zweiten Gipfels zum ersten Gipfel des postsynaptischen Stroms.
Ergebnisse
Wie wir vor kurzem7beschrieben, induziert Rotor Stab Ausbildung (Abbildung 1A) dynamische Veränderungen in der intrinsischen Plastizität der M1 Layer II/III pyramidalen Neuronen. Die Latenz zu messen, bis die Ratten aus den rotierenden Stab fallen ermöglicht es uns, die qualifizierte Lernleistung der Ratte zu schätzen. Längere Wartezeit bedeutet bessere Motorleistung. Am Tag 1 Training verbessert die Ratten Rotor Stab bis der Prozess beendet. Am 2. Tag, die Ratten erreicht fast asymptotische Ebenen in der gemittelten Sitzung punktet (Abbildung 1 b). Im Vergleich mit der Wartezeit bei der ersten Verhandlung, Post-hoc- Analyse zeigten signifikante Verbesserungen bei den abschließenden Prüfungen an den Trainingstagen (Abbildung 1).
Abbildung 4A zeigt ein Beispiel für Strom-Clamp-Analyse in der neuronalen Eigenschaften nach dem motorischen lernen geändert. Injektionen von 400 pA und 500 pA Strömungen waren nötig, um Aktionspotentiale in der ungeübte Gruppe und bei den 1-Tages ausgebildete Ratten, bzw. zu induzieren. Im Gegensatz dazu genügte Injektion nur eines 150 Pa aktuellen Aktionspotentiale in der 2-Tages ausgebildete Ratten zu entlocken. Abbildung 4 bzeigt die Beziehung zwischen der Stromstärke und der Anzahl der Aktionspotentiale. So wenig wie 50 pA aktuellen genügte, um Spitzen in der 2-Tages ausgebildete Ratten zu entlocken; im Gegensatz dazu reagiert 1 Tag ausgebildete Ratten mit weniger Aktionspotentiale als untrainierte Ratten auf 350 pA und höhere Ströme. Darüber hinaus Abbildung 4 zeigt, dass 1 Tag ausgebildete Ratten zeigten geringere ruht potential, höher spike Schwelle und tieferen Afterhyperpolarization, während 2-tägigen ausgebildete Ratten zeigte höhere Ruhepotential (Abbildung 4) und Widerstand () Membran Abbildung 4).
Wie wir bereits11beschrieben, induzierte IA Training (Abbildung 1) postsynaptischen Plastizität an erregenden und hemmenden Synapsen der hippocampalen CA1 Neuronen. Durch die Messung der Latenz im Lichtkasten, könnten wir die kontextbezogene Lernleistung der Ratte schätzen. Abbildung 1E zeigt die Ergebnisse der Aufgabe IA. Nach den gekoppelten elektrischen Schlag lernen die Ratten zu vermeiden die dunkle Seite des Kastens und bleiben in der beleuchteten Seite, die in der Regel nicht vorziehen würden. Die Tendenz, die dunkle Seite zu vermeiden zeigt daher die Übernahme von kontextuellen Erinnerungen.
Abbildung 5 zeigt ein Beispiel für Voltage-Clamp-Analyse in der Miniatur postsynaptischen Ströme nach kontextuellen Lernens drastisch geändert wurden. Zu untersuchen, lernen-induzierte Plastizität, spontane AMPA-vermittelten mEPSCs und GABA-A-vermittelten mIPSCs wurden nacheinander in Gegenwart von 0,5 µM Tetrodotoxin (Abb. 5A und B) aufgenommen. Wie gezeigt auf zweidimensionalen Flächen (Abbildung 5), hatte jedes Neuron CA1 unterschiedliche mittleren Amplituden für mEPSCs und mIPSCs. Obwohl die Amplituden niedrig waren und einen schmalen Verbreitungsgebiet in zeigte ungeübt, ungepaarten, und begehbare Ratten waren vielfältig in IA ausgebildete Ratten (Tabelle 5). ANOVA, gefolgt von Post-hoc- Analyse zeigte eine signifikante Zunahme der mittleren Amplituden der mEPSC und mIPSC in IA ausgebildete Ratten (Abb. 5E), was lernen-induzierte postsynaptischen Plastizität in den CA1-Neuronen.
Darüber hinaus stellte jedes Neuron CA1 verschiedene Frequenzen von mEPSC und mIPSC (Abbildung 5). Obwohl die Frequenzen niedrig waren und einen schmalen Verbreitungsgebiet in zeigte ungeübt, ungepaarten, und begehbare Ratten waren vielfältig in IA ausgebildete Ratten (Tabelle 6). ANOVA, gefolgt von Post-hoc- Analyse zeigte einen signifikanten Anstieg in den Frequenzen der mEPSC und mIPSC Ereignisse in IA ausgebildete Ratten (Abbildung 5F). Es gibt zwei mögliche Interpretationen dieser Ergebnisse. Die erste ist, dass kontextuellen Lernens die Anzahl der funktionellen Synapsen der Nervenzellen erhöht. Die andere ist, dass kontextuellen Lernens die Wahrscheinlichkeit der präsynaptischen Freisetzung von Glutamat und GABA erhöht.
Um präsynaptischen Plastizität weiter zu untersuchen, führten wir auch gepaart-Puls Stimulationen, wie bereits berichtet,10,11.
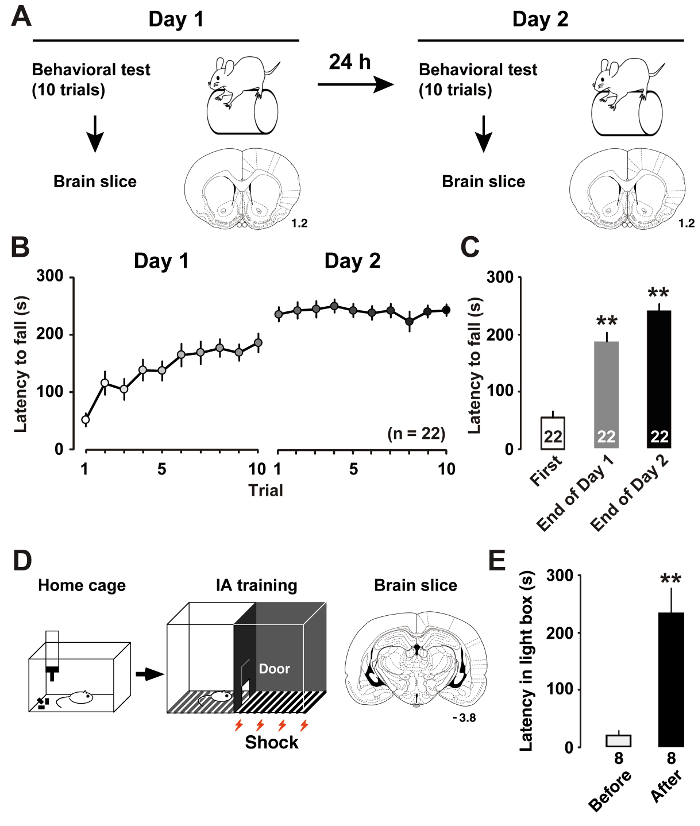
Abbildung 1 : Lernleistung nach dem Training.
A: das experimentelle Design zeigt den Rotor Stab Ausbildung und koronalen Gehirn-Scheibe. B: die mittlere Latenz von der Beschleunigung Rotor Stab Lauf fallen. C: die mittlere Wartezeit aus dem Stab auf den ersten und den letzten Studien zur Ausbildung Tage 1 und 27fallen. P< 0,01 vs. erster Versuch. D: Schema der hemmenden Vermeidung (IA) Aufgabe und koronalen Gehirn Scheibe. E: die mittlere Wartezeit der dunklen Kasten vor und nach IA Training11eingeben. P< 0,01 vs. vor IA Training. Die Zahlen von der koronalen Abschnitte zeigen den Abstand anterior Bregma in mm. Die Anzahl der Tiere ist an der Unterseite der Balken angezeigt. Fehlerbalken zeigen SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.
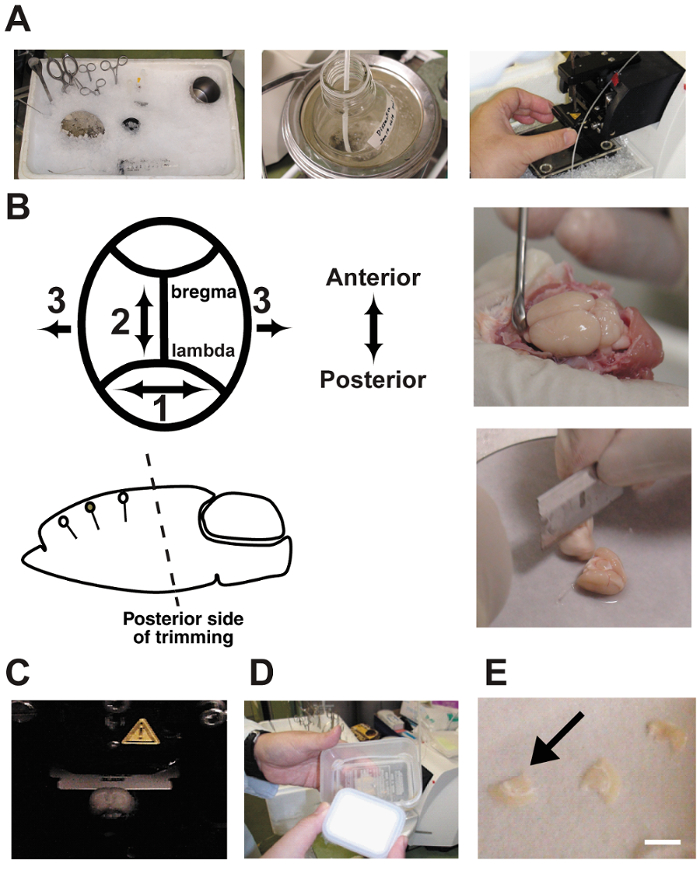
Abbildung 2 : Slice Verfahren.
A: Fotografien zeigen die Vorbereitung der akuten Hirnschnitten. Die Dissektion Werkzeuge wurden in zerstoßenem Eis vor dem Gebrauch gekühlt. B: Gehirn-Dissektion und trimmen. Beachten Sie, dass der Winkel des Ausschnitts auf der hinteren Seite parallel mit der dendritischen Orientierung ausgerichtet werden muss. C: das Gehirn in einer Vibratome Kammer schneiden. Das Gehirn ist in Dissektion Puffer gebadet und sprudelte kontinuierlich mit einem 5 % CO295 % O2 Gasgemisch. D: eine Schnittstelle Kammer machte zwei Kunststoff Essen-Container und ein Silikonschlauch. Die Kammer war gefüllt mit künstlichen CSF und blubberte kontinuierlich mit dem Gasgemisch. E: Gehirnscheiben wurden auf nassen Filterpapier in die Kammer gelegt.Bar = 5 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
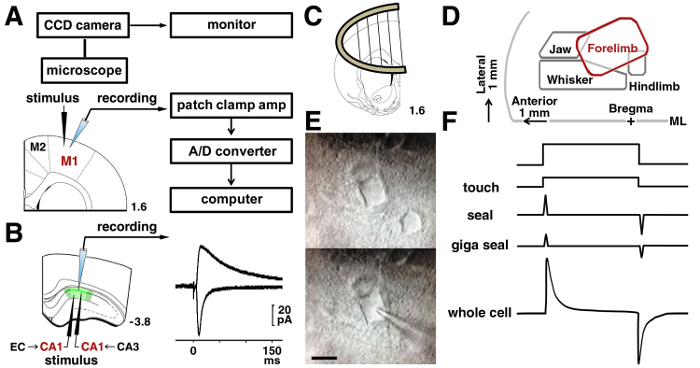
Abbildung 3 : Patch-Clamp-Verfahren.
A: der Patch-Clamp-System verwendet, um elektrische Signale von einer Nervenzelle zu erfassen. Die Lage der die anregende und Aufnahme von Elektroden in den Layer II/III-Neuronen sind im motorischen Kortex Ratte gezeigt. B: um die Schaffer Synapsen eines CA1 pyramidenförmigen Neurons zu analysieren, wurde eine anregende Elektrode an das Stratum Radiatum platziert. Um Temporoammonic Synapsen zu analysieren, wurde eine anregende Elektrode an das Stratum Moleculare gelegt. Vertreter der evozierten AMPA Spuren und NMDA-Rezeptor-vermittelten exzitatorischen postsynaptischen Ströme in der gleichen CA1 Nervenzelle dargestellt. C: ein Stück Anker wurde verwendet, um die Scheibe in der Aufnahme-Kammer zu stabilisieren. D: eine Darstellung Karte im motorischen Kortex, basierend auf den veröffentlichten Papiere15,16,17. ML = Mittellinie. E: IR-DIC Mikrographen M1 Schicht II/III-Neuronen vor (obere) und während der Aufnahme (niedriger). Bar = 10 µm. F: Änderungen in der Pipette aktuelle vor Touch (oben) und beim Membran Bruch (unten). Bitte klicken Sie hier für eine größere Version dieser Figur.
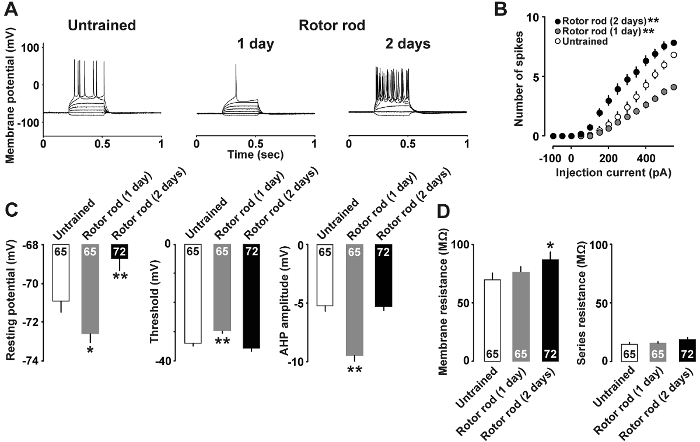
Abbildung 4 : Repräsentative Ergebnisse von Strom-Clamp Analyse7 .
A: repräsentative Spuren von Aktionspotentialen aufgezeichnet nach Induktion mit aktuellen Injektionen. B: Beziehungen zwischen der mittlere Stromeingang (pA) vs. Aktionspotential Ausgabe (Anzahl der Spikes) in Hirnschnitten von ungeschulten (offene Balken), 1-Tages ausgebildete (graue Balken) und 2-Tages ausgebildete Ratten (gefüllte Balken). C: Resting Potential, Schwelle und Afterhyperpolarization der Schicht II/III-Neuronen. D: Membran und Serie Beständigkeit der Neuronen. Wir haben 9-10 Ratten in jeder Gruppe. Die Anzahl der Zellen wird innerhalb jeder Balken angezeigt. Fehlerbalken zeigen SEM *P< 0,05, **P< 0,01 vs. ungeschult. Bitte klicken Sie hier für eine größere Version dieser Figur.
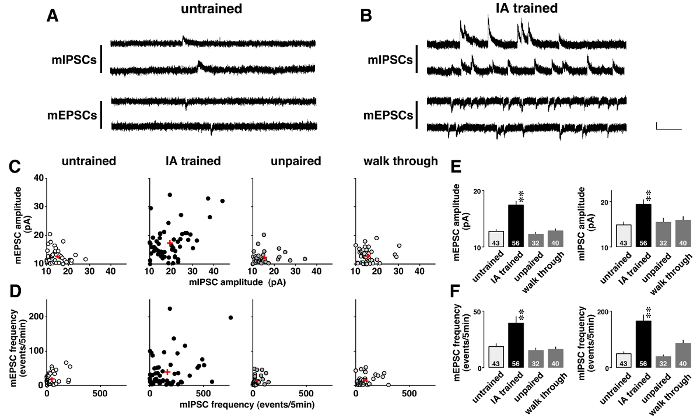
Abbildung 5 : Repräsentative Ergebnisse der Spannung-Clamp Analyse11 .
Repräsentative Spuren der Miniatur exzitatorischen und inhibitorischen postsynaptischen Ströme (mEPSCs und mIPSCs) in ungeschulten (A) und hemmenden Vermeidung (IA)-Ratten (B) ausgebildet. mEPSCs bei-60 mV und mIPSCs bei 0 mV wurden nacheinander in der gleichen CA1 pyramidale Nervenzelle im Beisein von Tetrodotoxin (0,5 µM) gemessen. Vertikaler Balken = 20 pA, Reck = 200 msec. C: zweidimensionale Grundstücke des Mittelwerts mir (I) PSC Amplituden in ungeübt, IA ausgebildet, ungepaarten, und begehbare Ratten. D: zweidimensionale Darstellungen von mir (I) PSC Frequenzen in 4 Gruppen. Beachten Sie, dass jedes Neuron CA1 verschiedene ausgestellt bedeuten mir (I) PSC Amplituden und Frequenzen. IA Training verstärkt nicht nur die mittleren Amplituden (E), sondern auch die Frequenzen von mir (I) PSC Veranstaltungen (F). Wir haben 4-6 Ratten in jeder Gruppe. Die Anzahl der Zellen ist an der Unterseite der Balken angezeigt. Roten Pluszeichen (C, D) und Bars mit vertikalen Linien (E, F) zeigen den Mittelwert ± SEM. **P< 0,01 vs. ungeschult Ratten. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Dissektion Puffer (insgesamt 1L) | ||
| NaH2PO4 • 2 H2O | 0,195 g | 1,25 Mmol/L |
| KCl | 0,188 g | 2,5 Mmol/L |
| CaCl2 | 0,074 g | 0,5 Mmol/L |
| MgCl2 • 6 H2O | 1,423 g | 7.0 Mmol/L |
| Cholinchlorid | 12,579 g | 90 Mmol/L |
| Ascorbinsäure | 2,340 g | 11.6 Mmol/L |
| Brenztraubensäure Säure | 0,342 g | 3.1 Mmol/L |
| Nahco33 | 2,100 g | 25 Mmol/L |
| Glukose | 4,500 g | 25 Mmol/L |
Tabelle 1: Ein Rezept für eine Dissektion Puffer
| Künstliche CSF (insgesamt 1L) | ||
| KCl | 0,186 g | 2,5 Mmol/L |
| NaCl | 6,700 g | 114.6 Mmol/L |
| NaH2PO4 •2H2O | 0,156 g | 1 Mmol/L |
| Glukose | 1,800 g | 10 Mmol/L |
| Nahco33 | 2,184 g | 26 Mmol/L |
| 1M MgCl2 | 4 mL | 4 Mmol/L |
| 1M CaCl2 | 4 mL | 4 Mmol/L |
Tabelle 2: Ein Rezept für künstliche Liquor cerebrospinalis (CSF)
| Intrazelluläre Lösung für Stromzange (insgesamt 200 mL) | ||
| KCl | 0,0746 g | 5 Mmol/L |
| K-Gluconat | 6,089 g | 130 Mmol/L |
| HEPES | 0,476 g | 10 Mmol/L |
| EGTA | 0,0456 g | 0,6 Mmol/L |
| 1M MgCl2 | 500 ΜL | 2,5 Mmol/L |
| Na2 ATP | 0,4408 g | 4 Mmol/L |
| Na3 GTP | 0,0418 g | 0,4 Mmol/L |
| Na Phosphokreatin | 0,510 g | 10 Mmol/L |
Tabelle 3: Eine Rezept für eine intrazelluläre Lösung für Stromzange Aufnahme
| Intrazelluläre Lösung für Spannung Klemme (insgesamt 200 mL) | ||||
| CsMeSO3 | 5 | |||
Tabelle 4: Eine Rezept für eine intrazelluläre Lösung für Spannung Klemme Aufnahme
| Parameter | ungeübte | IA ausgebildet | ungepaarte | Spaziergang durch | |
| mEPSC amplitude | Varianz | 5.8 | 32.1 | 4.7 | 5.9 |
| Standardabweichung | 2.4 | 5.7 | 2.2 | 2.4 | |
| Variationskoeffizient | 0.189 | 0.326 | 0,177 | 0.190 | |
| mIPSC amplitude | Varianz | 17.1 | 56,7 | 31,8 | 20,7 |
| Standardabweichung | 4.1 | 7.5 | 5.6 | 4.5 | |
| Variationskoeffizient | 0.279 | 0.387 | 0,367 | 0.286 |
Tabelle 5: Die Vielfalt der Miniatur exzitatorischen und inhibitorischen postsynaptischen aktuelle (mEPSC und mIPSC) Amplituden in hemmenden Vermeidung (IA)-Ratten ausgebildet
| Parameter | ungeübte | IA ausgebildet | ungepaarte | Spaziergang durch | |
| mEPSC Frequenz | Varianz | 278 | 2195 | 188 | 195 |
| Standardabweichung | 17 | 47 | 14 | 14 | |
| Variationskoeffizient | 0.902 | 1.198 | 0.893 | 0.874 | |
| mIPSC Frequenz | Varianz | 3282 | 27212 | 1385 | 5135 |
| Standardabweichung | 57 | 165 | 37 | 72 | |
| Variationskoeffizient | 1,195 | 1,006 | 0.955 | 0.836 |
Tabelle 6: Die Vielfalt der Miniatur exzitatorischen und inhibitorischen postsynaptischen aktuelle (mEPSC und mIPSC) Frequenzen in hemmenden Vermeidung (IA)-Ratten ausgebildet
Diskussion
Die größte Beschränkung der Slice-Patch-Clamp-Technik ist die Aufnahme im Slice-Vorbereitung, die nicht wiedergeben kann, was passiert, in Vivo. Obwohl in Vivo Strom-Clamp Analyse zuverlässiger ist, ist es technisch schwierig zu bewussten Tiere genügend Daten einholen. Da jedes pyramidale Neuron verschiedenen zelluläre Eigenschaften hat, braucht man eine ausreichende Anzahl von Zellen, Unterschiede in den Neuronen nach dem Training richtig zu analysieren. Darüber hinaus erfordert eine Analyse der Spannung-Clamp kontinuierliche medikamentöse Behandlung mit CNQX, APV oder Bicuculline zur Bestimmung der Art der postsynaptischen Antworten. Um die Miniatur-Reaktionen induziert durch eine einzelne Vesikel von Glutamat oder GABA zu analysieren, ist kontinuierlicher Behandlung mit Tetrodotoxin musste spontan Aktionspotentiale zu blockieren. Obwohl die neu entwickelte Multi-Photonen bildgebende Verfahren zur Analyse von morphologischer Veränderungen bei erregenden Synapsen19mächtig ist, wird eine kombinierte Patch-Clamp-Technik benötigt, um die Funktion der Synapsen in Vivozu analysieren. Derzeit ist es ziemlich schwierig, morphologische Veränderungen an den hemmenden Synapsen zu analysieren, da die meisten hemmende Synapsen keine Stacheln bilden. Zu diesem Zeitpunkt wäre die Scheibe Patch Clamp die am besten geeignete Technik zu Zelleigenschaften oder die Funktionen des exzitatorischen/hemmenden Synapsen bei trainierten Tieren zu analysieren.
Mit Strom-Clamp Analyse (Abbildung 4), haben wir vor kurzem berichtet motor Learning-induzierte intrinsischer Plastizität in Layer II/III Neuronen. Insbesondere die 1-Tages ausgebildete Ratten zeigten eine signifikante Abnahme der Membranpotential und einem Anstieg in der Spike-Schwelle ruhen. Die 2-Tages ausgebildete Ratten zeigte einen signifikanten Anstieg im ruhenden Membran-Potenzial, die zu erhöhter Erregbarkeit geführt. Diese Ergebnisse vorgeschlagen, dass es dynamische Veränderungen in der intrinsischen Plastizität des M1 Layer II/III Neuronen bei ausgebildeten Ratten waren. Zusätzliche Spannung-Clamp-Analyse ergab eine Zunahme des gepaart-Puls-Verhältnisses in 1-Tages ausgebildete Ratten, was darauf hindeutet, dass gab es ein vorübergehender Rückgang in der präsynaptischen GABA-Freisetzung Wahrscheinlichkeit7. Es ist daher möglich, dass Enthemmung von GABA in der Schicht II/III Synapsen die resultierende lernen-induzierte Plastizität im M1 auslösen könnte. Zur Unterstützung erfordert Slice Vorbereitung der M1 Bad Behandlung mit einem GABA-A Rezeptor Blocker, LTP20zu induzieren.
Analyse der Miniatur postsynaptischen Potenziale ist eine leistungsstarke Möglichkeit, synaptische Plastizität in IA ausgebildete Tiere zu erkennen. Sequentielle Erfassung von mEPSCs und mIPSCs in einem einzigen CA1 Neuron ermöglicht die Analyse der synaptischen exzitatorischen/hemmende Stärke jedes einzelnen Neuron. Seit einer einzigen mir (I) PSC Antwort ist zurückzuführen auf eine einzelne Vesikel von Glutamat oder GABA, eine Steigerung im mE (I) PSC Amplitude schlägt postsynaptischen Stärkung. Mit mir (I) PSC Analyse, fanden wir individuelle Unterschiede in der Stärke von exzitatorischen/inhibitorischen Eingang in jedes CA1-Neuron (Abbildung 5). IA-Training fördert die Vielfalt in der synaptischen Stärke eindeutig, aber dies wurde nicht beobachtet, in anderen Gruppen (Tabelle 5).
Lernen-induzierte synaptischen Vielfalt kann mathematisch analysiert werden. Durch die Erscheinung Wahrscheinlichkeit jedes Punktes berechnen, können Daten von jedem Neuron selbst-Entropie (bit) mit der Informationstheorie von Claude21umgewandelt werden. Ein Punkt mit hoher aussehen Wahrscheinlichkeit (rund um die mittlere Ebene) zeigt niedrigen Self-Entropie, während ein Punkt mit sehr seltenen Wahrscheinlichkeit (einem abgelenkten Punkt) hohen selbst-Entropie anzeigt. Verglichen mit ungeschulten Ratten, die selbst-Entropie pro Neuron war deutlich erhöht bei IA ausgebildete Ratten aber nicht im ungepaarten oder begehbare Ratten22. Dieser Analyse zufolge gab es eine Zunahme der Intra-CA1 Informationen nach dem kontextuellen lernen.
Die Slice-Patch-Clamp-Technik kann auch für abrufbereite Angst Konditionierung Studien in der lateralen Amygdala9 und Sinneserfahrung Studien in der Barrel Cortex8verwendet werden. Darüber hinaus kann diese Technik mit verschiedenen anderen Techniken für weitere Untersuchungen verwendet werden. Zum Beispiel das Virus-vermittelten grün fluoreszierende Protein (GFP)-tagged gen Lieferung Technik ist kombinierbar mit der Patch-Clamp-Technik, die Funktion von bestimmten Molekülen zu analysieren. Darüber hinaus kann fokale Mikroinjektion eine retrograde Tracer verwendet werden, um spezifischen Neuronen das Projekt auf einen bestimmten Bereich zu visualisieren. Dann können mit der Strom-Clamp-Technik, Zelle-spezifische Eigenschaften in der visualisierten Neuronen23analysiert werden. Weiter, hat kombiniert zwei-Photon Laserscanning-Mikroskopie mit zwei-Photonen-Laser uncaging Glutamat verwendet worden, zu zeigen, dass die Wirbelsäule-spezifische Wachstum und der EPSC Reaktion in Maus kortikalen Schicht II/III pyramidale Neuronen19. So wird der Slice-Patch-Clamp-Technik durch die Kombination mit neuartiger Chemikalien, gen Lieferung und Foto-Manipulation-Techniken verbessert.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte. Wir bestätigen, dass wir die Zeitschrift Position bezüglich der ethischen Veröffentlichung beteiligt habe, und wir bekräftigen, dass dieser Bericht in Übereinstimmung mit diesen Leitlinien steht. Die Geldgeber hatten keine Rolle in das Studiendesign, Datenerfassung oder Analyse, die Entscheidung, zu veröffentlichen oder der Manuskripterstellung.
Danksagungen
Wir möchten Dr. Paw-Min-Thein-Oo, Dr. Han-Thiri-Zin und Frau H. Tsurutani für ihre technische Unterstützung zu danken. Dieses Projekt wurde unterstützt von Grants-in-Aid für junge Wissenschaftler (h.k. und YS), wissenschaftliche Forschung B (d.m.), wissenschaftliche Forschung C (d.m.) und in innovativen Bereichen (d.m.), aus dem Ministerium für Bildung, Kultur, Sport, Wissenschaft, wissenschaftliche Forschung und Technologie von Japan.
Materialien
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
Referenzen
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten