Method Article
Sezione tecnica del Patch Clamp per l'analisi di plasticità indotta su apprendimento
In questo articolo
Riepilogo
La tecnica del patch clamp fetta è un metodo efficace per analizzare i cambiamenti indotti dall'apprendimento nella proprietà intrinseche e plasticità delle sinapsi eccitatorie o inibitorie.
Abstract
La tecnica del patch clamp fetta è un potente strumento per lo studio di apprendimento-indotta di plasticità neurale in regioni specifiche del cervello. Per analizzare la plasticità indotta motore-apprendimento, ci siamo allenati ratti facendo uso di un compito di asta di rotore accelerata. Ratti ha svolto il compito 10 volte a intervalli di 30 s per 1 o 2 giorni. Prestazioni è stata migliorata significativamente nei giorni di allenamento rispetto alla prima prova. Abbiamo quindi preparato fette di cervello acuto della corteccia motoria primaria (M1) in ratti non addestrati e qualificati. Corrente-morsetto analisi ha mostrato i cambiamenti dinamici nel potenziale di membrana, soglia di spike, afterhyperpolarization e resistenza di membrana di riposo in neuroni piramidali di livello II/III. Iniezione di corrente indotta più molti picchi nei ratti addestrati di 2 giorni che nei controlli non addestrati.
Per analizzare la plasticità indotta contestuale-apprendimento, ci siamo allenati ratti utilizzando un compito inibitorio dell'evitare (IA). Dopo aver sperimentato il piede-scossa nel lato oscuro di una casella, i ratti imparato a evitarlo, stare nel lato illuminato. Abbiamo preparato fette hippocampal acute da inesperto, IA-addestrati, spaiati e walk-through ratti. Analisi di tensione-morsetto è stata usata per registrare in sequenza in miniatura eccitatorie ed inibitorie correnti postsinaptiche (mIPSCs e mEPSCs) dal stesso neurone CA1. Abbiamo trovato diverse ampiezze di mEPSC e mIPSC medie in ogni neurone CA1, suggerendo che ogni neurone ha avuto diversi punti di forza postsinaptiche alle sue sinapsi eccitatorie ed inibitorie. Inoltre, rispetto ai comandi non addestrati, IA-addestrato ratti hanno avuti ampiezze superiori di mEPSC e mIPSC, con grande diversità. Questi risultati hanno indicato che contestuale apprendimento crea postsinaptica diversità nelle sinapsi sia eccitatori che inibitori a ogni neurone di CA1.
RecettoriA AMPA o GABA sembravano di mediare le correnti postsinaptiche, dal bagno di trattamento con CNQX o bicucullina bloccato gli eventi mEPSC o mIPSC, rispettivamente. Questa tecnica può essere utilizzata per studiare i diversi tipi di apprendimento in altre regioni, come la corteccia sensoriale e l'amigdala.
Introduzione
La tecnica del patch clamp, sviluppata da Neher e Sakmann, è stato ampiamente utilizzata per esperimenti elettrofisiologici1. La patch di cellule intere morsetto tecnica2 può essere utilizzato per registrare intracellulare corrente o tensione utilizzando la guarnizione gigaohm della membrana cellulare. La tecnica di corrente-morsetto permette di analizzare le differenze nelle proprietà di membrana come potenziale, resistenza e capacità3di riposo. La tecnica del morsetto di tensione permette di analizzare la plasticità sinaptica indotta su apprendimento alle sinapsi sia eccitatori che inibitori.
La corteccia motoria primaria (M1) è una regione centrale che è fondamentale per rendere i movimenti volontari qualificati. Precedenti studi elettrofisiologici hanno dimostrato lo sviluppo di potenziamento a lungo termine (LTP)-come plasticità nel livello II/III eccitatorio sinapsi dopo qualificati formazione motore4. Inoltre, in vivo imaging studi ulteriori hanno dimostrato il rimodellamento delle spine dendritiche M1 dopo un abile raggiungendo compito5,6. Tuttavia, plasticità sinaptica e intrinseco indotta su apprendimento non ha dimostrato in neuroni di M1.
Recentemente abbiamo riferito che un'attività di asta di rotore promosso cambiamenti dinamici nella glutamatergici e GABAergici sinapsi e alterato la plasticità intrinseca in M1 livello II/III neuroni7. Qui abbiamo usato la tecnica del patch clamp fetta per studiare la plasticità indotta su apprendimento. Questa tecnica è utilizzabile anche per studiare altri tipi di plasticità esperienza-dipendente in altre regioni del cervello. Ad esempio, input sensoriali nella corteccia barile può rinforzare AMPA ricevitore-mediata input eccitante nello strato di neuroni II/III8, ed acciaccato paura condizionata rafforza gli input eccitatori sui neuroni amigdala laterale, che è necessaria per paura di memoria9. Inoltre, apprendimento contestuale crea diversità in termini di input sinaptiche eccitatorie ed inibitorie in hippocampal CA1 neuroni10,11.
Protocollo
tutte le procedure chirurgiche e custodia degli animali erano in conformità con le linee guida per animale sperimentazione di Yamaguchi University School of Medicine e sono state approvate dal istituzionale Animal Care e uso Comitato di Yamaguchi Università.
1. animali
- utilizzare ratti Sprague-Dawley maschi di 4 a 5-week-old (postnatale 28 a 31 giorni di età).
- Casa i ratti in gabbie di plastica individuali (40 cm × 25 cm × 25 cm) mantenuti a temperatura costante (23 ° C ± 1 ° C) sotto un ciclo luce/buio di 12 h. Dare ratti ad libitum accesso all'acqua e cibo.
2. Test di asta di rotore
- per indagare le capacità motorie, di apprendimento, ogni ratto di sottoporre alla prova di asta di rotore (diametro stelo 7cm; Larghezza corsia 8,9 cm; altezza caduta 26,7 cm) per 1 o 2 giorni consecutivi ( Figura 1A in Kida et al, 2016 < sup classe = "xrif" > 7). Eseguire l'attività in una stanza tranquilla, temperatura controllata (23 ± 1 ° C). Non disturbare o gestire ratti prima il test.
- Impostare l'asta di rotore a modalità di accelerazione, che aumenta linearmente da 4 rotazioni/min a 40 giri/min (8 π/min a 80 π/min) a 5 min.
- Mettere il topo sullo stelo rotante che riposo. Confermare che tutte le arti sono sull'asta.
- Misurare la latenza per cadere dall'asta rotante per valutare le prestazioni del motore.
- Consentire ogni ratto 10 tentativi (prove) con intervalli di 30-s.
- Se il ratto cade dallo stelo rotante, è necessario impostarlo sull'asta dopo un intervallo di 10-20 s.
- Sacrificare il ratto con una overdose di pentobarbital (400 mg/kg) 30 min dopo il giudizio finale. Iniettare i ratti di controllo non addestrato con la stessa dose di anestesia nelle loro gabbie casa.
3. Test di inibitorio dell'evitare
- di indagare apprendimento contestuale, soggetto ratti ad un test di evitamento inibitorio (IA) ( Figura 1 a Mitsushima et al., 2011, 2013 10 , 11) evitare qualsiasi esperienze episodiche il giorno dell'esperimento come contatto con gli altri, cambiamenti di gabbia o di pulizia. Eseguire l'attività in una stanza tranquilla, temperatura controllata (23 ± 1 ° C).
Nota: L'apparecchiatura di addestramento di IA è una scatola acrilica due-a temperatura ambiente (lunghezza 33 cm; larghezza 58 cm; altezza 33 cm). Ha un lato sicuro illuminato ed un lato scuro scosse che sono separati da una botola ( Figura 1). - Posto il ratto nel lato sicuro (illuminato) della finestra illuminata. Gestire il ratto delicatamente senza stress.
- Aspettare un breve tempo (10-20 s) per acclimatare il ratto all'ambiente.
- Aprire la porta scorrevole per consentire il topo a entrare nella scatola scura a volontà.
- Misurare la latenza (s) prima che il topo entra nel lato oscuro romanzo della scatola. La latenza della prima prova rappresenta il ratto ' prestazioni di s prima dell'allenamento.
- Dopo l'entrata nel lato oscuro, chiudere la porta e applicare una piede elettrico strapazzate scossa (2 s, 1.6 mA) via coni retinici d'acciaio elettrici impostare nel pavimento della scatola. Consentire ratti walk-through esplorare l'attrezzo ginnico per 1 min senza essere scioccato. Casa ratti non abbinati in una gabbia di scossa illuminato per diversi giorni e improvvisamente daranno la scossa senza esperienze episodiche. Gestire delicatamente senza sforzo in qualsiasi gruppi.
- Mantenere ogni ratto nella casella scura per 10 s prima di tornare alla gabbia a casa.
- A 30 min dopo lo shock di piede, ancora posto il ratto nel lato illuminato della scatola. Misurare la latenza per immettere il lato oscuro.
- Tornare dalla gabbia ratto.
- A 60 min dopo lo shock, sacrificare il ratto con una overdose di pentobarbital (400 mg/kg). Gestire il ratto delicatamente e iniettare l'anestesia per via intraperitoneale. Nei ratti di controllo non addestrati, iniettare l'anestesia nelle loro gabbie casa senza l'esperienza descritta sopra.
4. Buffer di dissezione
- sciogliere cristalli di 0,195 g NaH 2 PO 4-2 H 2 O, 0,188 g KCl, 0,074 g CaCl 2, g 1,423 MgCl 2-6 H 2 O e 12,579 g di cloruro di colina in acqua ultrapura (900 mL a 950 mL) . Vedere la tabella 1.
- Sciogliere i cristalli di acido ascorbico 2,340 g, sale di sodio di acido piruvico 0,342 g, g 2,100 NaHCO 3 e 4,500 g di glucosio.
- Aggiungi acqua fino a 1000 mL. La gamma di osmolalità sarà tra 290 mOsm/L e 300 mOsm/L. Adjust osmolalità aggiungendo acqua ultrapura, se è finita la gamma.
- Bolla la soluzione con 5% CO 2 / 95% O 2 gas miscela alle gelide temperature per 5 min prima dell'uso.
5. Liquido cerebrospinale artificiale (aCSF)
- sciogliere cristalli di 0,186 g KCl, 6,700 g NaCl e g 0,156 NaH 2 PO 4-2 H 2 O in acqua ultrapura (900 mL a 950 mL). Vedere la tabella 2.
- Bolla con la miscela di gas per 5 min.
- Sciogliere i cristalli di 1,800 g glucosio e 2,184 g NaHCO 3 e quindi aggiungere soluzioni di riserva 4 mL MgCl 2 e 4 mL CaCl 2 da 1 M.
- Aggiungi acqua fino a 1000 mL. La gamma di osmolalità sarà tra 290 mOsm/L e 295 mOsm/L. Adjust osmolalità aggiungendo acqua ultrapura, se è finita la gamma.
- Bolla con il priore di miscela di gas da utilizzare.
6. Soluzioni intracellulare
- per corrente-morsetto registrazioni (tabella 3), sciogliere 0,0746 g KCl, 6,089 g K-gluconato, 0,476 g HEPES, 0,0456 g EGTA e 500 µ l MgCl 2 da 1m stock soluzione in 180 mL di acqua ultrapura (aggiustare il pH a 7,2 con KOH).
- Aggiungere g 0,4408 Na 2 - ATP, g 0,0418 Na 3 - GTP e 0,510 g Na-fosfocreatina. Aggiungere acqua a 200 mL e regolare il pH a 7.35 con KOH.
- Regolare il osmolality a circa 290 mOsm/L con l'aggiunta di acqua ultrapura.
- Store come aliquote di 1 mL nel congelatore (-30 ° C).
- Per registrazioni di tensione-morsetto (tabella 4), sciogliere 5,244 g CsMeSO 3, 0,672 g CsCl, soluzioni in 180 mL di acqua ultrapura di riserva 0,476 g HEPES, 0,0456 g EGTA e 500 µ l MgCl 2 da 1 M. Regolare il pH a 7,2 con CsOH. Registrazioni di mEPSPS e mIPSP, utilizzare modificate concentrazione di 5,814 CsMeSO 3 e 0,252 g CsCl per regolare il potenziale di inversione del recettore GABA A risposta 11.
- Aggiungere g 0,4408 Na 2 - ATP, g 0,0418 Na 3 - GTP e 0,510 g Na-fosfocreatina. Aggiungere acqua a 200 mL e regolare il pH a 7.35 con CsOH.
- Regolare il osmolality a circa 290 mOsm/L con l'aggiunta di acqua ultrapura.
- Store come aliquote di 1 mL nel congelatore (-30 ° C).
7. Affettare la preparazione
- priore a sacrificare, cool down tutti gli strumenti di dissezione con ghiaccio tritato ( Figura 2A). Aggiungere circa 500 mL di acqua fredda nel contenitore ghiaccio tritato per aumentare la superficie di contatto. Questa procedura è stata descritta precedentemente 10 , 11 , 12.
Nota: Gli strumenti qui sono: grandi forbici, forbici iris, una spatola, una spatola micro, pinze, pinzette, un becher da mL 200 in acciaio inox, una lama per cervello rifilatura, una siringa di aspersione cardiaca 120 mL riempita di tampone di dissezione trattate con la miscela di gas, di un tubo in silicone (20cm) collegato ad un ago calibro 18 appiattito, una fase di dissezione del cervello inox (spessore = 3mm, ϕ = 12 cm) e una fase di montaggio per il vibratome (ϕ = 5cm). - Sacrificare il ratto 30 min dopo aver completato il paradigma comportamentale di esso anestetizzando con una overdose di pentobarbital (400 mg/kg di peso corporeo). Eseguire la preparazione di fetta rapidamente per garantire che le fette sono sane come possibile 10 , 11 , 12. Il cervello extrprotocollo di azione soddisfa tutti gli standard veterinari per la nostra Università.
- Riempire una siringa di 120 mL con tampone di dissezione ghiacciata (tabella 1) gorgogliare con un 5% CO 2 / 95% O 2 miscela di gas. Rimuovere eventuali bolle d'aria prima della perfusione.
- Dopo aver esposto il cuore, inserire l'ago nella parte posteriore del ventricolo sinistro.
- Eseguire perfusione di aspersione del cervello manualmente utilizzando la siringa. Ratti più grandi richiedono più buffer di dissezione per aspersione. Immergere il cervello con buffer di dissezione ghiacciata per 5 min, bolla il buffer continuamente durante l'immersione.
- Tagliare la parte posteriore del cervello a un parallelo di angolo per l'orientamento dendritica della regione corticale destinazione utilizzando una lama. Poiché il cervello è salire su un palco di dissezione con il fondo di fine taglio, l'angolo iniziale determina l'angolo di tutte le sezioni successive del cervello. Questo passaggio è criticamente importante ( Figura 2B). Un'angolatura errata può tagliare attraverso i neuroni piramidali destinazione.
Nota: Gli strumenti qui sono: una lama per il taglio del cervello, una carta da filtro (ϕ = 10 cm), una fase di dissezione del cervello inox (spessore = 3mm, ϕ = 12 cm), una spatola, una supercolla, un contagocce e una fase di montaggio per il vibratome (ϕ = 5cm). - Fette 350-µm spessore della corona del cervello usando un vibratomo. Riempimento della camera di dissezione con buffer ghiacciata gorgogliare con un 5% CO 2 / 95% O 2 gas miscela ( Figura 2). Il buffer di Bubble continuamente durante la fetta di cervello.
- Tagliare la periferia dell'area target utilizzando forbici iris.
- Lavare le fette tagliate delicatamente a temperatura ambiente aCSF gorgogliare con 5% CO 2 / 95% O 2 (tabella 2). Fette di
- mantenere il profilato in un'aula di interfaccia fino a quando la registrazione è eseguita ( Figura 2D ed E). Incubazione per 1 h in aula migliora la condizione delle cellule, ma i fenotipi cambiare se le fette sono incubate per più di 10 ore. Chiudere il coperchio dell'alloggiamento per racchiudere i gas e le piccole gocce di aCSF.
8. Morsetto della intero-cellula patch
Nota: le registrazioni della intero-cellula richiedono un amplificatore e un filtro passa-basso che è impostato su una frequenza di taglio di 5 kHz. I segnali sono digitalizzati e archiviati in un PC. I dati memorizzati vengono analizzati non in linea ( Figura 3A).
- Elettrodi di vetro Create utilizzando un estrattore orizzontale. Riempire gli elettrodi con una soluzione adeguata (tabelle 3 e 4) usando una siringa da 1 mL in polietilene normale collegato ad un tubo di vetro fine e un filtro da 0,22 µm.
- Prima del contatto con la cellula, mantenere la pressione positiva e regolare la pipetta attuale a zero.
- Dopo che formano una guarnizione gigaohm, applicare una pressione negativa per la rottura della membrana cellulare (configurazione di cellule intere in Figura 3F).
9. Analisi corrente-morsetto
- proprietà della membrana cellulare
- riempire la patch registrazione pipette con la soluzione intracellulare per corrente-morsetto registrazioni (tabella 3). La resistenza della pipetta è tra 4 MΩ e 7 MΩ nel aCSF.
- Dopo la membrana si rompe, tenere la tensione della membrana a -60 mV in modalità V-CLAMP. Quindi, passare da " vasca " modalità per " cella " modalità nel test membrana utilizzando software per misurare le proprietà intrinseche delle cellule quali capacità di membrana, la resistenza e la costante di tempo.
- Studio corrente di iniezione
- dopo aver registrato le proprietà intrinseche delle celle, cambiare la modalità da V-CLAMP al brano (I = 0) /I-CLAMP normale per l'iniezione di corrente. Si noti che il potenziale di giunzione liquida non dovrebbe essere corretto 10.
- Iniettare corrente nella cella per 300 m. modificare l'intensità della corrente graduale da − 100 pA a pA + 550 con incrementi di 50-pA. Contare il numero di picchi (potenziali di azione) suscitata dalle iniezioni corrente.
- Misurare la tensione minima necessaria per indurre un potenziale di azione (è la tensione di soglia).
- Calcolare l'ampiezza di afterhyperpolarization come la differenza tra la tensione all'inizio di spike e il più basso raggiunto durante il afterhyperpolarization 7.
10. Analisi di tensione-morsetto
- The AMPA/NMDA rapporto
Nota: AMPA/NMDA il rapporto è un modo convenzionale per valutare postsinaptica plasticità alle sinapsi eccitatorie glutammatergiche 7 , 8 , 9 , 10 , 11. Tuttavia, notare che concomitanti aumenti in entrambi i componenti non possono cambiare il rapporto 13.- Profumi la camera di registrazione con soluzione fisiologica gorgogliare con la miscela di gas e mantenere la temperatura a 22 ° C-25 picrotoxin di 0,1 mM Aggiungi ° C. per la soluzione di bloccare il GABA A - mediata risposta e aggiungere 4 µM 2- chloroadenosine per stabilizzare la risposta neurale evocata 14.
- Riempire la patch registrazione pipette con la soluzione intracellulare per tensione-morsetto registrazioni (tabella 4). Controllare la resistenza della pipetta registrazione nel aCSF. La resistenza è tra 4 MΩ e MΩ 7.
- Per la registrazione in neuroni piramidali di livello II/III in M1, posizionare un bipolare tungsteno elettrodo 200 µm a 300 µm laterale alle cellule per essere registrato, sotto la superficie pial nella regione della rappresentazione di zampa anteriore di stimolazione (laterale di 2 mm per la linea mediana) 15 , 16 , 17.
- Per la registrazione in un neurone piramidale CA1, posizionare la stimolante elettrodo 200 µm a 300 µm laterale (fibra collaterale di Schaffer) o mediale (via temporoammonic) per le cellule che sarà registrato ( Figura 3B).
- Aumentare l'intensità dello stimolo fino alla risposta sinaptica > 10 PA.
- Calcolare il rapporto AMPA/NMDA come il rapporto tra la corrente di picco misurato al − 60 mV alla corrente misurata a + 40 mV 150 msec dopo l'inizio di stimolo. Si noti che dovrebbero essere una media di 50 a 100 tracce per calcolare il rapporto.
- Registrazioni correnti postsinaptiche in miniatura
Nota: correnti di postsinaptico eccitatorie in miniatura (mIPSCs) sono pensate per riflettere le risposte indotte dal rilascio presinaptico di una singola vescicola di glutammato 18 . Al contrario, correnti postsinaptiche inibitorie di miniatura (mEPSCs) sono pensate per riflettere le risposte indotte dal rilascio presinaptico di una singola vescicola di GABA 18. Aumenti le ampiezze di mIPSCs e mEPSCs riflette trasmissione postsinaptica rafforzamento, mentre aumenta in caso di frequenza aumenti del numero di sinapsi funzionali o la probabilità di rilascio presinaptico 11 .- Riempire la pipetta di registrazione patch con soluzione intracellulare modificata (tabella 4) per regolare il potenziale di inversione della corrente mediata dal recettore GABA A -60 mV.
- Tetrodotossina µM Aggiungi 0,5 al bagno per bloccare i potenziali di azione spontanei.
- Tenere la tensione a -60 mV a record gli eventi di mEPSC per 5 min.
- Cambiamento nell'azienda potenziale a 0 mV a registrare mIPSC eventi per 5 min. Perché i neuroni M1 mostrano inversione leggermente più alto potenziale per le correnti di recettore AMPA, mEPSCs dei neuroni M1 sono registrate a + 15 mV con 0,1 mM APV.
- Attendere pochi minuti per stabilizzare la corrente.
- Registrare gli eventi di mIPSC per 5 min.
- Rilevare gli eventi in miniatura utilizzando il software e utilizzare gli eventi sopra 10 pA per l'analisi. Contare il numero di eventi mIPSCs o mEPSCs per 5 min determinare la frequenza. Media le ampiezze degli eventi per ottenere l'ampiezza media.
- Confermare se trattamento vasca con 10 µM CNQX o con 10 µM bicucullina methiodide blocca gli eventi mIPSCs e mEPSCs, rispettivamente.
- Analisi Paired-pulse
Nota: plasticità presinaptica possono essere analizzati usando analisi di accoppiare-impulso. Un aumento del tasso di accoppiare-impulso suggerisce una diminuzione il glutammato presinaptica o GABA release probabilità 7 , 10 , 11.- Di analizzare sinapsi eccitatorie, aggiungere picrotoxin 0,1 mM e registrare la risposta a -60 mV. Anche se abbiamo aggiunto 4 µM 2-chloroadenosine per il bagno, abbiamo bisogno di tenere a mente che la droga colpisce la probabilità di rilascio presinaptico 14.
- Per analizzare le sinapsi inibitorie, aggiungere 0,1 mM APV e 4 µM 2-chloroadenosine al bagno e registrare la risposta a 0 mV. Nei neuroni M1, registrare la risposta a + 15 mV.
- Applicare impulsi appaiati con un intervallo di Inter-stimolo di 100 ms o MS 200.
- Registrare 50-100 tracce sequenziale presso ciascuna azienda potenziale e media dei valori in.
- Calcolare il rapporto di impulsi appaiati come il rapporto del secondo picco al primo picco della corrente postsinaptica.
Risultati
Come abbiamo descritto recentemente7, formazione di asta di rotore (Figura 1A) ha indotto cambiamenti dinamici nella plasticità intrinseca dei neuroni piramidali M1 strato II/III. Misurare la latenza fino a quando i ratti cadono dallo stelo rotante permette di stimare le prestazioni di apprendimento specializzato del ratto. Latenza più lunga indica la migliore prestazione del motore. Il giorno 1 della formazione, i ratti migliorato le loro prestazioni di asta di rotore fino a quando il processo si concluse. Il giorno 2, i ratti hanno raggiunto livelli quasi asintotica nella sessione media punteggi (Figura 1B). Confrontato con la latenza al primo processo, analisi post-hoc ha mostrato miglioramenti significativi alle prove finali nei giorni di allenamento (Figura 1).
Figura 4A Mostra un esempio di analisi corrente-morsetto in cui modificare le proprietà di un neurone dopo l'apprendimento di capacità motorie. Iniezioni di pA 400 e 500 pA correnti sono stati necessari per indurre i potenziali di azione del gruppo inesperto e nei ratti addestrati 1-giorno, rispettivamente. Al contrario, l'iniezione di solo un 150 pA corrente era sufficiente per elicitare potenziali d'azione nei ratti addestrati 2 giorni. Il rapporto tra l'intensità di corrente e il numero di potenziali di azione è mostrato in Figura 4B. Appena 50 pA corrente era sufficiente a suscitare picchi in ratti addestrati 2 giorni; al contrario, ratti addestrati 1 giorno ha risposto con meno potenziali di azione che i ratti non addestrati a 350 pA e correnti più elevate. Inoltre, la Figura 4 Mostra che 1 giorno addestrati ratti hanno mostrato che riposa inferiore potenziali, spike superiore soglia e afterhyperpolarization più profondo, mentre ratti addestrati 2 giorni hanno mostrato il più alto potenziale di riposo (Figura 4) e la resistenza della membrana ( Figura 4).
Come abbiamo descritto in precedenza11, formazione di IA (Figura 1) indotta postsinaptica plasticità alle sinapsi eccitatorie ed inibitorie dei neuroni hippocampal CA1. Misurando la latenza nel light box, abbiamo potuto stimare le prestazioni di apprendimento contestuale del ratto. Figura 1E Mostra i risultati dell'attività IA. Dopo la scossa elettrica accoppiata, i ratti imparano a evitare il lato oscuro della scatola e stare nel lato illuminato, che solitamente non preferirebbero. La tendenza ad evitare il lato oscuro di conseguenza indica l'acquisizione di ricordi contestuali.
Figura 5 Mostra un esempio di analisi di tensione-morsetto in cui miniatura correnti postsinaptiche sono state cambiate drammaticamente dopo l'apprendimento contestuale. Per studiare la plasticità indotta su apprendimento, mIPSCs AMPA-mediata spontanea e GABAA-mediata mEPSCs sono stati registrati sequenzialmente in presenza della tetrodotossina di 0,5 µM (Figura 5A e B). Come mostrato su appezzamenti bidimensionale (Figura 5), ogni neurone di CA1 ha avuto diverse ampiezze medie per mIPSCs e mEPSCs. Anche se le ampiezze basse, hanno mostrato una gamma stretta distribuzione in inesperto, spaiati, e ratti walk-through, quelli erano diversi in ratti addestrati IA (tabella 5). ANOVA seguita da analisi post-hoc ha mostrato un aumento significativo in medie ampiezze delle mEPSC e mIPSC in ratti addestrati IA (Figura 5E), suggerendo la plasticità postsinaptica apprendimento-indotta nei neuroni CA1.
Inoltre, ogni neurone di CA1 esposto diverse frequenze mEPSC e mIPSC (Figura 5). Anche se le frequenze basse, hanno mostrato una gamma stretta distribuzione in inesperto, spaiati, e ratti walk-through, quelli erano diversi in ratti addestrati IA (tabella 6). ANOVA seguita da analisi post-hoc ha mostrato un aumento significativo delle frequenze degli eventi mEPSC e mIPSC in ratti addestrati IA (Figura 5F). Ci sono due possibili interpretazioni di questi risultati. Il primo è che l'apprendimento contestuale aumentato il numero delle sinapsi funzionali dei neuroni. L'altro è che l'apprendimento contestuale aumentato la probabilità di rilascio presinaptico del glutammato e GABA.
Per più ulteriormente esaminare plasticità presinaptica, abbiamo anche condotto accoppiare-impulso stimolazioni, come riferito precedentemente10,11.
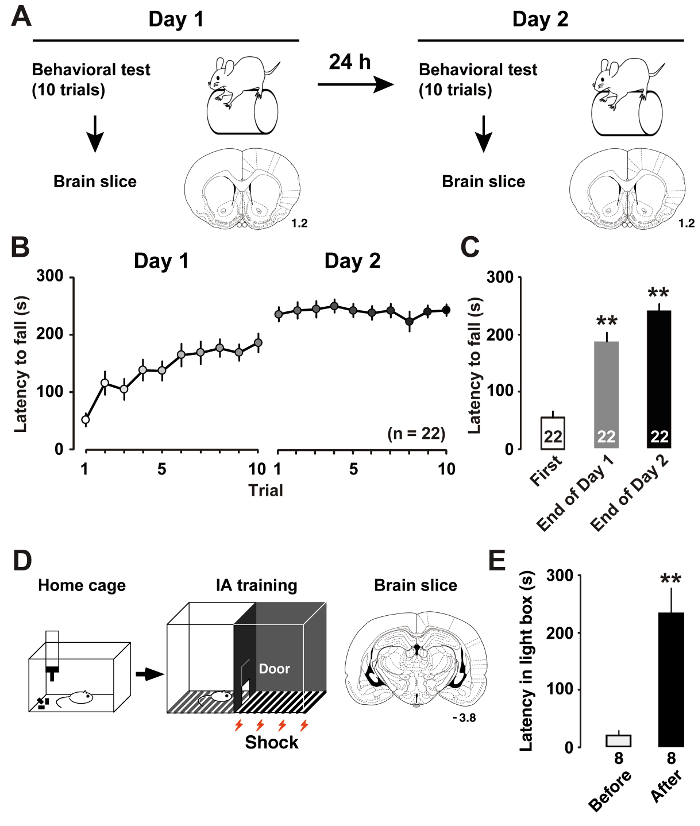
Figura 1 : Apprendimento di prestazioni dopo l'allenamento.
A: il disegno sperimentale spettacoli il rotore asta formazione e sezione coronale del cervello. B: la latenza media di cadere dalla canna asta rotore accelerare. C: la latenza media incrostata l'asta sul primo e le prove finali sulla formazione giorni 1 e 27. P< 0.01 vs prima prova. D: Schema della sezione di cervello inibitorio dell'evitare (IA) attività e coronale. E: la latenza media per entrare nella scatola scura prima e dopo IA formazione11. P< 0.01 vs prima dell'allenamento di IA. I numeri dalle sezioni coronali indicano la distanza anteriore il bregma in mm. Il numero di animali è mostrato nella parte inferiore delle barre. Barre di errore indicano SEM. Clicca qui per visualizzare una versione più grande di questa figura.
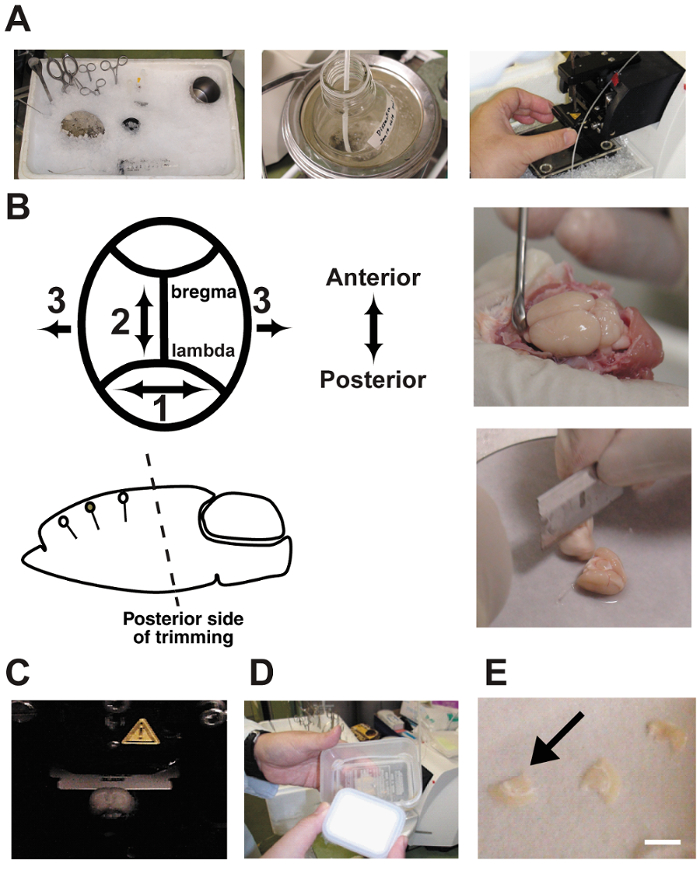
Figura 2 : Affettare procedure.
A: le fotografie mostrano la preparazione di fettine di cervello acuto. Gli strumenti di dissezione sono stati raffreddati in prima di ghiaccio tritato di usarla. B: dissezione e rifilatura del cervello. Si noti che l'angolo di taglio sul lato posteriore deve essere orientato in parallelo con l'orientamento dendritica. C: affettare il cervello in una camera del vibratome. Il cervello è bagnato nel buffer di dissezione e gorgogliare continuamente con una miscela di gas2 di 95% O di 5% CO2. D: una camera di interfaccia è costituito da due contenitori di plastica per alimenti e un tubo di silicone. La camera era pieni di liquido Cerebrospinale artificiale e gorgogliare continuamente con la miscela di gas. E: fettine di cervello sono stati collocati su carta da filtro bagnato nell'alloggiamento.Bar = 5 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
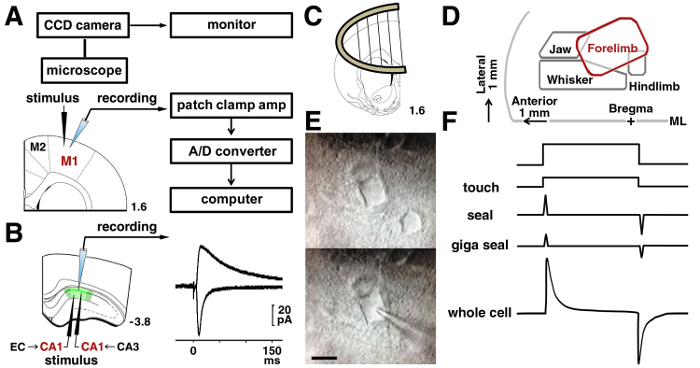
Figura 3 : Procedure di Patch clamp.
A: il sistema di patch-clamp utilizzato per registrare i segnali elettrici da un neurone. La posizione della stimolante ed elettrodi di registrazione nei neuroni di II/III livello sono mostrati nella corteccia di motore del ratto. B: per analizzare le Schaffer sinapsi di un neurone piramidale CA1, un elettrodo stimolante è stato messo alla strato radiato. Per analizzare le sinapsi temporoammonic, fu collocato un elettrodo stimolante la strato molecolare. Rappresentante tracce di AMPA evocato e correnti postsinaptiche eccitatorie mediata dal recettore NMDA nel stesso neurone CA1 sono mostrate. C: una fetta di ancoraggio è stato utilizzato per stabilizzare la fetta nella camera di registrazione. D: una mappa di rappresentazione nella corteccia motoria, basata sulle carte pubblicate15,16,17. ML = del midline. E: Neuroni II/III prima di strato micrografie IR-DIC della M1 (superiore) e durante la registrazione (inferiore). Bar = 10 µm. F: cambiamenti nella pipetta corrente prima tocco (parte superiore) ed alla rottura della membrana (infondo). Clicca qui per visualizzare una versione più grande di questa figura.
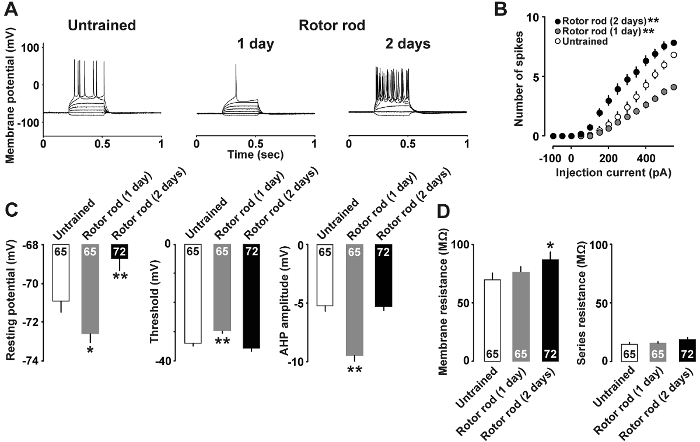
Figura 4 : Risultati rappresentativi di analisi corrente-morsetto7 .
A: tracce rappresentative dei potenziali d'azione registrata dopo induzione con iniezioni di corrente. B: relazioni tra l'ingresso di corrente media (pA) vs azione potenziale uscita (numero di picchi) nelle fette del cervello da inesperto (bar aperto), 1-giorno addestrate (barre grigie) e 2 giorni ratti addestrati (riempito bar). C: afterhyperpolarization dei neuroni II/III livello, soglia e potenziale di riposo. D: resistenza di membrana e resistenza in serie dei neuroni. Abbiamo usato il 9-10 ratti in ogni gruppo. Il numero di celle viene visualizzato all'interno di ogni barra. Barre di errore indicano SEM. *P< 0.05, * *P< 0.01 vs non addestrati. Clicca qui per visualizzare una versione più grande di questa figura.
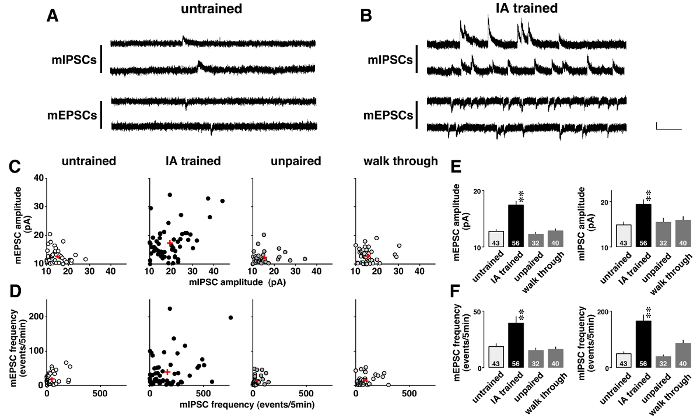
Figura 5 : Risultati rappresentativi delle analisi tensione-morsetto11 .
Rappresentante tracce di miniatura eccitatorie ed inibitorie correnti postsinaptiche (mIPSCs e mEPSCs) di inesperto (A) e inibitorio dell'evitare (IA)-addestrato ratti (B). mIPSCs a-60 mV e mEPSCs a 0 mV sono stati misurati in sequenza nel stesso neurone piramidale CA1 in presenza di tetrodotossina (0,5 µM). Barra verticale = 20 pA, barra orizzontale = 200 msec. C: terreni bidimensionale della media mE (I) PSC ampiezze in inesperto, IA-addestrato, spaiati e walk-through ratti. D: grafici bidimensionali di mE (I) PSC frequenze nei 4 gruppi. Nota che ogni neurone CA1 esposte diverse significa mE (I) frequenze e ampiezze PSC. Formazione di IA non solo ha rafforzato le ampiezze medie (E), ma anche aumentato le frequenze di mE (I) eventi PSC (F). Abbiamo usato 4-6 ratti in ogni gruppo. Il numero di celle viene visualizzato nella parte inferiore delle barre. Segno rosso (C, D) e le barre con linee verticali (E, F) indicano la media ± SEM. * *P< 0.01 vs non addestrato ratti. Clicca qui per visualizzare una versione più grande di questa figura.
| Buffer di dissezione (totale 1L) | ||
| NaH2PO4 • 2 H2O | 0,195 g | 1,25 mmol/L |
| KCl | g 0,188 | 2,5 mmol/L |
| CaCl2 | 0,074 g | 0,5 mmol/L |
| MgCl2 • 6 H2O | 1,423 g | 7.0 mmol/L |
| Cloruro di colina | 12,579 g | 90 mmol/L |
| Acido ascorbico | 2,340 g | 11,6 mmol/L |
| Acido piruvico | 0,342 g | 3,1 mmol/L |
| NaHCO3 | 2,100 g | 25 mmol/L |
| Glucosio | 4,500 g | 25 mmol/L |
Tabella 1: Una ricetta per il buffer di dissezione
| CSF artificiale (totale 1L) | ||
| KCl | 0,186 g | 2,5 mmol/L |
| NaCl | 6,700 g | 114,6 mmol/L |
| NaH2PO4 •2H2O | 0,156 g | 1 mmol/L |
| Glucosio | 1,800 g | 10 mmol/L |
| NaHCO3 | 2,184 g | 26 mmol/L |
| 1M MgCl2 | 4 mL | 4 mmol/L |
| 1M CaCl2 | 4 mL | 4 mmol/L |
Tabella 2: Una ricetta per artificiale del liquido cerebrospinale (CSF)
| Soluzione intracellulare per pinza amperometrica (Totale 200 mL) | ||
| KCl | 0,0746 g | 5 mmol/L |
| K-gluconato | 6,089 g | 130 mmol/L |
| HEPES | 0,476 g | 10 mmol/L |
| EGTA | 0,0456 g | 0,6 mmol/L |
| 1M MgCl2 | 500 Μ l | 2,5 mmol/L |
| Na2 ATP | 0,4408 g | 4 mmol/L |
| Na3 GTP | 0,0418 g | 0,4 mmol/L |
| Fosfocreatina na | 0,510 g | 10 mmol/L |
Tabella 3: Registrazione di una ricetta per una soluzione intracellulare per pinza amperometrica
| Soluzione intracellulare per morsetto di tensione (Totale 200 mL) | ||||
| CsMeSO3 | 5 | |||
Tabella 4: Registrazione di una ricetta per una soluzione intracellulare per morsetto di tensione
| Parametri | non addestrato | IA addestrato | spaiato | camminare attraverso | |
| ampiezza mEPSC | Varianza | 5.8 | 32,1 | 4.7 | 5.9 |
| Deviazione standard | 2.4 | 5.7 | 2.2 | 2.4 | |
| Coefficiente di variazione | 0,189 | 0.326 | 0.177 | 0.190 | |
| ampiezza mIPSC | Varianza | 17,1 | 56,7 | 31,8 | 20,7 |
| Deviazione standard | 4.1 | 7.5 | 5.6 | 4.5 | |
| Coefficiente di variazione | 0.279 | 0,387 | 0,367 | 0.286 |
Tabella 5: La diversità della miniatura inibitori ed eccitatori postsinaptici corrente (mEPSC e mIPSC) ampiezze in inibitorio dell'evitare (IA)-addestrato ratti
| Parametri | non addestrato | IA addestrato | spaiato | camminare attraverso | |
| mEPSC frequenza | Varianza | 278 | 2195 | 188 | 195 |
| Deviazione standard | 17 | 47 | 14 | 14 | |
| Coefficiente di variazione | 0.902 | 1.198 | 0.893 | 0,874 | |
| mIPSC frequenza | Varianza | 3282 | 27212 | 1385 | 5135 |
| Deviazione standard | 57 | 165 | 37 | 72 | |
| Coefficiente di variazione | 1.195 | 1.006 | 0,955 | 0.836 |
Tabella 6: La diversità della miniatura inibitori ed eccitatori postsinaptici corrente (mEPSC e mIPSC) frequenze in inibitorio dell'evitare (IA)-addestrato ratti
Discussione
La limitazione principale della tecnica del patch clamp fetta è la registrazione in fetta preparazione, che non rispecchiano ciò che accade in vivo. Anche se in vivo analisi corrente-morsetto è più affidabile, è tecnicamente difficile ottenere dati sufficienti da animali coscienti. Poiché ogni neurone piramidale ha diverse proprietà cellulari, un numero adeguato di cellule è necessaria per analizzare correttamente le differenze nei neuroni dopo l'allenamento. Inoltre, la tensione-morsetto analisi richiede trattamento farmacologico continuo con CNQX, APV o bicucullina per determinare la natura delle risposte postsinaptiche. Per analizzare le risposte in miniatura indotte da una singola vescicola di glutammato o GABA, un trattamento continuo con tetrodotossina è necessaria per bloccare i potenziali di azione spontanei. Sebbene la tecnica di imaging multi-fotone sviluppata di recente è potente per analizzare i cambiamenti morfologici alle sinapsi eccitatorie19, una tecnica combinata patch clamp è necessaria per analizzare la funzione delle sinapsi in vivo. Attualmente è abbastanza difficile da analizzare i cambiamenti morfologici alle sinapsi inibitorie, poiché più inibitorie sinapsi non formano spine. In questo momento, il morsetto di toppa fetta sarebbe la tecnica più adatta per analizzare le proprietà della cella o le funzioni delle sinapsi eccitatorie/inibitorie in animali addestrati.
Usando l'analisi corrente-morsetto (Figura 4), abbiamo recentemente segnalato plasticità motoria indotta da apprendimento intrinseco in neuroni di strato II/III. In particolare, i ratti addestrati di 1 giorno hanno mostrato una diminuzione significativa nel riposo di potenziale di membrana e un aumento della soglia di spike. I ratti addestrati di 2 giorni hanno mostrato un significativo aumento nel potenziale di membrana che hanno portato a una maggiore eccitabilità di riposo. Questi risultati hanno indicato che ci erano cambiamenti dinamici nella plasticità intrinseca dei neuroni II/III livello M1 in ratti addestrati. Tensione-morsetto ulteriori analisi ha rivelato un aumento del rapporto di accoppiare-impulso in ratti addestrati 1-giorno, suggerendo che c'era una diminuzione transitoria in probabilità presinaptici GABA release7. È quindi possibile che disinibizione da GABA a livello II/III sinapsi potrebbe innescare la plasticità indotta da apprendimento risultante in M1. A sostegno di ciò, preparazione di fetta della M1 richiede trattamento vasca con un bloccante del recettore GABAA indurre LTP20.
Analisi dei potenziali postsinaptici in miniatura sono un modo potente per rilevare la plasticità sinaptica in animali addestrati IA. Registrazione sequenziale del mIPSCs e mEPSCs in un singolo neurone CA1 permette l'analisi della forza sinaptica eccitatorio/inibitorio di ogni singolo neurone. Poiché un singolo mE (I) PSC risposta è attribuita a una singola vescicola di glutammato o GABA, un aumento in mE (I) PSC ampiezza suggerisce rafforzamento postsinaptici. ME (I) usando l'analisi PSC, abbiamo trovato le differenze individuali nella forza di input eccitatorio/inibitorio in ogni neurone CA1 (Figura 5). Formazione di IA chiaramente promosso diversità nella forza sinaptica, ma questo non è stato osservato in altri gruppi (tabella 5).
Indotta da apprendimento sinaptico diversità può essere analizzato matematicamente. Calcolando la probabilità di comparsa di ogni punto, i dati da ogni neurone possono essere convertiti a self-entropia usando la teoria dell'informazione di Shannon21(un po'). Un punto con la probabilità di comparsa alta (intorno al livello medio) indica bassa self-entropia, mentre un punto con probabilità molto raro (un punto deviato) indica self-entropia elevata. Rispetto ai ratti non addestrati, l'auto-entropia al neurone era chiaramente aumentato in ratti addestrati IA ma non in spaiati o walk-through ratti22. Questa analisi suggerisce che ci era un aumento in intra-CA1 informazioni dopo l'apprendimento contestuale.
La tecnica del patch clamp fetta può essere utilizzata anche per attirare paura condizionata studi l' amigdala laterale9 e per gli studi di esperienza sensoriale nella corteccia barile8. Inoltre, questa tecnica può essere utilizzata con varie altre tecniche per ulteriori indagini. Per esempio, il virus-mediate proteina fluorescente verde (GFP)-tagged gene consegna tecnica può essere combinata con la tecnica del patch clamp per analizzare la funzione di molecole specifiche. Inoltre, focale microiniezione di un tracciante retrogrado può essere utilizzato per visualizzare specifici neuroni tale progetto a un'area specifica. Quindi, utilizzando la tecnica corrente-clamp, proprietà specifiche della cella possono essere analizzati nei neuroni visualizzati23. Inoltre, combinando due fotoni laser-microscopia con due fotoni laser uncaging del glutammato è stata utilizzata per dimostrare la crescita della colonna vertebrale-specifici e la risposta EPSC nel topo corticale strato II/III neuroni piramidali19. Così, la tecnica del patch clamp fetta viene migliorata attraverso la combinazione con sostanze chimiche romanzo, consegna del gene e tecniche di manipolazione di foto.
Divulgazioni
Gli autori non dichiarano conflitti di interesse. Confermiamo che abbiamo letto posizione del giornale su questioni coinvolte nella pubblicazione etica, e affermiamo che questa relazione è coerenza con tali orientamenti. I finanziatori non avevano alcun ruolo nel disegno dello studio, raccolta dati o analisi, la decisione di pubblicare o la preparazione del manoscritto.
Riconoscimenti
Vorremmo ringraziare il Dr. zampa-Min-Thein-Oo, Dr. Han-Thiri-Zin e Sig. ra H. Tsurutani per la loro assistenza tecnica. Questo progetto è stato supportato da localizzativi per giovani scienziati (H.K. e Y.S.), B di ricerca scientifica (D.M.), C di ricerca scientifica (D.M.) e ricerca scientifica in aree Innovative (D.M.), dal Ministero della pubblica istruzione, cultura, sport, scienza, e Tecnologia del Giappone.
Materiali
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
Riferimenti
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon