Method Article
Fatia Patch Clamp técnica para análise de plasticidade induzida pela aprendizagem
Neste Artigo
Resumo
A técnica de braçadeira do remendo de fatia é um método eficaz para a análise de aprendizagem induzido por alterações nas propriedades intrínsecas e plasticidade de sinapses excitatórias ou inibitórias.
Resumo
A técnica de braçadeira do remendo de fatia é uma poderosa ferramenta para investigar a plasticidade neural induzida por aprendizagem em regiões específicas do cérebro. Para analisar o motor-aprendizagem plasticidade induzida, treinamos ratos usando uma tarefa de vara de rotor acelerado. Ratos realizado a tarefa 10 vezes em intervalos de 30 s para 1 ou 2 dias. Desempenho foi melhorado significativamente sobre os dias de treinamento em comparação com o primeiro julgamento. Então preparamos fatias de cérebro aguda do córtex motor primário (M1) em ratos treinados e destreinados. Análise de corrente-braçadeira mostrou mudanças dinâmicas no potencial de membrana, limiar de spike, afterhyperpolarization e resistência de membrana de repouso em neurônios piramidais de camada II/III. Injeção de corrente induzida por muitos picos mais em ratos treinados 2 dias do que em controles destreinados.
Para analisar a aprendizagem contextual plasticidade induzida, treinamos ratos usando uma tarefa de evasão inibitório (IA). Depois de experimentar pé-choque no lado escuro de uma caixa, os ratos aprenderam a evitá-lo, ficar no lado iluminado. Estamos preparados agudas fatias hippocampal destreinado, IA-treinado, não pareado e ratos de passo a passo. Análise de tensão-braçadeira foi usado para gravar sequencialmente em miniatura excitatórios e inibitórios pós-sinápticos correntes (mEPSCs e mIPSCs) do mesmo neurônio CA1. Encontramos diferentes amplitudes médios de mEPSC e mIPSC em cada neurônio CA1, sugerindo que cada neurônio tinha diferentes dosagens pós-sináptica em suas sinapses excitatórias e inibitórias. Além disso, em comparação com controles destreinados, ratos treinados IA tinham maiores amplitudes de mEPSC e mIPSC, com ampla diversidade. Estes resultados sugeriram que a aprendizagem contextual cria pós-sináptica diversidade nas sinapses excitatórias e inibitórias em cada neurônio CA1.
Leandro ou GABAA receptores parecem mediar as correntes pós-sinápticas, desde tratamento de banho com CNQX ou prosencefálico bloqueou os eventos mEPSC ou mIPSC, respectivamente. Esta técnica pode ser usada para estudar diferentes tipos de aprendizagem em outras regiões, como o córtex sensorial e a amígdala.
Introdução
A técnica de braçadeira do remendo, desenvolvida pela Neher e Sakmann, tem sido amplamente utilizada para experimentos eletrofisiológicos1. O remendo de células inteiras braçadeira técnica2 pode ser usado para gravar intracelular corrente ou tensão usando o selo gigaohm da membrana celular. A técnica de corrente-braçadeira nos permite analisar as diferenças nas propriedades da membrana como potencial, resistência e capacitância3a descansar. A técnica de tensão-braçadeira nos permite analisar a plasticidade sináptica induzida pela aprendizagem em sinapses excitatórias e inibitórias.
O córtex motor primário (M1) é uma região central que é essencial para fazer movimentos voluntários qualificados. Anteriores Estudos eletrofisiológicos demonstraram o desenvolvimento da potenciação de longa duração (LTP)-como plasticidade na camada II/III excitatório sinapses após treinamento hábil motor4. Além disso, na vivo estudos adicionais de imagem demonstrou a remodelação de espinhas dendríticas M1 após um hábil atingindo tarefa5,6. No entanto, plasticidade sináptica e intrínseca induzida pelo aprendizado não tem sido demonstrada em neurônios de M1.
Recentemente, informou que uma tarefa de vara de rotor promovido mudanças dinâmicas em glutamatérgico e gabaérgica sinapses e alterou a plasticidade intrínseca no M1 camada II/III neurônios7. Aqui usamos a técnica de braçadeira do remendo de fatia para investigar a plasticidade induzida pela aprendizagem. Esta técnica também pode ser usada para investigar outros tipos de plasticidade dependente da experiência em outras regiões do cérebro. Por exemplo, entrada sensorial para o córtex barril pode fortalecer Leandro mediada por receptores excitatória entrada na camada de neurônios II/III8e marcado medo condicionado fortalece as entradas excitatórias sobre os neurônios da amígdala lateral, que é necessário para medo de memória9. Além disso, a aprendizagem contextual cria diversidade em termos de entrada sináptica excitatória e inibitória em hippocampal CA1 neurônios10,11.
Protocolo
todos os procedimentos cirúrgicos e alojamento dos animais estavam em conformidade com as orientações para o Animal experimentação de Yamaguchi University School of Medicine e foram aprovados pelo Comitê de uso de Yamaguchi e institucional Cuidado Animal Universidade.
1. animais
- usar ratos Sprague-Dawley machos de 4 a 5 semanas de idade (pós-natal 28 a 31 dias de idade).
- De casa os ratos em gaiolas individuais de plástico (40 cm x 25 cm x 25 cm), mantidos a uma temperatura constante (23 ° C ± 1 ° C) sob um ciclo claro/escuro de 12-h. Dar ratos ad libitum acesso à água e alimentos.
2. Teste de vara de rotor
- para investigar a habilidade motora, aprendizagem, cada rato de assunto para o teste de haste do rotor (diâmetro da haste 7 cm; largura de faixa 8,9 cm; altura de queda 26,7 cm) por 1 ou 2 dias consecutivos ( figura 1A na Kida et al., 2016 < sup classe = "xref" > 7). Execute a tarefa em um quarto silencioso, com temperatura controlada (23 ± 1 ° C). Não perturbe ou lidar com ratos antes o teste
- Definir a haste do rotor para modo de aceleração, o que aumenta linearmente de 4 rotações/min a 40 rotações/min (8 π/min a 80 π/min) em 5 min.
- Colocar o rato na haste rotativa do descanso. Confirmar que todos os membros são barra.
- Medir a latência para cair da haste rotativa para avaliar o desempenho motor.
- Permitir que cada rato 10 tentativas (ensaios), com intervalos de 30-s.
- Se o rato cai da haste rotativa, configurá-lo na haste novamente após um intervalo de s de 10-20.
- Sacrificar o rato com uma overdose de pentobarbital (400 mg/kg) 30 min após o julgamento final. Injectar ratos destreinados controle com a mesma dose de anestesia em suas gaiolas casa.
3. Teste de evasão inibitório
- para investigar a aprendizagem contextual, assunto ratos a um teste de evasão inibitório (IA) ( Figura 1 na Mitsushima et al., 2011, 2013 10 , 11) Evite quaisquer experiências episódicas no dia do experimento tais como contato com os outros, mudanças de gaiola ou limpeza. Executar a tarefa em um quarto silencioso, com temperatura controlada (23 ± 1 ° C).
Nota: O aparelho de treinamento IA é uma caixa de acrílico com duas câmaras (comprimento 33 cm; largura 58 cm; altura 33 cm). Tem um lado iluminado e seguro e um lado escuro de choque que são separados por um alçapão ( Figura 1). - Colocar o rato no lado seguro (lit) da caixa iluminada. Manipular o rato suavemente sem stress.
- Esperar de um curto período de tempo (10 a 20 s) para se aclimatar o rato para o ambiente.
- Abrir a porta de correr para permitir que o rato inserir a caixa escura à vontade.
- Medir a latência (s) antes do rato entra o novo lado escuro da caixa. A latência do primeiro julgamento representa o rato ' s desempenho antes do treino.
- Após a entrada no lado escuro, feche a porta e aplicar um choque de pé elétrica ovos mexidos (2 s, 1.6 mA) através de barras de aço elétricas situado no assoalho da caixa. Permitem que ratos Walk-through explorar os aparelhos de treino para 1 min sem ser chocado. Casa da marcação sem paridade ratos em uma gaiola de choque iluminado por vários dias e de repente, dê o choque sem experiências episódicas. Manipular suavemente sem estresse em qualquer grupo.
- Manter cada rato na caixa escura para 10 s antes de retorná-lo para a gaiola casa.
- Em 30 min após o choque de pé, coloque novamente o rato para o lado iluminado da caixa. Medir a latência para entrar do lado escuro.
- Retornar o rato da gaiola casa.
- Em 60 min após o choque, sacrificar o rato com uma overdose de pentobarbital (400 mg/kg). Manipular o rato delicadamente e injetar a anestesia intraperitonealmente. Em ratos controle destreinado, injetar a anestesia nas jaulas em casa sem a experiência descrita acima.
4. Buffer de dissecação
- dissolver os cristais de 0,195 g NaH 2 PO 4-2 H 2 O, 0,188 g KCl, 0,074 g de CaCl 2, 1,423 g MgCl 2-6 H 2 O e cloreto de colina 12,579 g em água ultrapura (900 mL para 950 mL) . Consulte a tabela 1.
- Dissolver os cristais de ácido ascórbico de 2,340 g, sal de sódio ácido pirúvico 0,342 g, 2,100 g NaHCO 3 e glicose 4,500 g.
- Adicionar água até 1000 mL. A escala de osmolalidade será entre 290 mOsm/L e 300 mOsm/L. Adjust osmolalidade adicionando água ultrapura, se é sobre a faixa de.
- Bolha a solução com 5% CO 2 / 95% O 2 gás mistura a temperaturas geladas por 5 min antes do uso.
5. Líquido cefalorraquidiano artificial (aCSF)
- dissolver cristais de 0,186 g KCl, 6,700 g NaCl e 0,156 g NaH 2 PO 4-2 H 2 O em água ultrapura (900 mL para 950 mL). Consulte a tabela 2.
- Bolha com a mistura de gás de 5 min.
- Dissolver os cristais de 1,800 g glicose e g 2,184 NaHCO 3 e em seguida, adicione 4 mL de MgCl 2 e 4 mL de CaCl 2 de 1m de estoque soluções.
- Adicionar água até 1000 mL. A escala de osmolalidade será entre 290 mOsm/L e 295 mOsm/L. Adjust osmolalidade adicionando água ultrapura, se é sobre a faixa de.
- Bolha com a prévia de mistura de gás usar.
6. Soluções intracelulares
- para gravações de corrente-braçadeira (tabela 3), dissolver 0,0746 g de KCl, solução em 180 mL de água ultrapura reserva 6,089 g K-gluconato, 0,476 g HEPES, g 0,0456 EGTA e 500 µ l de MgCl 2 de 1m (ajustar o pH para 7.2 com KOH).
- Adicionar o 0,4408 g at 2 - ATP, g 0,0418 at 3 - GTP e 0,510 g at-fosfocreatina. Adicionar água a 200 mL e ajustar o pH a 7,35 com KOH.
- Ajustar a osmolalidade de aproximadamente 290 mOsm/L, adicionando água ultrapura.
- Loja como alíquotas de 1 mL no congelador (-30 ° C).
- Para gravações de tensão-braçadeira (tabela 4), dissolver 5,244 g CsMeSO 3, g 0,672 CsCl, 0,476 g HEPES, g 0,0456 EGTA e 500 µ l de MgCl 2 de 1m de estoque soluções em 180 mL de água ultrapura. Ajuste o pH para 7.2 com CsOH. Para as gravações de mEPSP e mIPSP, use concentração modificada de 5,814 CsMeSO 3 e g 0,252 CsCl para ajustar o potencial de reversão do receptor GABA A resposta 11.
- Adicionar o 0,4408 g at 2 - ATP, g 0,0418 at 3 - GTP e 0,510 g at-fosfocreatina. Adicionar água a 200 mL e ajustar o pH a 7,35 com CsOH.
- Ajustar a osmolalidade de aproximadamente 290 mOsm/L, adicionando água ultrapura.
- Loja como alíquotas de 1 mL no congelador (-30 ° C).
7. Preparação de cortar
- prévio para sacrificar, arrefecimento todas as ferramentas de dissecação com gelo picado ( Figura 2A). Adicione cerca de 500ml de água fria no recipiente de gelo picado para aumentar a área de superfície de contato. Este procedimento foi descrito anteriormente de 10 , 11 , 12.
Nota: As ferramentas aqui são: grande tesoura, tesoura de íris, uma espátula, uma micro espátula, fórceps, pinças, um copo de 200 mL de aço inoxidável, uma lâmina para o cérebro, aparar, uma seringa de perfusão cardíaca 120 mL cheia de buffer de dissecação, tratado com a mistura de gases, uma tubo de silicone (20 cm) conectado a uma agulha de calibre 18 achatada, numa fase de dissecação do cérebro de aço inoxidável (espessura = 3 mm, ϕ = 12 cm) e uma fase de montagem para o vibratome (ϕ = 5 cm). - Sacrificar o rato 30 min depois de completar o paradigma comportamental por anestesiá-lo com uma overdose de pentobarbital (400 mg/kg de peso corporal). Execute a preparação de fatia rapidamente para garantir que as fatias são tão saudáveis como possível 10 , 11 , 12. O cérebro extrProtocolo de ação cumpre todas as normas veterinárias para nossa Universidade.
- Encher uma seringa de 120 mL com tampão de dissecação gelada (tabela 1) borbulhava com 5% CO 2 / mistura de gás 95% O 2. Remover quaisquer bolhas de ar antes da perfusão.
- Depois de expor o coração, introduza a agulha na parte posterior do ventrículo esquerdo. Executar transcardial perfusão do cérebro manualmente utilizando a seringa de
- . Ratos maiores exigem mais buffer de dissecação para perfusão. Submergir o cérebro com buffer de dissecação gelada por 5 min. bolha buffer continuamente durante a submersão.
- Guarnição no lado posterior do cérebro em um paralelo de ângulo para a orientação dendrítica da região cortical alvo usando uma lâmina. Uma vez que o cérebro é ficar no palco de dissecação, com o fundo do corte final, o ângulo inicial determina o ângulo de todas as fatias do cérebro posterior. Esta etapa é criticamente importante ( Figura 2B). Um ângulo incorreto pode cortar os neurônios piramidais alvo.
Nota: As ferramentas aqui são: uma lâmina para corte do cérebro, um papel de filtro (ϕ = 10 cm), numa fase de dissecação do cérebro de aço inoxidável (espessura = 3 mm, ϕ = 12 cm), uma espátula, uma cola, um conta-gotas e uma fase de montagem para o vibratome (ϕ = 5 cm). - Corte fatias de cérebro coronal espessa 350-µm usando um vibratome. Encha a câmara de dissecação com buffer gelada borbulhava com 5% CO 2 / 95% O 2 gás mistura ( Figura 2). O buffer de bolha continuamente durante a fatia de cérebro.
- Guarnição na periferia da área de destino usando a tesoura íris.
- Lavagem as fatias aparadas delicadamente em temperatura ambiente aCSF borbulhava com 5% CO 2 / 95% O 2 (tabela 2).
- Manter o aparado de fatias em uma câmara de interface até que a gravação é executada ( Figura 2D e E). Incubação por 1h na câmara melhora a condição das células, mas os fenótipos mudam se as fatias são incubadas por mais de 10 horas. Feche a tampa da câmara para delimitar os gases e o líquido de pequeno gotas de aCSF.
8. Braçadeira do remendo de células inteiras
Nota: gravações de células inteiras exigem um amplificador e um filtro passa-baixa que é definido como uma frequência de corte de 5 kHz. Os sinais são digitalizados e armazenados em um PC. Analisam-se os dados armazenados off-line ( Figura 3A).
- Criar eletrodos de vidro usando um puxador horizontal. Encha os eléctrodos com uma solução adequada (tabelas 3 e 4) utilizando uma seringa de 1 mL de polietileno normal ligado a um tubo de vidro fino e um filtro de 0,22 µm.
- Antes do contato com a célula, manter pressão positiva e ajustar a pipeta atual para zero.
- Depois de formar um selo gigaohm, aplique pressão negativa a ruptura da membrana celular (célula inteira configuração na Figura 3F).
9. Análise de corrente-braçadeira
- Propriedades da membrana celular
- preencher o patch gravação pipetas com a solução intracelular para a corrente-braçadeira gravações (tabela 3). A resistência da pipeta é entre 4 MΩ e 7 MΩ na aCSF.
- Depois que rompe a membrana, mantenha a tensão de membrana -60 mV no modo V-CLAMP. Em seguida, alternar de " banho " modo a " celular " modo no teste de membrana, utilizando software para medir as propriedades de célula intrínsecas como capacitância da membrana, resistência e constante de tempo.
- Atual estudo de injeção
- depois de gravar as propriedades de célula intrínsecas, alterne para o modo de V-braçadeira para pista (eu = 0) /I-CLAMP NORMAL para a injeção de corrente. Observe que o potencial de junção líquida não deve ser corrigido 10.
- Inject atual dentro da célula para 300 ms. alterar a intensidade da corrente em etapas de − pA 100 a +550 pA com aumentos de 50-pA. Contar o número de picos (potenciais de ação) eliciada as injeções atuais.
- Medir a tensão mínima necessária para induzir um potencial de ação (esta é a tensão de limiar).
- Calcular a amplitude de afterhyperpolarization como a diferença entre a tensão na iniciação de pico e a mais baixa tensão atingida durante afterhyperpolarization 7.
10. Análise de tensão-braçadeira
- o Leandro/NMDA ratio
Nota: Leandro/NMDA a relação é uma maneira convencional para avaliar pós-sináptica plasticidade no glutamatérgico sinapses excitatórias 7 , 8 , 9 , 10 , 11. no entanto, observe que aumento concomitante de ambos os componentes não pode alterar a proporção de 13.- Perfuse câmara de gravação com solução fisiológica borbulhava com a mistura de gás e manter a temperatura entre 22 ° C e 25 Picrotoxina de 0,1 mM Add ° C. para a solução para bloquear o GABA A - mediada por resposta e adicionar 4 µM 2- chloroadenosine para estabilizar a resposta neural evocada 14.
- Preencher o patch gravação pipetas com a solução intracelular para tensão-braçadeira para gravações (tabela 4). Verifique a resistência da pipeta em aCSF a gravação. A resistência é entre 4 MΩ e 7 MΩ.
- Para gravação em neurônios piramidais de camada II/III na M1, coloque um bipolar tungstênio estimulando eletrodo 200 µm a 300 µm lateral para as células a ser gravado, abaixo da superfície pial na região da representação do membro anterior (2mm lateral para o linha média) 15 , 16 , 17.
- Para gravação em um neurônio piramidal CA1, coloque o estimulante µm de eletrodo 200 a 300 µm lateral (fibra colateral de Schaffer) ou medial (via temporoammonic) para as células que será gravada ( Figura 3B).
- Aumentar a intensidade do estímulo até a resposta sináptica > 10 Pa.
- Calcular a relação de Leandro/NMDA, como a relação entre a corrente de pico medido em − 60 mV para a corrente medida no + 40 mV a 150 ms após o início do estímulo. Observe que vestígios de 50 a 100 devem ser em média para calcular a taxa.
- Gravações de corrente pós-sináptica miniatura
Nota: correntes de pós-sinápticos excitatórias em miniatura (mEPSCs) que correspondem as respostas eliciadas pela liberação pré-sináptica de uma única vesícula de glutamato 18 . Em contraste, correntes de pós-sináptico inibitório de miniatura (mIPSCs) são pensadas para correspondem as respostas eliciadas pela liberação pré-sináptica de uma única vesícula de GABA 18. Aumentos nas amplitudes de mEPSCs e mIPSCs reflete a transmissão pós-sináptica reforço, enquanto aumentos no caso de frequência refletem aumentos no número de sinapses funcionais ou a probabilidade de liberação pré-sináptica 11 .- Encher a pipeta de gravação do remendo com solução intracelular modificada (tabela 4) para ajustar o potencial de reversão do atual mediada por receptores GABA À -60 mV.
- Tetrodotoxina de adicionar 0,5 µM para o banho para bloquear os potenciais de ação espontâneos.
- Mantenha a tensão no -60 mV a rECORD os eventos mEPSC por 5 min.
- Mudança na exploração potencial para 0 mV para eventos mIPSC record por 5 min. Porque M1 neurônios mostram reversão ligeiramente mais elevado potencial para correntes de Leandro mediada, os mIPSCs de neurônios M1 são registadas pelo + 15 mV com 0,1 mM APV.
- Esperar por alguns minutos para a atual estabilizar.
- Registrar os eventos de mIPSC 5 min.
- Detectar os eventos em miniatura usando o software e usar eventos acima 10 pA para a análise. Conte o número de eventos de mEPSCs ou mIPSCs por 5 min determinar a frequência. Média as amplitudes dos eventos para obter a amplitude média.
- Confirmar se o tratamento de banho com 10 µM CNQX ou com 10 µM prosencefálico reverte bloqueia os eventos mEPSCs e mIPSCs, respectivamente.
- Análise de cobertura-pulso
Nota: plasticidade pré-sináptica pode ser analisada usando análise de pulso emparelhado. Um aumento da taxa de pulso emparelhado sugere uma diminuição do glutamato pré-sináptica ou liberação de GABA probabilidade 7 , 10 , 11.- Para analisar as sinapses excitatórias, adicionar Picrotoxina 0,1 mM e gravar a resposta em -60 mV. Embora nós adicionamos 4 µM 2-chloroadenosine para o banho, precisamos ter em mente que a droga afeta a probabilidade de liberação pré-sináptica 14.
- Para analisar as sinapses inibitórias, adicionar 0,1 mM APV e 4 µM 2-chloroadenosine para o banho e gravar a resposta em 0 mV. Nos neurônios de M1, gravar a resposta em + 15 mV.
- Aplicar pulsos emparelhados com um intervalo de estímulo Inter de ms 100 ou 200 ms.
- Gravar traços sequenciais de 50-100 em cada exploração potencial e os valores médios.
- Calcular a taxa de pulso emparelhados como a relação do pico do segundo para o primeiro pico da corrente pós-sináptica.
Resultados
Como descrevemos recentemente7, formação de haste do rotor (figura 1A) induzido mudanças dinâmicas na plasticidade intrínseca dos neurônios M1 camada II/III piramidais. Medir a latência até os ratos caem da haste rotativa permite estimar o desempenho de aprendizagem hábil do rato. Latência mais indica melhor desempenho motor. No dia 1 do treinamento, os ratos melhoraram seu desempenho de haste do rotor até o julgamento terminou. No dia 2, os ratos alcançado níveis quase assintótica na sessão em média escores (figura 1B). Comparado com a latência no primeiro julgamento, a análise post-hoc mostrou melhorias significativas no julgamento final sobre os dias de treinamento (Figura 1).
A figura 4A mostra um exemplo de análise de corrente-grampo, no qual as propriedades neuronais alterada após a aprendizagem da habilidade motora. Injeções de pA 400 e 500 correntes pA eram necessários para induzir os potenciais de ação no grupo destreinado e nos ratos treinados dia-1, respectivamente. Em contraste, a injeção de apenas um pA 150 atual foi suficiente para provocar potenciais de ação nos ratos treinados 2 dias. A relação entre a intensidade de corrente e o número de potenciais de ação é mostrada na Figura 4B. Tão pouco quanto 50 AP atual foi suficiente para provocar picos em ratos treinados 2 dias; em contraste, 1 dia ratos treinados responderam com menos potenciais de ação que ratos destreinados para 350 pA e correntes mais elevadas. Além disso, a Figura 4 mostra que ratos treinados 1 dia mostraram baixa descansando potenciais, maior spike limiar e afterhyperpolarization mais profundo, Considerando que ratos treinados 2 dias mostraram maior potencial de repouso (Figura 4) e (de resistência de membrana A Figura 4).
Como descrevemos anteriormente11, treinamento de IA (Figura 1) induzido pós-sináptica plasticidade em sinapses excitatórias e inibitórias dos neurônios hippocampal CA1. Ao medir a latência em caixa de luz, nós poderia estimar o desempenho de aprendizagem contextual do rato. Figura 1E mostra os resultados da tarefa IA. Após o choque elétrico emparelhado, os ratos aprendem a evitar o lado escuro da caixa e ficar no lado iluminado, que geralmente não prefeririam. A tendência de evitar o lado negro, portanto, indica a aquisição de memórias contextuais.
A Figura 5 mostra um exemplo de análise de tensão-braçadeira em miniatura que correntes pós-sinápticas foram drasticamente alteradas após a aprendizagem contextual. Para investigar a plasticidade induzida pela aprendizagem, espontâneo mediada por Leandro mEPSCs e GABAA-mediadas mIPSCs sequencialmente foram gravadas na presença de 0,5 tetrodotoxina µM (Figura 5A e B). Como mostrado em parcelas bidimensionais (Figura 5), cada neurônio CA1 tinha diferentes amplitudes de média para mEPSCs e mIPSCs. Embora as amplitudes foram baixas e mostraram uma gama estreita distribuição em destreinados, pareado, e ratos de passo a passo, eram diversas em ratos treinados IA (tabela 5). ANOVA seguido de análise post-hoc mostrou um aumento significativo da médios amplitudes de mEPSC e mIPSC em ratos treinados IA (Figura 5E), sugerindo a plasticidade pós-sináptica induzida em aprendizagem nos neurônios CA1.
Além disso, cada neurônio CA1 exibiu diferentes frequências de mEPSC e mIPSC (Figura 5). Embora as frequências foram baixas e mostraram uma gama estreita distribuição em destreinados, pareado, e ratos de passo a passo, eram diversas em ratos treinados IA (quadro 6). ANOVA seguido de análise post-hoc mostrou um aumento significativo nas frequências dos eventos mEPSC e mIPSC em ratos treinados IA (Figura 5F). Há duas possíveis interpretações destes resultados. A primeira é que a aprendizagem contextual aumentou o número de sinapses funcionais dos neurônios. O outro é que a aprendizagem contextual aumentou a probabilidade de liberação pré-sináptica de glutamato e GABA.
Para aprofundar a análise de plasticidade pré-sináptica, realizamos também emparelhado-pulso estímulos, como relatado anteriormente,10,11.
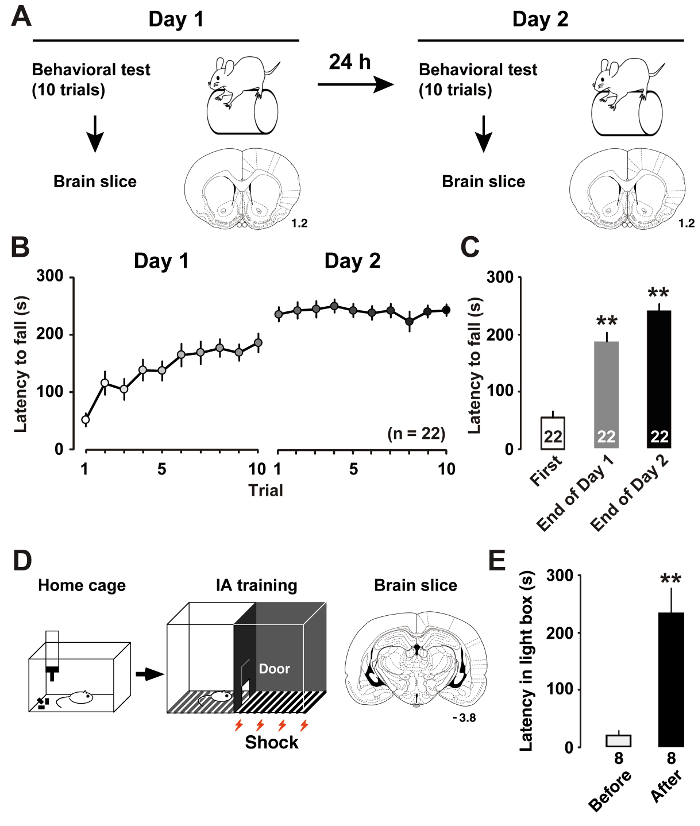
Figura 1 : Aprendizagem desempenho após o treino.
A: O desenho experimental mostra a formação de vara de rotor e fatias coronais do cérebro. B: A latência média cair do tambor de vara de rotor acelerada. C: A latência média de cair fora a haste sobre o primeiro e os ensaios finais na formação dias 1 e 27. P< 0,01 vs primeiro julgamento. D: esquema da evasão inibitório (IA) tarefa e coronal cérebro fatia. E: A latência média para entrar a caixa escura antes e depois IA formação11. P< 0,01 vs antes do treino de IA. Os números pelas seções coronais indicam a distância à frente o bregma em mm. O número de animais é mostrado na parte inferior das barras. Barras de erro indicam SEM. clique aqui para ver uma versão maior desta figura.
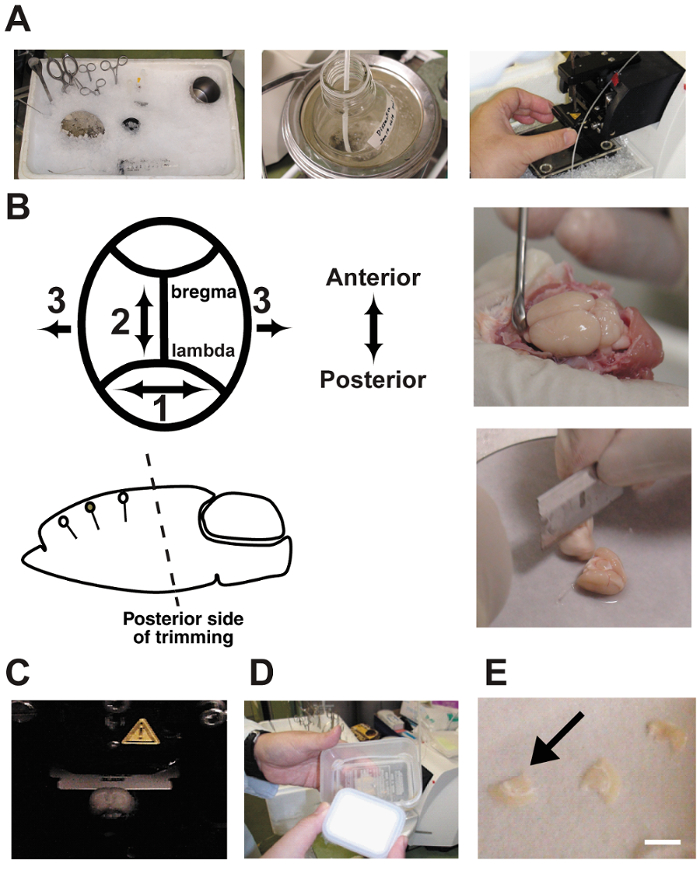
Figura 2 : Fatia procedimentos.
A: as fotografias mostram a preparação de fatias cerebral aguda. As ferramentas de dissecação foram refrigeradas no antes do gelo picado para usar. B: dissecção e remoção do cérebro. Observe que o ângulo de corte do lado posterior deve ser orientado em paralelo com a orientação dendrítica. C: cortar o cérebro em uma câmara de vibratome. O cérebro é banhado no buffer de dissecação e borbulhava continuamente com uma mistura de gás 5% CO295% O2 . D: uma câmara de interface é constituído por dois recipientes de comida de plástico e um tubo de silicone. A câmara foi preenchida com CSF artificial e borbulhava continuamente com a mistura de gases. E: fatias do cérebro foram colocadas no papel de filtro molhado na câmara.Barra = 5 mm. clique aqui para ver uma versão maior desta figura.
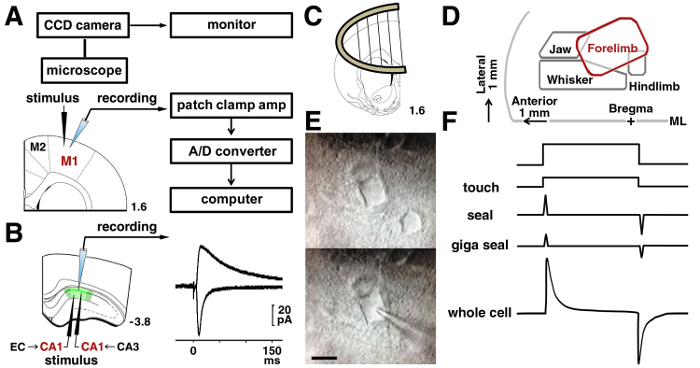
Figura 3 : Procedimentos de braçadeira Patch.
A: O sistema de remendo-braçadeira costumava gravar sinais elétricos de um neurônio. A localização do estímulo e gravação eletrodos nos neurônios camada II/III são mostradas no córtex motor de ratos. B: para analisar as sinapses Schaffer de um neurônio piramidal CA1, um estimulante eletrodo foi colocado no radiatum estrato. Para analisar as sinapses temporoammonic, um estimulante eletrodo foi colocado no moleculare estrato. Representante da Leandro evocado e NMDA mediada por receptores excitatórios pós-sinápticos correntes no mesmo neurônio CA1 são mostradas. C: uma fatia de âncora foi usada para estabilizar a fatia na câmara de gravação. D: um mapa de representação no córtex motor, com base em artigos publicados15,16,17. ML = mediana. E: Micrografias de IR-DIC de M1 neurônios II/III antes da camada (superior) e durante a gravação (inferior). Bar = 10 µm. F: mudanças em pipeta atual antes de toque (topo) e na ruptura de membrana (inferior). Clique aqui para ver uma versão maior desta figura.
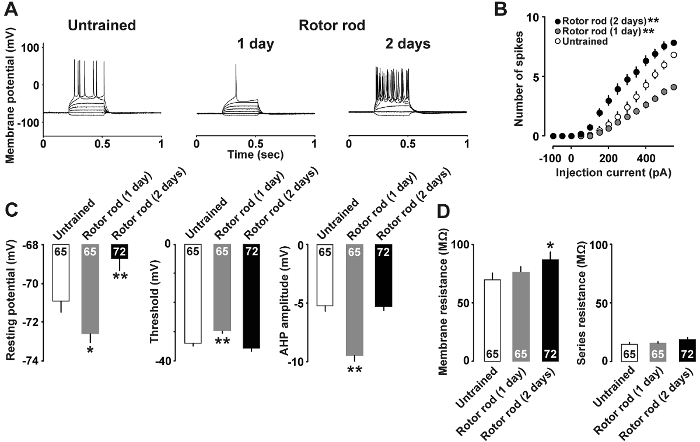
Figura 4 : Resultados representativos de análise de corrente-braçadeira7 .
A: traços representativos dos potenciais de ação registrada após indução com injeções de corrente. B: as relações entre a entrada atual média (pA) vs. saída do potencial de ação (número de picos) em fatias de cérebro do destreinado (barras abertas), 1-dia treinadas (barras cinza) e 2 dias ratos treinados (bares cheios). C: afterhyperpolarization dos neurônios camada II/III, limiar e potencial de repouso. D: resistência da membrana e resistência série dos neurônios. Usamos a 9-10 ratos em cada grupo. O número de células é mostrado dentro de cada barra. Barras de erro indicam a SEM. *P< 0.05, * *P< 0,01 vs destreinados. Clique aqui para ver uma versão maior desta figura.
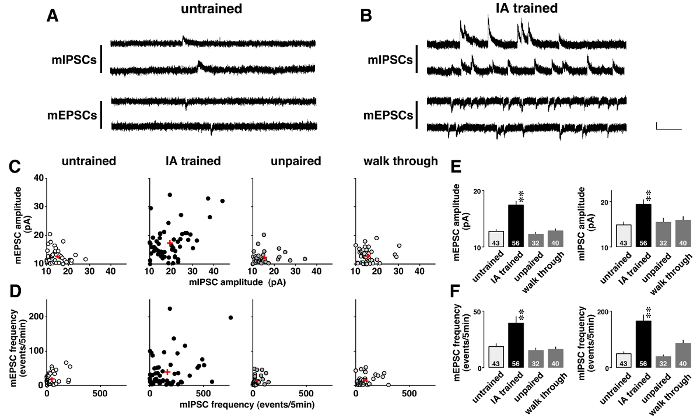
Figura 5 : Resultados representativos do tensão-braçadeira análise11 .
Traços representativos de miniatura excitatórios e inibitórios pós-sinápticos correntes (mEPSCs e mIPSCs) no destreinado (A) e evasão inibitório (IA)-treinados ratos (B). mEPSCs-60 mV e mIPSCs em 0 mV foram medidos sequencialmente no mesmo neurônio piramidal CA1 na presença de tetrodotoxina (0,5 µM). Barra vertical = 20 pA, barra horizontal = 200 mseg. C: bidimensional de parcelas a média mE (I) PSC amplitudes em destreinados, IA-treinado, não pareado e noções básicas ratos. D: parcelas bidimensionais de mim (I) PSC frequências em 4 grupos. Nota que cada neurônio CA1 exibiu diferentes falando de mim (I) frequências e amplitudes PSC. Treinamento de IA não só fortaleceu as amplitudes de média (E), mas também aumentou as frequências de mim (I) eventos PSC (F). Usamos 4-6 ratos em cada grupo. O número de células é mostrado na parte inferior das barras. Sinais de adição vermelhos (C, D) e bares com linhas verticais (E, F) indicam a média ± SEM. * *P< 0,01 vs destreinados ratos. Clique aqui para ver uma versão maior desta figura.
| Buffer de dissecação (Total 1L) | ||
| NaH2PO4 • 2 H2O | 0,195 g | 1,25 mmol/L |
| KCl | g 0,188 | 2,5 mmol/L |
| CaCl2 | 0,074 g | 0,5 mmol/L |
| MgCl2 • 6 H2O | 1,423 g | 7.0 mmol/L |
| Cloreto de colina | g 12,579 | 90 mmol/L |
| Ácido ascórbico | g 2,340 | 11,6 mmol/L |
| Ácido pirúvico | 0,342 g | 3.1 mmol/L |
| NaHCO3 | 2,100 g | 25 mmol/L |
| Glicose | 4,500 g | 25 mmol/L |
Tabela 1: Uma receita para o buffer de dissecação
| CSF artificial (Total 1L) | ||
| KCl | g 0,186 | 2,5 mmol/L |
| NaCl | g 6,700 | 114,6 mmol/L |
| NaH2PO4 •2H2, O | 0,156 g | 1 mmol/L |
| Glicose | 1,800 g | 10 mmol/L |
| NaHCO3 | 2,184 g | 26 mmol/L |
| 1M MgCl2 | 4 mL | 4 mmol/L |
| 1M CaCl2 | 4 mL | 4 mmol/L |
Tabela 2: Uma receita para artificial de líquido cerebrospinal (CSF)
| Solução intracelular para braçadeira atual (Total 200 mL) | ||
| KCl | g 0,0746 | 5 mmol/L |
| K-gluconato | g 6,089 | 130 mmol/L |
| HEPES | 0,476 g | 10 mmol/L |
| EGTA | g 0,0456 | 0,6 mmol/L |
| 1M MgCl2 | 500 Μ l | 2,5 mmol/L |
| At2 ATP | g 0,4408 | 4 mmol/L |
| At3 GTP | g 0,0418 | 0,4 mmol/L |
| Fosfocreatina at | g 0,510 | 10 mmol/L |
Tabela 3: Uma receita para uma solução intracelular para braçadeira atual para gravação
| Solução intracelular para braçadeira de tensão (Total 200 mL) | ||||
| CsMeSO3 | 5 | |||
Tabela 4: Uma receita para uma solução intracelular para braçadeira de tensão para gravação
| Parâmetros | sem treinamento | IA treinado | Não pareado | Caminhe | |
| mEPSC amplitude | Variação | 5.8 | 32,1 | 4.7 | 5.9 |
| Desvio-padrão | 2.4 | 5.7 | 2.2 | 2.4 | |
| Coeficiente de variação | 0.189 | 0.326 | 0,177 | 0,190 | |
| mIPSC amplitude | Variação | 17.1 | 56,7 | 31,8 | 20,7 |
| Desvio-padrão | 4.1 | 7.5 | 5.6 | 4.5 | |
| Coeficiente de variação | 0.279 | 0,387 | 0,367 | 0.286 |
Tabela 5: A diversidade de miniatura excitatórios e inibitórios pós-sinápticos atual (mEPSC e mIPSC) amplitudes em evasão inibitório (IA)-treinados ratos
| Parâmetros | sem treinamento | IA treinado | Não pareado | Caminhe | |
| frequência mEPSC | Variação | 278 | 2195 | 188 | 195 |
| Desvio-padrão | 17 | 47 | 14 | 14 | |
| Coeficiente de variação | 0.902 | 1.198 | 0.893 | 0.874 | |
| frequência mIPSC | Variação | 3282 | 27212 | 1385 | 5135 |
| Desvio-padrão | 57 | 165 | 37 | 72 | |
| Coeficiente de variação | 1.195 | 1.006 | 0.955 | 0.836 |
Tabela 6: A diversidade de miniatura excitatórias e inibitórias pós-sinápticos atual (mEPSC e mIPSC) frequências em evasão inibitório (IA)-treinados ratos
Discussão
A principal limitação da técnica de braçadeira do remendo da fatia é a gravação em fatia de preparação, que pode não refletir o que acontece em vivo. Embora na vivo análise de corrente-braçadeira é mais confiável, é tecnicamente difícil obter dados suficientes de animais conscientes. Desde que cada neurônio piramidal tem propriedades diferentes de celulares, um número adequado de células é necessário para analisar corretamente as diferenças nos neurônios após o treino. Além disso, a análise de tensão-braçadeira requer tratamento contínuo com CNQX, APV ou relação para determinar a natureza das respostas pós-sinápticas. Para analisar as respostas em miniatura induzidas por uma única vesícula de glutamato ou GABA, tratamento contínuo com tetrodotoxina é necessária para bloquear os potenciais de ação espontâneos. Embora a técnica de imagem recentemente desenvolvida multi fóton é poderosa para analisar as alterações morfológicas em sinapses excitatórias19, uma técnica de braçadeira do remendo combinada é necessária para analisar a função das sinapses na vivo. Atualmente é bastante difícil analisar mudanças morfológicas em sinapses inibitórias, desde que não formam sinapses inibidoras mais espinhas. Neste momento, a braçadeira do remendo de fatia seria a técnica mais adequada para analisar as propriedades da célula ou as funções das sinapses excitatório/inibitório em animais treinados.
Usando a análise de corrente-grampo (Figura 4), recentemente, informou motor plasticidade induzida por aprendizagem intrínseca nos neurônios de camada II/III. Especificamente, os ratos treinados 1 dia mostraram uma diminuição significativa no repouso potencial de membrana e um aumento no limiar pico. Os ratos treinados 2 dias mostraram um aumento significativo no potencial de membrana que levou a excitabilidade aumentada. Estes resultados sugeriram que lá foram mudanças dinâmicas na plasticidade intrínseca dos neurônios II/III de camada de M1 em ratos treinados. Análise de tensão-braçadeira adicional revelou um aumento na proporção de pulso pareado em ratos treinados de 1 dia, sugerindo que houve uma redução transitória na pré-sináptica GABA lançamento probabilidade7. É portanto possível que desinibição do GABA na camada II/III sinapses pode desencadear a plasticidade induzida por aprendizagem resultante na M1. Para apoiar isso, preparação de fatia da M1 requer tratamento de banho com um bloqueador do receptor GABAA induzir a LTP20.
Análise dos potenciais pós-sinápticos em miniatura é uma maneira poderosa para detectar plasticidade sináptica em animais treinados IA. Sequencial de gravação de mEPSCs e mIPSCs em um único neurônio CA1 permite a análise da força sináptica excitatório/inibitório da cada neurônio individual. Desde um único mE (I) PSC resposta é atribuída a uma única vesícula de glutamato ou GABA, um aumento em mim (I) PSC amplitude sugere reforço pós-sináptica. Usando-mE (I) análise PSC, encontramos diferenças individuais na força da excitatório/inibitório entrada para cada neurônio CA1 (Figura 5). Treinamento de IA claramente promovido diversidade na força sináptica, mas isto não foi observado em outros grupos (tabela 5).
Diversidade sináptica induzida a aprendizagem pode ser analisada matematicamente. Calculando a probabilidade do aparecimento de cada ponto, os dados de cada neurônio podem ser convertidos em autoentropia (um pouco) usando a teoria da informação de Claude E. Shannon21. Um ponto com probabilidade alta de aparência (em torno do nível médio) indica baixa autoentropia, enquanto um ponto com probabilidade muito raro (um ponto de desvio) indica alta autoentropia. Em comparação com ratos destreinados, a autoentropia por neurônio foi claramente aumentada em ratos treinados IA mas não pareada ou Walk-through ratos22. Esta análise sugere que houve um aumento no intra-CA1 informações após a aprendizagem contextual.
A técnica de braçadeira do remendo de fatia também pode ser usada para o marcado medo condicionado estudos na amígdala lateral9 e para estudos de experiência sensorial no barril córtex8. Além disso, esta técnica pode ser usada com várias outras técnicas para mais investigações. Por exemplo, a vírus mediada por proteína verde fluorescente (GFP)-gene etiquetado entrega técnica pode ser combinada com a técnica de braçadeira do remendo para analisar a função das moléculas específicas. Além disso, focal microinjeção de um traçador retrógrado pode ser usada para visualizar os neurônios específicos esse projeto para uma área específica. Em seguida, usando a técnica de corrente-braçadeira, propriedades específicas da célula podem ser analisadas em neurônios visualizado23. Além disso, utilizou-se microscopia de varredura a laser de combinar dois fotões com dois fotões do laser uncaging de glutamato para demonstrar o crescimento da coluna específica e a resposta EPSC mouse cortical da camada de neurônios piramidais II/III19. Assim, a técnica de braçadeira do remendo de fatia está sendo melhorada combinando-a com novos produtos químicos, gene entrega e técnicas de manipulação de foto.
Divulgações
Os autores declaram não há conflitos de interesse. Confirmamos que lemos posição do jornal sobre as questões envolvidas na publicação ética, e afirmamos que este relatório seja consistente com essas orientações. Os financiadores não tiveram nenhum papel no projeto de estudo, coleta de dados ou análise, a decisão de publicar ou a preparação do manuscrito.
Agradecimentos
Gostaríamos de agradecer o Dr. pata-Min-Thein-Oo, Dr. Han-Thiri-Zin e Sra. H. Tsurutani por sua assistência técnica. Este projecto foi apoiado pelo Grants-in-Aid para jovens cientistas (H.K. e Y.S.), B de pesquisa científica (DM), C de investigação científica (DM) e a investigação científica em áreas inovadoras (DM), do Ministério da educação, cultura, esportes, ciência, e Tecnologia do Japão.
Materiais
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
Referências
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados