Method Article
Tranche Patch Clamp Technique d’analyse de plasticité induite par l’apprentissage
Dans cet article
Résumé
La technique du patch clamp tranche est une méthode efficace pour analyser les changements induits par l’apprentissage dans les propriétés intrinsèques et la plasticité des synapses excitatrices ou inhibitrices.
Résumé
La technique du patch clamp tranche est un outil puissant pour étudier la plasticité neuronale induite par l’apprentissage dans certaines régions du cerveau. Pour analyser la plasticité induite de moteur d’apprentissage, nous avons formé des rats en utilisant une tâche de tige rotor accélérée. Rats a accompli la tâche 10 fois à intervalles de 30 s pour 1 ou 2 jours. Performance a été significativement améliorée sur les jours de formation par rapport au premier procès. Ensuite, nous avons préparé tranches cérébrale aiguë du cortex moteur primaire (M1) chez les rats non formés et entraînés. Courant-clamp analyse a montré des changements dynamiques dans le potentiel de membrane, seuil de spike, post-hyperpolarisation et la résistance de la membrane de repos dans les neurones pyramidaux de la couche II/III. Injection de courant induit des pointes plus nombreux en 2 jours les rats entraînés que chez les témoins non formés.
Pour analyser l’apprentissage contextuel plasticité induite, nous avons formé des rats en utilisant une tâche d’évitement inhibitrice (IA). Après avoir connu un choc dans le côté obscur d’une boîte, les rats ont appris à, éviter de rester dans le côté lumineux. Nous avons préparé des tranches d’hippocampe aiguës non formés, formés à l’IA, non apparié et les rats de portique. Analyse de voltage clamp a servi à enregistrer dans l’ordre miniature excitatrices et inhibitrices courants postsynaptiques (mEPSCs et mIPSCs) du même neurone CA1. Nous avons trouvé différentes amplitudes moyennes de CPSEM et mIPSC dans chaque neurone CA1, suggérant que chaque neurone avait différentes forces post-synaptique à ses synapses excitatrices et inhibitrices. En outre, par rapport aux témoins non formés, formés à l’IA des rats avaient amplitudes plus élevées, CPSEM et mIPSC, avec une grande diversité. Ces résultats suggèrent qu’apprentissage contextuel crée la diversité postsynaptique dans les synapses excitatrices et inhibitrices à chaque neurone de CA1.
AMPA ou GABA récepteursA semblent à la médiation les courants postsynaptiques, depuis le traitement bain avec CNQX ou bicuculline bloqué les événements CPSEM ou mIPSC, respectivement. Cette technique peut servir à étudier les différents types d’apprentissage dans d’autres régions, telles que le cortex sensoriel et l’amygdale.
Introduction
La technique de patch clamp, développée par Neher et Sakmann, a été largement utilisée pour des expériences électrophysiologiques1. La cellule entière patch clamp technique2 peut servir à enregistrer intracellulaire et tension à l’aide du sceau de gigaohm de la membrane cellulaire. La courant-clamp technique nous permet d’analyser les différences dans les propriétés de la membrane comme potentiel, la résistance et capacité3de repos. La technique de voltage clamp nous permet d’analyser la plasticité synaptique induite par l’apprentissage au niveau des synapses excitatrices et inhibitrices.
Le cortex moteur primaire (M1) est une région centrale qui est essentielle pour faire des mouvements volontaires qualifiés. Des études électrophysiologiques antérieures ont démontré l’élaboration de la potentialisation à long terme (LTP)-comme la plasticité en couche II/III excitateur synapses après métier formation moteur4. De plus, in vivo études supplémentaires d’imagerie démontre le remodelage des épines dendritiques M1 après une habile pour atteindre tâche5,6. Toutefois, la plasticité synaptique et intrinsèque induite par l’apprentissage n’a pas été démontrée dans les neurones de la M1.
Nous avons récemment rapporté qu’une tâche de tige rotor promu variations dynamiques glutamatergique et GABAergiques synapses et altéré la plasticité intrinsèque dans M1 couche II/III neurones7. Ici, nous avons utilisé la technique du patch clamp tranche d’enquêter sur la plasticité induite par l’apprentissage. Cette technique peut également servir à enquêter sur d’autres types de plasticité dépendante de l’expérience dans d’autres régions du cerveau. Par exemple, entrée sensorielle dans le cortex de baril peut renforcer la LPCA médiée par les récepteurs excitateur entrée en couche de neurones II/III8et conditionnement de peur indicé renforce les entrées excitateurs sur les neurones de l’amygdale latérale, qui est nécessaire pour peur de mémoire9. En outre, apprentissage contextuel crée la diversité en termes d’entrées synaptiques excitatrices et inhibitrices dans hippocampe CA1 neurones10,11.
Protocole
tous les logement des animaux et des interventions chirurgicales étaient conformes aux lignes directrices pour l’Animal Experimentation de Yamaguchi University School of Medicine et ont été approuvés par le Comité emploi de Yamaguchi et d’institutionnels animalier Université.
1. animaux
- utiliser des rats Sprague-Dawley mâles âgés de 4 à 5 semaines (28 à 31 jours d’âge).
- Abritent les rats dans des cages en plastique individuels (40 cm × 25 cm × 25 cm) maintenues à une température constante (23 ° C ± 1 ° C) sous un cycle lumière/obscurité de 12 h. Donner des rats ad libitum accès à l’eau et de nourriture.
2. Essais de tige rotor
- d’enquêter sur la motricité, l’apprentissage, sous réserve de tous les rats à l’épreuve de tige rotor (diamètre de la tige 7 cm ; largeur de voie 8,9 cm ; hauteur de chute 26,7 cm) pour 1 ou 2 jours consécutifs ( Figure 1 a dans Kida et al., 2016 < sup Class = « xref » > 7). Exécuter la tâche dans une pièce calme, température contrôlée (23 ± 1 ° C). Ne pas déranger ou gérer des rats avant le test.
- Régler la tige du rotor à mode d’accélération, qui augmente linéairement de 4 rotations/min à 40 rotations/minute (8 min/π à π/min 80) en 5 min.
- Mettre le rat sur la tige de rotation au repos. Vérifiez que tous les membres sont sur la tige.
- Mesurer la latence à l’automne de la tige rotative pour évaluer la performance du moteur à.
- Permettre à tous les rats 10 essais (essais) avec des intervalles de 30 s.
- Si le rat tombe de la tige rotative, posez-le sur la tige après un intervalle de 10-20 s.
- Sacrifier le rat avec une surdose de pentobarbital (400 mg/kg) 30 min après la dernière épreuve. Injecter des rats témoins non formés avec la même dose d’anesthésie dans leurs cages maison.
3. Essai d’évitement inhibiteur
- d’enquêter sur l’apprentissage contextuel, sujet rats à un test d’évitement inhibitrice (IA) ( Figure 1 dans Mitsushima et al., 2011, 2013 10 , 11) Eviter des expériences épisodiques sur le jour de l’expérience comme entrer en contact avec d’autres, changement de cage ou de nettoyage. Exécuter la tâche dans une pièce calme, température contrôlée (23 ± 1 ° C).
Remarque : L’appareil de musculation IA est une boîte acrylique deux-chambré (longueur 33 cm, largeur 58 cm ; hauteur 33 cm). Il a un bon côté éclairé et un côté dark choc qui sont séparées par une trappe ( Figure 1). - Placer le rat dans le côté sécuritaire (éclairé) de la zone éclairée. Gérer le rat doucement sans stress.
- Attendre une courte période (10 à 20 s) s’acclimater le rat pour l’environnement.
- Ouvrir la porte coulissante pour permettre le rat entrer dans la zone sombre à volonté.
- Mesurer la latence (s) avant le rat ne pénètre dans le côté obscur roman de la boîte. La latence du premier essai représente le rat ' s la performance avant l’entraînement.
- Après l’entrée dans le côté obscur, fermer la porte et appliquer un choc brouillés pied électrique (2 s, 1,6 mA) par l’intermédiaire de tiges d’acier électriques définie dans le plancher de la boîte. Permettre des rats de portique d’explorer l’appareil de musculation pendant 1 min sans être choqué. Maison des rats non appariés dans une cage de choc illuminé pendant plusieurs jours et tout à coup donnent le choc sans expériences épisodiques. Manipulez avec douceur sans stress dans tous les groupes.
- Garder chaque rat dans la zone sombre pour 10 s avant de la retourner à la maison cage.
- À 30 min après le choc du pied, placez à nouveau le rat dans le côté lumineux de la boîte. Mesurer la latence pour entrer dans le côté obscur.
- Retourner le rat à la cage.
- À 60 min après le choc, sacrifier le rat avec une surdose de pentobarbital (400 mg/kg). Gérez le rat doucement et injecter l’anesthésie par voie intrapéritonéale. Chez les rats de témoins non formés, injecter l’anesthésie dans leur maison sans l’expérience décrite ci-dessus.
4. Tampon de dissection
- dissoudre les cristaux de 0,195 g NaH 2 PO 4-2 H 2 O, 0,188 g KCl, g 0,074 CaCl 2, g 1,423 MgCl 2-6 H 2 O et 12,579 g de chlorure de choline dans l’eau ultrapure (900 mL à 950 mL) . Voir le tableau 1.
- Dissoudre les cristaux d’acide ascorbique 2,340 g, sel de sodium de l’acide pyruvique 0,342 g, g 2,100 NaHCO 3 et 4,500 g de glucose.
- Ajouter de l’eau à 1000 mL. La gamme de l’osmolalité se situera entre 290 mOsm/L et 300 mOsm/L. Adjust osmolalité en ajoutant de l’eau ultrapure, si c’est sur la plage.
- La solution avec 5 % de CO 2 de bulle / mélange à des températures glacées pendant 5 min avant utilisation de gaz 95 % O 2.
5. Liquide céphalo-rachidien artificiel (FSCA)
- dissoudre des cristaux de 0,186 g KCl, 6,700 g NaCl et 0,156 g NaH 2 PO 4-2 H 2 O en eau ultrapure (900 mL à 950 mL). Voir le tableau 2.
- Bulle avec le mélange de gaz pendant 5 min.
- Dissoudre les cristaux de 1,800 g glucose et g 2,184 NaHCO 3 et ajouter 4 mL MgCl 2 et 4 mL CaCl 2 de 1 M en stock solutions.
- Ajouter de l’eau à 1000 mL. La gamme de l’osmolalité se situera entre 290 mOsm/L et 295 mOsm/L. Adjust osmolalité en ajoutant de l’eau ultrapure, si c’est sur la plage.
- Bulle avec le préalable de mélange gaz utiliser.
6. Des solutions intracellulaires
- pour les enregistrements de courant-clamp (tableau 3), dissoudre 0,0746 g KCl, solution dans 180 mL d’eau ultrapure mère 6,089 g K-gluconate, 0,476 g HEPES, g 0,0456 EGTA et 500 µL du MgCl 2 de 1 M (ajuster le pH à 7,2 avec KOH).
- Ajouter g 0,4408 Na 2 - ATP, g 0,0418 Na 3 - GTP et g 0,510 Na-phosphocréatine. Ajouter de l’eau à 200 mL et ajuster le pH à 7,35 avec KOH.
- Ajuster l’osmolalité à environ 290 mOsm/L en ajoutant de l’eau ultrapure.
- Store en aliquotes de 1 mL dans le congélateur (-30 ° C).
- Pour les enregistrements de voltage clamp (tableau 4), dissoudre 5,244 g CsMeSO 3, g 0,672 CsCl, 0,476 g HEPES, g 0,0456 EGTA et 500 µL du MgCl 2 de 1 M en stock solutions dans 180 mL d’eau ultrapure. Ajuster le pH à 7,2 avec CsOH. Les enregistrements mEPSP et mIPSP, utilisez concentration modifiée de 5,814 CsMeSO 3 et g 0,252 CsCl pour ajuster le potentiel d’inversion du récepteur GABA A réponse 11.
- Ajouter g 0,4408 Na 2 - ATP, g 0,0418 Na 3 - GTP et g 0,510 Na-phosphocréatine. Ajouter de l’eau à 200 mL et ajuster le pH à 7,35 avec CsOH.
- Ajuster l’osmolalité à environ 290 mOsm/L en ajoutant de l’eau ultrapure.
- Store en aliquotes de 1 mL dans le congélateur (-30 ° C).
7. Tranchez la préparation
- préalable à sacrifier, de refroidissement tous les outils de dissection avec glace pilée ( Figure 2 a). Ajouter environ 500 mL d’eau froide dans le récipient de la glace pilée pour augmenter la surface de contact. Cette procédure a été décrit précédemment 10 , 11 , 12.
Remarque : Les outils ici sont : grands ciseaux, ciseaux iris, une spatule, une spatule micro, forceps, pince à épiler, un bécher de 200 mL en acier inoxydable, une lame pour cerveau faucheuse, une seringue de perfusion cardiaque 120 mL remplie avec le tampon de dissection traité avec le mélange de gaz, un tube de silicone (20 cm) relié à une aiguille de calibre 18 aplatie, un stade de dissection du cerveau en acier inoxydable (épaisseur = 3 mm, ϕ = 12 cm) et une étape de montage pour le vibratome (ϕ = 5 cm). - Sacrifier le rat 30 min après avoir terminé le paradigme comportemental par anesthésier il avec un surdosage de pentobarbital (400 mg/kg de poids corporel). Effectuer la préparation de tranche rapidement pour que les tranches soient aussi sains que possible 10 , 11 , 12. Le cerveau extrprotocole d’action respecte toutes les normes vétérinaires pour notre Université.
- Remplir une seringue de 120 mL avec le tampon de dissection glacee (tableau 1) barboter avec un 5 % CO 2 / 95 % O 2 mélange de gaz. Éliminez les bulles d’air avant perfusion.
- Après avoir exposé le cœur, introduire l’aiguille dans la partie postérieure du ventricule gauche.
- Perform transcardial perfusion du cerveau manuellement à l’aide de la seringue. Plus gros rats nécessitent plus tampon de dissection pour perfusion. Submerger le cerveau avec le tampon de dissection glacée pendant 5 min. bulle le tampon en permanence pendant la submersion.
- Couper le côté postérieur du cerveau à un parallèle de l’angle de l’orientation dendritique de la région corticale de cible à l’aide d’une lame. Puisque le cerveau est debout sur la scène de dissection avec le bas de l’extrémité coupée, l’angle initial détermine l’angle de toutes les tranches de cerveau ultérieures. Cette étape est cruciale ( Figure 2 b). Un angle incorrect peut couper à travers les neurones pyramidaux cible.
Remarque : Les outils ici sont : une lame pour coupe de cerveau, un filtre en papier (ϕ = 10 cm), une étape de dissection du cerveau en acier inoxydable (épaisseur = 3 mm, ϕ = 12 cm), une spatule, une colle, un compte-goutte et une étape de montage pour le vibratome (ϕ = 5 cm). - Coupe coupes de cerveau coronale épais de 350 µm en utilisant un vibratome. Remplir la chambre de dissection avec tampon glacee barboter avec un 5 % CO 2 / 95 % O 2 gaz mélange ( Figure 2). La mémoire tampon de bulle en permanence pendant la tranche de cerveau.
- Trim à la périphérie de la zone de la cible à l’aide de ciseaux iris.
- Laver les tranches taillées doucement à température ambiante FSCA barboter avec 5 % de CO 2 / 95 % O 2 (tableau 2). Tranches de
- maintenir la taillée dans une chambre d’interface jusqu'à ce que l’enregistrement soit effectué ( Figure 2D et E). Incubation pendant 1 h dans l’hémicycle améliore l’état des cellules, mais les phénotypes changent si les tranches sont incubés pendant plus de 10 heures. Fermer le couvercle de la chambre pour encadrer les gaz et le liquide de petit gouttes de fsca.
8. Cellule entière patch clamp de
Remarque : enregistrements de germes entiers nécessitent un amplificateur et un filtre passe-bas qui est réglé sur une fréquence de coupure de 5 kHz. Les signaux sont numérisés et stockés dans un PC. Les données stockées sont analysées en mode hors connexion ( Figure 3 a).
- Créer les électrodes de verre à l’aide d’un extracteur horizontal. Remplir les électrodes avec une solution appropriée (tableaux 3 et 4) à l’aide d’une seringue de 1 mL polyéthylène ordinaire attaché à un tube de verre fin et un filtre de 0,22 µm.
- Avant le contact avec la cellule, maintenir la pression positive et ajuster la pipette actuelle à zéro.
- Après avoir formé un joint gigaohm, appliquer une pression négative à la rupture de la membrane de la cellule (cellule entière configuration dans Figure 3F).
9. Analyse de courant-clamp
- Propriétés de la membrane cellulaire
- remplissent le patch enregistrement pipettes avec la solution intracellulaire pour des enregistrements de courant-clamp (tableau 3). La résistance de la pipette est comprise entre 4 MΩ et 7 MΩ dans le fsca.
- Après la membrane se rompt, maintenir la tension membranaire à -60 mV en mode V-pince. Ensuite, passer de " bain " mode de " cellule " mode dans le test de la membrane à l’aide de logiciels pour mesurer les propriétés de cellule intrinsèques tels que la capacité de la membrane, la résistance et la constante de temps.
- Étude injection
- après avoir enregistré les propriétés de cellule intrinsèques, changez le mode de V-pince à piste (I = 0) /I-CLAMP NORMAL pour l’injection de courant. Notez que le potentiel de jonction liquide ne doit pas être corrigée 10.
- Inject actuel dans la cellule pour Mme 300 varier l’intensité du courant par étapes de − pA 100 à + 550 pA avec des augmentations de 50-pA. Compter le nombre d’épis (potentiels d’action) provoquée par les injections actuelles.
- Mesurer la tension minimale nécessaire pour induire un potentiel d’action (c’est la tension de seuil).
- Calculer l’amplitude du potentiel consécutif positif comme la différence entre la tension au début de l’épi et la plus basse tension atteint au cours de la post-hyperpolarisation 7.
10. Analyse de voltage clamp
- l’AMPA/NMDA ratio
Remarque : ratio de l’AMPA/NMDA est une façon conventionnelle afin d’évaluer la plasticité postsynaptique de 7 , les synapses excitatrices glutamatergiques 8 , 9 , 10 , 11. Cependant, Notez que l’augmentation concomitante des deux composantes ne peut-être modifier le ratio 13.- Perfuse la chambre d’enregistrement avec une solution physiologique barboter avec le mélange de gaz et maintenir la température à 22 ° C à 25 ° C. Ajouter 0,1 mM la picrotoxine à la solution pour bloquer le GABA A - réponse et ajouter 4 µM 2- chloroadénosine pour stabiliser la réponse neuronale évoqués 14.
- Remplir le patch enregistrement pipettes avec la solution intracellulaire pour voltage clamp enregistrements (tableau 4). Vérifiez la résistance de la pipette d’enregistrement dans le fsca. La résistance est comprise entre 4 MΩ et MΩ 7.
- Pour l’enregistrement dans les neurones pyramidaux de couche II/III dans le M1, placez un bipolaire tungstène électrode 200 µm à 300 µm latérale aux cellules d’être enregistrées, sous la surface pial dans la région de la représentation des membres antérieurs de stimulant (2 mm latéral à la ligne médiane) 15 , 16 , 17.
- Pour l’enregistrement dans un neurone pyramidal CA1, placer le stimulant µm d’électrode 200 à 300 µm latérale (fibre collatérale de Schaffer) ou médiale (voie temporoammonic) aux cellules qui sera enregistré ( Figure 3 b).
- Augmenter l’intensité de la stimulation jusqu'à la réponse synaptique > 10 PA.
- Calculer le ratio de l’AMPA/NMDA comme le rapport entre le pic de courant mesuré à − 60 mV au courant mesuré à + 40 mV à 150 MS après le début de la stimulation. Notez que des traces de 50 à 100 devraient être en moyenne pour calculer le taux de.
- Enregistrements courants postsynaptiques miniature
Remarque : les courants postsynaptiques excitateurs Miniature (mEPSCs) sont censés correspondent aux réponses induites par la libération présynaptique d’une vésicule simple du glutamate 18 . En revanche, les courants postsynaptiques inhibitrice miniature (mIPSCs) sont censés correspondent aux réponses induites par la libération présynaptique d’une vésicule simple de GABA 18. Augmentation de l’amplitude des mEPSCs et mIPSCs reflète transmission postsynaptique renforcer, tout augmente en cas de fréquence compte de l’augmentation du nombre de synapses fonctionnelles ou la probabilité de libération présynaptique 11 .- Remplir la pipette enregistrement mis à jour le solution intracellulaire (tableau 4) pour ajuster le potentiel d’inversion du courant médiée par les récepteurs GABA A à -60 mV.
- Ajouter 0,5 de la tétrodotoxine µM à la baignoire pour bloquer les potentiels d’action spontanées.
- Maintenir la tension à -60 mV à rECORD les événements CPSEM pendant 5 min.
- Changement l’exploitation potentielle à 0 mV aux événements mIPSC record pendant 5 min. Parce que M1 neurones offrent des possibilités des courants médiée par les récepteurs AMPA inversion légèrement plus élevée, les mIPSCs des neurones de M1 sont comptabilisées au + 15 mV avec 0,1 mM APV.
- Attendre quelques minutes que le courant se stabilise.
- Enregistrer les événements de mIPSC pendant 5 min.
- Détecter les événements de la miniature à l’aide du logiciel et utiliser des événements supérieure à 10 pA pour l’analyse. Compter le nombre d’événements mEPSCs ou mIPSCs pendant 5 min déterminer la fréquence. En moyenne les amplitudes des événements pour obtenir l’amplitude moyenne.
- Confirmer si traitement bain avec 10 µM CNQX ou avec 10 µM bicuculline néfopam bloque les événements mEPSCs et mIPSCs, respectivement.
- Analyse jumelés-impulsion
Remarque : plasticité présynaptique peut être analysée à l’aide d’impulsions pairées analyse. Une augmentation du taux d’impulsions pairées suggère une diminution du glutamate présynaptique ou GABA release probabilité 7 , 10 , 11.- Pour analyser les synapses excitatrices, ajouter la picrotoxine 0,1 mM et enregistrer la réponse à -60 mV. Bien que nous avons ajouté 4 µM 2-chloroadénosine pour le bain, nous devons garder à l’esprit que le médicament influe sur la probabilité de libération présynaptique 14.
- Pour analyser des synapses inhibitrices, ajouter 0,1 mM APV et 4 µM 2-chloroadénosine à la salle de bain et d’enregistrer la réponse à 0 mV. Dans les neurones de la M1, enregistrer la réponse + 15 mV.
- Appliquer des impulsions jumelées avec un intervalle de relance inter de ms 100 ou 200 m
- Enregistrer 50-100 traces séquentiels à chaque exploitation potentielle et les valeurs moyennes de.
- Calculer le rapport de pulsation jumelé comme le rapport de la deuxième pointe à la première crête du courant postsynaptique.
Résultats
Nous avons décrits récemment7, formation de tige rotor (Figure 1 a) induit des changements dynamiques dans la plasticité intrinsèque des neurones pyramides M1 couche II/III. Mesurer la latence jusqu'à ce que les rats tombent de la tige tournante nous permet d’évaluer les performances d’apprentissage qualifiés du rat. Plus longue latence indique de meilleures performances moteur. Le jour 1 de la formation, les rats amélioré leur performance de tige rotor jusqu'à ce que le procès s’est terminé. Le jour 2, les rats atteint des niveaux presque asymptotique dans la session en moyenne des scores (Figure 1 b). Comparée à la latence lors du premier procès, analyse post-hoc a montré des améliorations significatives aux procès finales sur les jours de formation (Figure 1).
Figure 4 a montre un exemple d’analyse de courant-clamp dans lequel les propriétés neuronales modifiées après l’apprentissage de la motricité. Injections de pA 400 et 500 pA courants ont été nécessaire pour induire des potentiels d’action dans le groupe non formé et chez les rats entraînés de 1 jour, respectivement. En revanche, l’injection d’un courant de seulement 150 pA était suffisante pour obtenir des potentiels d’action dans les rats entraînés de 2 jours. La relation entre l’intensité du courant et le nombre de potentiels d’action est illustrée à la Figure 4 b. Aussi peu que 50 pA actuelle était suffisante pour obtenir des pics dans les 2 jours de rats entraînés ; en revanche, 1 jour rats entraînés ont répondu avec des potentiels d’action moins que les rats non formés de 350 pA et des courants plus élevés. En outre, la Figure 4 montre que 1 jour rats entraînés ont montré inférieur au repos potentiels, spike plus haut seuil et post-hyperpolarisation plus profond, alors que 2 jours rats entraînés ont montré plus haut potentiel de repos (Figure 4) et (résistance) membrane La figure 4).
Que nous avons décrit précédemment11, formation IA (Figure 1) induit la plasticité postsynaptique au niveau des synapses excitatrices et inhibitrices des neurones CA1 hippocampal. En mesurant le temps de latence dans la boite à lumière, nous pourrions estimer les performances d’apprentissage contextuel du rat. 1E de la figure montre les résultats de la tâche de l’IA. Après l’électrochoc apparié, les rats apprennent à éviter le côté sombre de la boîte et rester dans le côté lumineux, qui habituellement, ils ne préfèrent pas. La tendance à éviter le côté sombre indique donc l’acquisition de souvenirs contextuelles.
Figure 5 illustre un exemple d’analyse de voltage clamp dans laquelle miniature courants postsynaptiques ont radicalement changés après apprentissage contextuel. Pour étudier la plasticité induite par l’apprentissage, spontanée mEPSCs induite par l’AMPA et GABAA-médiation mIPSCs ont été enregistrées dans l’ordre en présence de 0,5 tétrodotoxine µM (Figure 5 a et B). Comme indiqué dans les parcelles à deux dimensions (Figure 5), chaque neurone CA1 avait différentes amplitudes moyennes pour mEPSCs et mIPSCs. Bien que les amplitudes sont faibles et ont montré une gamme étroite de distribution en non formés, non appariées, et les rats de portique, ceux sont diverses chez les rats entraînés IA (tableau 5). ANOVA suivie d’analyse post-hoc a montré une augmentation significative de l’amplitude moyenne des CPSEM et mIPSC chez les rats entraînés IA (Figure 5E), ce qui suggère la plasticité postsynaptique induite par l’apprentissage dans les neurones CA1.
En outre, chaque neurone CA1 présentait des fréquences différentes de CPSEM et mIPSC (Figure 5). Bien que les fréquences sont faibles et ont montré une gamme étroite de distribution en non formés, non appariées, et les rats de portique, ceux sont diverses chez les rats entraînés IA (tableau 6). ANOVA suivie d’analyse post-hoc a montré une augmentation significative dans les fréquences des événements CPSEM et mIPSC chez les rats entraînés IA (Figure 5F). Il y a deux interprétations possibles de ces résultats. La première est que l’apprentissage contextuel a augmenté le nombre de synapses fonctionnelles des neurones. L’autre est que l’apprentissage contextuel augmentait la probabilité de libération présynaptique de glutamate et le GABA.
Pour examiner davantage la plasticité présynaptique, nous avons aussi organisé des impulsions pairées stimulations, comme indiqué précédemment10,11.
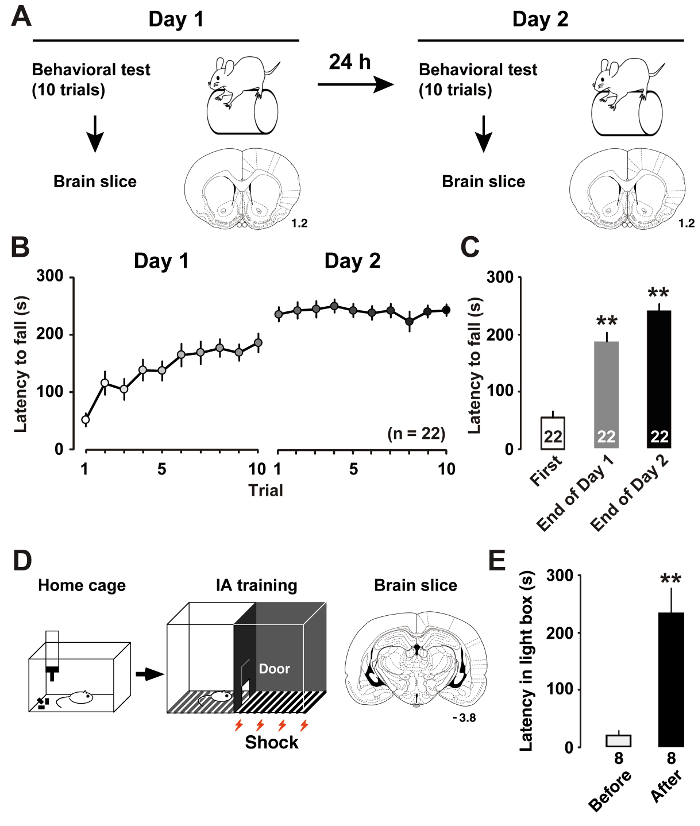
Figure 1 : Performance après une formation d’apprentissage.
A: le protocole expérimental montre la formation de tige rotor et la tranche de cerveau coronale. B: la latence moyenne de tomber dans le Canon, tige rotor accélération. C: la latence moyenne de tomber hors de la tige sur les premiers et les derniers essais sur la formation des jours 1 et 27. P< 0,01 vs premier procès. D: schéma de la tranche de cerveau de tâche et coronale évitement inhibitrice (IA). E: la latence moyenne pour entrer dans la boîte noire avant et après IA formation11. P< 0,01 par rapport à avant la formation de l’IA. Les nombres par les sections coronales indiquent la distance avant le bregma en mm. Le nombre d’animaux est affiché dans le bas des barres. Barres d’erreur indiquent SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
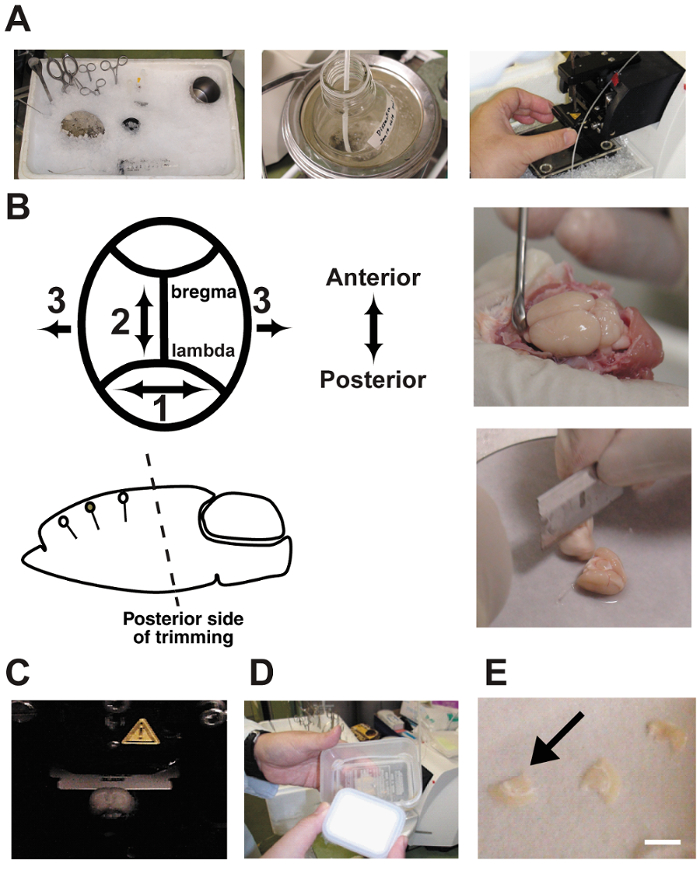
Figure 2 : Couper des procédures.
A: photographies montrent la préparation des tranches de cerveau aiguë. Les outils de dissection ont été refroidis dans de la glace pilée à avant utilisation. B: dissection et coupe de cerveau. Notez que l’angle de la garniture sur le côté postérieur doit être orienté parallèlement à l’orientation dendritique. C: émincer le cerveau dans une chambre vibratome. Le cerveau est baigné dans le tampon de la dissection et barboter en permanence avec un mélange de gaz de 5 % CO295 % O2 . D: une chambre interface faite de deux conteneurs en plastique alimentaire et un tube de silicone. La chambre était remplie de CSF artificiel et barboter en permanence avec le mélange de gaz. E: tranches de cerveau ont été placés sur un papier filtre humide dans la chambre.Bar = 5 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
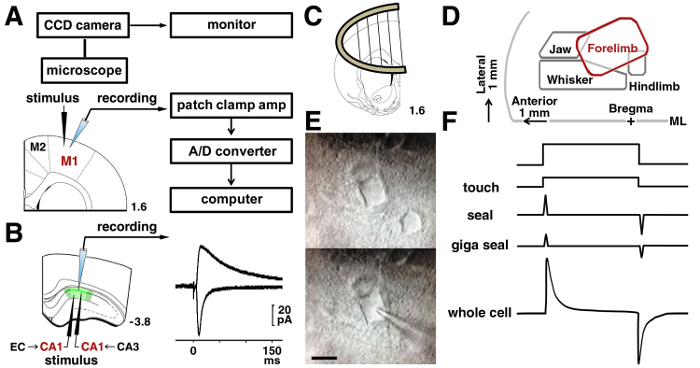
Figure 3 : Procédures de Patch clamp.
A: le système de patch clamp utilisé pour enregistrer les signaux électriques d’un neurone. L’emplacement de la stimulation et électrodes d’enregistrement dans les neurones de la couche II/III sont indiquées dans le cortex de moteur de rat. B: pour analyser les synapses Schaffer d’un neurone pyramidal CA1, une électrode de stimulation a été placée au stratum radiatum. Pour analyser les synapses de temporoammonic, une électrode de stimulation a été placée à la moleculare de la strate. Représentant des traces d’évoqués AMPA et NMDA médiée par les récepteurs courants postsynaptiques excitateurs dans le même neurone CA1 apparaissent. C: un point d’ancrage de la tranche a été utilisé pour stabiliser la tranche dans la chambre d’enregistrement. D: une carte de représentation dans le cortex moteur, basée sur les articles publiés15,16,17. ML = ligne médiane. E: Micrographies IR-DIC de M1 couche de neurones II/III avant (haute) et lors de l’enregistrement (enbas). Bar = 10 µm. F: changements dans la pipette actuelle avant de toucher (enhaut) et à la rupture des membranes (enbas). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
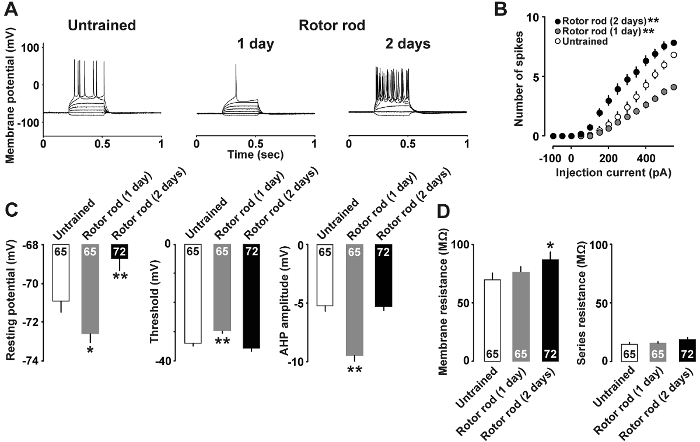
Figure 4 : Les résultats représentatifs du courant-clamp analyse7 .
A: traces représentatives des potentiels d’action enregistrement après l’induction avec des injections de courant. B: relations entre l’entrée actuelle moyenne (AP) vs sortie de potentiel d’action (nombre d’épis) dans des tranches de cerveau de non formés (bars ouverts) et formés (barres grises) 1 jour 2 jours rats entraînés (rempli bars). C: repos potentiel seuil et post-hyperpolarisation des neurones couche II/III. D: résistance de la Membrane et de la résistance en série des neurones. Nous avons utilisé des rats de 9-10 dans chaque groupe. Le nombre de cellules est illustré au sein de chaque barre. Barres d’erreur indiquent le SEM. *P< 0,05, **P< 0,01 vs non entraînés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
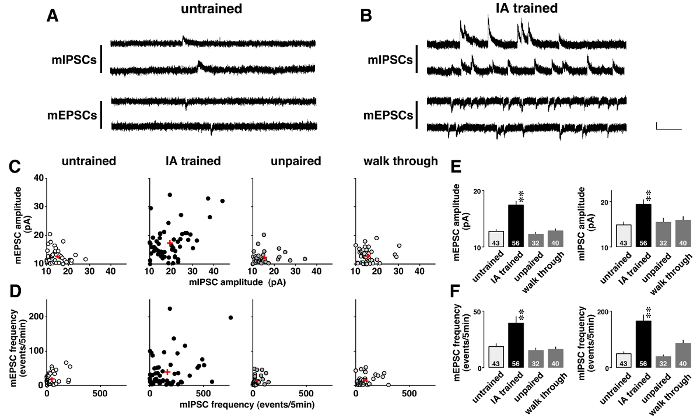
Figure 5 : Des résultats représentatifs de l' analyse de voltage clamp11 .
Des traces représentatives de miniature excitatrices et inhibitrices courants postsynaptiques (mEPSCs et mIPSCs) sans formation (A) et évitement inhibitrice (IA)-formés de rats (B). mEPSCs à-60 mV et mIPSCs à 0 mV ont été mesurés dans l’ordre dans les mêmes neurones pyramidaux CA1 en présence de la tétrodotoxine (0,5 µM). Barre verticale = 20 pA, barre horizontale = 200 msec. C: bidimensionnelle des parcelles de la moyenne mE (I) CFP amplitudes dans exercée, formés à l’IA, impair et les rats de portique. D: parcelles bidimensionnelles du mE (I) CFP fréquences dans les 4 groupes. Remarque que chaque neurone CA1 présente différents mE (I) signifie fréquence et l’amplitude de la CFP. Formation de IA renforcé non seulement les amplitudes moyennes (E) mais aussi augmenté les fréquences du mE (I) les événements CFP (F). Nous avons utilisé des rats de 4 à 6 dans chaque groupe. Le nombre de cellules est affiché dans le bas des barres. Des signes plus rouges (C, D) et des bars avec des lignes verticales (E, F) indiquent la moyenne ± SEM. **P< 0,01 vs non formés des rats. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Tampon de dissection (Total 1L) | ||
| NaH2PO4 • 2 H2O | 0,195 g | 1,25 mmol/L |
| KCl | 0,188 g | 2,5 mmol/L |
| CaCl2 | 0,074 g | 0,5 mmol/L |
| MgCl2 • 6 H2O | 1,423 g | 7,0 mmol/L |
| Chlorure de choline | 12,579 g | 90 mmol/L |
| Acide ascorbique | 2,340 g | 11.6 mmol/L |
| Acide pyruvique | 0,342 g | 3.1 mmol/L |
| NaHCO3 | 2,100 g | 25 mmol/L |
| Glucose | 4,500 g | 25 mmol/L |
Tableau 1 : Une recette pour le tampon de dissection
| CSF artificiel (Total 1L) | ||
| KCl | 0,186 g | 2,5 mmol/L |
| NaCl | 6,700 g | 114,6 mmol/L |
| NaH2PO4 •2H2O | 0,156 g | 1 mmol/L |
| Glucose | 1,800 g | 10 mmol/L |
| NaHCO3 | 2,184 g | 26 mmol/L |
| 1M MgCl2 | 4 mL | 4 mmol/L |
| 1M CaCl2 | 4 mL | 4 mmol/L |
Tableau 2 : Une recette pour artificiel liquide céphalo-rachidien (LCR)
| Solution intracellulaire pour pince ampèremétrique (Total 200 mL) | ||
| KCl | 0,0746 g | 5 mmol/L |
| K-Gluconate | g 6,089 | 130 mmol/L |
| HEPES | 0,476 g | 10 mmol/L |
| EGTA | 0,0456 g | 0,6 mmol/L |
| 1M MgCl2 | 500 ΜL | 2,5 mmol/L |
| Na2 ATP | g 0,4408 | 4 mmol/L |
| Na3 GTP | 0,0418 g | 0,4 mmol/L |
| Phosphocréatine na | 0,510 g | 10 mmol/L |
Tableau 3 : Une recette pour une solution intracellulaire pour pince ampèremétrique enregistrement
| Solution intracellulaire pour bride de tension (Total 200 mL) | ||||
| CsMeSO3 | 5 | |||
Tableau 4 : Une recette pour une solution intracellulaire pour bride de tension d’enregistrement
| Paramètres | sans formation | IA formé | non-appariés | promenade à travers | |
| amplitude CPSEM | Variance | 5.8 | 32.1 | 4.7 | 5.9 |
| Écart-type | 2.4 | 5.7 | 2.2 | 2.4 | |
| Coefficient de variation | 0,189 | 0,326 | 0,177 | 0.190 | |
| amplitude mIPSC | Variance | 17.1 | 56,7 | 31,8 | 20,7 |
| Écart-type | 4.1 | 7.5 | 5.6 | 4.5 | |
| Coefficient de variation | 0.279 | 0.387 | 0,367 | 0,286 |
Tableau 5 : La diversité des miniatures excitatrices et inhibitrices postsynaptique (CPSEM et mIPSC) amplitudes de courant à un évitement inhibitrice (IA)-formés des rats
| Paramètres | sans formation | IA formé | non-appariés | promenade à travers | |
| CPSEM fréquence | Variance | 278 | 2195 | 188 | 195 |
| Écart-type | 17 | 47 | 14 | 14 | |
| Coefficient de variation | 0,902 | 1,198 | 0,893 | 0,874 | |
| mIPSC fréquence | Variance | 3282 | 27212 | 1385 | 5135 |
| Écart-type | 57 | 165 | 37 | 72 | |
| Coefficient de variation | 1,195 | 1.006 | 0,955 | 0,836 |
Tableau 6 : La diversité des miniatures excitatrices et inhibitrices postsynaptique actuel (CPSEM et mIPSC) fréquences évitement inhibitrice (IA)-formés des rats
Discussion
La limitation majeure de la technique du patch clamp tranche est l’enregistrement en préparation de la tranche, qui peut-être ne pas refléter ce qui passe in vivo. Bien que l’analyse in vivo courant-clamp est plus fiable, il est techniquement difficile à obtenir suffisamment de données à partir d’animaux conscients. Chaque neurone pyramidal ayant des propriétés cellulaires différentes, un nombre suffisant de cellules est nécessaire pour analyser correctement les différences dans les neurones après la formation. En outre, analyse de voltage clamp nécessite un traitement continu avec CNQX, APV ou bicuculline pour déterminer la nature des réponses postsynaptiques. Pour analyser les réponses de miniature induites par une seule vésicule de glutamate ou GABA, un traitement continu avec la tétrodotoxine est nécessaire pour bloquer des potentiels d’action spontanées. Bien que la technique d’imagerie multiphotonique récemment mise au point est puissante pour l’analyse des changements morphologiques dans les synapses excitatrices19, une technique du combiné patch clamp est nécessaire pour analyser la fonction des synapses en vivo. Actuellement, il est assez difficile d’analyser les changements morphologiques au niveau des synapses inhibitrices, car les synapses inhibitrices plus ne font pas d’épines. A cette époque, le patch clamp de la tranche serait la technique plus adaptée pour analyser les propriétés de cellule ou les fonctions des synapses excitatrices/inhibitrices dans animaux entraînés.
Selon l’analyse de courant-clamp (Figure 4), nous avons récemment rapporté plasticité intrinsèque induite par l’apprentissage moteur, dans les neurones de couche II/III. Plus précisément, les rats entraînés 1 jour montrent une diminution significative au repos potentiel membranaire et une augmentation du seuil de spike. Les rats entraînés 2 jours montrent une augmentation significative au potentiel de membrane qui a conduit à l’excitabilité accrue de repos. Ces résultats suggèrent qu’ont été les changements dynamiques dans la plasticité intrinsèque des M1 couche II/III neurones de rats entraînés. Bride de tension supplémentaire l’analyse a révélé une augmentation du ratio d’impulsions pairées dans 1 jour de rats entraînés, ce qui suggère qu’il y avait une diminution transitoire de la probabilité de libération présynaptique GABA7. Il est donc possible que désinhibition de GABA au niveau de la couche II/III de synapses pouvant déclencher la plasticité induite par l’apprentissage qui en résulte dans le M1. À l’appui de cela, préparation de tranches de l’autoroute M1 exige le traitement de bain avec un bloqueur des récepteurs GABAA pour induire LTP20.
Analyse des potentiels post-synaptiques miniature est un moyen puissant pour détecter la plasticité synaptique chez les animaux formés à l’IA. Séquentiel d’enregistrement de mEPSCs et mIPSCs en un seul neurone CA1 permet l’analyse de la force synaptique excitatrice/inhibiteur de chaque neurone individuel. Depuis un seul mE (I) CFP réponse est attribuée à une seule vésicule de glutamate ou GABA, une augmentation dans le mE (I) CFP amplitude suggère renforcement postsynaptique. Selon mE (I) l’analyse de la CFP, nous avons constaté des différences individuelles dans la force des excitateurs/inhibiteur d’entrée dans chaque neurone CA1 (Figure 5). Formation de IA clairement promu la diversité dans la force synaptique, mais cela n’a pas observé dans les autres groupes (tableau 5).
La diversité synaptique induite par l’apprentissage peut être analysée mathématiquement. En calculant la probabilité d’apparition de chaque point, les données de chaque neurone peuvent être converties en soi-entropie (bit) à l’aide de la théorie de l’information de Claude E. Shannon21. Un point avec une probabilité forte apparence (autour du niveau moyen) indique faible auto-entropie, tandis qu’un point avec une probabilité très rare (un point dévié) indique haute auto-entropie. Comparativement aux rats non formés, l’auto-entropie par neurone a été nettement augmenté chez les rats entraînés IA mais pas en non appariée ou portique rats22. Cette analyse suggère qu’il y avait une augmentation intra-CA1 information après l’apprentissage contextuel.
La technique du patch clamp tranche permet également de peur indicée conditionnement des études dans l' amygdale latérale9 et pour les études d’expérience sensorielle dans le cortex de baril8. En outre, cette technique peut servir à diverses autres techniques pour complément d’enquête. Par exemple, la médiation virus protéine fluorescente verte (GFP)-gène tagged livraison technique peut être combinée avec la technique du patch clamp pour analyser la fonction des molécules spécifiques. En outre, focale microinjection d’un traceur rétrograde peut être utilisée pour visualiser des neurones spécifiques de ce projet à une zone spécifique. Puis, en utilisant la technique de courant-clamp, les propriétés spécifiques des cellules peuvent être analysées dans les neurones visualisée23. En outre, microscopie biphotonique à balayage laser combinant avec deux photons laser uncaging de glutamate a été utilisée pour démontrer la croissance axée sur la colonne vertébrale et la réponse EPSC souris corticale couche de neurones pyramidaux II/III19. Ainsi, la technique du patch clamp tranche sera améliorée en le combinant avec nouveaux produits chimiques, la livraison de gène et les techniques de manipulation de photo.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêt. Nous confirmons que nous avons lu la position de la revue sur les enjeux éthique publication et nous affirmons que ce rapport est conforme à ces directives. Les bailleurs de fonds n’avaient aucun rôle dans la conception de l’étude, collecte de données ou l’analyse, la décision de publier ou la préparation du manuscrit.
Remerciements
Nous tenons à remercier m. Paw-Min-Thein-Oo, Dr. Han-TREHET-Zin et Mme H. Tsurutani pour leur assistance technique. Ce projet a bénéficié de subventions pour jeunes scientifiques (H.K. et Y.S.), B de la recherche scientifique (D.M.), C de la recherche scientifique (D.M.) et en domaines innovants (D.M.), depuis le ministère de l’éducation, Sports, Culture, Science, la recherche scientifique et Technologie du Japon.
matériels
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
Références
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon