需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在体内轴突兴奋性试验对大鼠尺神经的电生理测量
摘要
轴突兴奋技术提供了一个强有力的工具, 以检查病理生理学和生物物理变化之前, 不可逆转的退化事件。这篇手稿展示了这些技术在麻醉大鼠尺神经上的应用。
摘要
电生理学能够客观评估周围神经功能在体内。传统的神经传导措施, 如振幅和潜伏期检测慢性轴突损失和鞘, 分别。轴突兴奋技术 "通过阈值跟踪" 扩大了这些措施, 提供有关的离子通道, 泵和交换器的活动有关的急性功能和可能之前的退化事件的信息。因此, 在神经紊乱动物模型中使用轴突兴奋性可以为评估新的治疗干预提供一个有用的体内措施。在这里, 我们描述了一个实验设置的多项措施的运动轴突兴奋技术在大鼠尺神经。
动物被麻醉与异氟醚和仔细监测, 以确保持续和充分的麻醉深度。持续监测血液中的体温、呼吸速率、心率和血氧饱和度。轴突兴奋性研究是利用经皮刺激尺神经和记录从鱼际肌肉的前肢爪。在正确的电极放置, 一个明确的复合肌肉动作电位增加振幅随着刺激强度增加记录。然后利用一个自动程序提供一系列的电脉冲, 产生5特定的兴奋性措施在以下序列: 刺激反应行为, 强度持续时间常数, 阈 electrotonus, 电流阈值关系和恢复周期。
这里提供的数据表明, 这些措施是可重复的, 并显示了在同一天评估左、右尺神经的相似性。这些技术的局限性是在麻醉条件下剂量和时间的影响。对这些变数进行仔细的监测和记录应在分析时加以考虑。
引言
使用电生理学技术是一个必要的工具, 在体内研究周围神经功能的神经紊乱。传统的神经传导方法利用 supramaximal 刺激记录运动动作电位振幅和潜伏期。因此, 这些技术提供了关于导电纤维数量和最快纤维的传导速度的有用信息。一个有价值的辅助工具是轴突兴奋性测试。这种技术使用复杂的电生理刺激模式间接评估周围神经的生物物理特性, 如离子通道、能量依赖性泵、离子交换过程和膜电位的活性1。
轴突兴奋性测试通常用于临床设置, 以调查病理生理过程和治疗干预对各种神经疾病的影响。重要的是, 轴突兴奋性措施是敏感的治疗干预, 影响周围神经功能, 如静脉注射免疫球蛋白 (丙种球蛋白) 治疗2, 化疗3和磷酸抑制剂 (CNI) 治疗4. 虽然这些研究提供了重要的见解, 但临床研究往往排除了早期疾病特征的调查和新的治疗方案5。因此, 这些方法在神经紊乱动物模型中的应用最近获得了牵引6,7,8,9。事实上, 这些方法提供了一个机会, 以了解特定的神经兴奋性变化与这些疾病相关, 从而推进转化研究。
这里描述的程序是一种简单而可靠的方法来记录轴突兴奋性措施的完整大鼠尺神经。
研究方案
这里描述的所有实验程序都符合悉尼新南动物保育和伦理委员会的要求, 并按照澳大利亚国家卫生和医学研究理事会 (澳洲) 的规定进行动物实验。
1. 实验设置
注:12 周前, 雌性长埃文斯大鼠被用于此手术。
- 麻醉在感应室使用4% 异氟醚和1升每分钟2流量。确认充分的麻醉, 通过测试矫正反射, 并确保其缺席之前, 从诱导室移除动物。请注意, 各种麻醉药对神经兴奋性有不同的影响10。
- 安全地将动物的鼻子放在鼻锥附件中, 并提供2.5% 异氟烷和1升每分钟的维护剂量 (2流率。
- 通过捏动动物的脚趾并轻轻地触碰它的眼睛, 确认适当的麻醉, 同时检查踏板和角膜的反射。
注意: 建议使用兽医软膏, 以防止在麻醉时干燥, 但并不必要, 因为手术通常需要30分钟的动物。 - 使用反馈控制加热垫和直肠温度计探头, 在37° c 下保持大鼠体温。将加热垫和集成体温传感器设置为40° c, 以防止在较高温度下发生任何皮肤损伤。
注意: 建议每10s 使用动物生理监测系统监测和记录生理措施 (心率、氧饱和度、体温和呼吸率)。最佳记录程序应包括局部测量的肢体温度, 因为外围温度可能比核心温度11 (图 1) 冷。 - 戴上防腐手套, 始终使用70% 乙醇清洗过的器械, 在整个过程中保持无菌环境。
2. 电生理设置
- 使用低阻抗铂脑电图 (EEG) 针电极为这个过程。
- 通过鱼际肌肉和参考电极插入记录针电极 (图 1; 紫色表示), 通过第四位数字的背侧 (图 1; 表示橙色) 记录复合肌肉动作电位 (CMAPs)。
- 在刺激和记录电极 (图 1; 绿色指示) 之间, 将接地电极通过皮肤放在前臂的上级方面。插入电极时要小心, 以避免肌肉组织。
- 通过插入阴极 (图 1; 用蓝色标记) 约4毫米的远端肘管的肘部, 准备经皮刺激针电极。插入阳极 (图 1; 用红色标记) 大约1厘米下部通过 axillar 区域的皮肤。

图 1: 大鼠前肢针电极放置的示意图.负极 ( 蓝色 ) 入大约 4 毫米远端对肘形隧道在弯头和阳极 ( 红色 ) 入大约 1 cm 下部通过 axillar 区域的皮肤。地面针电极 (绿色) 通过皮肤在刺激和记录电极之间的前臂的高级方面插入。记录 (紫色) 和参考 (橙色) 针电极插入通过鱼际肌肉和通过背部方面的 4th数字。温度探针 (灰色) 被放置在鱼际肌肉的优越方面。请单击此处查看此图的较大版本.
3. 轴突兴奋性程序
- 执行啮齿动物运动神经 TRONDNF 协议使用半自动化, 计算机控制轴突兴奋性程序 (见材料表) 链接到一个恒定电流刺激器和扩音器。使用 50/60 hz 的噪声消除器去除超过50赫兹的电噪声。
- 记录 CMAP 从鱼际肌肉, 同时可视化的 CMAP 形态学和应用 1 ms 方波脉冲到尺神经与阴极针电极。
- 要实现最佳记录, 请仔细调整阴极的角度和/或位置, 直到达到具有恒定振幅的最佳双相响应曲线 (图 2A。一旦确定了最佳位置, 就用可电极保持器稳定阴极。
注: 使用的软件自动交付测试刺激, 下面描述, 并增加或减少当前所需的达到阈值。
- 要实现最佳记录, 请仔细调整阴极的角度和/或位置, 直到达到具有恒定振幅的最佳双相响应曲线 (图 2A。一旦确定了最佳位置, 就用可电极保持器稳定阴极。
- 通过将 1 ms 冲量的刺激强度增量递增 1 mA 来记录刺激反应曲线, 直到达到最大响应。
注: 图2B 和2C 中的紫色和绿色线分别代表了刺激强度和自动系统的增量增长。阈值跟踪的目标振幅自动设定为刺激响应曲线上最陡斜率区域对应的最大振幅的40%。各种测试刺激所诱发的 "阈值" (即激发 40% CMAP 所需的刺激) 的变化是在该协议的其余部分中获得的变量。 - 记录多个轴突兴奋性参数, 包括阈值 electrotonus (TE)、当前阈值 (I/V) 关系和恢复周期 (RC), 如参考12所述。
注: 计算机控制轴突兴奋性程序评估阈值 (TE) 与 100 ms 阈极化和极化电流设置在±和±40% 的控制阈值电流。在极化和极化电流后, 阈值的变化在100毫秒偏振电流和极化电流后12点自动记录在14时间点。阈值 electrotonus 间接评估间电导, 是膜电位的标志。与 200 ms 阈调节电流, 在强度从 +50% 到-100% 的控制阈值交替10% 的增量。I/V 的关系不同于 TE, 因为电流在持续时间较长, 极化强度从 +50% 逐渐改变为-100%, 并且在极化电流停止后每强度1毫秒评估阈值变化。"I/V" 关系提供了对轴突1的整流特性的洞察。RC 是用配对的脉冲范式评估的, 在这里, 最初的 supramaximal 调节刺激是应用在特定的时间间隔, 从2.5 毫秒到200毫秒的一系列测试刺激. 此参数测试在节点中发生的一系列定义良好的事件。轴突的区域在 supramaximal 刺激以后。这些事件包括, 电压门控 Na+通道失活, 这使得它更难引出一个后续的反应, 并通过耐火和相对耐火期1量化。其次是对节间的充电和由快速钾通道介导的高度兴奋期, 由 superexcitability。最后, 缓慢激活钾通道调解后期的兴奋性降低, 量化为 subexcitability。
- 记录 CMAP 从鱼际肌肉, 同时可视化的 CMAP 形态学和应用 1 ms 方波脉冲到尺神经与阴极针电极。
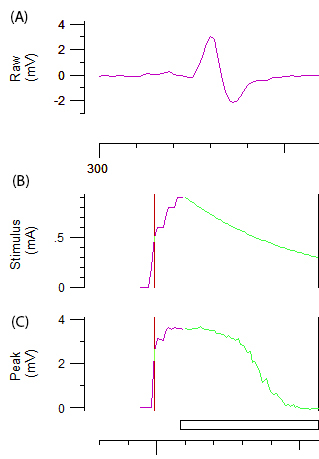
图 2: 轴突兴奋性测试的原始数据.在对尺神经的刺激增量增加后, abiphasic CMAP 反应曲线。面板 B 和 C 分别代表刺激强度 (mA) 和振幅的 CMAP (mV)。B 和 C 的绿色成分描述了自动增量减少刺激强度和相关的乙状结肠形减少 CMAP 所需的阈值跟踪。
4. 后电生理程序
- 把老鼠转移到一个单独的笼子里, 直到它恢复了足够的意识来维持胸骨卧床。在完全从麻醉中恢复之前, 不要把动物单独留在其他动物的陪伴下。一旦老鼠完全从麻醉中恢复过来, 把它转移回原来的笼子。
- 在研究完成后, 安乐鼠无疼痛的动物, 如致命的腹腔注射巴比妥 (如 lethabarb)。
结果
采用本方案获得了大鼠尺神经的电生理测量。图 3演示了一个12周大的雌性长埃文斯鼠左尺神经的有代表性的记录。复合肌肉动作电位与同时激活的导电纤维数量有关。supramaximal 峰值响应 (mV) (图 3A) 演示了在增量递增刺激之前达到的峰值响应 (图 2B)。
讨论
所描述的过程证明了一种简单而可靠的微创技术, 允许在短时间内对轴突的生物物理特性和膜电位进行评估。与其他更多的侵入性技术, 需要暴露的神经, 目前的方法轴突兴奋性测试诱导最小的组织损害, 从而使在体内评估, 保留了生理条件神经的兴趣, 并允许重复测量。
为了确保取得一致的结果, 有一些方法上的考虑需要加以解决。其中一个因素是麻醉的浓度和类型。以...
披露声明
作者没有什么可透露的。
致谢
该项目得到了 Lundbeck 基金会、诺德基金会、丹麦医学研究理事会、Ludvig 和萨拉 Elsass 基金会、神经病学研究基金会和 Jytte Kaj 基金会的支持。R. A 得到澳大利亚国家卫生和医学研究理事会 (#1091006) 早期职业博士后奖学金的支持
材料
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
参考文献
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。