JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Vivo에서 Axonal 흥분 테스트 쥐 척 골 신경의 electrophysiological 측정
요약
Axonal 흥분 기법 이상 및 퇴행 성 돌이킬 수 없는 이벤트를 앞 생물 변화를 검사 하는 강력한 도구를 제공 합니다. 이 원고는 마 취 쥐의 척 골 신경에 이러한 기술의 사용을 보여줍니다.
초록
전기 생리학 주변 신경 기능 비보의 객관적인 평가 수 있습니다. 전통적인 신경 전도 같은 진폭 및 대기 만성 축 삭 손실 및 검출 demyelination, 각각 측정 한다. "임계값 추적"으로 axonal 흥분 기술 이온 채널, 펌프 및 급성 기능 관련 고 퇴행 성 이벤트 앞에 있습니다 교환기의 활동에 관한 정보를 제공 하 여 이러한 조치에 따라 확장 합니다. 따라서, axonal 흥분 성 신경 질환의 동물 모델에서의 사용 새로운 치료 적 중재를 평가 하기 위해 유용한 vivo에서 측정을 제공할 수 있습니다. 여기는 쥐 척 골 신경에 모터 axonal 흥분 기술의 여러 측정값에 대 한 실험 설정에 설명합니다.
동물은 isoflurane와 취 고 신중 하 게 보장 하기 위해 모니터링 지속적이 고 적절 한 마 취의 깊이. 체온, 호흡 속도, 심장 박동과 혈액에 산소의 채도 지속적으로 모니터링 된다. Axonal 흥분 연구는 척 골 신경 및 녹음의 forelimb 발 hypothenar 근육에서의 경 피 적인 자극을 사용 하 여 수행 됩니다. 올바른 전극 위치와 진폭 자극 강도 증가 함께 증가 분명 복합 근육 활동 전위 기록 됩니다. 다음 순서로 5 특정 흥분 측정값을 생성 하는 전기 펄스의 시리즈를 제공 하는 자동화 된 프로그램 활용 다음: 전류 임계값, 임계값 electrotonus, 강도 기간 시간 상수, 자극 응답 동작 관계 그리고 복구 주기입니다.
여기에 제시 된 데이터 이러한 반복은 같은 날 부과 때 왼쪽과 오른쪽 척 골 신경 사이의 유사성을 보여 나타냅니다. 이 설정에서 이러한 기술의 제한 시간과 복용량 마 취의 효과입니다. 신중 모니터링 하 고 이러한 변수의 기록 분석 시 고려 사항을 위해 이루어져야 한다.
서문
Electrophysiological 기술의 사용 신경 질환에서 말 초 신경 기능 vivo에서 조사를 위한 필수적인 도구입니다. 기존의 신경 전도 방법 supramaximal 자극 모터 활동 전위의 진폭 및 대기 시간을 기록 하는 데 사용 합니다. 이러한 기술은 빠른 섬유의 전도 속도 및 섬유의 수에 따라서 유용한 정보를 제공 합니다. 보완 하는 유용한 도구가 axonal 흥분 테스트입니다. 이 기술은 정교한 electrophysiological 자극 패턴을 사용 하 여 주변 신경, 이온 채널, 에너지 종속 펌프, 이온 교환 프로세스 및 막 잠재적인 활동의 생물 속성을 직접 평가 하기 위해 1.
Axonal 흥분 테스트는 pathophysiological 프로세스와 다양 한 신경 질환에 치료 내정간섭의 효과 조사 하는 임상 설정에서 일반적으로 이용 된다. 중요 한 것은, axonal 흥분 조치는 정 맥 면역 글로불린 (IVIg) 치료2, 등 말 초 신경 기능에 영향을 주는 치료 내정간섭에 민감한 화학 요법3 및 calcineurin 억제제 (CNI) 치료 4. 비록 이러한 연구는 중요 한 통찰력을 제공 하 고, 임상 연구는 종종 초기 질병 특성 및 새로운 치료 옵션5의 조사 배제. 따라서, 신경 성 질환의 동물 모델에서 이러한 메서드를 사용 하 여 최근 견인6,7,,89를 얻고 있다. 사실, 이러한 메서드는 따라서 변환 연구 전진이 질환과 관련 된 특정 신경 흥분 성 변화를 이해 하는 기회를 제공 합니다.
여기에 설명 된 절차는 그대로 쥐의 척 골 신경에 기록 axonal 흥분 조치 간단 하 고 신뢰할 수 있는 방법입니다.
프로토콜
여기 설명 하는 모든 실험 절차 동물 관리 및 윤리 위원회의 UNSW 시드니를 준수 하 고 국민 건강 및 의료 연구 위원회 (NHMRC) 동물 실험에 대 한 호주 규정의 수행 했다.
1. 실험 설정
참고: 12 주 오래 된, 여성 롱-에반스 쥐가이 절차에서 사용 되었다.
- 분 O2 흐름 율 당 4 %isoflurane 및 1 L를 사용 하 여 유도 실에서 쥐 anesthetize 충분 한 마 취 righting 반사에 대 한 테스트 하 여 확인 하 고 유도 챔버에서 동물을 제거 하기 전에 그것의 부재를 보장. 참고 다양 한 마 취 에이전트 신경 흥분10대 차동 효력이 있다.
- 안전 하 게 동물의 주 둥이 원뿔 첨부 파일에 놓고 분 O2 흐름 율 당 2.5% isoflurane 1 L의 유지 보수 복용량을 제공 합니다.
- 동물의 발가락을 꼬 집 고 그것의 눈을 만지고 부드럽게 페달 철수 및 각 막 반사 검사 하 여 적절 한 마 취를 확인 합니다.
참고: 마 취에서 건조를 방지 하기 위해 눈, 수 의사 연 고의 응용 프로그램은 권장 하지만 절차는 일반적으로 동물 마다 30 분 걸립니다 중요 하지. - 피드백 제어 난방 매트와 직장 온도계 프로브를 사용 하 여 37 ° C에서 쥐의 체온을 유지 한다. 높은 온도 함께 발생 하는 모든 피부 손상을 방지 하기 위해 40 ° C에 난방 매트 및 통합된 몸 온도 센서를 설정 합니다.
참고:이 좋습니다 모니터 및 기록 생리 적 조치 (심장 박동, 산소 포화, 체온, 호흡 속도)는 동물 생리 적 모니터링 시스템의 사용과 모든 초. 최적의 녹음 절차 주변 온도 코어 온도11 (그림 1) 보다 추운 수 로컬 사지 온도 측정을 포함 해야 합니다. - 살 균 장갑을 착용 하 고 항상 절차에 걸쳐 병원 체 자유로운 환경을 유지 하 70% 에탄올, 청소 된 악기를 사용 합니다.
2. electrophysiological 설정
- 이 절차에 대 한 낮은 임피던스 플래티넘 뇌 파 (EEG) 바늘 전극을 사용 합니다.
- Hypothenar 근육과 등 부분의 4 자리를 통해 참조 전극을 통해 녹음 바늘 전극 (그림 1에 표시 된 보라색);를 삽입 하 여 기록 바늘 전극을 준비 (그림 1에 표시 된; 오렌지) 복합 근육 활동 전위 (Cmap) 기록.
- 피부를 통해 접지 전극을 사이의 자극 및 기록 전극 (그림 1에 표시 된 녹색); 팔 뚝의 우수한 측면에 놓습니다. 근육 조직을 피하기 위해 전극을 삽입 하는 때 주의 합니다.
- 경 피 적인 자극 바늘 전극을 음극 (그림 1,에 이라는 파란색)을 삽입 하 여 준비 약 4 m m는 cubital에 원심 팔꿈치 터널. (그림 1,에 이라는 빨간색) 양극 삽입 proximally axillar 지역의의 피부를 통해 약 1 cm.

그림 1: 쥐 forelimb에 바늘 전극 배치의 회로도. 음극 (청색)이 약 4 m m 팔꿈치 cubital 갱도에 말 초 삽입 되 고 양극 (적색) 삽입 proximally axillar 지역의의 피부를 통해 약 1 cm. (녹색) 지상 바늘 전극 자극 및 기록 전극 사이 팔 뚝의 우수한 측면에서 피부를 통해 삽입 됩니다. 4번째 손가락의 등 쪽 부분 및 hypothenar 근육 통해 녹음 (보라색) 및 참조 (오렌지) 바늘 전극 삽입 됩니다. 온도 프로브 (회색)는 thenar 근육의 우수한 측면에 배치 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
3. axonal 흥분 절차
- 설치류 모터 신경 반 자동화를 사용 하 여 TRONDNF 프로토콜을 수행, 컴퓨터 제어 axonal 흥분 프로그램 일정 전류 자극 기 및 증폭기에 연결 (재료의 표 참조). 50/60 Hz 노이즈 제거 기를 사용 하 여 초과 50 Hz 전기 노이즈를 제거 합니다.
- 동시에 CMAP 형태를 시각화 하는 1을 적용 하 여 hypothenar 근육에서 CMAP 기록 ms 구형 파 펄스 음극 바늘 전극과 척 골 신경.
- 최적의 녹음을 달성,까지 일정 한 진폭으로 최적의 복 형 응답 곡선 각도 및 음극의 위치를 신중 하 게 조정 (그림 2A) 달성. 최적의 위치를 결정 하는 일단 안정 repositionable 전극 홀더를 가진 음극 선.
참고: 자동으로 사용 하는 소프트웨어, 아래에 설명 된 테스트 자극을 제공 하 고 늘리거나 줄입니다 전류 임계값을 달성 하는 데 필요한.
- 최적의 녹음을 달성,까지 일정 한 진폭으로 최적의 복 형 응답 곡선 각도 및 음극의 위치를 신중 하 게 조정 (그림 2A) 달성. 최적의 위치를 결정 하는 일단 안정 repositionable 전극 홀더를 가진 음극 선.
- 1의 자극 강도 점차적으로 증가 하 여 자극-반응 곡선을 기록 1 ms 전류 mA 최대 응답을 얻을 때까지.
참고: 그림 2B와 2c에 보라색과 녹색 라인은 각각 자극 강도 및 자동화 시스템의 증분 증가 나타냅니다. 임계값 추적 대상 진폭 자극-응답 곡선에 가파른 슬로프의 영역에 해당 하는 최대 진폭의 40%로 자동으로 설정 됩니다. '문 턱'에서 변화 (40%를 유도 하는 데 필요한 자극 즉 CMAP) 각종에 의해 유도 된 테스트 자극은의 변수는 프로토콜의 나머지를 통해 얻은. - 임계값 electrotonus (테)를 포함 하 여 여러 axonal 흥분 매개 변수 기록 전류 임계값 (I / V) 관계 및 복구 주기 (RC) 참조에 설명 된 대로12.
참고: 컴퓨터 제어 axonal 흥분 프로그램 임계값 (테) 100 ms subthreshold depolarizing 및 전류를 hyperpolarizing으로 설정 된 제어 임계값의 ±40 %와 ± 20% 현재를 평가 합니다. 변화 후에 depolarizing 및 hyperpolarizing 전류 임계값에 자동으로 기록 됩니다 14 시간 지점에서 12 점과 현재 편광 100 ms 동안 현재 편광 후. 간접적으로 임계값 electrotonus internodal conductances 평가 하 고 막 잠재력의 표식입니다. I / V 관계에서 + 50 강도 대체 200 ms subthreshold 컨디셔닝 전류와 평가-100 %10% 단위로 제어 임계값의 %. I / V 관계 기간에는 전류는 더 이상 테에 달리, 분극의 강도 점진적으로 50에서 변경-100% %와 임계값 변경 각 강도로 1 평가 ms 정지는 현재 편광 후. I / V 관계1축 삭 조정 속성에 대 한 통찰력을 제공 합니다. RC는 짝된 펄스 패러다임, 초기 supramaximal 컨디셔닝 자극 적용 됩니다 다음 테스트 자극의 시리즈 특정 간격 2.5 ms에서이 매개 변수는 꾸벅꾸벅 졸 기에 잘 정의 된 일련의 이벤트가 발생 하는 테스트 200 양 평가 supramaximal 자극에 따라 축 삭의 지역입니다. 이러한 이벤트를 포함, 더 어렵게 이후 응답을 유도 하 고 하 중 및 상대적인 내 화물 기간 1계량은 전압 개폐 나+ 채널의 비활성화. 이 위치인 및 높게 한 흥분 빠른 칼륨 채널, superexcitability에 의해 계량에 의해 중재의 기간 충전 옵니다. 마지막으로, 천천히 활성화 칼륨 채널 중재 subexcitability로 정량 감소 흥분의 늦은 기간.
- 동시에 CMAP 형태를 시각화 하는 1을 적용 하 여 hypothenar 근육에서 CMAP 기록 ms 구형 파 펄스 음극 바늘 전극과 척 골 신경.
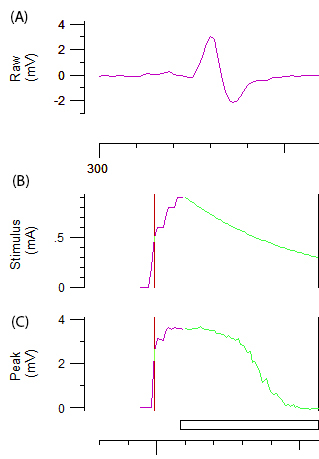
그림 2: axonal 흥분 테스트에서 원시 데이터 패널 A 척 골 신경 자극의 증분 증가 후 abiphasic CMAP 응답 곡선을 보여 줍니다. 패널 B와 C 각각 자극 강도 (mA) 및 CMAP (mV)의 진폭을 나타냅니다. B와 C의 녹색 구성 요소는 자극 강도 자동된 증분 감소 및 CMAP 임계값 추적에 필요한 관련된 sigmoid 모양의 감소 묘사.
4. 게시물 전기 생리학 절차
- Sternal recumbency를 유지 하기 위해 충분 한 의식 회복 될 때까지 별도 케이지를 쥐를 전송 합니다. 두지 마십시오 동물 무인 및 다른 동물의 회사에는 마 취에서 완전히 복구 되었습니다 때까지. 일단 쥐는 완전히 마 취에서 회복 하 고, 그것의 원래 감 금으로 다시 전송.
- 연구의 완성에서 쥐 바르 (예: lethabarb)의 동물, 예를 들어 치명적인 복 주사에 대 한 고통 없이 안락사.
결과
쥐 척 골 신경의 electrophysiological 조치는 현재 프로토콜을 획득 했다. 그림 3 에서는 12 주 된 여성 긴 에반스 쥐의 왼쪽된 척 골 신경에서 기록 하는 대표를 보여 줍니다. 복합 근육 활동 전위는 동시에 활성화는 섬유의 수를 관련이 있습니다. Supramaximal 피크 응답 (mV) (그림 3A)는 거기에에서는 변화가 없습니다 (그?...
토론
설명된 절차 설명 간단 하 고 신뢰할 수 있는, 최소한-침략 적 기법을 수 수 생물 속성의 평가 및 축 삭의 막 잠재력 시간의 짧은 기간에. 신경의 노출을 요구 하는 다른 더 침략 적 기법에 비해 axonal 흥분 테스트의 현재 방법 유도 최소한의 조직 손상의 생리 조건을 유지 비보에 평가 활성화는 관심의 신경 반복된 측정에 대 한 수 있습니다.
되도록 일관 된 결과 몇 가지 ?...
공개
저자는 공개 없다.
감사의 말
프로젝트는 Lundbeck 재단, Novo Nordisk 기초, 덴마크 의학 연구 위원회는 루트비히와 사라 Elsass 재단, 신경과 및 Jytte 연구 재단 및 Kaj Dahlboms 재단에 의해 지원 되었다. R.A 국가 건강과 의료 연구 위원회의 호주 (#1091006)의 초기 경력 장래가 친교에 의해 지원 됩니다.
자료
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
참고문헌
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유