Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In Vivo Elektrophysiologische Messungen der Ratte ulnaris mit axonalen Erregbarkeit testen
In diesem Artikel
Zusammenfassung
Axonalen Erregbarkeit Techniken bieten ein leistungsfähiges Werkzeug zur Prüfung Pathophysiologie und biophysikalische Veränderungen, die irreversible degenerative Ereignisse vorausgehen. Diese Handschrift zeigt den Einsatz dieser Techniken auf der ulnaren Nerv anästhesierten Ratten.
Zusammenfassung
Elektrophysiologie ermöglicht eine objektive Beurteilung der peripheren Nerv Funktion in Vivo. Traditionelle Nervenleitgeschwindigkeit Maßnahmen wie Amplitude und Latenz chronische Axon Verlust und Demyelinisierung, bzw. zu erkennen. Axonalen Erregbarkeit Techniken "von Schwelle tracking" erweitern auf diese Maßnahmen durch die Bereitstellung von Informationen über die Aktivität der Ionenkanäle, Pumpen und Wärmetauscher, die beziehen sich auf akute Funktion und degenerative Ereignisse vorausgehen können. Als solche können die Verwendung der axonalen Erregbarkeit in Tiermodellen der neurologischen Störungen eine Maßnahme nützlich in Vivo um neue therapeutische Interventionen zu beurteilen. Hier beschreiben wir einen Versuchsaufbau für mehrere Maßnahmen der axonalen motorischen Erregbarkeit Techniken in der Ratte ulnaris.
Die Tiere sind mit Isofluran betäubt und sorgfältig überwacht werden, um konstante und ausreichende Tiefe der Narkose zu gewährleisten. Körpertemperatur, Atemfrequenz, Herzfrequenz und Sättigung des Sauerstoffs im Blut werden kontinuierlich überwacht. Axonalen Erregbarkeit Studien werden durchgeführt mit perkutane Stimulation des ulnaris und Aufnahme von den Hypothenar Muskeln Vordergliedmaße Pfote. Mit der Platzierung der richtigen Elektrode wird eine klare Verbindung Muskel Aktionspotential, die Amplitude steigt mit zunehmender Reizstärke aufgezeichnet. Kein automatisiertes Programm wird dann genutzt, um eine Reihe von elektrischen Impulsen zu liefern, die 5 spezifischen Erregbarkeit Maßnahmen in der folgenden Reihenfolge zu generieren: Stimulus Ansprechverhalten, Stärke Dauer Zeitkonstante, Schwelle Electrotonus, Strom-Schwelle Beziehung und der Regenerationszyklus.
Die hier vorgestellte Daten zeigen, dass diese Maßnahmen wiederholbar sind und Ähnlichkeit zwischen links und rechts ulnaren Nerven zeigen wenn am selben Tag geprüft. Eine Einschränkung dieser Techniken in dieser Einstellung ist die Wirkung der Dosis und Zeit unter Narkose. Sorgfältige Überwachung und Aufzeichnung dieser Variablen sollten für die Prüfung zum Zeitpunkt der Analyse durchgeführt werden.
Einleitung
Elektrophysiologische Techniken ist ein wesentliches Instrument für die in Vivo -Untersuchung des peripheren Nervenfunktion bei neurologischen Erkrankungen. Konventionelle Nerv Wärmeleitung Methoden nutzen supramaximalen Reize motor Aktionspotential Amplitude und Latenz aufnehmen. Diese Techniken bieten daher nützliche Informationen über die Anzahl der Durchführung von Fasern und die Leitgeschwindigkeit der schnellsten Fasern. Ein wertvolles ergänzendes Instrument ist der axonalen Erregbarkeit zu testen. Diese Technik nutzt ausgefeilte elektrophysiologische Stimulation Muster indirekt die biophysikalischen Eigenschaften der peripheren Nerven, wie die Aktivität der Ionenkanäle, Energie-abhängige Pumpen, Ionenaustausch Prozesse und Membranpotential bewerten 1.
Axonalen Erregbarkeit zu testen ist in der klinischen Einstellung, pathophysiologische Prozesse und Wirkungen therapeutischer Interventionen auf verschiedenen neurologischen Erkrankungen zu untersuchen häufig genutzt. Vor allem axonalen Erregbarkeit Maßnahmen reagieren empfindlich auf therapeutische Interventionen, die Funktion der peripheren Nerven wie intravenöses Immunglobulin (IVIg) Therapie2, beeinflussen Chemotherapie3 und Calcineurin-Inhibitor (CNI) 4. Obwohl diese Studien wichtige Erkenntnisse zur Verfügung gestellt haben, klinische Studien oft entgegen, Untersuchung der frühen Krankheit Eigenschaften und neuartige Therapieoptionen5. Daher hat die Verwendung dieser Methoden in Tiermodellen der neurologischen Erkrankungen vor kurzem Traktion6,7,8,9gewonnen. In der Tat, diese Methoden bieten die Möglichkeit, die spezifischen Nerv Erregbarkeit Veränderungen im Zusammenhang mit diesen Erkrankungen, so translationalen Forschung voranbringen zu verstehen.
Das hier beschriebene Verfahren ist eine einfache und zuverlässige Methode, um Rekord axonalen Erregbarkeit Maßnahmen auf der ulnaren Nerven intakt Ratte.
Protokoll
Alle hier beschriebenen Versuchsverfahren Animal Care und Ethik Komitee der UNSW Sydney eingehalten und wurden in Übereinstimmung mit der National Health and Medical Research Council (NHMRC) Australien Regelungen für Tierversuche durchgeführt.
(1) experimentelle einrichten
Hinweis: 12 Woche alte, weibliche lang-Evans-Ratten wurden in diesem Verfahren verwendet.
- Die Ratte in eine Induktion-Kammer mit 4 % Isofluran und 1 L pro min O2 Durchfluss zu betäuben. Bestätigen Sie ausreichende Anästhesie durch Tests des aufrichtenden Reflexes zu und gewährleisten Sie seine Abwesenheit zu, bevor Sie das Tier aus der Induktion Kammer entfernen. Beachten Sie, dass verschiedene Anästhetika differenzielle Auswirkungen auf Nerven Erregbarkeit10haben.
- Sicher platzieren Sie des Tieres Schnauze in der Rumpfspitze Anlage und liefern Sie eine Erhaltungsdosis von 2,5 % Isofluran und 1 L pro min O2 Durchfluss.
- Bestätigen Sie ausreichende Anästhesie durch Überprüfung von Pedal Rückzug und der Hornhaut Reflexe durch Einklemmen des Tieres Zehen und sanft berühren seine Auge.
Hinweis: Anwendung der Tierarzt Salbe auf Augen, Trockenheit während Narkose zu verhindern ist empfehlenswert, aber nicht notwendig, da der Eingriff in der Regel 30 min pro Tier dauert. - Pflegen Sie die Körpertemperatur der Ratte bei 37 ° C mit einer Heizmatte Feedback gesteuert und eine rektale Thermometer-Sonde. Stellen Sie Heizmatte und integrierte Körper-Temperatur-Sensor bis 40 ° C Schädigung der Haut zu verhindern, die mit höheren Temperaturen auftritt.
Hinweis: Es ist zu überwachen und aufzeichnen physiologische Maßnahmen (Herzfrequenz, Sauerstoffsättigung, Körpertemperatur und Atemfrequenz) alle 10 s mit dem Einsatz von einem tierischen physiologischen monitoring-System empfohlen. Optimale Aufnahme Verfahren sollten lokale Messung der Temperatur der Gliedmaßen umfassen, so sich die periphere Temperatur kälter als der Kern Temperatur11 (Abbildung 1 lassen). - Tragen Sie antiseptische Handschuhe und immer verwenden Sie Instrumente, die gereinigt wurden mit 70 % Ethanol um zu einem Pathogen-freies Umfeld während des Verfahrens zu erhalten.
(2) elektrophysiologische einrichten
- Verwenden Sie niedrige Impedanz Platin Elektroenzephalogramm (EEG) Nadelelektroden für dieses Verfahren.
- Bereiten Sie die Aufnahme Nadelelektroden durch Einfügen der Aufnahme Nadelelektrode (Abbildung 1, angegeben in lila) durch die Hypothenar Muskeln und die Referenzelektrode durch den dorsalen Aspekt der 4. Ziffer (Abbildung 1, angegeben in Orange) zusammengesetzte Muskel Aktionspotentiale (CMAPs) aufnehmen.
- Ort der Masseelektrode über die Haut auf dem überlegenen Aspekt des Unterarms zwischen Förderung und Aufnahme Elektroden (Abbildung 1, angegeben in grün). Achten Sie beim Einlegen der Elektroden zur Vermeidung von Muskelgewebe.
- Bereiten Sie die perkutane anregende Nadelelektroden durch Einfügen von der Kathode (Abbildung 1, beschriftet in blau) ca. 4 mm distal der cubital tunnel am Ellenbogen. Legen Sie die Anode (Abbildung 1, beschriftet in rot) ca. 1 cm nach proximal durch die Haut der Region sowie.

Abbildung 1: Schematische Darstellung der Nadel Elektrode Platzierungen in der Ratte Vordergliedmaße. Die Kathode (blau) ist ca. 4 mm distal der cubital Tunnel am Ellenbogen und die Anode (rot) eingefügt ist ca. 1 cm nach proximal durch die Haut der Region sowie. Die Masseelektrode (grün) Nadel wird durch die Haut auf dem überlegenen Aspekt des Unterarms zwischen Förderung und Aufnahme Elektroden eingefügt. Die Aufnahme (lila) und Referenzelektroden (Orange) Nadel sind durch die Hypothenar Muskeln und der dorsalen Aspekt der 4th Ziffer eingefügt. Der Temperaturfühler (grau) wird auf dem überlegenen Aspekt der Thenar Muskel platziert. Bitte klicken Sie hier für eine größere Version dieser Figur.
(3) axonalen Erregbarkeit Verfahren
- Nagetier motorischen Nervus TRONDNF Protokoll verwendet eine halbautomatische durchführen, kontrollierte axonalen Erregbarkeit Computerprogramm (siehe die Tabelle Materialien) um eine konstant aktuelle Stimulator und einem Verstärker verbunden. Entfernen Sie überschüssige elektrische Störungen, die 50 Hz mit einem 50/60 Hz-Rauschen-Eliminator.
- Aufzeichnen der CMAP vom Hypothenar Muskel durch gleichzeitiges visualisieren die CMAP-Morphologie und anwenden einer 1 ms Rechtecksignal Puls des ulnaren Nervs mit der Kathode-Nadel-Elektrode.
- Um optimale Aufnahmen erzielen, sorgfältig justiert die Winkel und/oder die Position der Kathode ist eine optimale biphasische-Response-Kurve mit konstanter Amplitude erreicht (Abbildung 2A). Sobald die optimale Position festgestellt worden ist, stabilisieren Sie die Kathode mit einem Repositionierbarer Elektrodenhalter.
Hinweis: Die Software automatisch liefert der Test-Reize, wie unten beschrieben, und steigt oder sinkt den Strom benötigt, um die Schwelle zu erreichen.
- Um optimale Aufnahmen erzielen, sorgfältig justiert die Winkel und/oder die Position der Kathode ist eine optimale biphasische-Response-Kurve mit konstanter Amplitude erreicht (Abbildung 2A). Sobald die optimale Position festgestellt worden ist, stabilisieren Sie die Kathode mit einem Repositionierbarer Elektrodenhalter.
- Aufzeichnen eine Stimulus-Response-Kurve durch schrittweise Erhöhung der Reizintensität von 1 ms Impuls von 1 mA bis eine maximale Reaktion erreicht ist.
Hinweis: Die lila und grüne Linie in Abbildung 2 b und 2C stellt die inkrementelle Steigerung von der Reizstärke und das automatisierte System bzw.. Die Ziel-Amplitude für Schwelle tracking wird automatisch auf 40 % der maximalen Amplitude auf den Bereich der die steilste Piste auf der Reiz-Reaktions-Kurve entsprechend eingestellt. Die Veränderung der "Schwelle" (d. h. Reiz benötigt, um 40 % zu entlocken CMAP) induziert durch verschiedene Test Reize ist die Variable für den Rest des Protokolls erhalten. - Zeichnen mehrere axonalen Erregbarkeit Parameter, einschließlich Schwelle Electrotonus (TE), Strom-Schwelle (ich / V) Beziehung und Recovery-Zyklus (RC) wie in der Referenz beschrieben12.
Hinweis: Das Computerprogramm kontrollierten axonalen Erregbarkeit bewertet die Schwelle (TE) mit einer 100 ms Eingangssignale depolarisierende und hyperpolarizing Ströme, die bei ±20 % und ±40 % der Kontrolle Schwelle aktuelle festgelegt ist. Die Veränderung der Schwellenwert nach depolarisierende und hyperpolarizing Ströme wird automatisch zu 14 Zeitpunkten während der 100 ms polarisierenden aktuelle und 12 Punkte nach der polarisierenden aktuelle aufgezeichnet. Schwelle Electrotonus indirekt beurteilt die Internodien maßgearbeitet und ist ein Marker des Membranpotentials. I / V-Verhältnis ist mit 200 ms Eingangssignale Klimaanlage Strömungen, die in ihrer Intensität von + 50 abwechseln beurteilt %-100 % der Kontrolle Schwelle in 10 % Schritten. I / V-Verhältnis unterscheidet sich zu TE, dass die Strömungen in der Dauer länger sind, die Intensität der Polarisation wird schrittweise verändert von + 50 %-100 % und die Schwelle Änderung bemisst sich an jede Intensität 1 ms nach der polarisierenden aktuelle aufgehört hat. Die I / V-Verhältnis bietet einen Einblick in die gleichrichtende Eigenschaften des Axon1. Die RC ist bewertet mit einem gekoppelten Puls Paradigma, wo, ein ersten supramaximalen Klimaanlage Impuls angewendet wird gefolgt von eine Reihe von Test-Reize in bestimmten Intervallen von 2,5 ms bis 200 Ms. dieses Parameters testet eine klar definierte Reihe von Ereignissen, die auftreten in der Knotenpunkte Region des Axons nach supramaximalen Stimulation. Zu diesen Ereignissen gehören, die Inaktivierung von Voltage-gated Na+ Kanäle, das macht es schwieriger, eine anschließende Reaktion auslösen und ist durch die Feuerfestigkeit und die relative feuerfesten Zeitraum 1quantifiziert. Danach erfolgt eine Erhebung der Internodium und eine gesteigerte Erregbarkeit, vermittelt durch schnelle Kaliumkanäle, durch Superexcitability quantifiziert. Schließlich vermitteln langsam aktivierenden Kaliumkanäle Spätzeit des reduzierten Erregbarkeit, als Subexcitability quantifiziert.
- Aufzeichnen der CMAP vom Hypothenar Muskel durch gleichzeitiges visualisieren die CMAP-Morphologie und anwenden einer 1 ms Rechtecksignal Puls des ulnaren Nervs mit der Kathode-Nadel-Elektrode.
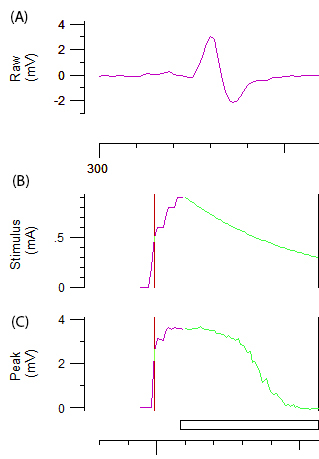
Abbildung 2: Rohdaten aus einer axonalen Erregbarkeit Test Zentrale A zeigt Abiphasic-CMAP-Wirkungs-Kurve nach schrittweise Erhöhung der Stimulation des ulnaren Nervs. Platten B und C stellen die Reizintensität (mA) und Amplitude der CMAP (mV), beziehungsweise. Die grüne Komponente B und C zeigt die automatische inkrementelle Rückgang der Reizstärke und der zugehörigen sigmoid geformte Rückgang CMAP Schwelle tracking gefordert.
4. Post Elektrophysiologie Verfahren
- Übertragen Sie die Ratte zu einem separaten Käfig, bis es ausreichend Bewusstsein zur Aufrechterhaltung der sternalen liegen wiedererlangt hat. Lassen Sie kein Tier unbeaufsichtigt und in Gesellschaft anderer Tiere bis es vollständig aus der Narkose erholt hat. Sobald die Ratte aus der Narkose vollständig erholt hat, übertragen Sie es wieder in seinem ursprünglichen Käfig.
- Nach Abschluss der Studie einschläfern der Ratte ohne Schmerzen für das Tier, z.B. tödliche intraperitoneale Injektion von ein Barbiturat (z.B. Lethabarb).
Ergebnisse
Elektrophysiologische Maßnahmen von der Ratte ulnaris wurden mit diesem Protokoll erzielt. Abbildung 3 zeigt einen Aufnahme von der linken ulnaren Nerv einer 12 Wochen alten weiblichen lange Evans Ratte Vertreter. Zusammengesetzte Muskel-Aktionspotenzial bezieht sich auf die Anzahl der Durchführung von Fasern, die gleichzeitig aktiviert werden. Die supramaximalen Spitze Antwort (mV) (Abbildung 3A) zeigt die Peak-Reaktion erreic...
Diskussion
Die beschriebene Vorgehensweise zeigt eine einfache und zuverlässige, ermöglicht die minimal-invasive Technik, die der biophysikalischen Eigenschaften und das Potenzial der Membran des Axons in kurzer Zeit. Im Vergleich zu anderen mehr invasiven Techniken, die die Belichtung des Nervs erfordern, das vorliegende Verfahren der axonalen Erregbarkeit Prüfung induziert minimaler Gewebeschädigung, wodurch es in Vivo Beurteilung, die die physiologischen Bedingungen des bewahrt die Nerven von Interesse und für wied...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Das Projekt wurde unterstützt von Lundbeck-Stiftung, die Novo Nordisk Stiftung, dem dänischen Medical Research Council, der Ludvig und Sara Elsass Foundation, der Stiftung für Forschung in der Neurologie und Jytte und Kaj Dahlboms Stiftung. R.A stützt sich auf eine frühe Karriere Postdoc Fellowship of National Health and Medical Research Council of Australia (#1091006)
Materialien
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
Referenzen
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten