Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In Vivo Mesures électrophysiologiques du nerf cubital Rat avec test d’excitabilité axonale
Dans cet article
Résumé
Techniques de l’excitabilité axonale fournissent un outil puissant pour étudier la physiopathologie et les changements biophysiques qui précèdent les événements dégénératives irréversibles. Ce manuscrit illustre l’utilisation de ces techniques sur le nerf cubital de rats anesthésiés.
Résumé
Électrophysiologie permet l’évaluation objective des nerfs périphériques fonction in vivo. Conduction nerveuse traditionnelle des mesures telles que l’amplitude et la latence détectent perte axonale chronique et la démyélinisation, respectivement. Techniques de l’excitabilité axonale « par seuil de suivi » étoffer ces mesures en fournissant des informations concernant l’activité des canaux ioniques, pompes et échangeurs se rapportant à la fonction aiguë et peuvent précéder les manifestations dégénératives. Par conséquent, l’utilisation de l’excitabilité axonale dans des modèles animaux de troubles neurologiques peut-être prévoir une mesure utile en vivo pour évaluer les nouvelles interventions thérapeutiques. Nous décrivons ici un montage expérimental pour plusieurs mesures techniques moteur excitabilité axonale dans le nerf cubital du rat.
Les animaux sont anesthésiés à l’isoflurane et soigneusement surveillés pour s’assurer une profondeur constante et adéquate de l’anesthésie. Température corporelle, rythme respiratoire, rythme cardiaque et la saturation d’oxygène dans le sang sont surveillés en permanence. Études d’excitabilité axonale sont effectuées en utilisant une stimulation percutanée du nerf ulnaire et enregistrement des muscles de la patte de la patte avant hypothénarien. Avec électrodes correct, un potentiel d’action musculaire clair composé qui augmente en amplitude avec l’intensité de la stimulation est enregistré. Un programme automatisé est ensuite utilisé pour offrir une série d’impulsions électriques qui génèrent 5 mesures d’excitabilité spécifiques dans l’ordre suivant : comportement de stimulus réponse, constante de temps de durée force, electrotonus seuil seuil courant la relation et le cycle de régénération.
Les données présentées ici indiquent que ces mesures sont répétables et voir la similitude entre les nerfs cubital droit et gauche sur le même jour. Une limitation de ces techniques dans ce paramètre est l’effet de la dose et l’heure sous anesthésie. Attention de surveillance et d’enregistrement de ces variables devraient être entrepris aux fins d’examen au moment de l’analyse.
Introduction
L’utilisation de techniques électrophysiologiques est un outil essentiel pour l’étude in vivo de la fonction de nerf périphérique dans les troubles neurologiques. Méthodes de conduction nerveuse classiques utilisent stimuli supramaximal enregistre la latence et l’amplitude des potentiels d’action moteur. Ces techniques fournissent donc des informations utiles sur le nombre des fibres et sur la vitesse de conduction des fibres plus rapide. Un outil complémentaire précieux est celle du test d’excitabilité axonale. Cette technique utilise des modèles de stimulation électrophysiologique sophistiqués pour évaluer indirectement les propriétés biophysiques des nerfs périphériques, tels que l’activité des canaux ioniques, de pompes à dépendant de l’énergie, de processus d’échange d’ions et de potentiel de membrane 1.
Test d’excitabilité axonale est couramment utilisé dans le contexte clinique pour étudier les processus physiopathologiques et les effets des interventions thérapeutiques sur divers troubles neurologiques. Ce qui est important, mesures d’excitabilité axonale sont sensibles aux interventions thérapeutiques qui affectent la fonction des nerfs périphériques tels que les immunoglobulines intraveineuses (IgIV) thérapie2, chimiothérapie3 et la calcineurine inhibiteur (CNI) 4. bien que ces études ont fourni des renseignements importants, les études cliniques empêchent souvent enquête de caractères juvénile de la maladie et de nouvelles options thérapeutiques5. Par conséquent, l’utilisation de ces méthodes dans des modèles animaux des troubles neurologiques a récemment obtenu de traction6,7,8,9. En effet, ces méthodes fournissent une occasion de comprendre les changements d’excitabilité nerveuse spécifiques associés à ces troubles, ainsi faire avancer la recherche translationnelle.
La procédure décrite ici est une méthode simple et fiable aux mesures d’excitabilité axonale record sur les nerfs cubital du rat intact.
Protocole
Toutes les procédures expérimentales décrites ici respectée l’éthique Comité de l’UNSW Sydney et animalier et ont été effectuées conformément à la santé nationale et du Medical Research Council (NHMRC) du règlement de l’Australie à l’expérimentation animale.
1. expérimental mis en place
NOTE : les rats Long-Evans âgés de 12 semaines, les femmes ont été utilisés dans cette procédure.
- Anesthésier le rat dans une chambre d’induction à l’aide de 4 % isoflurane et 1 L par min O2 débit. Confirmer l’anesthésie suffisante en vérifiant le réflexe de redressement et d’assurer son absence avant de retirer l’animal de la chambre de l’induction. Notez que plusieurs agents anesthésiques ont des effets différents sur d’excitabilité nerveuse10.
- Placez le museau de l’animal dans la fixation de la coiffe et administrer une dose d’entretien de 2,5 % isoflurane et 1 L par min O2 débit en toute sécurité.
- Confirmer anesthésie adéquate en vérifiant pour retrait pédale et réflexes cornéens en pinçant ses orteils de l’animal et toucher doucement ses yeux.
Remarque : L’Application d’une pommade vétérinaire sur les yeux, pour prévenir le dessèchement tandis que sous anesthésie, est recommandée mais pas indispensable car la procédure prend généralement de 30 min par animal. - Maintenir la température corporelle du rat à 37 ° C à l’aide d’un tapis chauffant de rétroaction contrôlée et d’une sonde thermomètre rectal. Définir la trame chauffante et le capteur de température intégré à 40 ° C pour empêcher des dommages de la peau qui se produit avec des températures plus élevées.
Remarque : Il est recommandé de surveiller et enregistrer les mesures physiologiques (fréquence cardiaque, saturation en oxygène, température corporelle et fréquence respiratoire) toutes les 10 secondes à l’aide d’un système de surveillance physiologique animal. Procédures d’enregistrement optimale devraient inclure la mesure locale de la température de la branche car la température périphérique peut être plus froide que celle de la base température11 (Figure 1). - Porter des gants antiseptiques et utilisez toujours des instruments qui ont été nettoyés avec l’éthanol à 70 %, de maintenir un environnement exempt d’agents pathogènes dans l’ensemble de la procédure.
2. électrophysiologiques mis en place
- Utilisez les électrodes aiguilles de basse impédance platine électroencéphalogramme (EEG) pour cette procédure.
- Préparer les électrodes d’aiguille enregistrement en insérant l’électrode à aiguille d’enregistrement (Figure 1; indiqué en violet) à travers le muscle hypothénarien et l’électrode de référence par le biais de l’aspect dorsal du chiffre 4 (Figure 1, il est indiqué au orange) pour enregistrer les potentiels d’action composé de muscle (CMAPs).
- Placer l’électrode de terre à travers la peau sur l’aspect supérieur de l’avant-bras entre stimulant et enregistrement des électrodes (Figure 1; indiquée en vert). Faites attention lorsque vous insérez les électrodes afin d’éviter les tissus musculaires.
- Préparer les électrodes d’aiguille stimulant percutanée en insérant la cathode (Figure 1; marquées en bleu) environ 4 mm de distal de la cubitale tunnel au niveau du coude. Insérer l’anode (Figure 1; marqués en rouge) environ 1 cm proximalement par la peau de la région d’axillaires.

Figure 1 : un diagramme schématique le positionnement d’électrode aiguille dans le membre antérieur de rat. La cathode (bleu) est insérée environ 4 mm de distal du tunnel cubital au coude et l’anode (rouge) est inséré environ 1 cm proximalement par la peau de la région d’axillaires. L’électrode à aiguille au sol (vert) est inséré à travers la peau sur l’aspect supérieur de l’avant-bras entre stimulant et électrodes d’enregistrement. L’enregistrement (violet) et les électrodes de référence (orange) aiguilles sont insérées par le biais du muscle hypothénarien et l’aspect dorsal du 4ème chiffre. La sonde de température (gris) est placée sur l’aspect supérieur du muscle thénar. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
3. axones excitabilité procédures
- Effectuer le nerf moteur rongeur protocole TRONDNF utilisant un semi-automatique, ordinateur contrôlé excitabilité axonale programme (voir la Table des matières) lié à un stimulateur de courant constant et un amplificateur. Retirez l’excès bruit électrique de 50 Hz à l’aide d’un éliminateur de bruit 50/60 Hz.
- Enregistrer la CMAP du muscle hypothénarien en simultanément visualiser la morphologie de la CMAP et en appliquant un 1 impulsion d’ondes carrées ms pour le nerf cubital avec l’électrode à aiguille cathode.
- Pour réaliser des enregistrements optimales, ajuster soigneusement l’angle et/ou la position de la cathode, jusqu'à ce qu’une courbe de réponse optimale biphasique avec amplitude constante est obtenue (Figure 2 a.). Une fois la position optimale a été déterminée, stabiliser la cathode avec un porte-électrode repositionnables.
Remarque : Le logiciel utilisé automatiquement délivre les stimuli de l’épreuve, décrits ci-dessous et augmente ou diminue l’intensité nécessaire pour atteindre le seuil.
- Pour réaliser des enregistrements optimales, ajuster soigneusement l’angle et/ou la position de la cathode, jusqu'à ce qu’une courbe de réponse optimale biphasique avec amplitude constante est obtenue (Figure 2 a.). Une fois la position optimale a été déterminée, stabiliser la cathode avec un porte-électrode repositionnables.
- Enregistrer une courbe de stimulus / réponse en augmentant progressivement l’intensité de la stimulation d’un 1 impulsion de ms par 1 mA jusqu'à l’obtention d’une réponse maximale.
Remarque : La ligne pourpre et verte dans la figure 2 b et 2C représente respectivement l’augmentation progressive de l’intensité de la stimulation et l’automatisme. L’amplitude de la cible pour seuil de suivi est automatiquement définie à 40 % de l’amplitude maximale correspondant à la superficie de la pente plus raide sur la courbe de stimulus / réponse. Le changement de « seuil » (c'est-à-dire les stimulus requis pour obtenir 40 % CMAP) induite par différents stimuli de test est la variable d’obtenus dans le reste du protocole. - Enregistrer plusieurs paramètres d’excitabilité axonale, y compris electrotonus de seuil (TE), courant-seuil (I / V) relation et rétablissement du cycle (RC) tel que décrit dans référence12.
NOTE : Le programme informatique de l’excitabilité axonale contrôlé évalue le seuil (TE) avec un 100 ms une dépolarisation et hyperpolarisant courants qui est fixé à ±20 % et ± 40 % du seuil de contrôle actuel. Le changement de seuil après les dépolarisants et hyperpolarisants courants est automatiquement enregistré à 14 points de temps pendant les 100 ms courant de polarisation et de 12 points après le courant de polarisation. Electrotonus de seuil indirectement évalue les conductances internodales et est un marqueur du potentiel de membrane. L’I / V relation est évaluée avec les courants d’une climatisation 200 ms qui alternent en intensité de + 50 % à -100 % du seuil de contrôle par incréments de 10 %. I / relation V diffère de TE parce que les courants sont plus longues dans la durée, l’intensité de la polarisation est progressivement modifiée par rapport à + 50 % à -100 % et le changement de seuil est évaluée à chaque intensité 1 ms après que le courant de polarisation a cessé. I / relation V donne un aperçu des propriétés rectification de l' axone1. Le RC est évaluée avec un paradigme d’impulsions jumelés, où un stimulus de conditionnement initial supramaximal est appliqué suivi d’une série de stimuli d’essai à des intervalles spécifiques de 2,5 ms à Mme 200 ce paramètre teste une série bien définie des événements qui se produisent dans le nodal région de l’axone après stimulation supramaximal. Ces événements incluent, l’inactivation de voltage-dépendant des canaux Na+ , ce qui rend plus difficile à obtenir une réponse ultérieure et est quantifiée par la période réfractaire et de la relative période réfractaire 1. Il est suivi par une imputation de l’entre-nœud et une période d’excitabilité accrue véhiculée par les canaux potassium rapide, quantifiées par superexcitability. Enfin, lentement activateur des canaux potassiques véhiculent une fin de la période de l’excitabilité réduite, quantifiée comme subexcitability.
- Enregistrer la CMAP du muscle hypothénarien en simultanément visualiser la morphologie de la CMAP et en appliquant un 1 impulsion d’ondes carrées ms pour le nerf cubital avec l’électrode à aiguille cathode.
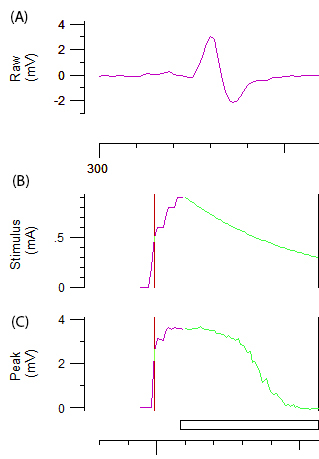
Figure 2 : données brutes d’un test d’excitabilité axonale. Paroi A montre la courbe de réponse abiphasic CMAP après augmentation de la stimulation du nerf cubital. Groupes B et C représentent l’intensité de stimulation (mA) et l’amplitude de la CMAP (mV), respectivement. La composante verte de B et C représente la diminution incrémentielle automatique dans l’intensité de la stimulation et la baisse de forme sigmoïde associée CMAP requis pour seuil de suivi.
4. appliquer les procédures d’électrophysiologie
- Transférer le rat dans une cage séparée jusqu'à ce qu’il a repris connaissance suffisante pour maintenir le décubitus sternal. Ne pas laisser un animal sans surveillance et en compagnie d’autres animaux jusqu'à ce qu’il a pleinement récupéré de l’anesthésie. Une fois que le rat a complètement récupéré de l’anesthésie, transférez-le dans sa cage originale.
- À la fin de l’étude, euthanasier le rat sans douleur pour l’animale, par exemple létale injection intrapéritonéale d’un barbiturique (p. ex. lethabarb).
Résultats
Des mesures électrophysiologiques du nerf cubital rat ont été obtenus avec le présent protocole. La figure 3 montre un représentant d’enregistrement du nerf cubital gauche d’un rat Long Evans femelle de 12 semaines. Potentiel d’action musculaire composé désigne le nombre des fibres qui sont activés en même temps. La réponse de crête supramaximal (mV) (Figure 3 a) montre la réponse de crête atteinte en augmentan...
Discussion
La procédure décrite montre un simple et fiable, technique mini-invasive qui permet l’évaluation des propriétés biophysiques et potentiel de la membrane de l’axone dans un court laps de temps. Par rapport aux autres techniques plus invasives, qui exigent l’exposition du nerf, la présente méthode d’essai d’excitabilité axonale induit des lésions des tissus minimal permettant ainsi l’évaluation in vivo qui préserve les conditions physiologiques de la nerf d’intérêt et permet des mesures ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le projet a été soutenu par la Fondation de Lundbeck, le Novo Nordisk Foundation, le Conseil danois de la recherche médicale, le Ludvig et Sara Elsass Foundation, la Fondation pour la recherche en neurologie et Jytte et Kaj Dahlboms. Rachid est pris en charge par un début de carrière Post-Doctoral Fellowship de la National Health and Medical Research Council of Australia (#1091006)
matériels
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
Références
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon